DOI:
https://doi.org/10.14483/udistrital.jour.colomb.for.2007.1.a08Publicado:
01-01-2007Número:
Vol. 10 Núm. 20 (2007): Enero-DiciembreSección:
Artículos de investigación científica y tecnológicaMultisantina mexicana Chapin (Coleóptera: Coccinellidae) depredador de chupadores de savia de árboles ornamentales en Bogotá
Multisantina mexicana Chapin (Coleoptera: Coccinellidae) predator of sap suckers of ornamental trees in Bogota
Palabras clave:
Coccinellidae, Membracidae, Pseudoccocidae, Psyllidae, Phylloxeridae, árboles, Bogotá (es).Palabras clave:
Coccinellidae, Membracidae, Pseudoccocidae, Psyllidae, Phylloxeridae, trees, Bogotá. (en).Descargas
Referencias
Barba, D. G. Caicedo. 1999. Regulación de Ceroplastes cundinamarcensis Mosquera (Homoptera:Coccidae) en la arborización de Santafé de Bogotá D.C. Resúmenes del XXVI Congreso de la Sociedad Colombiana de Entomología. Bogotá. pg. 153.
Blackwelder, R. 1944-1947. Checklist of the coleopterous insects of Mexico, Central America,
Caicedo, G. 1999. Hospederos de Ceroplastes cundinamarcensis Mosquera (Homoptera: Coccidae) en el ornato público en Santa fe de Bogotá D.C. Resúmenes del XXVI Congreso de la Sociedad Colombiana de Entomología. Bogotá. p. 16.
Caicedo, G. & E. Castelblanco, 1999. Aspectos ecológicos de la escama cerosa Ceroplastes cundinamarcensis Mosquera (Homoptera: Coccidae) en Santafé de Bogotá D.C. Resúmenes del XXVI Congreso de la Sociedad Colombiana de Entomología. Santafé de Bogotá: SOCOLEN, 1999. p. 49.
Chapin, J. 1985. Revision of the genus Mulsantina Weise (Coleoptera: Coccinellidae). Annals of the Entomological Society of America. 78( 1): 348 367
Civolani, S. & E. Pasqualini E. 2003. Cacopsylla pyri L. (Hom., Psyllidae) and its predators relationship in Italy's Emilia-Romagna Region. Journal of Applied Entomology. 127(4): 214-220.
Contreras, G. 1951. Coccinellidae colombianos. Ordenación e iconografía. Revista de la Academia de Ciencias Exactas, Físicas y Naturales. Colombia. Vol VIII. ( 30): 243 - 245.
DAMA. 2000. Guía preliminar de insectos de Santafé de Bogotá y sus alrededores. Bogotá: Alcaldía Mayor de Bogotá, 2000. 95 p.
Dixon, A. 1970. Factors limiting the effectiveness of the coccinellidae beetle, Adalia bipunctata (L.) as a predator of the sycamore aphid, Drepanosiphum platanoides (Schr.). Journal of Animal Ecology. 39: 739-751
Dixon, A. 2000. Insect predator-prey dynamics. Ladybird beetles and biological control. Cambridge. University Press. 257 pgs.
Evans, E. & A. Dixon. 1986. Cues for oviposition by ladybird beetles (Coccinellidae): response to aphids. Journal of Animal Ecology 55: 10271034.
Gordon, R. 1985. The Coccinellidae (Coleoptera) of America North of Mexico. Journal of the New York Entomological Society 93(1): 1- 912
Hales, D. 1979. Population dynamics of Harmonia conformis Coleoptera : Coccinellidae on Acacia. General & Applied Entomology. 11 :3-8.
Hodek, I. & A. Honek. 1996. Ecology of Coccinellidae. Kluwer Academic Publishers. 464 pgs.
Leshen, R. 2000. Beetles feeding on bugs (Coleoptera, Hemiptera): Repeated shifts from mycophagous ancestors. Invertebrate Taxonomy. 14(6): 917-929.
Pinzón, O. & R. González. 2001. Caracterización biológica, hábitos, enemigos naturales y luctuación poblacional de Callophya schini Tuthill en la especie forestal Shinus molle L. en Bogotá. Revista Cientíica. Revista Centro de Investigaciones y Desarrollo Cientíico. Universidad Distrital Francisco José de Caldas Bogotá 3: 149-164.
Pinzón, O. & F. Pedreros 1996. Biología, hábitos y enemigos naturales de la chinche del Urapan (Tropidosteptes chapingoensis) en Santafé de Bogota. Vol. 4 (9): 44-55
Pinzón, O. 1999. Problemas itosanitarios en árboles ornamentales en Santafé de Bogotá. Colombia Forestal. 6(12): 44-51.
Pinzón, O. & Y. Osorio 2001. Contribución al conocimiento de Mastigimas sp. plaga de Cedrela sp. en Bogota. Resúmenes XXVIII Congreso Sociedad Colombiana de Entomología Sociedad Colombiana de Entomología Agosto-XXVIII. Pg. 22.
Pinzón, O. & P. Quintero 2001. Caracterización biológica, hábitos y enemigos naturales de Aconophora elongatiformis Dietrich en Tecoma stans árbol ornamental de Bogota. Revista Colombia Forestal. 7 (14): 33-54
Piñeros, L. 1997. Reconocimiento y evaluación preliminar de neurópteros asociados con el Urapan (Fraxinus chinensis var. Acuminata Lingelesch), sobre la chinche Tropidosteptes chapingensis Carvalho y Rosas ( Hemíptera Miridae) en Santafé de Bogotá. D.C. Bogotá, 1997, 115 p. Tesis de grado (Ingeniero Agrónomo). Universidad Nacional de Colombia. Facultad de Agronomía.
Richards, D. & E. Evans. 1998. Reproductive responses of aphidophagous lady beetles (Coleoptera: Coccinellidae) to nonaphid diets: An example from alfalfa. Annals of the Entomological Society of America. 91(5): 632-640.
Rogers, L. 2001. CABI. Comunicación personal.
Torres, D., H. Bravo, J.Vera & T. Saito 1982. Biología, morfología y comportamiento alimenticio de Mulsantina picta minor (Coleoptera: Coccinellidae). Agrociencia. 50: 17-34.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Colombia Forestal, Diciembre del 2007 vol:10 nro:20 pág:148-160
Mulsantina mexicana Chapin (Coleóptera: Coccinellidae) Depredador de chupadores de savia de árboles ornamentales de BogotÁ
Paola Quintero
Ricardo González
John Ruiz
Andrea Wanumen
Universidad Distrital Francisco José de Caldas. paolafdaquintero@yahoo.com, ricardo_gonzalez76@hotmail.com, jhoncruiz@hispavista.com, andreawanumen@yahoo.es
Olga Pinzón
Profesor Titular Proyecto Curricular de Ingeniería Forestal, Universidad Distrital Francisco José de Caldas. oppinzon78@hotmail.com
Resumen
En este estudio se llevó a cabo la identiicación taxonómica, observaciones de biología en condiciones de laboratorio y ocurrencia en campo de un coccinélido que se alimenta de chupadores de savia que infestan varias especies de arbustos ornamentales de Bogotá. Adicionalmente, en el laboratorio se realizó la descripción de las características morfológicas propias de cada estado de desarrollo y se comparó el tiempo de desarrollo de la larva y el adulto alimentados con Aconophora elongatiformis Dietrich (Membracidae), Callophya schini Tuthill (Psyllidae) y una especie de Phylloxeridae. El Coccinellidae fue determinado como Mulsantina mexicana Chapin. Los resultados sugieren que M. mexicana puede contribuir a regular poblaciones de algunas especies de itófagos que se establecen en árboles ornamentales de Bogota las cuales puede utilizar como presas alternativas dentro de su dieta.
Palabras clave: Coccinellidae, Membracidae, Pseudoccocidae, Psyllidae, Phylloxeridae, árboles, Bogotá.
Abstract
This study comprised the taxonomic identification, biological observations in laboratory conditions and ield observations of one species of Coccinellidae that feeds on sap-suckers infesting several ornamental trees in Bogota, Colombia. In laboratory conditions, using eggs collected in the ield, we characterized morphologic parameters for each of its stages, and compared developmental time of its larva and adults when fed with Aconophora elongatiformis Dietrich (Hem.: Membracidae), Callophya schini Tuthill (Hem.: Psyllidae) and one species of Phylloxeridae. The Coccinellidae was determined as Mulsantina mexicana Chapin. Our results suggest M. mexicana may help to regulate populations of several phytophagous species of ornamental trees in Bogota that serve as alternative preys in its diet.
Key words: Coccinellidae, Membracidae, Pseudoccocidae, Psyllidae, Phylloxeridae, trees, Bogotá.
INTRODUCCIÓN
La composición de la lora urbana arbórea de Bogotá ha sufrido modiicaciones importantes como consecuencia de infestaciones severas de plagas insectiles entre las que se destacan los ataques de la cochinilla harinosa de las acacias (Acacia sp.), el pulgón (Cinara sp.) del ciprés (Cupressus lusitanica Mill.) y más recientemente la infestación generalizada de los urapanes (Fraxinus sp.) con la chinche del urapán (Tropidosteptes chapingoensis Carvalho) (Pinzón y Pedreros 1996). Este último ataque sorpresivo y generalizado a todos los árboles de urapán de la ciudad, inalmente signiicó el aprovechamiento y reemplazo de un alto porcentaje de árboles a consecuencia del deterioro del follaje y muerte descendente de ramas. Esta severa infestación y la imposibilidad de su control, hizo evidente un total desconocimiento y falta de preparación para enfrentar uno los principales factores de riesgo para la sobrevivencia de la lora urbana arbórea, como es la potencial ocurrencia de plagas y enfermedades devastadoras de las cuales existen trágicos registros en la literatura mundial. Estas experiencias, generaron interés por caracterizar la composición de entomofauna benéica y dañina asociada con la lora ornamental arbórea de Bogota como una herramienta base para planiicación e implementación de medidas de prevención y manejo (Piñeros 1997, Pinzón y Pedreros 1996, Pinzón 1999, Caicedo y Castelblanco 1999; Caicedo 1999, Barba y Caicedo 1999).
Los daños causados por una devastación producida por insectos a la lora urbana, si bien es cierto que no se cuantiican en términos de pérdidas económicas (madera, látex, semillas, etc.), si se pueden valorar en la reducción considerable de los servicios ambientales que brinda a la calidad de vida de los habitantes de la ciudad, como son belleza paisajística, mejoramiento de la calidad del aire, mejoramiento de las condiciones del microclima de la ciudad y amortiguación del ruido, entre otras.
El uso de insecticidas para supresión de poblaciones insectiles dañinas en árboles urbanos presenta restricciones para su aplicación, por el riesgo de contaminación de la población humana, de contaminación de vertederos de aguas y posibles efectos nocivos indirectos sobre la fauna de vertebrados. Adicionalmente, su aplicación requiere de métodos y personal especializado y se pueden requerir aplicaciones periódicas dado que los insecticidas tienen un tiempo de acción determinado.
Una alternativa ambientalmente segura para el manejo de poblaciones itófagas de árboles urbanos consiste en optimizar la efectividad de factores de mortalidad natural, para lo cual es necesario profundizar en el conocimiento de su diversidad, así como de los factores que afectan la dinámica de la población. La acción de los depredadores, parásitos y microorganismos entomopatógenos son factores de mortalidad poco estudiados en ambientes urbanos.
Durante la realización de los inventarios de la entomofauna asociada con las especies forestales como el chicalá: Tecoma stans (L.) Juss. ex HBK., falso pimiento: Schinus molle L, roble: Quercus humboldtii Bonpland y caucho sabanero: Ficus andicola Standley en el área urbana de Bogotá, se observó frecuentemente la actividad depredadora de un coccinélido de cuya presencia no se tenían registros previos en Colombia, que se alimenta de varias especies de chupadores de savia entre ellos: Aconophora elongatiformis Dietrich (Hem.:Membracidae), Callophya schini Tuthill (Hem.: Psyllidae) y una especie de Phylloxeridae presente en Q. humboldtii (Pinzón y Quintero 2002, Pinzón y González 2002). Así mismo, se observaron posturas y adultos del coccinellidae en árboles severamente infestados por Pseudococcus calceolariae (Maskell) (Hem.: Pseudoccocidae).
Búsquedas en las colecciones del Instituto de Ciencias Naturales y del Instituto Colombiano Agropecuario, así como una revisión exhaustiva de la literatura disponible sugieren que no hay registros previos de la ocurrencia de esta especie de Coccinellidae en Colombia (Blackwelder 1944-1947; Contreras 1951) y puede por lo tanto tratarse de una especie introducida que se ha adaptado a las condiciones ambientales de Bogotá.
Considerando que no se tenían registros previos, sobre la ocurrencia de este depredador, se adelantó un estudio para conocer su determinación taxonómica, desarrollar observaciones de ocurrencia en campo, caracteres morfológicos distintivos de cada estado de desarrollo, estimar el tiempo de desarrollo y capacidad depredadora así como observar el comportamiento depredador.
MATERIALES Y MÉTODOS
OBSERVACIONES DE MORFOLOGÍA, TIEMPO DE DESARROLLO Y HÁBITOS DEPREDADORES
Las observaciones de biología y morfología de los diferentes estados de desarrollo de M. mexicana, se iniciaron con la recolección de posturas recientes las cuales se encuentran sobre los folíolos de varias especies forestales ornamentales; para el caso especiico se colectó en follaje de chicalá, falso pimiento y roble. Las posturas se trasladaron en contenedores para protegerlas de daño físico y prevenir desecación y se incubaron en el Laboratorio de Sanidad Forestal de la Universidad Distrital Francisco José de Caldas a una temperatura promedia 18.1 ± 2oC y humedad relativa 62.5 ± 1%, medidas continuamente con higrotemografos Haenni. Las posturas generalmente adheridas al envés de la hoja de las plantas hospederas fueron incubadas en cajas petri de vidrio de 150 x 25 mm conteniendo papel iltro humedecido.
Después de la eclosión, las larvas de primer instar se colocaron en contenedores individuales para evitar canibalismo y cada larva fue incubada en una caja petri de vidrio de 150 x 25 mm, adaptada con papel iltro húmedo y pequeñas ramas del árbol hospedero de cada una de las especies de itófagos que se le ofrecieron como presa.
Los insectos ofrecidos como presa fueron colectados en árboles de chicalá, falso pimiento y roble severamente infestados con estos chupadores de savia, en diferentes lugares de la ciudad, mantenidos por pocos días alimentándose de ramas de la especie hospedera y luego separados manualmente para ser ofrecidos como alimento al depredador. En el caso del C. schinni, dado que las ninfas se desarrollan insertas en el foliolo formando una agalla, se ofrecieron entonces secciones de foliolo conteniendo el número de presas necesarias.
Grupos separados de larvas y adultos de M. mexicana fueron alimentados con ninfas y adultos de A. elongatiformis, C. schini, con huevos, ninfas y adultos de P. calceolariae y con ninfas de una especie de Phylloxeridae que se alimenta en el follaje de roble. Diariamente se cuantiicó el consumo de presas y se renovó el alimento ofreciendo un número y tamaño de presas acorde con el tamaño del depredador y suiciente para mantener saciado el apetito del insecto, los cuales se estimaron previamente en pruebas alimenticias exploratorias. Las observaciones de tiempo de desarrollo con cada tipo de presa de M. mexicana se realizaron con un número que varió entre treinta y sesenta individuos.
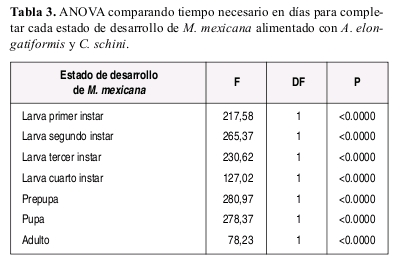
Las diferencias en la duración de cada estado de desarrollo de M. mexicana con dietas a base de C. schini y A. elongatiformis fueron comparadas utilizando análisis de varianza ANOVA con 0.05 de nivel de signiicancia. Con estas mismas dietas, se calculó el porcentaje de sobrevivencia (Lx) de cada estado de desarrollo larval de M. mexicana mediante la relación entre número inicial de larvas en cada instar y el numero de larvas que pasaron al siguiente instar de desarrollo.
OCURRENCIA
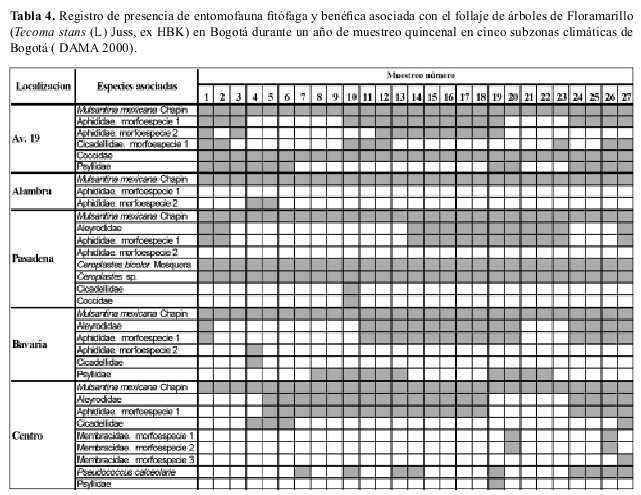
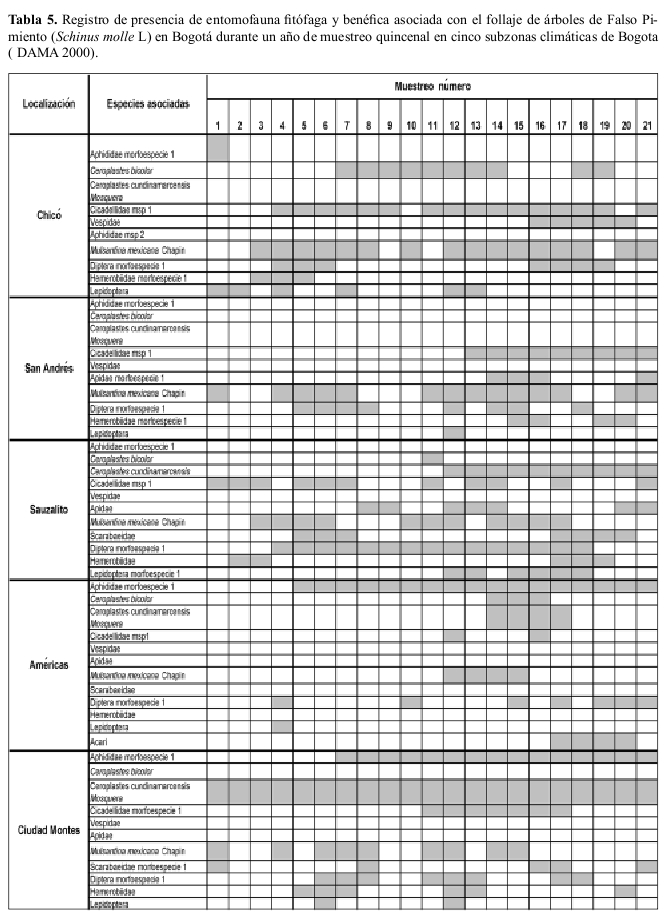
En campo se hicieron observaciones quincenales al follaje de 5 grupos de 10 árboles cada uno de cada una de las dos especies forestales: chicalá y falso pimiento, ubicados en diferentes zonas climáticas en las cuales está sectorizada la ciudad (DAMA 1997) donde a la vez que se registró la ocurrencia de especies itofagas, también se determino la presencia o ausencia de M. mexicana.
RESULTADOS
DETERMINACIÓN TAXONÓMICA
La determinación taxonómica del Coccinellidae al nivel de especie fue solicitada al Museo de Historia Natural de Londres (NHM L. Rogers det.) y posteriormente a USDA (Dra. Vandenberg. det.), mediante el envío de parejas de adultos capturados en copula. La especie fue determinada como Mulsantina mexicana Chapin (Coleoptera: Coccinellidae).
CARACTERÍSTICAS MORFOLÓGICAS
M. mexicana pasa por los estados de huevo (Figura 1a), cuatro instares larvales (Figura 1b-e), prepupa (Figura 1f), pupa (Figura 1g) y adulto (Figura 1h), todos con características morfológicas distintivas. Los huevos son de forma oval alargada y color amarillo rojizo, generalmente colocados en grupos de tres hasta catorce unidades y adheridos a hojas, ramillas y fuste de los árboles hospederos. A medida que avanza el periodo de incubación, los huevos se tornan grisáceos o negruzcos lo que advierte la proximidad de la eclosión. Los huevos de cada grupo eclosionan casi simultáneamente y las larvas permanecen de uno a dos días sobre los remanentes del corion, luego comienzan a dispersarse. Las larvas de M. mexicana pasan por cuatro instares que miden en promedio 1.9 mm., 3.2 mm., 4.8 mm. y 6.4 mm de longitud, respectivamente para el primer al cuarto instar. A medida que se desarrollan, las larvas presentan cambios en la coloración, los tubérculos y las márgenes blancas de la región dorso-lateral del tórax y abdomen que permiten la diferenciación visual de los diferentes instares (Figura 1 b-e).
Las larvas son de tipo carabiforme, de cuerpo elongado, aplanado y relativamente corto, de color grisáceo a negruzco, lustroso, decorado con tres bandas angostas de color blanco, que se ubican sobre la línea media longitudinal del cuerpo y en cada uno de los extremos dorsolaterales, respectivamente. Cabeza bien diferenciada, subcuadrada, parcialmente hundida o cubierta por el protórax; de color negro con aparato bucal masticador bien desarrollado. Foramen occipital distintivamente más angosto que la cabeza, sutura frontal presente, sutura frontoclipeal ausente. Antenas de tres segmentos. Los tres segmentos torácicos son distintivamente más engrosados que los segmentos abdominales. El protórax más ancho que los otros dos segmentos torácicos, es de color blanco; dorsalmente presenta dos grandes y amplias manchas negras y abundantes chalazae. El meso y metanoto son de color grisáceo, con un par de manchas negras mas pequeñas que las del protórax. De cada segmento torácico se desprende un par de patas largas y delgadas de color negro. En vista lateral, el meso y metanoto, al igual que cada uno de los segmentos abdominales presenta tres estrumas de color negro, cada una con dos setas cortas que se ubican con posición submedia, medialateral y lateroventral respectivamente; en conjunto estas estrumas forman tres hileras que recorren longitudinalmente el cuerpo del insecto. El último segmento del abdomen presenta un órgano de succión que la larva utiliza hábilmente durante la búsqueda de alimento, durante el periodo de sujeción de la presa y para adherirse al sustrato al momento de la muda.
Las larvas son de color grisáceo en los instares uno y dos y negro en los instares tres y cuatro. Las tres bandas blancas dorsales y dorsolaterales se tornan más gruesas, claras y notorias a medida que la larva se desarrolla; así mismo las pequeñas hileras de tubérculos se hacen más prominentes en los estados avanzados. Al inal del cuarto instar la larva presenta un leve engrosamiento y disminuye considerablemente su movilidad iniciando de esta forma el periodo de prepupa. Luego, se torna de una tonalidad más oscura y mate y paulatinamente adopta una posición arqueada (Figura 1f). M. mexicana presenta pupa libre, con los apéndices cubiertos con la exuvia del último estadio larval, la cual se transforma a un color blanco con manchas típicas color negro y marrón. Aunque permanecen inmóviles, pueden reaccionar con un sólo movimiento brusco ante un estímulo externo.
Los adultos examinados midieron en promedio 4.9 mm de largo sin dimorismo sexual evidente con relación al tamaño o patrones de coloración. El cuerpo es oval-redondo con supericie dorsal fuertemente convexa y supericie ventral plana. Cabeza corta, transversa, parcialmente cubierta o hundida en el protórax, de color negro, presenta en la parte anterior una gran mancha blanca, bien deinida, con dos hileras longitudinales de pequeñas manchas negras. Tórax con pronoto transverso, convexo, emarginado y modiicado cubriendo los demás segmentos toráxicos sin producir estructuras que cubran la cabeza. El pronoto es de color blanco con un grupo de manchas negras simétricas equidistantes, que en conjunto semejan una letra M; adicionalmente se observan manchas aisladas, de tamaño más pequeño y forma no completamente deinida, ubicadas hacia los extremos ventrolaterales (Figura 1h). Las patas son de tonalidad naranja a marrón y las tibias y tarsos se retraen cerca al cuerpo. Las alas anteriores son un par de élitros convexos de supericie dorsal glabra y lustrosa, de márgenes laterales enteros que cubren por completo el abdomen. Presentan una coloración que varía desde rosa pálida hasta el rojo intenso y en vista lateral, cada élitro presenta dos manchas negras, siendo la anterior redondeada y la posterior ovalada y alargada.
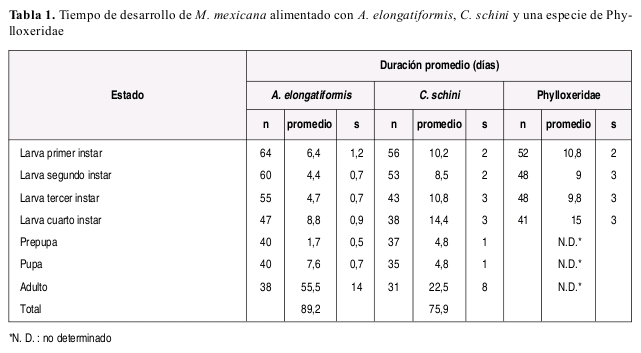
TIEMPO DE DESARROLLO
M. mexicana requirió de mayor tiempo para completar el estado larval cuando se alimento con C. schinni (promedio: 43.9 días) o la especie de Phylloxeridae (promedio: 44.6 días) (Tabla 1), en comparación con el tiempo requerido (promedio: 24.3 días) cuando se alimento con A. elongatiformis (Tabla 2).
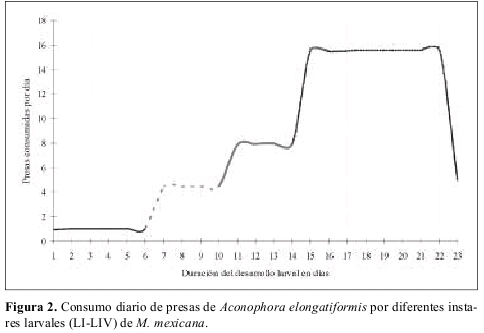
La duración de cada instar en proporción a la duración total del estado larval fue aproximadamente constante sin importar el tipo de alimento suministrado, y la duración del cuarto instar fue mayor que la duración del primer a tercer instar en todos los casos independientemente de la dieta suministrada. El número de presas requeridas diariamente fue variable de acuerdo con la especie presa y con el estado de desarrollo de la presa suministrado como alimento (Tabla 3). A manera de ejemplo se incluye la Figura 2 ilustrando el numero de presas requeridas y tiempo de desarrollo de cada instar larval de M. mexicana alimentada con A. elongatiformis.
M. mexicana se desarrolló normalmente desde huevo hasta el estado adulto con las dietas suministradas, sin embargo no se obtuvo postura de huevos en condiciones de laboratorio. En el caso de la dieta a base de A. elongatiformis se obtuvo mayor longevidad de los adultos que con la dieta a base de C. schini pero en ninguno de los dos casos ocurrió postura de huevos por parte de ninfas vírgenes o de aquellas mantenidas en coninamiento con machos. En general se observó mayor longevidad en hembras que en los machos adultos.

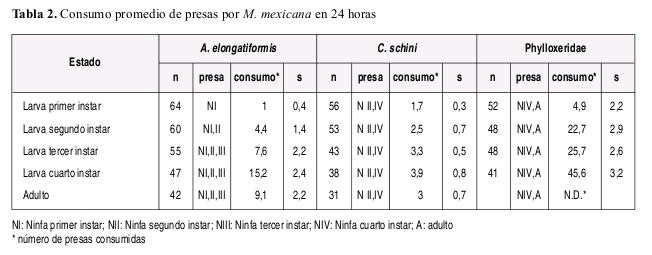
Observaciones sobre el comportamiento depredador. Las observaciones de comportamiento de búsqueda, captura y manipulación de los diferentes tipos de presas ofrecidas, permitieron evidenciar en forma cualitativa la mayor apetencia de M. mexicana por A. elongatiformis y la especie de Phylloxeridae mientras que se observó diicultad para acceder y consumir ninfas de C. schini. M. mexicana preiere presas relativamente más pequeñas que su tamaño lo cual se hizo muy evidente con la especie A. elongatiformis en la cual los últimos estados larvales y el adulto son evitados por el depredador preiriendo atacar ninfas de primer y segundo instar que le resultaron mas fáciles de manipular. Aparentemente el pronoto en forma de espina del membrácido es una efectiva forma de defensa física contra depredadores, como se evidenció en la incapacidad de M. mexicana para alimentarse de este estado del insecto.
En condiciones de campo, se observaron algunas posturas de M. mexicana en árboles de Caucho severamente infestados por P. calceolariae. Sin embargo, en condiciones de coninamiento los ataques de M. mexicana fueron rápidamente neutralizados por secreciones de coloración rojiza de las ninfas de la escama harinosa, que causaron rápidamente la muerte del depredador.
En general las larvas de los dos primeros instar de M. mexicana no son muy voraces independientemente de la presa ofrecida, siendo más voraces las larvas de tercer y cuarto instar. Estos devoran con gran habilidad ninfas de primer a tercer instar de A. elongatiformis y mostrando preferencia por los instares dos y tres. Mientras la ninfa de primer instar es usualmente desapercibida y la ninfa de cuarto instar consumida con diicultad, la ninfa de quinto instar ni los adultos de A. elongatiformis fueron consumidas en condiciones de laboratorio y el consumo de ninfas de quinto instar fue observado en el campo eventualmente. Las larvas de M. mexicana alimentadas con C. schini mostraron preferencia por el tercer y cuarto instar. Las larvas de segundo y tercer instar de M. mexicana mostraron gran apetencia en general por individuos de la especie de Phylloxeridae que infesta al Q. humboldti, mostrando más apetencia por los individuos de mayor tamaño.
Las larvas de M. mexicana muestran varias adaptaciones para la actividad de depredación. Por ejemplo, utilizan el órgano de succión para ijarse y desplazarse sobre el sustrato durante la búsqueda de la presa, lo cual es especialmente difícil en el caso de A. elongatiformis que produce abundante mielecilla de consistencia pegajosa y sin embargo el depredador no es atrapado. Así mismo, cuando se alimentan con ninfas de C. schini utilizan las mandíbulas para realizar una incisión sobre la capa gruesa cerosa exterior que protege dorsalmente el cuerpo de las ninfas, las cuales se desarrollan incrustadas dentro de agallas en la hoja, y de esa forma acceden a los tejidos internos de la presa.
Se observó que una mayor proporción de larvas sobrevivió con la dieta a base de A. elongatiformis en comparación con la de C. schinni, sin embargo el número de individuos que alcanza el estado de pupa y el estado adulto fue muy similar con las dos dietas (Figura 3).
Ocurrencia en campo La riqueza de especies insectiles asociadas con el chicalá fueron muy similares en diversas áreas de la ciudad; M. mexicana ocurrió en todas las áreas de la ciudad y estuvo presente durante todo el año de muestreo (Tablas 4, 5).
ANÁLISIS Y DISCUSIÓN DE RESULTADOS
El género Mulsantina cuenta con nueve especies distribuidas desde Canadá hasta Guatemala y Haití, que usualmente son colectados en Pinaceae, pero se conoce que algunas especies ocurren en Quercus, Populus y Cinchona (Chapin 1985). Registros biológicos de M. mexicana erróneamente determinada como M. picta minor (Chapin 1985) fueron estudiados en México (Torres et al. 1982). Las especies de este género son reconocidas como depredadoras de alta movilidad en plantaciones forestales maduras (Hodek y Honek 1996, Gordon 1985).
En general, las observaciones morfológicas de este estudio concuerdan con las descripciones morfológicas y de voracidad de los estados larvales de las poblaciones mexicanas de M. picta minor (Torres et al. 1982). El patrón de coloración observado en Bogotá no presenta variabilidad y corresponde al patrón más comúnmente observado de los 16 que ocurren en Mexico (Torres et al. 1982).
Las observaciones de tiempo de desarrollo en las condiciones ambientales de Bogotá sugieren que M. mexicana puede tener de 3 a 4 generaciones por año. El tiempo requerido para el desarrollo de M. mexicana en Bogotá fue mayor en comparación con el promedio requerido por M. picta minor estudiada en México. Estas diferencias pueden atribuirse a la temperatura de incubación y régimen alimenticio, ya que en ese estudio el coccinélido fue mantenido a temperatura mayor y alimentado únicamente a base de áidos como se discutirá más adelante (Torres et al. 1982).
Así mismo la poca actividad depredadora observada en el primer instar es comúnmente observada en coccinélidos cuyos primeros instares son extremadamente ineicientes en la captura de sus presas. De la misma manera la mayor duración del cuarto instar de desarrollo larval es una característica de este grupo de depredadores (Dixon 2000), podría decirse que los estados más eicientes para efectos de control natural son el segundo al cuarto instar.
M. mexicana se alimenta ávidamente de algunas poblaciones itófagas que infestan especies arbóreas ornamentales en Bogotá y constituye un elemento regulador interesante de ser estudiado con mayor profundidad, pero de la misma forma como ha sido observado en otros coccinélidos depredadores, el tiempo de desarrollo de M. mexicana es mayor al tiempo de desarrollo de las presas suministradas (Dixon 2000; Pinzón y Quintero 2002; Pinzón y González 2002) lo que limita su efectividad para regular especies de alto potencial reproductivo.
No todas las especies que un coccinélido depredador puede usar como alimento contienen todos los requerimientos nutricionales para su óptimo desarrollo; en general se considera que los coccinélidos de la tribu Coccinellini son particularmente especializados en el consumo de áidos que constituyen un 85% de su dieta principal y aunque existen casos, pocos se alimentan mayormente de psyllidos o membrácidos (Hales 1979, Hodek y Honek 1996, Leshen 2000, Civolani y Pasqualini 2003, Evans y Dixon 1986, Dixon 1970, Richards y Evans 1998). En adición a condiciones ambientales, las características de la dieta suministrada en nuestro estudio también pueden explicar diferencias en la duración del tiempo de desarrollo de M. mexicana comparada con estudios previos (Torres et al. 1982) y particularmente del estado de larva dependiendo de la especie presa suministrada. Los resultados de nuestro estudio sugieren que A. elongatiformis ofrece relativamente mejor calidad nutricional que las otras dos especies ofrecidas como alimento, dado que el tiempo de desarrollo fue menor con esa dieta. En el caso de la dieta a base de A. elongatiformis la longevidad de las hembras alcanzó en algunos casos mas de 80 días lo cual puede atribuirse a la ausencia de reproducción que parece estar relacionada con mayor longevidad para coccinélidos (Dixon 2000). En general se observó que la longevidad de los machos fue menor en comparación con la de las hembras.
Acorde con la deinición de Hodek y Honek (1996), las especies A. elongatiformis y C. schini pueden ser considerados como presas aceptadas o alternativas para M. mexicana pero no esenciales para su desarrollo dado que aunque el depredador alcanzó el estado adulto no fue posible obtener reproducción con esta dieta. Igualmente, la especie de Phylloxeridae es aceptada por el Coccinellidae pero se desconoce su esencialidad ya que no se estudio el consumo de presas y desarrollo con el estado adulto del depredador. En este trabajo no se hicieron observaciones de desarrollo de genitalia interna para analizar grado de inhibición o de afectación atribuible a la dieta ofrecida.
Los resultados del estudio en México (Torres et al.1882) sugieren la esencialidad de los áidos en la alimentación de M. mexicana para desarrollar normalmente la capacidad reproductiva. Así mismo, un análisis más detallado de la composición de las poblaciones insectiles presentes en las especies arbóreas estudiadas evidenciaron la constante presencia de poblaciones de áidos en bajas densidades, muy posiblemente a consecuencia de la actividad depredadora de M. mexicana que pasó inadvertida en nuestro estudio y que podría explicar la reproducción de M. mexicana en campo.
Dado que la escama harinosa del caucho (P. calceolariae) resultó toxica para M. mexicana, los intentos por atacar, y manipular la presa en el laboratorio pueden ser considerados más como resultado de ayuno extremo más que preferencia por la presa, sugiriendo que la presencia de huevos cerca de los ovisacos de la escama harinosa son casos excepcionales más que comunes en las preferencias de alimentación de M. mexicana.
REFERENCIAS BIBLIOGRÁFICAS
Barba, D. G. Caicedo. 1999. Regulación de Ceroplastes cundinamarcensis Mosquera (Homoptera:Coccidae) en la arborización de Santafé de Bogotá D.C. Resúmenes del XXVI Congreso de la Sociedad Colombia na de Entomología. Bogotá. pg. 153.
Blackwelder, R. 1944-1947. Checklist of the coleopterous insects of Mexico, Central America,
Caicedo, G. 1999. Hospederos de Ceroplastes cundinamarcensis Mosquera (Homoptera: Coccidae) en el ornato público en Santa fe de Bogotá D.C. Resúmenes del XXVI Congreso de la Sociedad Colombiana de Entomología. Bogotá. p. 16.
Caicedo, G. & E. Castelblanco, 1999. Aspectos ecológicos de la escama cerosa Ceroplastes cundinamarcensis Mosquera (Homoptera: Coccidae) en Santafé de Bogotá D.C. Resú menes del XXVI Congreso de la Sociedad Colombiana de Entomología. Santafé de Bogotá: SOCOLEN, 1999. p. 49.
Chapin, J. 1985. Revision of the genus Mul santina Weise (Coleoptera: Coccinellidae). Annals of the Entomological Society of America. 78( 1): 348 367
Civolani, S. & E. Pasqualini E. 2003. Ca copsylla pyri L. (Hom., Psyllidae) and its predators relationship in Italy's Emilia-Ro magna Region. Journal of Applied Ento mology. 127(4): 214-220.
Contreras, G. 1951. Coccinellidae colombia nos. Ordenación e iconografía. Revista de la Academia de Ciencias Exactas, Físicas y Naturales. Colombia. Vol VIII. ( 30): 243 245.
DAMA. 2000. Guía preliminar de insectos de Santafé de Bogotá y sus alrededores. Bogo tá: Alcaldía Mayor de Bogotá, 2000. 95 p.
Dixon, A. 1970. Factors limiting the effective ness of the coccinellidae beetle, Adalia bi punctata (L.) as a predator of the sycamore aphid, Drepanosiphum platanoides (Schr.). Journal of Animal Ecology. 39: 739-751
Dixon, A. 2000. Insect predator-prey dyna mics. Ladybird beetles and biological con trol. Cambridge. University Press. 257 pgs.
Evans, E. & A. Dixon. 1986. Cues for ovipo sition by ladybird beetles (Coccinellidae): response to aphids. Journal of Animal Eco logy 55: 10271034.
Gordon, R. 1985. The Coccinellidae (Coleop tera) of America North of Mexico. Journal of the New York Entomological Society 93(1): 1912
Hales, D. 1979. Population dynamics of Harmonia conformis Coleoptera : Coc cinellidae on Acacia. General & Applied Entomology. 11 :3-8.
Hodek, I. & A. Honek. 1996. Ecology of Coc cinellidae. Kluwer Academic Publishers. 464 pgs.
Leshen, R. 2000. Beetles feeding on bugs (Coleoptera, Hemiptera): Repeated shifts from mycophagous ancestors. Invertebrate Taxonomy. 14(6): 917-929.
Pinzón, O. & R. González. 2001. Carac terización biológica, hábitos, enemigos naturales y luctuación poblacional de Ca llophya schini Tuthill en la especie forestal Shinus molle L. en Bogotá. Revista Cien tíica. Revista Centro de Investigaciones y Desarrollo Cientíico. Universidad Dis trital Francisco José de Caldas Bogotá 3: 149-164.
Pinzón, O. & F. Pedreros 1996. Biología, há bitos y enemigos naturales de la chinche del Urapan (Tropidosteptes chapingoensis) en Santafé de Bogota. Vol. 4 (9): 44-55
Pinzón, O. 1999. Problemas itosanitarios en árboles ornamentales en Santafé de Bogo tá. Colombia Forestal. 6(12): 44-51.
Pinzón, O. & Y. Osorio 2001. Contribución al conocimiento de Mastigimas sp. plaga de Cedrela sp. en Bogota. Resúmenes XXVIII Congreso Sociedad Colombiana de Ento mología Sociedad Colombiana de Entomo logía Agosto-XXVIII. Pg. 22.
Pinzón, O. & P. Quintero 2001. Caracteriza ción biológica, hábitos y enemigos natura les de Aconophora elongatiformis Dietrich en Tecoma stans árbol ornamental de Bo gota. Revista Colombia Forestal. 7 (14): 33-54
Piñeros, L. 1997. Reconocimiento y evalua ción preliminar de neurópteros asociados con el Urapan (Fraxinus chinensis var. Acuminata Lingelesch), sobre la chinche Tropidosteptes chapingensis Carvalho y Rosas ( Hemíptera Miridae) en Santafé de Bogotá. D.C. Bogotá, 1997, 115 p. Tesis de grado (Ingeniero Agrónomo). Univer sidad Nacional de Colombia. Facultad de Agronomía.
Richards, D. & E. Evans. 1998. Reproductive responses of aphidophagous lady beetles (Coleoptera: Coccinellidae) to nonaphid diets: An example from alfalfa. Annals of the Entomological Society of America. 91(5): 632-640.
Rogers, L. 2001. CABI. Comunicación per sonal.
Torres, D., H. Bravo, J.Vera & T. Saito 1982. Biología, morfología y comportamien to alimenticio de Mulsantina picta minor (Coleoptera: Coccinellidae). Agrociencia. 50: 17-34.
Notas
1 Trabajo de investigación inanciado parcialmente con recursos del Centro de Investigaciones y Desarrollo Cientíico de la Universidad Distrital Francisco José de Caldas.
Creation date:
Licencia
Colombia Forestal conserva los derechos patrimoniales (copyright) de las obras publicadas, y favorece y permite la reutilización de las mismas bajo la licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional por lo cual se pueden copiar, usar, difundir, transmitir y exponer públicamente, siempre que:
Se reconozcan los créditos de la obra de la manera especificada por el autor o el licenciante (pero no de una manera que sugiera que tiene su apoyo o que apoyan el uso que hace de su obra).









