DOI:
https://doi.org/10.14483/22484728.4398Publicado:
2013-09-01Número:
Vol. 7 Núm. 1 (2013)Sección:
Visión ActualEstado del arte en biocompatibilidad de recubrimientos
Biocompatibility of coatings: survey paper
Palabras clave:
Biocompatibility, coating, corrosion, cell in vitro culture, implant (en).Palabras clave:
Biocompatibilidad, recubrimiento, corrosión, cultivos in vitro, implante. (es).Descargas
Referencias
M.E. Sánchez e I. Campos. Tecnología de materiales. México: Editorial Trillas, 2010.
J. Hetch, “Kennewick Man led a rough, tough life”, New science, vol. 169, fasc. 2541, 2006.
D. F. Williams, “Definitions in Biomaterials”, presented at Procedings of a consensus conference of the European society of biomaterials. Chester, England, 1986.
D. F. Williams, J. Black y P. J. Doherty, “Second consensus conference on definitions in biomaterials”, Chester, England. In P. J. Doherty, R.F. Williams, D.F. Williams, A. Lee, eds. Biomaterial-tissue interfaces. Advances in biomaterials, Vol. 10. Elsevier, Amsterdam, 1992.
D. F. Williams, Definitions in biomaterials. Amsterdam: Elsevier, 1987.
Biomaterials editorial, “Trends in biomaterials research: An analysis of the scientific program of the world biomaterials congress 2008”, Biomaterials, vol. 29, pp. 3047 3052, 2008.
D. F. Williams, “On the mechanics of biocompatibility”, Biomaterials, vol. 29, pp. 2941-2953, 2008.
D. Clavijo, “Crecimiento y caracterización de un recubrimiento nanoestructurado para uso biomédico”, Tesis de maestría, Universidad Nacional de Colombia, Bogotá, Colombia, 2010.
R. Olivares, J.J. Olaya, C. Ramírez and S. Rodil, “Biocompatibility of niobium coatings”, Coatings, Vol 1, pp. 72-87, 2011.
C. K. Kang and Y. S. Lee, “Carbohydrate polymer grafting on stainless steel surface and its biocompatibility study”, Journal of industrial and Engineering Chemistry, vol. 18, N.º 5, 1670-1675, pp. 1-6, 2012.
S. Rodil, “Modificación superficial de biomateriales mecánicos”, Revista latinoamericana de metalurgia y materiales, vol. 29, pp. 67-83, 2009.
A. Santana, J. Mirza-Rozca, E. Vasilescu, P. Drobb, D. Raducanu and L. Angelescu, “Technical and functional properties of some biocom thin films”, Materials Chemestry and physics, vol. 86, pp. 38-43, 2004.
E. O. Martz, V. K. Goel, M. H. Pope and J. B. Park, “Materials and Design of Spinal Implants”, Journal of Biomedical Materials Research, vol. 38, pp. 267-288, 1997.
C. Trépanier, T. K. Leung and M. Tabrizian “Preliminary investigation of the effects of surface treatments on biological response to shape memory NiTi stents”, Journalof Biomedical Materials Research, vol. 48, pp. 165-171, 1999.
H. Matsuno, A. Yokoyama, F. Watari, M. Uo, and T. Kawasaki, “Biocompatibility and osteogenesis of refractory metal implants, titanium, hafnium, niobium, tantalum and rhenium”, Biomaterials, vol. 22, pp. 1253-1262, 2001.
H. Aita, N. Hori, M. Takeuchi, T. Suzuki, M. Yamada, M. Anpo, and T. Ogawa, “The effect of ultraviolet functionalization of titanium on integration with bone”, Biomaterials, vol 30, pp. 1015-1025, 2009.
N. R. Washburn, K. M. Yamada, C. G. Simon, S. B. Kennedy and E. J. Amis, “High-throughput investigation of osteoblast response to polymer crystallinity: influence of nanometer-scale roughness on proliferation”, Biomaterials, vol. 25, pp. 1215-1224, 2004.
M. Bächle and R. J. Kohal, “A systematic review of the influence of different titanium surfaces on proliferation, differentiation and protein synthesis of osteoblast-like MG63 cells”, Clin Oral Implants, vol. 15, pp. 683-92, 2004.
C. Ramírez, S. Rodil, H. Arzate y C. Magaña, “Influencia de la rugosidad de películas de carbono amorfo en la adhesión de osteoblastos”, presentado en Octavo congreso de microscopia, México, 2006.
E. Eisenbarth, M. Muller, R. Thull, D. Velten and J. Breme, “Nanostructured niobium oxide coatings influence osteoblast adhesión”, Journal of Biomedical Materials Research, vol 79, pp. 166-217, 2006.
G. Bordjih, J. Jouzeau, D. Mainard, E. Payan, J. P. Delagoutte and P. Netter, “Evaluation of the effect of three surface treatments on the biocompatibility of 316L stainless steel using human differentiated cells”, Biomaterials, vol. 17, pp. 491-500, 1996.
J. Vanegas, D. Garzón y M. Casale, “Interacción entre osteoblastos y superficies de titanio: aplicación en implantes dentales”, Revista Cubana de Investigaciones Biomédicas, vol. 29, 2010.
J. Serrano, J. De la Fuente, M. Álvarez, M. García, C. Hernández, A. Arellano, J. Juárez y O. Álvarez, “Caracterización y respuesta biológica de nanocerámicas de óxido de circonio sintetizado por el método de rocío pirolítico ultrasónico”, Superficies y Vacío, vol. 2, pp. 27-30, 2010.
G. Ramírez, “Biocompatibilidad de películas delgadas de oxido de Niobio depositadas por sputtering sobre acero inoxidable 316L”, Tesis de maestría, Universidad Nacional de Colombia, Bogotá, Colombia, 2010.
E. G. Hayman, E. Engvall, E. A’Hearn, D. Barnes, M. Pierschbacher and E. Ruoslahti, “Cell attachment on replicas of SDS polyacrylamide gels reveals two adhesive plasma proteins”, J Cell Biol, vol 95, pp. 220-223, 1982.
S. Rodil, R. Olivares, H. Arzate and S. Muhl, “Properties of carbon films and their biocompatibility using in vitro tests”, Diamond and Related Materials, vol. 12, pp. 931-937, 2003.
J. Davies, “Bone bonding at natural and biomaterial surfaces”, Biomaterials, vol. 28, pp. 5058-5067, 2007.
LL. Guéhennec, A. Soueidan, P. Layrolle and Y. Amouriq, “Surface treatments of titanium dental implants for rapid osseointegration”, Dental Materials, vol. 23, pp. 844-854, 2007.
G. Mazzaglia, “Evaluación de la humectabilidad y de la rugosidad de superficies de titanio con diferentes tratamientos y su relación con la adhesión celular”, Tesis doctoral, Universidad de Granada, Granada, España, 2006.
J. Gómez, L. Forero, P. Escobar y W. Valdivieso, “Estudio de citotoxicidad y de adhesión de células humanas de osteosarcoma en Ti-6Al-4V superficialmente modificado”, Scientia et Technica Año XIII, vol. 36, pp. 85-89, 2007.
S. Bruni, M. Martinesi, M. Stio, C. Treves, T. Bacci, and F. Borgioli, “Effects of surface treatment of Ti–6Al–4V titanium alloy on biocompatibility in cultured human umbilical vein endothelial cells”, Acta Biomaterialia, vol. 1, pp. 223-234, 2005.
A. Soto, “Introducción a los Biominerales y Biomateriales”, Programa de Doctorado en Ciencias de la Ingeniería, Universidad de Chile, Santiago, Chile, pp. 1-31, 2003.
A. Boskey, “Biomineralization: An overview”, Connective Tissue Research, vol. 44, pp. 5-9, 2003. [34] B. D. Boyan, T. W. Hummert, D. D. Dean and Z, Schwartz, “Role of mate rial surfaces in regulating bone and cartilage cell response”, Biomaterials, vol. 17, pp. 137-146, 1996.
M. Ahmad, M. McCarthy and G. Gronowicz, “An in vitro model for mineralization of human osteoblast-like cells on implant materials”, Biomaterials, vol. 20, pp. 211 220, 1999.
H. Zhanga, L. Courtland, M. Aronowa and G. Gronowicza, “The effects of patient age on human osteoblasts response to Ti–6Al–4V implants in vitro”, Journal of Orthopaedic Research, vol. 22, pp. 30-38, 2004.
K. Sagomonyants, M. Jarman-Smith, J. Devine, M. Aronow and G. Gronowicz, “The in vitro response of human osteoblasts to polyetheretherketone (PEEK) substrates compared to commercially pure titanium”, Biomaterials, vol 29, pp. 1563-1572, 2008.
E. Kitamura, R. Stegaroiu, S. Nomura and O. Mikakawa, “Biomechanicalaspects of marginal bone resorption around osseointegrated implants:considerations based on a three-dimensional finite element analysis”, Clin Oral Implants, vol. 15, pp. 401-412, 2004.
J. Rho, R. Ashman and C. Turner, “Young’s modulus of trabecular and cortical bone material: ultrasonic and microtensile measurements”, Journal of Biomechanical, vol. 26, pp. 11-119, 1993.
F. Isidor, “Influence of forces on periimplant bone”, Clin Oral Implants, vol. 17, pp. 8-18, 2006.
M. Khadraa, S. Lyngstadaasb, H. Haanæsa and K. Mustafa, “Effect of laser herapy on attachment, proliferation and differentiation of human osteoblast like cells cultured on titanium implant material”, Biomaterials, vol. 26, pp. 3503-3509, 2005.
H. J. Guzmán, “Aleaciones para colados de uso odontológico”, Federación Odontológica Colombiana, vol. 27, pp. 32-45, 1980.
K. C. Paul, “Enhancement of surface properties of biomaterials using plasma- based technologies”, Surface and Coatings Technology, vol. 201, pp. 8076- 8082, 2007.
J. Wataha, “Biocompatibility of dental casting alloys. A review”, Journal of Prosthetic Dentals, vol. 83, pp. 223-233, 2000.
C.W. Wu, “corrosion-wear study of 304 stainless steel in various NaCl solutions”, Wear, vol 162-164, pp. 950-953, 1993.
Y. Meas, “Técnicas electroquímicas para la medición de la velocidad de corrosión”, [En línea]. disponible en http://depa.pquim.unam.mx/labcorr/libro/Teoriacorrosion.PDF.
I. A. García, “Medidor de voltametría cíclica para dispositivos de transmitancia controlable”, [En línea]. Disponible en http:// http://e archivo.uc3m.es/bitstream/10016/10674/1/PFC_IvanAndres_Gonzalez_Garcia.pdf.
T. O. Hanawa and M. Ota, “Characterization of Surface Film Formed on Titanium in Electrolyte using XPS”, Applied Surface Science, vol. 55, pp. 269-276, 1992.
A. Moroni, V. L. Caja, E. L. Egger, L. Trinchesea, E. Y. S. Chaob “Histomorphometry of hydroxyapatite coated and uncoated porous titanium bone implants”, Biomaterials, vol. 15, pp. 926-930, 1994.
G. M. Pardo, F. Y. Oliva y O. R. Cámara, “Diseño y caracterización fisicoquímica de superficies de materiales biocompatibles (óxidos de metales)”, en 2do Encuentro de Jóvenes Investigadores en Ciencia y Tecnología de Materiales. Posadas, Misiones, Argentina, 16-17, pp. 1-6, octubre 2008.
M. M. Atik and M. A. Aegerterb “Corrosion Resistant sol-gel ZrO coatings on stainless Steel”, Non-Crystalline Solids, vol.147-148, pp. 813-819, 1992.
R. Maggio, S. Rossi, L. Fedrizzi and P. Scardi “ZrO2-CeO2 Films as protective coatings against dry and wet corrosion of metallic alloys”, Surface and coatings technology, vol. 89, pp. 292-298, 1999.
A.V. Zykova, V. V. Lukyanchenkob and V. I. Safonov, “The corrosion properties of implanted materials with protective coatings in isotonic physiological solution”, Surface & Coatings Technology, vol. 200, pp. 90-93, 2005.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
VISIÓN ACTUAL
Visión Electrónica, 2013-06-03 Volumen:7, Año:1 pág: 160–177
ESTADO DEL ARTE EN BIOCOMPATIBILIDAD DE RECUBRIMIENTOS
BIOCOMPATIBILITY OF COATINGS: SURVEY PAPER
Fecha de envío: junio de 2012
Fecha de recepción: agosto de 2012
Fecha de aceptación: diciembre de 2012
Andrés O. Garzón
Ingeniero de Diseño y Automatización Electrónica, estudiante de Maestría en Materiales y Procesos de Manufactura. Universidad Nacional de Colombia. aogarzonp@unal.edu.co
Nelly O. Aguirre
Ingeniera Mecánica, estudiante de Maestría en Materiales y Procesos de Manufactura. Universidad Nacional de Colombia. noaguirret@unal.edu.co
Jhon J. Olaya
Ingeniero Metalúrgico, MSc y Phd en Materiales. Coordinador y docente del Departamento de Ingeniería Mecánica– mecatrónica. Universidad Nacional de Colombia. jjolayaf@unal.edu.co
RESUMEN
El éxito de un material biocompatible está intrínsecamente ligado con el mejoramiento de sus propiedades superficiales, ya que es la superficie la que estará en contacto directo con el sistema vivo en el caso de que el material sea implantado. Se ha demostrado, por ejemplo, mediante cultivos de células in vitro, que factores como la rugosidad superficial aumentan la adhesión celular sobre el biomaterial. En consecuencia, las investigaciones actuales sobre el diseño y desarrollo de materiales biocompatibles para implantes dentro de sistemas vivos deben abordar las técnicas de recubrimientos y modificaciones superficiales. El artículo que se tratará a continuación es una revisión bibliográfica sobre biocompatibilidad de recubrimientos superficiales, teniendo como referencia las pruebas que para tal efecto se usan: adhesión celular, viabilidad celular, biomineralización y corrosión; así como sus métodos fundamentales.
Palabras claveBiocompatibilidad, recubrimiento, corrosión, cultivos in vitro, implante.
Abstract
The success of a biocompatible material is intrinsically linked to the improvement on its surface properties since the surface is to be in direct contact with the living system when the material is implanted. For example, it has been shown that, via in vitro cell cultures, factors such as surface roughness or porosity increase cell adhesion on the biomaterial. Consequently, recent research on the design and development of biocompatible materials for implants in living systems must be closely connected to surface modifications and coating manufacturing techniques. The present article describes biocompatibility of surface coatings using, as a point of reference, widely implemented tests, namely cell adhesion, cell viability, biomineralization and corrosion, as well as their fundamental methods.
Key WordsBiocompatibility, coating, corrosion, cell in vitro culture, implant.
Introducción
Usualmente, los biomateriales pueden definirse como materiales biológicos comunes, bien sea la piel, la madera o cualquier material no biológico que reemplace la función de los tejidos o de los órganos vivos. En otros términos, un biomaterial es una sustancia farmacológicamente inerte diseñada para ser implantada o incorporada dentro de un sistema vivo [1].
La evidencia más antigua de un material no biológico interactuando con un organismo vivo fue una flecha con cabeza de piedra encontrada en la cadera del hombre Kennewick, nombre dado a los restos de un hombre prehistórico, descubiertos en 1996 en Norte América, el cual se conservo por más 9000 años. Sobre la flecha se evidencia cicatrización, indicando la recuperación de la marcha funcional y una elevada tolerancia a la presencia de un cuerpo extraño [2]. Hallazgos del 2000 a. C. comprueban tratamientos externos de fracturas, amputaciones y reemplazos exitosos con prótesis de madera, talladas para imitar rasgos anatómicos característicos de las extremidades humanas.
la bioreactividad in vivo sobre perros, usando metales como oro, plata, platino, acero y níquel. Más adelante, en 1924 Arthur Zierold documentó la reacción de los tejidos vivos frente a materiales como aluminio, plata y oro, de los cuales determinó que, a pesar de su buena tolerancia, sus propiedades mecánicas no eran aceptables, lo cual fue el punto de partida de muchas investigaciones que tenían como fin elaborar aleaciones entre metales que combinaran buena tolerancia con características mecánicas aceptables. Posterior a las primeras síntesis de materiales poliméricos artificiales, en 1940 se pensó en estos como posibles alternativas en vez de los metales para implantes. A materiales como el nylon y el celofán se les practicaron pruebas in vitro, pero evidenciaron reacciones marcadamente fibróticas. Por su parte, materiales biocompatibles ampliamente usados como el titanio y el teflón aparecieron en el ámbito científico en 1947 y 1949 respectivamente.
La Segunda Guerra Mundial fue el punto de partida para el desarrollo de nuevos biomateriales y procesos, ante la necesidad de rehabilitar y mejorar la calidad de vida de los heridos en combate. Entre los éxitos con más trascendencia en este periodo histórico se encuentra el adelanto de los implantes intraoculares de poli–metilmetacrilato ((C5 O2 H8)n) y el establecimiento de la multidisciplinariedad en la ciencia de los materiales, por el trabajo conjunto que desarrollaron profesionales de la medicina e ingenieros. Aun con todo esto, fue hasta 1987 que se dio una definición consensuada de biomaterial: “un biomaterial es un material no viable usado en dispositivos médicos tratando de interactuar con sistemas biológicos” [3].
Hacia 1992 se obtuvo en conformidad una segunda definición más puntual: “Materiales destinados a hacer una interfase con sistemas biológicos para evaluar, tratar, aumentar o reemplazar algún tejido, órgano o función del cuerpo” [4]. De manera que este tipo de materiales, al estar en interacción directa con un organismo vivo, generan sobre este una respuesta biológica, en la cual el material puede afectar el medio o bien el medio puede afectar el material. Como mecanismo de defensa ante la intrusión de elementos ajenos a su naturaleza, todos los organismos vivos poseen un sistema de protección; en el cuerpo humano el sistema inmunológico es el encargado de cumplir esta tarea de identificación, determinando si un objeto es material propio del cuerpo o extraño al mismo, para luego constituir una reacción frente a dichos cuerpos extraños, bien sea eliminándolos cuando son de tamaño molecular mediante anticuerpos o generando reacciones inflamatorias alrededor de este cuando son de un mayor tamaño. En esta medida, se puede decir que algunos materiales son más biocompatibles que otros al no generar algún tipo de reacciones de rechazo por parte del cuerpo [1].
Una primera definición oficial aceptada de biocompatibilidad se obtuvo en la conferencia de Chester de la European Society for biomaterials en 1987, en la que se define la biocompatibilidad como “la capacidad de un material de ser utilizado en una aplicación específica con una respuesta adecuada del tejido receptor” [5]. Aunque posteriormente se definiría de una manera más acertada, como la:
Habilidad de un biomaterial para llevar a cabo una función deseable con respecto a una terapia médica, sin producir efectos indeseables locales o sistémicos en el recipiente o beneficiario de esta terapia, generando una respuesta celular o tisular apropiadamente benéfica en una situación específica y optimizando el rendimiento clínicamente para esta terapia [6, 7].
Esta última definición, a diferencia de su anterior, presenta un mayor entendimiento sobre los impactos que tiene la interacción de los biomateriales con los tejidos vivos; además de recalcar no solo el efecto negativo que puede llegar a tener esta relación, sino también mostrar a los biomateriales como responsables de potenciar y optimizar el proceso de crecimiento celular [8].
1. Biomateriales y superficies
Para el desarrollo de dispositivos biomédicos e implantes, la naturaleza química y la textura superficial de los biomateriales son factores determinantes en la biocompatibilidad, ya que la superficie del biomaterial es la primera en entrar en contacto con el tejido vivo cuando este se introduce en el cuerpo [9].
Cuando los biomateriales se insertan en el cuerpo humano, sus superficies entran en contacto con el tejido huésped o con los fluidos corporales induciendo una variedad de respuestas biológicas tales como la adsorción de proteínas, la formación de trombos e inflamación; determinadas en gran parte, como se mencionó anteriormente, por las propiedades superficiales de los materiales. En consecuencia, una respuesta biológica desfavorable puede reducir con rapidez el desempeño esperado de un biomaterial o causar efectos secundarios graves, convirtiendo la modificación de las superficies de los materiales biocompatibles en un factor que es críticamente importante [10].
Resulta bastante complicado encontrar un material biocompatible que combine excelentes propiedades mecánicas adaptables al organismo, tales como resilencia, módulo elástico, dureza, buena resistencia a la fatiga de acuerdo al tiempo de vida [11], junto con características superficiales biocompatibles. Debido a esto, durante las últimas dos décadas se ha acelerado y expandido el desarrollo de diferentes técnicas de modificación superficial de materiales biocompatibles que no sean solamente tóxicos para el organismo sino que, a su vez, propicien el crecimiento celular (biofuncionales). De esta manera, es posible hacer biomateriales ideales con atributos superficiales que reaccionen adecuadamente con los tejidos del huésped, además de tener como valor agregado sustituir las aleaciones de alto costo, como las de titanio y CrCo, con recubrimientos en forma de películas delgadas más estables y económicas [12].
Materiales, como el acero inoxidable, han sido usados ampliamente en implantes ortopédicos, prótesis y stents debido a su resistencia mecánica y de corrosión (propiedad que determina el tiempo de servicio de un dispositivo y establece la nocividad de los productos de corrosión que pueden ser liberados hacia el organismo) [9], pero no se recomienda el uso de este sin ningún recubrimiento o tratamiento superficial, ya que puede causar una respuesta desfavorable para el organismo vivo [13,14], además de ser un material poco biofuncional.
Un ejemplo de biocompatibilidad de metales fue desarrollado por H. Matsuno y colaboradores en 2001 [15], quienes evaluaron la biocompatibilidad de metales como el renio, titanio, tantalio, hafnio y niobio, implantando alambres de estos materiales en el tejido subcutáneo de la región abdominal y en la médula ósea femoral de ratas, por tiempos de dos a cuatro semanas, con el fin de observar un crecimiento óseo y una buena compatibilidad con los tejidos. Los resultados mostraron un crecimiento en el porcentaje de hueso así como una biocompatibilidad óptima.
En la figura 1 se muestra cómo la región con un contraste más brillante corresponde a un implante de metal, la zona gris adyacente es el hueso recién formado y la zona más oscura es la médula ósea. El hueso recién formado se observó en una capa con un espesor casi constante de aproximadamente 20 micras.
Figura 1. Imágenes tomadas por microscopio electrónico de barrido (SEM) de la interface compuesta por el implante de metal (a. Titanio, b. Hafnio) y el hueso formado alrededor de este después de 4 semanas.

Fuente: [15].
A continuación se referenciarán una serie de trabajos en los cuales se han analizado la biocompatibilidad de recubrimientos superficiales, mediante pruebas in vivo e in vitro, con el fin de recalcar la importancia que tiene el surgimiento de estas nuevas técnicas e investigaciones sobre recubrimientos biocompatibles en el diseño y fabricación de diferentes productos, destinados a cumplir funciones ortopédicas, prótesis o de implantes dentales.
2. Pruebas de biocompatibilidad sobre recubrimientos
El desarrollo de las nuevas tecnologías de recubrimientos biocompatibles, generadas aproximadamente durante las últimas dos décadas, se ha basado en la deposición de películas delgadas del orden de los 100 a 200 nm sobre sustratos de materiales biocompatibles o inertes, para su posterior estudio in vitro o in vivo, mediante el uso de técnicas como la deposición física en estado de vapor (PVD), electrospray, sol–gel, técnicas de deposición químicas en estado de vapor (CVD), entre otras, con el fin de evaluar su biocompatibilidad mediante el estudio de la corrosión, adición, viabilidad, proliferación y biomineralización en el caso de cultivos celulares de origen óseo.
2.1 Adhesión, proliferación y viabilidad celular
Debido a que la adhesión celular hace referencia a la cantidad de células que se pueden adherir a la superficie de un material biocompatible, este se vuelve un factor relevante dentro de la biocompatibilidad de materiales para implantes y en especial para su superficie de contacto, como es el caso de los recubrimientos en la medida en que se encuentran en contacto directo con los tejidos de un sistema vivo.
Se ha establecido que la adhesión celular está ligada intrínsecamente a una apropiada morfología superficial; al aumentar la rugosidad del material y, por lo tanto, el área de contacto entre el implante y el tejido, hay una mayor adhesión celular [16], [19].
En el 2006, Eisenbarth y colaboradores [20] evaluaron la incidencia de la rugosidad de los recubrimientos en la adhesión celular. Mediante la técnica de sol–gel recubrieron el titanio con diferentes óxidos (Al2 O3, Nb2O6, Ta2O6, TiO2, ZrO2) y luego compararon la viabilidad celular, in vitro, de células preosteoblásticas MC3T3–E1 en contacto con el material, durante 6 días. Observaron que hay diferencias, estadísticamente significativas, entre el titanio CP y los recubrimientos de óxido de tantalio y óxido de zirconio (ver figura 2). Por su excelente biocompatibilidad seleccionaron el recubrimiento de Nb2O6 y sobre este se evaluó la incidencia de la rugosidad del recubrimiento en la adhesión celular. La rugosidad varió entre 7 y 40 nm, por medio de tratamientos térmicos. A temperaturas mayores de 450 °C y con una rugosidad de 15 nm es más lenta la adhesión y migración celular, pero hay adhesión y producción de colágeno.
Figura 2. Imagen modificada de la viabilidad celular de los recubrimientos de óxidos metálicos tomando como control Ti. Nanostructured niobium oxide coatings influence osteoblast adhesion. Eisenbarth
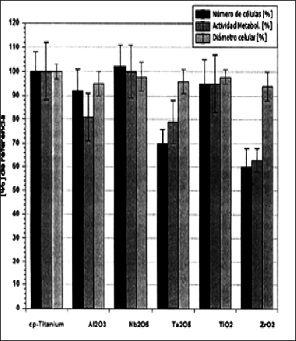
Fuente: [20].
En 1996, Bordjih y colaboradores [21] evaluaron la biocompatibilidad de tres tratamientos superficiales aplicados sobre acero inoxidable 316L, utilizando células humanas diferenciadas (osteoblastos y fibroblastos). Los tratamientos además tenían la finalidad de mejorar la dureza, la resistencia a la corrosión y el desgaste. Los resultados arrojaron que aunque se presenta una marcada mejora en las propiedades del acero inoxidable 316L, sobre todo en su resistencia a la corrosión, la nitruración disminuye citocompatibilidad debido a las características superficiales obtenidas, destacando la importancia topográfica que debe tener la superficie para obtener una optima adhesión y crecimiento celular.
El procedimiento usado por varios estudios [22,23] para determinar la adhesión celular sobre la superficie de un biomaterial empieza con la incubación de las muestras del cultivo celular durante cierto periodo de tiempo, que oscila entre las 12 y 24 horas [21]–[24], bajo condiciones determinadas. Luego de la incubación, las células sin adherir al sustrato se retiran mediante lavados con sustancias como el agua estéril o buffer de fosfatos (PBS). Por su parte las células que permanecen adheridas al sustrato se fijan y se tiñen con 300 µL de una solución compuesta por 0,1 % de azul de toluidina y de un 3,5 % o 4 % de paraformaldehido [25,26]. Posterior a un lapso de tiempo que varía según las especificaciones del estudio y a temperatura ambiente, se extrae un volumen determinado de la muestra para medir su absorción óptica a una longitud de onda establecida mediante un ensayo inmunoabsorbente ligado a enzimas (Elisa). El número de células con actividad mitocondrial, es decir, las células vivas y adheridas al sustrato, es proporcional a la absorbancia de las muestras experimentales [24], [26].
J. Vanegas y colaboradores, en el 2010 [22], analizaron la respuesta biológica de células humanas con carácter osteoblástico sobre superficies de implantes dentales, usualmente empleados para determinar cuál poseía un comportamiento óptimo en términos de adhesión celular, proliferación celular y biomineralización. Las cuatro superficies trabajadas fueron: a) superficies maquinadas, b) superficies tratadas con chorro de arena y grabado ácido (SBAE), c) superficies recubiertas con hidroxiapatita (HA) y fosfato tricálcico (TCP), y d) superficies recubiertas con TCP y tratadas con grabado ácido (TCP + ácido), aplicadas sobre sustratos Ti–6Al–4V.
Los resultados del ensayo de adhesión celular mostraron que las células osteoblásticas se adhieren a las superficies TCP y (TCP + ácido) de mejor forma que sobre las superficies maquinadas y SBAE. Sugiriendo un incremento en la interacción celular como consecuencia de la presencia de bordes y cortes en la superficie del biomaterial (rugosidades). A su vez, se demostró que la adhesión celular en superficies con poco tratamiento superficial es menor, corroborando la importancia de las estructuras a micro y submicro escala sobre el sustrato de prueba [27], [29].
En el 2010, un estudio realizado por J. Bello y colaboradores [22] muestra el desarrollo y la importancia de la adhesión celular. En él se caracterizó la respuesta biológica de nanocerámicas de óxido de zirconio y se demostró que la citotoxicidad por parte del ZrO2 hacia las células osteoblásticas es nula, ya que las células muestran una adhesividad mayor al 100 % en las superficies cerámicas respecto a la superficie del vidrio (corning glass 7059), utilizado como patrón de referencia, así como una viabilidad celular excelente.
Por su parte, para cuantificar la citotoxicidad celular de un biomaterial se emplea el ensayo de MTT [8], [22–24], [29]. Dicha prueba analiza, de manera simultánea, el proceso de proliferación celular y la viabilidad celular. Esta última se refiere a la capacidad de las células de seguir desarrollando sus funciones metabólicas de manera “saludable” ante la presencia del biomaterial. El ensayo MTT (bromuro de 3–[4–5, dimetiltiazol–2–ilo]–2,5– difeniltetrazol) es una prueba colorimétrica estandarizada, el MTT amarillo es reducido a formazán púrpura cuando hay actividad mitocondrial, por lo tanto, el formazán que se produzca dentro de la muestra es directamente proporcional a las células vivas [8].
J. Gómez y colaboradores [30], en el 2007, estudiaron la citotoxicidad y la adhesión de células humanas de osteosarcoma en Ti–6Al–4V superficialmente modificado. Para ello utilizaron la prueba colorimétrica de viabilidad celular MTT, con la cual se pudo determinar cómo las superficies modificadas no presentaron citotoxicidad aparente, dado posiblemente por la capa de óxido de titanio que de manera natural se forma sobre las aleaciones de este tipo de material, el cual se tanioconsidera un factor en el aumento en la biocompatibilidad; como se reafirma en el estudio del 2005, hecho por S. Bruni y colaboradores, en el cual se analizaron los efectos que tienen los tratamientos superficiales sobre la aleación de titanio Ti–6Al–4V respecto al aumento de su biocompatibilidad, utilizando cultivos de células endoteliales de vena umbilical humana [31]. Concluyendo mediante los ensayos de calorimetría MTT que hay una mayor viabilidad en los cultivos celulares, en la medida que se modifica la superficie de la aleación de titanio; en este caso, las modificaciones superficiales están orientadas a aumentar el grosor de la capa de óxido formado.
De las figuras 3, 4 y 5, tomadas de [30], [24], [8] respectivamente, se puede concluir que según los estudios colorimétricos MTT hay una mayor viabilidad en las superficies modificadas de las probetas del Ti–6Al–4V y el acero inoxidable 316L conforme pasan las horas de incubación in vitro.
Figura 3. Curva de crecimiento de células HOS sobre discos de Ti6Al4V. Evaluación de la humectabilidad y de la rugosidad de superficies de titanio con diferentes tratamientos y su relación con la adhesión celular
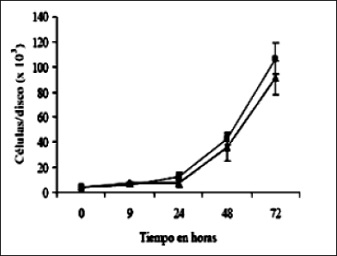
Fuente: [30].
Figura 4. Proliferación celular para 0, 24, 48, 72, 96 horas de incubación. Biocompatibilidad de películas delgadas de óxido de Niobio depositadas por sputtering sobre acero inoxidable 316L
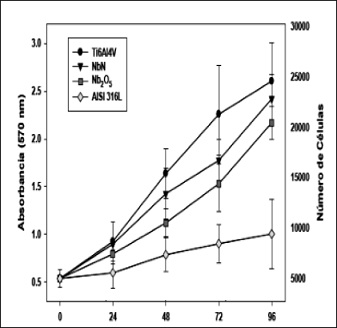
Fuente: [24].
Figura 5. Resultados de ensayo de viabilidad celular. Cultivos celulares depositados en Ti: Titanio sin recubrir, Ti+R: Titanio con recubrimiento de TiO2, C: Vidrio. Crecimiento y caracterización de un recubrimiento nanoestructurado para uso biomédico
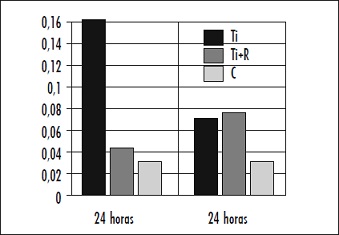
Fuente: [8].
2.2 Biomineralización
Muchos trabajos han definido la biomineralización como los procesos que conllevan los organismos para la nucleación y crecimiento de cristales, tal como la formación de depósitos minerales o sólidos inorgánicos [32]. En este proceso, las células conducen a formar minerales mediante la expresión de proteínas que tienen como función la nucleación en la célula o en la matriz extracelular, así como impedir la formación de minerales en lugares no deseados [33].
Se conoce que estructuralmente los biominerales son en un 80 % cristalinos y en un 20 % amorfos. Por otra parte, el calcio constituye cerca del 50 % de todo el biomineral conocido. Un 25 % se atribuye a fosfatos. Además, el grupo hidroxilo está presente en un 60 %, generalmente en compuestos de calcio, hierro o silicio. Por otro lado, la dureza en los biominerales obedece al tipo de material y a su grado de mineralización. En ellos también están presentes organismos biológicos que controlan la biomineralización [32].
En los huesos, los procesos de biomineralización se dan en la matriz extracelular producida por los osteoblastos, siendo estos mismos los que mineralizan la matriz. La matriz extracelular se compone en un 70 a 90 % de material inorgánico compuesto de hidroxiapatita (Ca5 (PO4)3(OH)) y otros fosfatos de calcio [24].
La óseo–integración es el proceso por el cual un hueso maduro se deposita directamente en los materiales del implante sin intervención del tejido duro o fibroso. Para que un implante sea exitoso, tal y como se había mencionado anteriormente, es necesario un acople perfecto entre la superficie del implante y el hueso.
Los estudios de biomineralización en sistemas in vitro son desarrollados con el fin de analizar la integración de los osteoblastos, la secreción de la matriz extracelular (ECM) y la precipitación de la hidroxiapatita. De otra manera, los estudios in vivo han sido muy valiosos al demostrar que la óseo–integración está influenciada por factores como la locación anatómica, el tamaño del implante, superficie y diseño del implante, procedimientos quirúrgicos, cargas en el material, cambios en el material como respuesta a fluidos biológicos, edad, sexo y tipo de animal [34].
Para entender el mecanismo de la óseo–integración, los investigadores han desarrollado sistemas in vitro de células/implante. En el pasado, la mayoría de dichos estudios describen la respuesta inicial de las células frente a los materiales usados para implantes, mas no cómo se comportan los osteoblastos frente a la superficie del implante y mucho menos el efecto que tiene el tiempo sobre dicha relación; por lo que M. Ahmad y colaboradores en 1997 [35] desarrollaron un procedimiento que se ha empleado de manera muy similar para los estudios de biomineralización sobre recubrimientos contemporáneos, en superficies de Ti–6Al–4V (ASTM F–136) y Co–Cr–Mo (ASTM F–75).
Al igual que el ensayo colorimétrico MTT, usado en principio por casi todas las pruebas de viabilidad celular donde solo se varían unos pocos factores dependiendo del estudio, en los ensayos de biomineralización sucede lo mismo, remitiéndonos a todos los estudios de biocompatibilidad mencionados en [35], además de [36]–[38]. En los ensayos in vitro de mineralización se cultivan las células durante periodos variables, por lo general de 5 a 15 días [8], [22–24], [36]; las células pueden cultivarse en medios con factores de crecimiento, hormonas y dexametasona (C22 H29 FO6), cuya función es proveer a las células de la concentración de fósforo y calcio necesarios para acelerar el proceso de mineralización [22]–[35], o simplemente en soluciones sin factores inductores de biomineralización ni factores de crecimiento [8].
Muchos estudios han centrado su atención en la modificación y la aplicación de superficies sobre sustratos de titanio y sus aleaciones para el diseño de implantes, debido a su buena adhesión celular, elevada resistencia a la fatiga y a la habilidad que tiene de promover la óseointegración. Sin embargo, K. Sagomonyants y colaboradores estudiaron, en el 2008, la respuesta in vitro de osteoblastos humanos sobre superficies de polieteretercetona (PEEK), polietercetona recubierta con fibras de carbono (CFR PEEK) y titanio comercial biocompatible [37], con el fin de encontrar materiales substitutos al titanio para implantes. Siendo la polietercetona (polímero termoplástico) uno de los materiales más prometedores debido a que combina excelentes propiedades mecánicas, tales como la relación de bajo módulo de elasticidad, elevada resistencia y bajo peso, con su versatilidad en procesos de producción y manufactura, baja toxicidad, elevada resistencia química y baja conducción térmica, además de ser un material usado especialmente en implantes cráneo–maxilofaciales.
Todo esto debido a que el titanio y sus aleaciones, así como otras aleaciones metálicas, tienen algunos inconvenientes referentes a la relación existente entre el potencial de liberación de iones del metal y la osteólisis o las alergias subsecuentes. Otros problemas aluden a la facilidad con la cual se corroen muchos metales y a la pobre compatibilidad con modernas técnicas de imagen por resonancia magnética (MRI). Desde el punto de vista de las propiedades mecánicas, típicamente los metales usados para implantación tienen un elevado módulo de elasticidad, aproximadamente de 6 a 20 veces mayor que el hueso que lo rodea [38]–[40], causando que la transmisión de carga no sea igual a lo largo de la interface entre el implante y el hueso, lo que puede causar una disminución en el tejido óseo.
En [37], además, se evaluaron la adhesión y proliferación de osteoblastos humanos sobre superficies de PEEK y CFR PEEK con diferentes rugosidades resultantes de distintos procesos de producción y los compararon con superficies de titanio, al cabo de dos semanas se obtuvieron los resultados que se muestran en la figura 6. Los símbolos Pm y Pcm hacen referencia a la superficie del PEEK y CFR PEEK tras un proceso de maquinado con una rugosidad de Pm = 0,902 µm, Pc = 1,106 µm; por su parte, Pi y Pci hacen referencia a las superficies del PEEK y CFR PEEK tras un proceso de inyección, estos tienen una rugosidad de Pi = 0,095 µm, Pci = 0,350 µm.
Figura 6. Imagen obtenida por el microscopio electrónico de barrido (SEM) de los cultivos de osteoblastos sobre cada una de las superficies: a) TR, b) TS, c) Pm, d) Pcm, e) Pi, f) Pci. Respuesta in vitro de osteoblastos humanos sobre superficies de polieteretercetona (PEEK), comparados con el titanio comercial
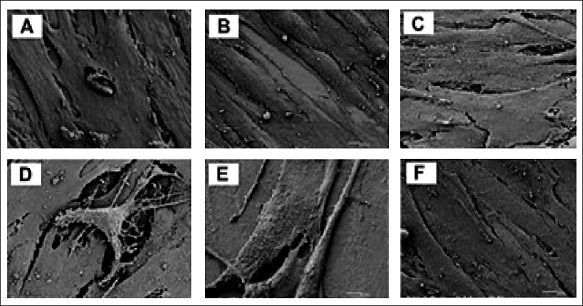
Fuente: [37]
Estas muestras se compararon con dos superficies de titanio Tr y Ts con una diferencia en su rugosidad superficial Ts = 0,200 µm y Tr = 0,554 µm. Los resultados obtenidos mostraron que sobre las superficies de titanio Ts se logró un cultivo de osteoblastos más uniforme y extenso, mientras que los cultivos en las superficies del PEEK y CFR PEEK mecanizado (Pm–Pcm) fueron menos extensos siguiendo arreglos paralelos de formas convexas ordenadas a lo largo de la superficie; en las superficies PEEK Y CFR PEEK (Pi–Pci), adquiridas por medio de inyección, se produjeron cultivos menos numerosos y ordenados que en las superficies obtenidas por mecanización. Por otro lado, se observaron cristales de fosfato de calcio en las superficies de titanio Tr, Pci y Pi, además de evidenciarse numerosas fibras de matriz extracelular en el compuesto Pcm (CFR PEEK con superficie mecanizada).
Aunque la óseo–integración de las superficies de polieteretercetona y de la polieteretercetona reforzada con fibras de carbono sigue siendo menor respecto a las superficies del Titanio, puede mejorarse si se implementan posibles soluciones como las desarrolladas en los estudios de M. Khadraa y colaboradores [41], en el cual se estudió el efecto del tratamiento con láser en la adhesión, proliferación y diferenciación de osteoblastos humanos en un cultivo in vitro sobre la superficie de un implante de titanio. Concluyeron, entonces, que la exposición de los cultivos a la luz láser aumenta significativamente la producción de osteocalcina, lo que significa un incremento en la actividad osteoblástica; por lo cual, puede afirmarse que la terapia laser modula la actividad de las células y de los tejidos que rodean un implante.
2.3 Corrosión en materiales de biocompatibilidad
Para la modificación superficial de un sustrato de aplicación biomédica deben tenerse en cuenta las propiedades físicas del material base, para que el proceso de deposición sea altamente reproducible, de forma que las características superficiales del recubrimiento protector sean las deseables para la aplicación biológica requerida [43]. Propiedades como fricción, desgaste, resistencia, corrosión y biocompatibilidad son esenciales a la hora de generar capas delgadas, como sistemas protectores de sustratos biocompatibles [36]. En los recubrimientos nanoestructurados se realiza el análisis de corrosión, ya que el material puede generar desgaste total o parcial bien sea por reacción química o electroquímica con el medio ambiente [42]. La corrosión es una propiedad que tiene consecuencias sobre otras propiedades de la aleación o recubrimiento, tales como la estética, la resistencia y la biocompatibilidad [44].
2.3.1 Métodos aplicados para estudios de corrosión en materiales biocompatibles
En este tipo de estudios existen diferentes técnicas, tales como las electroquímicas para medición de la velocidad de corrosión y las de polarización, potensiostática y potensiodinámica; todas se han convertido en herramientas muy útiles para el estudio de fenómenos involucrados en la reacción de corrosión. Los conceptos sobre los que se fundamentan estas técnicas se basan en la ley de Tafel [46], quien dedujo de manera teórica la reacción de reducción del protón y la ecuación de polarización de un electrodo reversiblemente polarizable, en coordenadas semilogarítmicas. Estas relaciones se representan por las rectas de la figura 7.
Figura 7. Rectas de Tafel
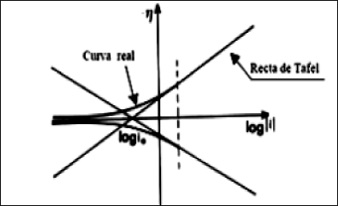
Fuente: [46].
El razonamiento que sugirió Tafel para la interpretación de la reducción del protón se basa en la formación de hidrogeno en dos etapas:
- Etapa electroquímica:
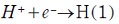
- Etapa química:
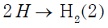 .
.
También se utiliza la técnica voltiamperimétrica cíclica (VC), la cual es una técnica electroquímica de microelectrólisis de tipo transitorio (donde el transporte de materia al electrodo se produce por difusión). Se utiliza para la obtención de información de forma muy rápida sobre las reacciones químicas asociadas a los procesos de transferencia electrónica [47]. La técnica voltiamperimétrica cíclica consiste en alcanzar un voltaje V2, punto desde cual la exploración se invierte y el voltaje es barrido de vuelta hasta un voltaje V1, originando una forma triangular figura 8.
Figura 8. Onda triangular (VC)
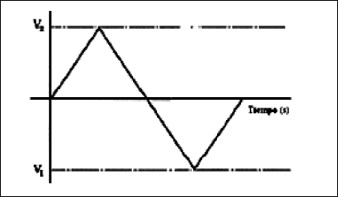
Fuente: [47].
El voltaje aplicado se mantiene inicialmente en el potencial inicial, donde no se produce ningún proceso de electrólisis y por lo tanto no existe flujo de corriente faradáica, la cual aparece cuando existe un proceso de transferencia directa de electrones en una reacción de oxidación de un electrodo y una reacción de reducción en el otro electrodo [47].
El titanio es ampliamente usado como material de implante debido a su baja densidad, su alta resistencia mecánica y su elevada resistencia a la corrosión. El comportamiento del titanio como material óptimo para implantes ha sido asociado a la existencia de la película superficial de óxido (TiO2), que lo recubre completamente con gran adherencia y le otorga una alta resistencia a la corrosión en medios químicamente agresivos [48]. El éxito de un implante de titanio se debe, en gran medida, a su interacción con las células de osteoblastos, promoviendo su crecimiento, adhesión y diferenciación (bioactividad). El titanio por sí solo no es bioactivo, pero recubierto con materiales bioactivos como los fosfatos de calcio (Ca–P) o la hidroxiapatita (HA), se incrementa marcadamente este comportamiento [48,49].
En el estudio llevado a cabo en 1992 por Hanawa [48], se realizaron depósitos de HA sobre diferentes óxidos de titanio (electrodos) a través de la técnica biomimética. Esta técnica consiste en la deposición de HA sobre la superficie de los electrodos por inmersión en una solución sobresaturada de fosfato de calcio, mantenida a 37 °C por 7 días [5]. Las superficies resultantes se caracterizaron físicamente mediante Microscopía Electrónica de Barrido (SEM), y se efectuó su caracterización electroquímica [50].
El crecimiento de los óxidos potenciodinámicos
se desarrolló empleando una celda
electroquímica convencional con una configuración
de tres electrodos, que utilizó como
electrodo de referencia un Electrodo de Calomel
Saturado (SCE) y como contraelectrodo
una placa de platino de gran área superficial.
Se prepararon dos tipos de óxidos diferentes,
el primero de ellos en un medio que contiene
cloruro de sodio (NaCl), denominado TiO2
– NaCl, y el segundo en un medio que contiene
fosfato de sodio (Na3 PO4/Na2HPO4), denominado
TiO2–Na3PO4; el medio en el cual
se preparan los óxidos le otorga propiedades
electroquímicas diferentes. El crecimiento
potenciodinámico de estos óxidos electroquímicos
fue desarrollado mediante un barrido
lineal de potencial desde –1,3V y hasta 1,5V,
empleando una velocidad de barrido del potencial
de 0,1 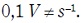
Por medio de los resultados obtenidos se determinó que los diferentes óxidos poseen parámetros electroquímicos diferentes, como lo son el potencial de circuito abierto (OCP) y el potencial al cual empieza a crecer la película de óxido denominado potencial de electroformación del óxido. También se observó que durante el barrido hacia potenciales negativos con respecto al OCP, la corriente aumenta en valores negativos debido a la reducción de H+ del medio en la superficie. Cuando el barrido es invertido, la corriente crece abruptamente hacia valores positivos hasta mantenerse constante, donde tiene lugar el crecimiento anódico del óxido electroquímico. Se puede estimar que el óxido electroquímico que proliferó en el medio del fosfato de sodio es más grueso que el óxido electroquímico desarrollado en el medio del cloruro de sodio, debido a que el potencial de inicio de la zona de electroformación es menor, dicho de otra manera, la carga anódica involucrada en la electroformación es mayor [50].
Las películas delgadas de óxido de zirconio (ZrO2) han mostrado buena resistencia a la corrosión cuando son atacadas mediante ácido sulfúrico (H2SO4), a diferentes temperaturas; estos recubrimientos se depositan por la técnica de inmersión–extracción a una velocidad constante de 10 cm/min, en presencia de radiación ultrasónica a 20 kHz [51]. Las películas obtenidas se sinterizan a una temperatura de 900 oC, para obtener espesores entre 35 nm y 55 nm [52].
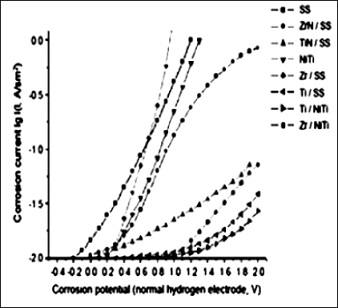
Otras investigaciones realizadas han centrado sus esfuerzos en evaluar la corrosión superficial de materiales implantados mediante soluciones fisiológicas; los materiales implantados están conformados por un material base (sustrato) y un material superficial (recubrimiento) [53]. Estos estudios utilizan procesos de ensayo por corrosión electroquímica, los cuales se analizan por medio de una solución fisiológica isotónica al 0.9 % de NaCl, con un pH = 6, a temperatura ambiente. Los ensayos se realizan durante 6 horas, tiempo durante el cual se precia que las propiedades a la corrosión cambian de acuerdo al tipo de sustrato (figura 9). Hay una mayor corrosión durante el ensayo en el medio de solución fisiológica, cuantificable a través de la corriente de corrosión en los materiales cuyo sustrato es el acero inoxidable (SS), como el caso de los recubrimientos de nitruro de zirconio (ZrN), zirconio (Zr), nitruro de titanio (TiN) y el acero inoxidable sin recubrir.
Figura 9. Prueba de corrosión dependiente del potencial de corrosión para varios tipos de recubrimientos (Ti, Zr, TiN, ZrN) en 0.9 % NaCl (pH = 6.0)
Fuente: [53].
Por otro lado, los sustratos de níquel–titanio (NiTi) proporcionan una mayor resistencia a la corrosión, de tal manera que los recubrimientos en este tipo de sustrato, como lo son el zirconio (Zr) y el titanio (Ti), así como el níquel–titanio sin recubrir (NiTi) presentan una menor corriente de corrosión en la medida que aumenta el potencial de corrosión.
3. Conclusiones
Gracias a esta revisión, se verifica que las investigaciones desde 1992 hasta 2011 y las perspectivas sobre el desarrollo de materiales biocompatibles no solo han enfocado sus esfuerzos en lograr un buen acople entre los tejidos vivos y el material que se va a implantar, de tal manera que no sea rechazado por el organismo en cuestión, sino que además han buscado niveles de funcionalidad mayor por parte de los materiales implantados, variando sus características mediante de múltiples procedimientos tales como la modificación de su superficie, con el fin de lograr una mayor y mejor integración con el organismo por medio de la disminución de la citotoxicidad, el aumento de la viabilidad celular y, en el caso de implantes para reemplazos óseos, propiciando la biomineralización.
Se destaca el papel fundamental que tiene la superficie y las características superficiales del biomaterial, para que este reaccione y se acople con los sistemas vivos de una manera más adecuada, por ejemplo, al aumentar la rugosidad superficial se observa una mayor adhesión celular.
Los estudios de biomineralización en cultivos de células in vitro se generan con el fin de estudiar la integración de los osteoblastos, así como la secreción de la matriz extracelular y finalmente la precipitación de la hidroxiapatita. Por su parte, los estudios de implantes de biomateriales in vivo han demostrado que la óseo–integración se ve influenciada por variables como la locación anatómica, las dimensiones del implante, sus características superficiales y su diseño, además de otros factores como los procedimientos quirúrgicos, la distribución de las cargas en el material y sus cambios como respuesta a fluidos biológicos, edad, sexo y tipo de animal.
Los recubrimientos superficiales en metales y materiales biocompatibles hacen que el comportamiento de estos últimos frente a la corrosión se mejore ostensiblemente. Dichos tratamientos alteran las propiedades electroquímicas en la superficie del material, que además de aumentar la resistencia a la corrosión, hacen compatible el crecimiento de células osteoblasticas in vitro.
4. Bibliografía
- M.E. Sánchez e I. Campos. Tecnología de materiales. México: Editorial Trillas, 2010.
- J. Hetch, “Kennewick Man led a rough, tough life”, New science, vol. 169, fasc. 2541, 2006.
- D. F. Williams, “Definitions in Biomaterials”, presented at Procedings of a consensus conference of the European society of biomaterials. Chester, England, 1986.
- D. F. Williams, J. Black y P. J. Doherty, “Second consensus conference on definitions in biomaterials”, Chester, England. In P. J. Doherty, R.F. Williams, D.F. Williams, A. Lee, eds. Biomaterial–tissue interfaces. Advances in biomaterials, Vol. 10. Elsevier, Amsterdam, 1992.
- D. F. Williams, Definitions in biomaterials. Amsterdam: Elsevier, 1987.
- Biomaterials editorial, “Trends in biomaterials research: An analysis of the scientific program of the world biomaterials congress 2008”, Biomaterials, vol. 29, pp. 3047–3052, 2008.
- D. F. Williams, “On the mechanics of biocompatibility”, Biomaterials, vol. 29, pp. 2941–2953, 2008.
- D. Clavijo, “Crecimiento y caracterización de un recubrimiento nanoestructurado para uso biomédico”, Tesis de maestría, Universidad Nacional de Colombia, Bogotá, Colombia, 2010.
- R. Olivares, J.J. Olaya, C. Ramírez and S. Rodil, “Biocompatibility of niobium coatings”, Coatings, Vol 1, pp. 72–87, 2011.
- C. K. Kang and Y. S. Lee, “Carbohydrate polymer grafting on stainless steel surface and its biocompatibility study”, Journal of industrial and Engineering Chemistry, vol. 18, N.° 5, 1670–1675, pp. 1–6, 2012.
- S. Rodil, “Modificación superficial de biomateriales mecánicos”, Revista latinoamericana de metalurgia y materiales, vol. 29, pp. 67–83, 2009.
- A. Santana, J. Mirza–Rozca, E. Vasilescu, P. Drobb, D. Raducanu and L. Angelescu, “Technical and functional properties of some biocom thin films”, Materials Chemestry and physics, vol. 86, pp. 38–43, 2004.
- E. O. Martz, V. K. Goel, M. H. Pope and J. B. Park, “Materials and Design of Spinal Implants”, Journal of Biomedical Materials Research, vol. 38, pp. 267–288, 1997.
- C. Trépanier, T. K. Leung and M. Tabrizian “Preliminary investigation of the effects of surface treatments on biological response to shape memory NiTi stents”, Journal of Biomedical Materials Research, vol. 48, pp. 165–171, 1999.
- H. Matsuno, A. Yokoyama, F. Watari, M. Uo, and T. Kawasaki, “Biocompatibility and osteogenesis of refractory metal implants, titanium, hafnium, niobium, tantalum and rhenium”, Biomaterials, vol. 22, pp. 1253–1262, 2001.
- H. Aita, N. Hori, M. Takeuchi, T. Suzuki, M. Yamada, M. Anpo, and T. Ogawa, “The effect of ultraviolet functionalization of titanium on integration with bone”, Biomaterials, vol 30, pp. 1015–1025, 2009.
- N. R. Washburn, K. M. Yamada, C. G. Simon, S. B. Kennedy and E. J. Amis, “High–throughput investigation of osteoblast response to polymer crystallinity: influence of nanometer–scale roughness on proliferation”, Biomaterials, vol. 25, pp. 1215–1224, 2004.
- M. Bächle and R. J. Kohal, “A systematic review of the influence of different titanium surfaces on proliferation, differentiation and protein synthesis of osteoblast–like MG63 cells”, Clin Oral Implants, vol. 15, pp. 683–92, 2004.
- C. Ramírez, S. Rodil, H. Arzate y C. Magaña, “Influencia de la rugosidad de películas de carbono amorfo en la adhesión de osteoblastos”, presentado en Octavo congreso de microscopia, México, 2006.
- E. Eisenbarth, M. Muller, R. Thull, D. Velten and J. Breme, “Nanostructured niobium oxide coatings influence osteoblast adhesión”, Journal of Biomedical Materials Research, vol 79, pp. 166–217, 2006.
- G. Bordjih, J. Jouzeau, D. Mainard, E. Payan, J. P. Delagoutte and P. Netter, “Evaluation of the effect of three surface treatments on the biocompatibility of 316L stainless steel using human differentiated cells”, Biomaterials, vol. 17, pp. 491–500, 1996.
- J. Vanegas, D. Garzón y M. Casale, “Interacción entre osteoblastos y superficies de titanio: aplicación en implantes dentales”, Revista Cubana de Investigaciones Biomédicas, vol. 29, 2010.
- J. Serrano, J. De la Fuente, M. álvarez, M. García, C. Hernández, A. Arellano, J. Juárez y O. álvarez, “Caracterización y respuesta biológica de nanocerámicas de óxido de circonio sintetizado por el método de rocío pirolítico ultrasónico”, Superficies y Vacío, vol. 2, pp. 27–30, 2010.
- G. Ramírez, “Biocompatibilidad de películas delgadas de oxido de Niobio depositadas por sputtering sobre acero inoxidable 316L”, Tesis de maestría, Universidad Nacional de Colombia, Bogotá, Colombia, 2010.
- E. G. Hayman, E. Engvall, E. A'Hearn, D. Barnes, M. Pierschbacher and E. Ruoslahti, “Cell attachment on replicas of SDS polyacrylamide gels reveals two adhesive plasma proteins”, J Cell Biol, vol 95, pp. 220–223, 1982.
- S. Rodil, R. Olivares, H. Arzate and S. Muhl, “Properties of carbon films and their biocompatibility using in vitro tests”, Diamond and Related Materials, vol. 12, pp. 931–937, 2003.
- J. Davies, “Bone bonding at natural and biomaterial surfaces”, Biomaterials, vol. 28, pp. 5058–5067, 2007.
- LL. Guéhennec, A. Soueidan, P. Layrolle and Y. Amouriq, “Surface treatments of titanium dental implants for rapid osseointegration”, Dental Materials, vol. 23, pp. 844–854, 2007.
- G. Mazzaglia, “Evaluación de la humectabilidad y de la rugosidad de superficies de titanio con diferentes tratamientos y su relación con la adhesión celular”, Tesis doctoral, Universidad de Granada, Granada, España, 2006.
- J. Gómez, L. Forero, P. Escobar y W. Valdivieso, “Estudio de citotoxicidad y de adhesión de células humanas de osteosarcoma en Ti–6Al–4V superficialmente modificado”, Scientia et Technica Año XIII, vol. 36, pp. 85–89, 2007.
- S. Bruni, M. Martinesi, M. Stio, C. Treves, T. Bacci, and F. Borgioli, “Effects of surface treatment of Ti–6Al– 4V titanium alloy on biocompatibility in cultured human umbilical vein endothelial cells”, Acta Biomaterialia, vol. 1, pp. 223–234, 2005.
- A. Soto, “Introducción a los Biominerales y Biomateriales”, Programa de Doctorado en Ciencias de la Ingeniería, Universidad de Chile, Santiago, Chile, pp. 1–31, 2003.
- A. Boskey, “Biomineralization: An overview”, Connective Tissue Research, vol. 44, pp. 5–9, 2003.
- B. D. Boyan, T. W. Hummert, D. D. Dean and Z, Schwartz, “Role of material surfaces in regulating bone and cartilage cell response”, Biomaterials, vol. 17, pp. 137–146, 1996.
- M. Ahmad, M. McCarthy and G. Gronowicz, “An in vitro model for mineralization of human osteoblast–like cells on implant materials”, Biomaterials, vol. 20, pp. 211–220, 1999.
- H. Zhanga, L. Courtland, M. Aronowa and G. Gronowicza, “The effects of patient age on human osteoblasts response to Ti–6Al–4V implants in vitro”, Journal of Orthopaedic Research, vol. 22, pp. 30–38, 2004.
- K. Sagomonyants, M. Jarman–Smith, J. Devine, M. Aronow and G. Gronowicz, “The in vitro response of human osteoblasts to polyetheretherketone (PEEK) substrates compared to commercially pure titanium”, Biomaterials, vol 29, pp. 1563–1572, 2008.
- E. Kitamura, R. Stegaroiu, S. Nomura and O. Mikakawa, “Biomechanicalaspects of marginal bone resorption around osseointegrated implants:considerations based on a three–dimensional finite element analysis”, Clin Oral Implants, vol. 15, pp. 401–412, 2004.
- J. Rho, R. Ashman and C. Turner, “Young's modulus of trabecular and cortical bone material: ultrasonic and microtensile measurements”, Journal of Biomechanical, vol. 26, pp. 11–119, 1993.
- F. Isidor, “Influence of forces on periimplant bone”, Clin Oral Implants, vol. 17, pp. 8–18, 2006.
- M. Khadraa, S. Lyngstadaasb, H. Haanasa and K. Mustafa, “Effect of laser therapy on attachment, proliferation and differentiation of human osteoblast like cells cultured on titanium implant material”, Biomaterials, vol. 26, pp. 3503–3509, 2005.
- H. J. Guzmán, “Aleaciones para colados de uso odontológico”, Federación Odontológica Colombiana, vol. 27, pp. 32–45, 1980.
- K. C. Paul, “Enhancement of surface properties of biomaterials using plasma– based technologies”, Surface and Coatings Technology, vol. 201, pp. 8076– 8082, 2007.
- J. Wataha, “Biocompatibility of dental casting alloys. A review”, Journal of Prosthetic Dentals, vol. 83, pp. 223–233, 2000.
- C.W. Wu, “corrosion–wear study of 304 stainless steel in various NaCl solutions”, Wear, vol 162–164, pp. 950–953, 1993.
- Y. Meas, “Técnicas electroquímicas para la medición de la velocidad de corrosión”, [En línea]. disponible en http://depa.pquim.unam.mx/labcorr/libro/ Teoriacorrosion.PDF.
- I. A. García, “Medidor de voltametría cíclica para dispositivos de transmitancia controlable”, [En línea]. disponible en http:// http://e–archivo.uc3m.es/ bitstream/10016/10674/1/PFC_IvanAndres_ Gonzalez_Garcia.pdf.
- T. O. Hanawa and M. Ota, “Characterization of Surface Film Formed on Titanium in Electrolyte using XPS”, Applied Surface Science, vol. 55, pp. 269–276, 1992.
- A. Moroni, V. L. Caja, E. L. Egger, L. Trinchesea, E. Y. S. Chaob “Histomorphometry of hydroxyapatite coated and uncoated porous titanium bone implants”, Biomaterials, vol. 15, pp. 926– 930, 1994.
- G. M. Pardo, F. Y. Oliva y O. R. Cámara, “Diseño y caracterización fisicoquímica de superficies de materiales biocompatibles (óxidos de metales)”, en 2do Encuentro de Jóvenes Investigadores en Ciencia y Tecnología de Materiales. Posadas, Misiones, Argentina, 16–17, pp. 1–6, octubre 2008.
- M. M. Atik and M. A. Aegerterb “Corrosion Resistant sol–gel ZrO coatings on stainless Steel”, Non–Crystalline Solids, vol.147–148, pp. 813–819, 1992.
- R. Maggio, S. Rossi, L. Fedrizzi and P. Scardi “ZrO2–CeO2 Films as protective coatings against dry and wet corrosion of metallic alloys”, Surface and coatings technology, vol. 89, pp. 292–298, 1999.
- A.V. Zykova, V. V. Lukyanchenkob and V. I. Safonov, “The corrosion properties of implanted materials with protective coatings in isotonic physiological solution”, Surface & Coatings Technology, vol. 200, pp. 90–93, 2005.
Creation date: Junio de 2013


.png)




.jpg)