DOI:
https://doi.org/10.14483/udistrital.jour.colomb.for.2015.1.a05Publicado:
01-01-2015Número:
Vol. 18 Núm. 1 (2015): Enero-JunioSección:
Artículos de investigación científica y tecnológicaComposición florística del bosque tropical seco del santuario "Los besotes" y fenología de especies arbóreas dominantes (Valledupar, Cesar, Colombia)
Floristic composition of the dry tropical forest in biological reserve (sanctuary) "Los Besotes" and phenology of the dominant arboreal species (Valledupar, Cesar, Colombia)
Palabras clave:
tropical dry forest, leaf fall, phenology, vegetation (en).Palabras clave:
Bosque seco, caída foliar, fenología, vegetación (es).Descargas
Referencias
Alvim, P. (1964). Tree growth periodicity in tropical climates. En M. H. Zimmermann (ed.). The formation of wood in forest trees (pp 479-495). Nueva York: Academic Press.
Bullock, S., & Solís-Magallanes, J. (1990). Phenology of cannopy trees of a tropical deciduous forest in México. Biotropica, 22, 22-35.
Camacho, M., & Orozco, L. (1998). Patrones fenológicos de doce especies arbóreas del bosque montano de la Cordillera de Talamanca, Costa Rica. Rev. Biol. Trop, 46(3), 533-542.
Canavides-R, J., Agudelo, N., & Molina, A. (2001). Estudio ecológico, silvícola y de utilización del sangre, Pterocarpus rohrii Vahl, en bosques latifoliados de Honduras. (Trabajo de grado, Desarrollo Socioeconómico y Ambiente). Honduras, Tegucigalpa: Escuela Agrícola Panamericana El Zamorano. 47 p.
Dugand-G., A. (1941). Estudios geobotánicos colombianos: Descripción de una sinecia típica en la subxerofitia del litoral Caribe. Rev. Acad. Col. Cienc. Ex Fis Nat., 4(14),135-141.
Fournier, L. A. (1974). Un método cuantitativo para la medición de características fenológicas en árboles. Turrialba, 24, 422-423.
Fournier, L. A. (1976). The dendrophenograph, a graphic representation of tree phenology. Turrialba, 26(1), 96-97.
García, E. G., & Di Stefano, J. F. (2005). Fenología de árbol Sideroxylon capiri (Sapotaceae) en el bosque seco tropical de Costa Rica. Rev. Biol. Trop., 53(1-2), 5-14.
Gómez-M., D. A., & Macías-P, D. J. (2012). Fenología del palo cruz (Brownea rosa-de-monte Bergius) en un bosque seco de Bolívar, Cauca. Colombia Forestal, 15(1),105-117.
Gordon, W. F., Baker, H. G., & Opler, P. A. (1974). Comparative phenological studies of trees in tropical wet and dry forests in the lowlands of Costa Rica. Journal of Ecology, 62(3), 881-919.
Holdridge, L. R. (1982). Ecología Basada en Zonas de Vida. Costa Rica. Instituto Interamericano de Cooperación para la Agricultura. 216 p.
Jiménez, L. C. (1992). Climatología de la sierra Nevada de Santa Marta. Zenit, 3,47-64.
Madrigal-J., T. A. (1996-1997). Fenología y ecofisiología de Quercus oocarpa (Fagaceae),Cartago, Costa Rica. Rey. Biol. Trop, 44(3)/45(1), 117-123.
Mahecha G., Ovalle, A., Camelo, D., Rozo, A., & Barrero, D. (2004). Vegetación del territorio CAR. 450 especies de sus llanuras y montañas. Bogotá: 881 p.
Rangel-Ch, J.O., & Velásquez, A. (1997). Métodos de estudios de la vegetación. En: J.O. Rangel-Ch. (ed.). Colombia Diversidad Biótica II. Tipos de vegetación en Colombia (pp 59-87). Bogotá: Instituto de Ciencias Naturales, Universidad Nacional de Colombia.
Rangel-Ch, J.O., Carvajal, J.E., Cortés, J. & Rivera, O. (2009). Amenazas a la biota (vegetación, fauna, flora y ecosistemas) de la serranía del Perijá. En: J.O. Rangel-Ch. (ed.). Colombia diversidad biótica VIII. Media y baja montaña de la serranía de Perijá (661-676). Bogotá: Instituto de Ciencias Naturales, Universidad Nacional de Colombia.
Rangel-Ch., J.O. (2012). La vegetación de la región Caribe de Colombia: composición florística y aspectos de la estructura. En: J.O. Rangel-Ch. (ed.). Colombia Diversidad Biótica XII. La región Caribe de Colombia (365-476). Bogotá: Instituto de Ciencias Naturales, Universidad Nacional de Colombia.
Rangel-Ch., J. O., & Carvajal-C, J. E. (2012). Clima de la región Caribe colombiana. En: J.O. Rangel-Ch. (ed.). Colombia Diversidad Biótica XII. La región Caribe de Colombia (67-129). Bogotá: Instituto de Ciencias Naturales, Universidad Nacional de Colombia.
Rodríguez-B., C. (2009). Fenología de Quercus ilex L. y Quercus suber L. en una dehesa del Centro Peninsular. (Proyecto Fin de Carrera. Ingeniería Técnica Forestal). España, Madrid: Universidad politécnica de Madrid. 100 p.
Silva, A. G., Freitas, L. & Pires, J. P. A. (2014). A Fournier Index upgrade as a new approach for quantitative phenological studies in plant communities. Tropical Ecology, 55(1), 137-142.
Vilchez, B., Chazdon, R., & Alvarado, W. (2007). Fenología reproductiva de las especies del dosel superior en seis sitios de la región Huetar Norte de Costa Rica. Kurú Revista Forestal, 4(10),1-16.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Artículo de investigación
COMPOSICIÓN FLORÍSTICA DEL BOSQUE TROPICAL SECO DEL SANTUARIO "LOS BESOTES" Y FENOLOGÍA DE ESPECIES ARBÓREAS DOMINANTES (VALLEDUPAR, CESAR, COLOMBIA)
Floristic composition of the dry tropical forest in biological reserve (sanctuary) "Los Besotes" and phenology of the dominant arboreal species (Valledupar, Cesar, Colombia)
Mary Lee Berdugo-Lattke1 & Jesús Orlando Rangel-Ch2
1 Instituto de Ciencias Naturales, Universidad Nacional de Colombia. Bogotá D.C., Colombia. mlberdugol@unal.edu.co Autor para correspondencia
2Instituto de Ciencias Naturales, Universidad Nacional de Colombia. Bogotá, D.C., Colombia. jorangelc@unal.edu.co
Recepción: 10 de noviembre de 2014 / Aprobación: 15 de diciembre de 2014
RESUMEN
Se caracterizó la vegetación de la formación bosque seco tropical del santuario "Los Besotes" (Valledupar, Cesar) entre 248 y 1046 m de altitud con base en la composición florística, en aspectos estructurales y se valoraron características fenológicas en 35 individuos pertenecientes a nueve especies arbóreas dominantes en dos tipos de bosque. Se realizaron siete monitoreos, durante un año, de acuerdo con el régimen de distribución de la lluvia. En las especies de los bosques de Myrcianthes aff. fragrans y Brosimum alicastrum la caída foliar no superó el 20%. Independientemente de la época climática (sequía o lluvias), otras especies dominantes del sotobosque presentaron una caída foliar menor al 40%, con lo cual se puede considerar que las especies del dosel son siempreverdes y las del sotobosque son brevicaducifolias. La floración tuvo mayor expresión en la época más seca y la fructificación en las dos épocas de lluvias. En las especies de los bosques de Bursera simaruba y Pterocarpus acapulcensis la caída foliar superó el 60% en las épocas de sequía, igualmenteotras especies dominantes del sotobosque presentaron una caída foliar mayor al 60%; tanto las especies del dosel como las del sotobosque son caducifolias. La floración se observó en épocas de sequía (diciembre-marzo; julio) y es probable que también se presente en octubre; la fructificación se observó en la época más lluviosa (noviembre). En la formación de bosque seco tropical, se diferencian comunidades vegetales siempreverdes con valores de caída foliar menores al 40% y comunidades caducifolias con valores mayores al 60%.
Palabras clave: bosque tropical seco, caída foliar, fenología, tipos de vegetación.
ABSTRACT
Based on the floristic composition and structural aspects, the formation tropical dry forest of the reserve "Los Besotes" (Valledupar, Cesar; 248 y 1046m of altitude) was characterized. In 35 individuals from nine dominant tree species in two forest types, the phenological characteristics were assessed. Seven monitoring were performed along one year according to the scheme of distribution of rainfall. The leaf fall in the forests of Myrcianthes aff. fragrans and Brosimum alicastrum did not exceed 20% regardless of the climatic period (drought or rainy seasons). In others dominant understory species the leaf fall was less than 40%, thus species of the canopy are classified as evergreen while those of the understory as semideciduous. Blooming peaked during the dry season while fruit production peaked during the two rainy seasons. In the forest of Bursera simaruba and Pterocarpus acapulcensis the leaf fall exceeded 60% in the dry season, while in the rainy season was only 30%. The leaf fall increased to 60% in others dominant understory species. Both canopy as well as understory species are deciduous. Blooming was observed during the dry season (December to March, and July), but it is also likely to occur in October; fruit production was observed at the end of the rainy season. In the tropical dry forest formation evergreen plant communities with low values of leaf fall (40%) and deciduous communities with values greater than 60% are recognized.
Key words: tropical dry forest, leaf fall, phenology, vegetation.
INTRODUCCIÓN
En la formación bosque seco tropical en Colombia se agrupan territorios en los cuales la precipitación anual varía entre 600 y 1400 mm anuales (Rangel & Carvajal, 2012). En otros países cercanos como Costa Rica se extiende el límite superior hasta 2000 mm (Holdridge, 1982). Entre los tipos de vegetación que se pueden encontrar en esta formación vegetal figuran los bosques bajos y ralos muy secos, los bosques muy secos con elementos armados, los bosques riberinos de planicie, los bosques secos siempreverdes y los bosques secos estacionales con follaje caedizo (Rangel-Ch, 2012). En los bosques secos estacionales, en las épocas con menos cantidad de lluvias, buena parte de sus especies dominantes pierden su follaje, comportamiento que ilustra la relación entre las variables ambientales (precipitación especialmente) y los ciclos fenológicos como respuesta de la especie. Dugand (1941) encontró que en las comunidades vegetales subxerofíticas del Caribe colombiano, el 70% de las especies sufrían caída foliar, mientras que un 26% conservaba su follaje en las épocas más secas del año. Debido a esto calificó a las comunidades como caducifolias y denominó brevicaducifolias a las especies que descartaban sus hojas de manera parcial.
Uno de los objetivos básicos de los estudios de fenología es reunir información sobre el inicio, la duración y culminación de los procesos relacionados con la formación de yemas, de flores, de frutos, permanencia y caída de hojas y su relación con factores climáticos como la precipitación y la temperatura (Rodríguez-B, 2009). Fournier (1974, 1976) propuso un método cuantitativo de estimación de la floración, fructificación y variación en la cobertura foliar (caída y renovación de hojas) con base en la presencia (%) de la característica y también en la elaboración de fenogramas para resumir el patrón de desarrollo de las especies en el tiempo. Silva et al. (2014), modificaron el índice de Fournier e incluyeron el área basal de las especies para indicar la dominancia y resaltar la importancia ecológica de la dinámica fenológica del dosel en el análisis integral de la comunidad vegetal. Existen varias propuestas para estudiar los periodos de floración, fructificación, caída foliar y su relación con los cambios periódicos del clima (Madrigal-Jiménez, 1996,1997; Camacho & Orozco, 1998; García & Di Stefano, 2005; Vilchez et al., 2007; Gómez-M & Macías-P, 2012). Aunque los métodos se pueden ajustar de acuerdo con el objetivo del estudio, es aconsejable realizar observaciones en otras especies (sotobosque) en temporadas críticas, en las cuales se presenten los cambios en los regímenes pluviométricos de la zona.
En la región Caribe de Colombia se definieron catorce unidades climáticas con montos de precipitación que fluctúan entre 221 mm y 3 815 mm. Las áreas con climas muy secos generalmente poseen un régimen de lluvias bimodal-tetraestacional (Rangel-Ch & Carvajal, 2012). En la actualidad, en las localidades con ambientes secos y muy secos del Caribe colombiano, la vegetación original está confinada en parches de diferente extensión, los cuales se encuentran rodeados por áreas de uso agropecuario. La transformación se halla en proceso de expansión y reduce cada vez más estos parches relictuales a fin de dar paso a pastizales dedicados a la ganadería extensiva, a los monocultivos y cultivos ilícitos (coca y marihuana) (Rangel-Ch et al., 2009).
El objetivo de este estudio fue caracterizar la vegetación según la composición florística y efectuar las observaciones sobre las fases fenológicas de especies dominantes en la formación de bosque tropical seco en el santuario de vida silvestre "Los Besotes" (Valledupar, Cesar).
MATERIALES Y MÉTODOS
Área de estudio
El santuario de vida silvestre "Los Besotes" se ubica en los corregimientos de Los Corazones y Río Seco del municipio de Valledupar, departamento de Cesar. Se ubica en las estribaciones iniciales de la Sierra Nevada de Santa Marta; su punto más alto se encuentra en el "Cerro Boquinete" o "Cerro de Los Cóndores" a los 1 680 m de altitud y el límite inferior se localiza hacia el Sur del área, aproximadamente a 190 m de altitud (Barbosa-Castillo et al., 2008). La vegetación original es la del bosque seco tropical del Caribe de Colombia con diversas comunidades que hemos agrupado en la gran formación de los bosques de Machaerium biovulatum Micheli y Eugenia procera (Sw.) Poir. También se encuentra vegetación de tipo matorral espinoso y herbazales en las áreas de recuperación (Sandino & Castillo, 2014).
Según Rangel & Carvajal (2012), la precipitación anual de áreas contiguas al santuario varía entre 1100 y 1280 mm, con lo cual la zona se incluiría en la unidad climática B2 caracterizada por un régimen de lluvias bimodal-tetraestacional; los periodos de mayor precipitación se presentan entreabril-junio y entre agosto-noviembre, mientras que los periodos secos se presentan entre diciembre y marzo y en julio ("veranillo").
El sustrato se caracteriza por ser pedregoso, con suelos poco desarrollados (entisoles) debido a las fuertes pendientes. Aunque en el pasado las áreas fueron utilizadas para actividad agropecuaria, en la actualidad el 92% está dedicado a la conservación. Los bosques de regeneración secundaria (40% del área) en la parte baja y plana de la reserva tienen un proceso de recuperación natural mayor a diez años. Los bosques de la cima y de la parte plana (ribereños) mantienen sus características originales (Barbosa-Castillo et al., 2008).
Trabajo de campo y análisis
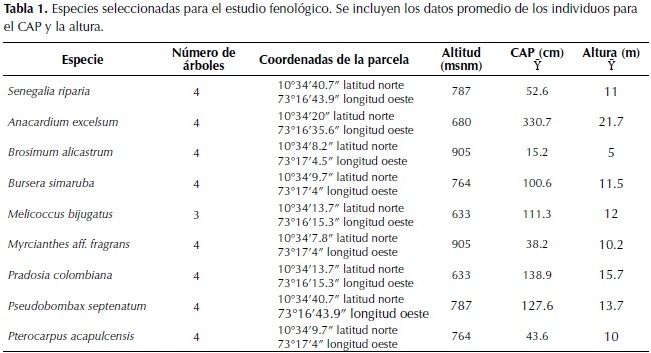
Con el propósito de caracterizar la vegetación se realizaron parcelas con un área mínima de 500 m2 según las recomendaciones de Rangel-Ch & Velázquez (1997), en zonas donde la vegetación mostraba una distribución homogénea entre 248 m y 1 046 m de altitud.Para cada individuo se tomaron datos sobre su denominación taxonómica, circunferencia a la altura del pecho (cm), altura (m) y cobertura (%). El material herborizado bajo las colecciones de DMC= Diana Marcela Castillo; MBL= Mary Berdugo Lattke; JDG= Juan Diego García, fue identificado y se depositó en el Herbario Nacional Colombiano (COL).
Los tipos de bosque se diferenciaron según la composición florística y el valor de cobertura (%). En la tabla respectiva, las especies solamente aparecen una vez con el valor mayor de cobertura (%) que presentaron en cualquiera de los estratos (arbóreo, subarbóreo, arbustivo y herbáceo). Para el seguimiento fenológico se seleccionaron cuatro individuos por cada especie dominante encontrada en el área de estudio (Tabla 1). Cada individuo fue marcado con un aro de alambre y una ficha con un número único para su ubicación. La información fenológica se registró en porcentajes (%), según la presencia, ausencia y aparición de las características fenológicas en los individuos evaluados. Se tomó como referencia toda la copa visible de los individuos (100%). Se hicieron estimaciones de las características foliares (yemas, hojas jóvenes, hojas maduras y caída foliar) y de los procesos de floración y fructificación.
Se realizaron siete monitoreos durante un año de acuerdo con el régimen de precipitación. El primer monitoreo fue del nueve al trece marzo del 2012 durante la estación seca. El segundo fue del veinte al veintitrés de mayo del 2012 durante el comienzo de la temporada de lluvias. El tercero fue del veintidós al veintitrés de junio del 2012, cuando se presentó una reducción parcial de las lluvias. El cuarto entre el tres y siete de agosto del 2012, al comienzo de la época más lluviosa del año (agosto y noviembre). El quinto se realizódel veintiocho de septiembre al cuatro de octubre del 2012, durante el periodo medio de la época más lluviosa (finales de septiembre) se reportó un vendaval que azotó la zona del santuario. El sexto monitoreo se ejecutó del veintiocho de noviembre al dos de diciembre del 2012, periodo en que se redujeron significativamente las lluvias. El séptimo seguimiento fenológico se realizó del veinte al veinticuatro de febrero del 2013, durante el periodo de sequía con eventos esporádicos de lluvia.
Se realizó una síntesis de las observaciones para cada especie y se identificaron periodos y sincronía en los procesos de floración, fructificación, así como el comportamiento de la caída natural y marchitez de las hojas. Se comparó el régimen de lluvias con la frecuencia en la caída y renovación foliar. Adicionalmente se elaboraron los fenogramas (% cada característica versus tiempo)según lo propuesto por Fournier (1974, 1976) para individuos adultos. Se incluyeron datos preliminares sobre floración y/o fructificación de otras especies. En total se marcaron 31 individuos pertenecientes a ocho especies arbóreas dominantes en los tipos de bosque del santuario y cuatro individuos jóvenes de Brosimum alicastrum Sw., debido a la dificultad de observar claramente la copa de individuos con una altura mayor a 25 m. (Tabla 1).
RESULTADOS
Precipitación (mm)
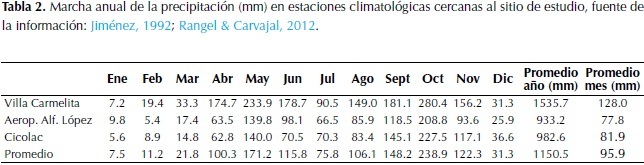
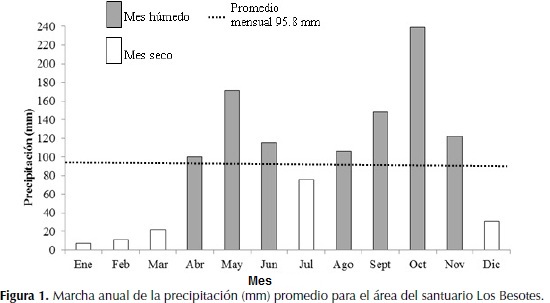
Con la información de las estaciones climatológicas seleccionadas de los alrededores, se elaboró la marcha anual de la precipitación para el área del santuario Besotes (Tabla 2 y Figura 1).
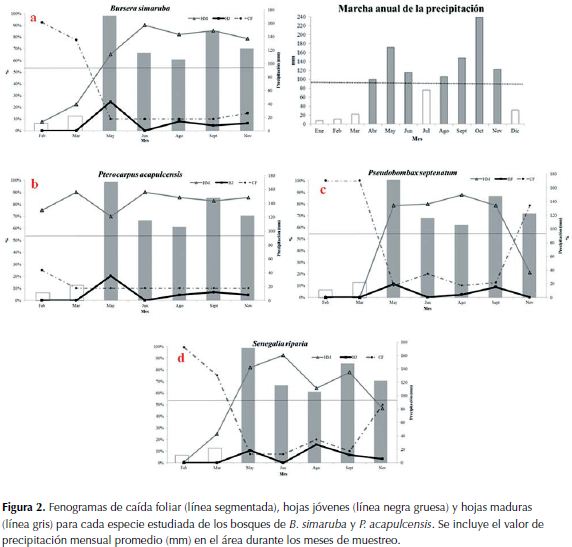
La precipitación anual es de 1150.5 mm, con un régimen de distribuciónbimodal-tetraestacional. El periodo lluvioso de mayor intensidad va de agosto hasta noviembre y significa el 52.42% de la lluvia anual total, con octubre como el mes más lluvioso con 238.9 mm. El otro periodo lluvioso incluye desde abril hasta junio y significa 32.98% de la lluvia anual. El periodo seco de mayor intensidad va desde diciembre hasta marzo cuando se recibe el 8.13% de la lluvia total, con enero como el mes más seco con 7.5 mm. Julio representa al otro periodo seco con 75.8 mm que significa 6.47%.
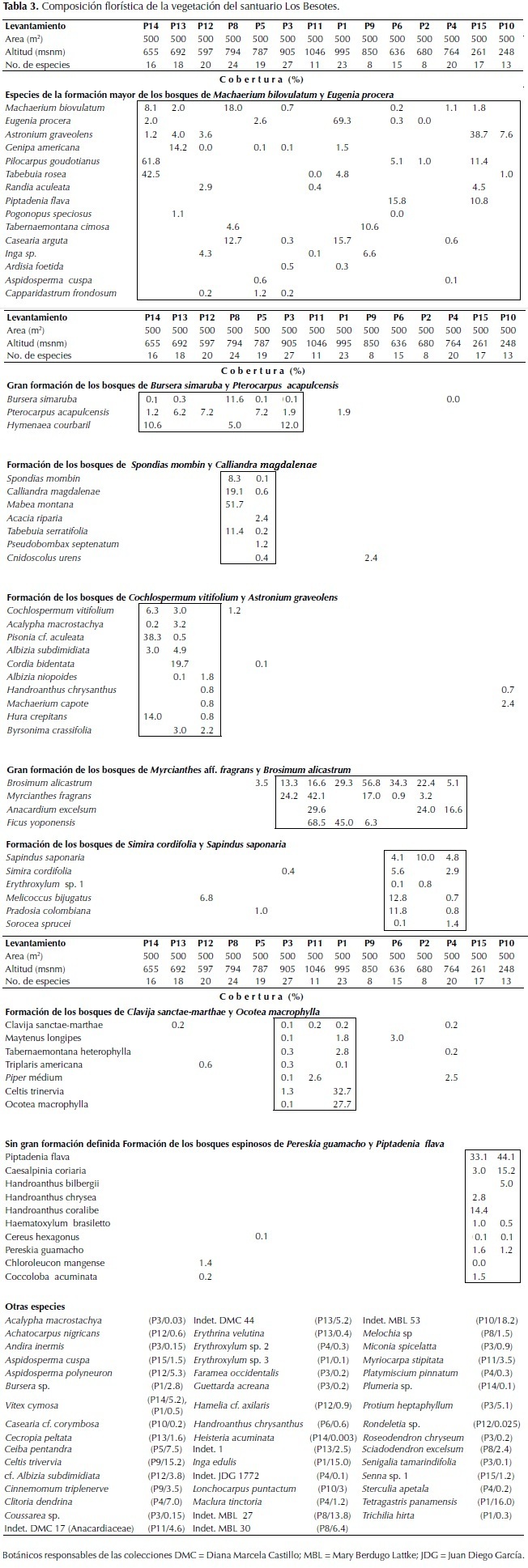
Vegetación
En la Tabla 3 se presenta la composición florística de las unidades de vegetación boscosa que se caracterizaron. Las diferentes formaciones o comunidades se agrupan en la formación mayor de M. biovulatum y E. procera que incluye dos grandes formaciones de bosques tropicales secos. La gran formación de los bosques de Bursera simaruba (L.) Sarg. y Pterocarpus acapulcensis Rose entre 570 y 900 m de altitud en sitios con una pendiente entre media y fuerte (20° a 70°) con un dosel entre 12 y 25 m de altura. En esta formación se diferenciaron los bosques dominados por Spondias mombin L. y Calliandra magdalenae (Bertero ex DC.) Benth entre 770 y 790 m de altitud, con un dosel de 10 a 12 m de altura con individuos aislados emergentes de 21 m y los bosques de Cochlospermum vitifolium (Willd.) Spreng. y Astronium graveolens Jacq. entre 570 y 690 m de altitud, con un dosel de 10 a 12 m de altura con emergentes de 26 m.
La otra gran formación es la de Myrcianthes aff. fragrans y Brosimum alicastrum entre 630 y 1046 m de altitud en sitios con una pendiente media y fuerte (20° a 70°), que constituyen bosques primarios poco intervenidos con un dosel entre 15 m y 25 m de altura. En esta formación se diferenciaron los bosques de Simira cordifolia (Hook. f.) Steyerm. y Sapindus saponaria L. entre 630 y 760 m de altitud, con un dosel de 13 m a 16 m de altura con emergentes de 22 m y a los bosques de Clavija sanctae-martae Ruiz & Pav.y Ocotea macrophylla Kunth entre 900 y 1050 m de altitud, con un dosel de 15 a 20 m de altura con individuos aislados emergentes de 25 m.
En el área del santuario igualmente se establece el bosque espinoso de Pereskia guamacho F.A.C. Weber y Piptadenia flava (Spreng. ex DC.) Benth, entre 240 y 260 m de altitud con elementos arborescentes que alcanzan entre 7 y 10 m de altura.
Fenología
Especies de los bosques de B. simaruba y P. acapulcensis
B. simaruba : el mayor porcentaje de caída foliar se presentó en febrero (92.5%). En mayo se observaron individuos en el estado fenológico de yemas (11.3%) y de hojas jóvenes (24.8%) y en junio predominaron las hojas maduras (90%). La floración se dio en marzo (22.5%) y los valores más altos en fructificación en agosto (26.3%) y en noviembre (27.5%), aunque también se presentó en febrero, marzo, mayo y junio con valores entre 7% y 15%. La fructificación comenzó en la parte inferior de la copa (bordes) del individuo hasta cubrir la totalidad de la copa (Figura 2a).
P. acapulcensis:el mayor porcentaje de caída foliar se presentó en febrero (25%). En marzo predominaron las hojas maduras (90%), mientras que en mayo se observaron algunas yemas (11.3%) y hojas jóvenes (20.3%). No se observó floración. En junio nuevamente predominaron hojas maduras (90%). En mayo en individuos diferentes a los marcados (cercanos a caminos) se observó la fase de fructificación (Figura 2b).
Pseudobombax septenatum (Jacq.) Dugand: el mayor porcentaje de caída foliar se presentó en febrero y en marzo (100%). Las hojas jóvenes (11.3%) predominaron en mayo, mientras que en agosto lo hicieron las hojas maduras (87.8%) y se observaron yemas (2.5%) en septiembre. La fructificación se presentó en noviembre (30%) y un valor bajo (1.3%) en febrero, lo cual indica que la floración sucede entre septiembre y octubre. Se evidenció sincronía de las fases fenológicas reproductivas (floración y fructificación), lo cual indica que todos los individuos cumplen estas fases, aproximadamente, al mismo tiempo (Figura 2c).
Senegalia riparia (Kunth) Britton:El mayor porcentaje de caída foliar se presentó en febrero (99.3%). En junio se observó una prevalenciade hojas maduras (92.5%), mientras que en agosto se observaron hojas jóvenes(15.8%), en septiembre aparecieron algunas yemas (5.6%). La floración probablemente se presenta entre enero y febrero y se observaron algunos frutos en marzo (3.8%). Se observaron signos de marchitez foliar (15%) en noviembre (Figura 2d).
Especies de los bosques de M. aff. fragrans y B. alicastrum
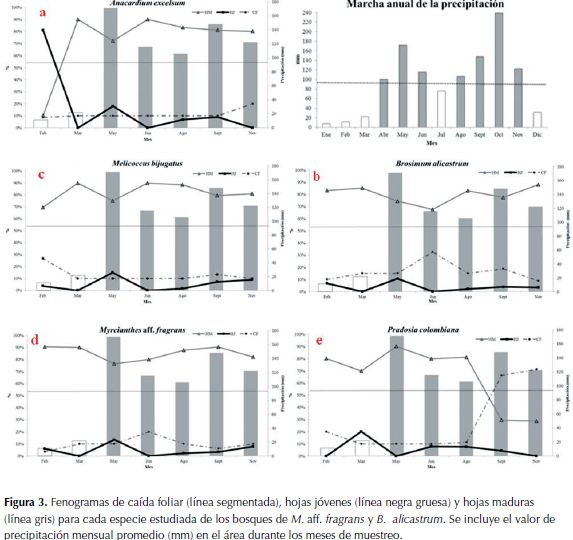
Anacardium excelsum (Bertero & Balb. ex Kunth) Skeels:el mayor porcentaje de caída foliar se presentó en noviembre (20%). Se observó la aparición de yemas (15%) y el predominio de hojas jóvenes (81%) en febrero. En marzo y junio dominaron las hojas maduras (90%). La floración comienza en febrero (20%) y alcanza el 75% en marzo. La fructificación comienza en marzo con 25% y alcanza los valores altos (60%) en mayo, también hay valores importantes en junio (45%) y agosto (40%). Se evidenció sincronía de las fases fenológicas reproductivas (floración y fructificación) entre individuos (Figura 3a).
B. alicastrum (guaimaro): el mayor valor de caída foliar se presentó en junio (32.5%) Aunque los individuos marcados eran juveniles, se observó el predominio de hojas jóvenes (10.6%) en mayo y de hojas maduras (82 - 88%) en febrero, marzo, agosto y noviembre. No se observó floración y/o fructificación durante la época de muestreo (Figura 3b).
Melicocus bijugatus Jacq. : el mayor porcentaje de caída foliar se presentó en febrero (26.7%). Se observó el predominio de hojas jóvenes en mayo (15%) y de las hojas maduras en marzo y junio (90%). No se observó floración ni fructificación, sin embargo en otros individuos no marcados se observaron frutos maduros al final de agosto (Figura 3c).
M. aff. fragrans : el mayor porcentaje de caída foliar se presentó en junio (20%). Las hojas jóvenes predominaron en mayo (13.5%) y las hojas maduras en febrero y septiembre (90.5-90.4%). Aunque no se observó la floración, los frutos fueron comunes en noviembre (6.3%) (Figura 3d).
Pradosia colombiana (Standl.) Penn. ex T.J. Ayers & Boufford: los mayores valores de caída foliar se presentaron en febrero (71.3%) y en noviembre (66.3%). Las hojas jóvenes se observaron en mayo (20.3%) y en junio las hojas maduras (90%). La floración se presentó en junio y en agosto (15-45%). Aunque los valores mayores de fructificación se presentaron en noviembre (48.8%), también hubo valores importantes en septiembre (30%) y febrero (27.5%), Se evidenció sincronía de las fases fenológicas reproductivas (floración y fructificación) entre individuos (Figura 3e).
DISCUSIÓN
Los tipos de bosque en el santuario
La vegetación del área de estudio se agrupa en la formación mayor de los bosques de M. biovulatum y E. procera con área de distribución en otras localidades del Caribe como en las estribaciones del Parque Nacional Natural Tayrona (Lozano, 1984) y en el departamento del Cesar (Delgado, 2013). Se diferenciaron dos grandes tipos de bosque. La formación de los bosques de B. simaruba y P. acapulcensis entre 570 y 690 m de altitud, donde se agrupan bosques secos frecuentes en las planicies del Caribe dominados por S. mombin y C. magdalenae y por C. vitifolium y A. graveolens (Rangel, 2012), estos bosques se asocian con fitoclimas cálidos en áreas secas.
La otra formación mayor de los bosques de M. aff. fragans y B. alicastrum entre 630 y 1040 m de altitud, constituye una novedad fitoecológica. B. alicastrum es de amplia valencia ecológica, además de ser dominante en bosques secos, también figura como especie importante en bosques húmedos del Chocó biogeográfico (Rangel, 2004). Una especie del género Myrcianthes (M. ternifolia (O. Berg) McVaugh) es dominante característica de la vegetación de la región Andina de la Sierra Nevada de Santa Marta entre 2500 y 3200 m de altitud (Cleef et al., 1984). En esta formación se incluyeron los bosques de S. cordifolia y S. saponaria con elementos florísticos característicos de la región cálido tropical y los boques de C. sanctae-marthae y O. macrophylla que pueden alcanzar la región subandina en áreas limítrofes con la media montaña. Estos bosques se asocian con un fitoclima menos seco, transición hacia condiciones húmedas propias de la media montaña en estas estribaciones de la Sierra Nevada de Santa Marta.
En el área de estudio igualmente se caracterizaron los bosques espinosos de P. guamacho y P. flava propios de otro fitoclima (seco-árido) frecuente en áreas muy secas y áridas del Caribe, en La Guajira y cerros de Santa Marta (Rangel, 2012; Delgado, 2013). El hallazgo de este tipo de vegetación ilustra muy bien los procesos de colonización por parte de la vegetación proveniente de áreas con condiciones ecológicas diferentes pero que se adapta muy bien a las nuevas condiciones microclimáticas de los sitios que se encuentran directamente relacionadas con la influencia permanente del hombre.
Especies sincrónicas en las fases reproductivas
Independientemente del tipo de bosque del cual hacen parte, las siguientes especies presentaron esta condición: A. excelsum y P. colombiana de los bosques de M. aff. fragrans y B. alicastrum que se establecen en un fitoclima húmedo. Dichas especies florecen y fructifican en los meses más lluviosos, aunque en P. colombiana puede presentarse un pico de floración en julio (mes seco "veranillo"). Las fenofases de A. excelsum en Besotes duran más tiempo que las de los bosques de Costa Rica (Gordon et al., 1974).
P. septenatum del bosque de B. simaruba y P. acapulcensis que se establece en un fitoclima seco florece en la época de lluvia y fructifica en los meses secos. Estas fenofases aunque no coinciden exactamente con las mencionadas por Mahecha et al. (2004) para áreas del departamento de Cundinamarca, en donde la floración se manifiesta entre marzo (mes seco)-junio y la fructificación entre julio (mes seco)-agosto, sí presentan una ligera convergencia en la condición climática al inicio de las fenofases.
Especies sin sincronía en las fenofases reproductivas
En B. simaruba y P. acalpulcensis especies de los bosques de fitoclima seco, la fructificación se presenta en los meses lluviosos, mientras que en S. riparia se presenta en un mes seco. En B. simaruba, la única especie en la cual se observó la floración, esta se presentó en el periodo seco de mayor duración (diciembre-marzo). El tiempo de las fenofases en Besotes coincide con los resultados de Gordon et al. (1974), aunque estos autores solamente mencionaron la presencia de frutos entre septiembre y octubre. En individuosde P. acapulcensis que crecían cerca a los bordes de los caminos y en áreas clareadas, las fenofases reproductivas fueron muy frecuentes, condición que es similar a la que exhiben otras especies del género que han sido catalogadas por esto como heliófitas (Canavides-R et al., 2001).
En los bosques de fitoclima húmedo, M. aff. fragrans florece y fructifica en meses húmedos y en meses secos. B. alicastrum florece en meses secos y fructifica en meses húmedos, sus fenofases en Besotes no coinciden con los resultados de Ramírez & álvarez (2000) en bosques tropicales de Honduras, seguramente debido a las diferencias en las condiciones climáticas de los dos sitios.
Caída y renovación foliar
Las especies que responden en sincronía con el régimen de lluvia pueden perder desde el 30% hasta el 100% de sus hojas en los meses más secos (enero y febrero), como se observó en P. acapulcensis, M. bijugatus, S. riparia, B. simaruba, P. septenatum y P. colombiana. Estas últimas tres especies después de perder sus hojas entran en la fase de floración, probablemente como una respuesta estratégica para destinar recursos energéticos a la producción y dispersión de las semillas (Alvim, 1964).
B. alicastrum y M. aff. frangans pierden cerca del 30% de su follaje al inicio del veranillo de julio; A. excelsum no presentó una caída foliar significativa, aunque se observó una pérdida foliar inferior al 30% en noviembre (mes húmedo).
Los valores más altos de renovación foliar (hojas jóvenes) se presentan en los meses húmedos (mayo, agosto y septiembre). Estos resultados se relacionan con la optimización en el uso de la reserva hídrica sin que se genere un déficit para la planta. Mientras no haya un déficit, las plantas optimizan su productividad mediante el desarrollo de nuevas hojas e incrementos en la fotosíntesis y en el intercambio gaseoso. Hacia noviembre, la renovación foliar disminuye debido a la entrada de la época más seca del año. A. excelsum al contrario de las demás especies, tiene el mayor porcentaje de renovación foliar en febrero (época seca). Quizás en esta situación particular se encuentren involucradas las raíces que se profundizan considerablemente hacia los cauces cercanos a los sitios en los cuales se establecen los individuos.
La coexistencia de tipos de vegetación con especies caducifolias y con especies siempreverdes bajo un mismo mesoclima ya había sido mencionada en otros estudios; Eamus & Prior, (2001) y Vico et al. (2014) encontraron que las especies siempreverdes se favorecenpor temporadas cortas de sequía o porque pueden acceder a reservas de agua en el suelo, condición por la cual las denominó oportunistas que en besotes se ilustran con A. excelsum. La estacionalidad marcada con una época seca de larga duraciónse relaciona directamente con la presencia de especies de hoja caediza, es decir la caída foliar puede representar una ventaja competitiva frente a descensos de lluvia marcados, como se infiere de los hallazgos de Lima & Rodal (2010)sobre el inicio de la abscisión foliar después de las lluvias comorespuesta a los primeros síntomas de escasez de agua en el suelo. La abscisión foliar en la estación seca ha sido consideradauna respuesta adaptativa para controlar la disminución de los óptimos hidráulicos, la eficiencia fotosintética, la desecación de hojas maduras y la cavitación,acciones que evitan un aumento crítico y desfavorable del potencial hídrico (Jackson et al., 1995; Borchert y Rivera, 2001).En el caso de las especies siempreverdes que pueden soportar periodos de sequía de corta intensidad, sus adaptaciones y estrategias fisiológicas aún son desconocidas (Markesteijn et al., 2011).
CONCLUSIONES
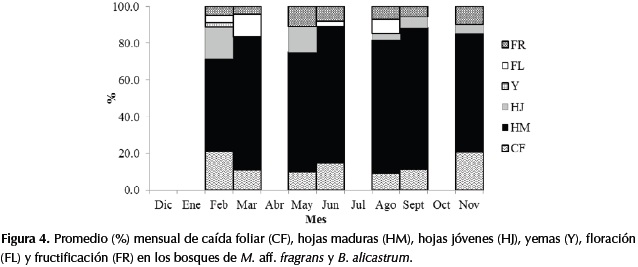
En las especies de los bosques de M. aff. fragrans y B. alicastrum la caída foliar no superó el 20%, independientemente de las épocas de sequía y lluvias. Adicionalmente en otras especies del sotobosque se presentó una caída foliar menor al 40%, como fue el caso de Erythroxylum sp., Pilocarpus goudotianus Tul., Platypodium elegans Vogel., Aspidosperma cuspa (Kunth) S.F. Blake ex Pittier, Platymiscium pinnatum (Jacq.) Dugand., Handroanthus chrysanthus S. O. Grose., Cassearia arguta Kunth., Clitoria dendrina Pittier, Maclura tinctoria (L.) D. Don ex Steud. y Sorocea sprucei (Baill.) J.F. Macbr. Por lo anterior, se puede considerar que este bosque es siempreverde y según Dugand (1941) las especies de sotobosque mencionadas son brevicaducifolias(Figura 4). La sombra que produce un dosel denso que no sufre una caída foliar significativa en las épocas más secas, permite reducir el impacto de las altas radiaciones hacia el interior del bosque, lo cual genera condiciones favorables que reducen el impacto del déficit hídrico en el sotobosque.
La fase de floración fue más representativa en las épocas de sequía, por consiguiente la fase de fructificación fue más frecuente en las épocas de lluvias, posiblemente por el tipo de dispersión y conservación de las semillas. Además de las especies objeto de este estudio, este comportamiento también se observó en C. sanctae-marthae y en Ficus yoponensis Desv.
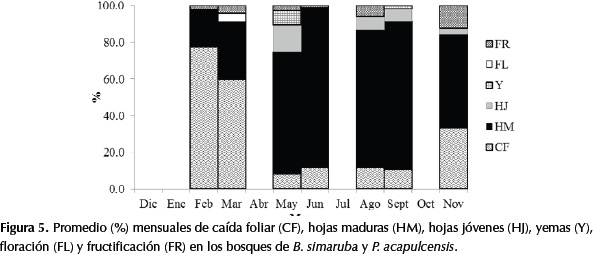
En las especies de los bosques de B. simaruba y P. acapulcensis, la caída foliar superó el 60% en las épocas de sequía con relación a un 30% en la época de lluvias (a excepción del mes de noviembre que marca la entrada de la época más seca del año). En otras especies del sotobosque también se presentó una caída foliar mayor al 60%, como fueron los casos de A. cuspa, C. magdalenae, Capparidastrum frondosum (Jacq.) Cornejo & Iltis., Cnidoscolus urens (L.) Arthur., Cordia bidentata L., E. procera, Gouania virgata Reissek, Guettarda elliptica Sw., P. flava, Pogonopus speciosus (Jacq.) K. Schum.y Pseudobomax máximum A. Robyns. En los sitios en donde se establecen estos bosques se observó una gran cantidad de claros y por esta razón es posible que en los meses más secos los individuos se encuentren expuestos a una mayor radiación, que induce a una caída foliar generalizada. Por lo anterior, se concluye que este bosque es caducifolio y según Dugand (1941) las especies de sotobosque mencionadas igualmente son caducifolias (Figura 5).
La fase de floración solamente se observó en las épocas de sequía (diciembre-marzo; julio), sin embargo es probable que en octubre también se presente. La fase de fructificación fue más frecuente al final de la época más lluviosa (noviembre), posiblemente para mejorar la dispersión, germinación y conservación de semillas. En especies del sotobosque se observó el mismo comportamiento, como fueron los casos de Tabernamontana cimosa Jacq., C. frondosum, Hura crepitans L., Cedrela sp. y Mabea montana Aubl.
En síntesis:
A. Las fenofases documentadas están directamente relacionadas con variaciones climáticas, especialmente con el régimen de distribución de la precipitación, que condiciona periodos de sequía o de concentración de lluvia como ha sido ilustrado para otros países por Bullock & Solís-Magallanes (1990) y Duarte et al. (1993) y en Colombia por Goméz & Macias (2012). Estos autores encontraron en un bosque seco de Bolívar, Cauca, que las fenofases reproductivas (floración-fructificación) de Brownea rosa-de-monte Bergius predominaron entre enero y agosto, periodo que incluye meses secos como enero, febrero, marzo y húmedos como mayo y junio, mientras que la fase vegetativa (follaje) prevaleció entre agosto y diciembre, meses húmedos.
B. Bajo un clima regional en el bosque tropical seco del santuario Los Besotes, se caracterizaron comunidades siempreverdes con valores menores al 40% en la caída foliar y comunidades caducifolias con valores mayores al 60%.
AGRADECIMIENTOS
A la corporación autónoma regional del Cesar (CORPOCESAR), al Dr. Tomas Darío Gutiérrez, Director del santuario Los Besotes y a la comunidad de la zona, por el apoyo para la realización de la investigación. Así mismo, extendemos nuestro agradecimiento a los integrantes del grupo de Biodiversidad y Conservación del Instituto de Ciencias Naturales (Universidad Nacional), al Ph.D(c) Andrés Avella, al M.Sc. César Delgado y a las ingenieras forestales Diana Castillo y Tatiana Sandino. Finalmente, agradecemos la contribución de dos revisores anónimos que mejoraron la versión final.
REFERENCIAS BIBLIOGRÁFICAS
Alvim, P. (1964). Tree growth periodicity in tropical climates. En M. H. Zimmermann (ed.).The formation of wood in forest trees (pp. 479-495). Nueva York: Academic Press.
Bullock, S., & Solís-Magallanes, J. (1990). Phenology of cannopy trees of a tropical deciduous forest in México. Biotropica, 22, 22-35.
Barbosa-Castillo, C., Ruíz-Delgado, A., García-Quiñones, H., & Gutiérrez, T. D. (2008). Guía ilustrada de plantas destacadas del santuario de vida silvestre Los Besotes, Valledupar, Cesar, Colombia. En J. V. Rodríguez-Mahecha & Márquez W. (eds.). Guía ilustrada de plantas destacadas del santuario de vida silvestre Los Besotes, Valledupar, Cesar, Colombia (1-273). Bogotá: Conservación internacional.
Borchert, R., & Rivera, G. (2001). Photoperiodic control of seasonal development and dormancy in tropical stem-succulent trees. Tree Physiology 21, 213-221.
Camacho, M., & Orozco, L. (1998). Patrones fenológicos de doce especies arbóreas del bosque montano de la Cordillera de Talamanca, Costa Rica. Rev. Biol. Trop, 46(3), 533-542.
Canavides-R, J., Agudelo, N.,& Molina, A. (2001). Estudio ecológico, silvícola y de utilización del sangre, Pterocarpus rohrii Vahl, en bosques latifoliados de Honduras. (Trabajo de grado, Desarrollo Socioeconómico y Ambiente). Honduras, Tegucigalpa: Escuela Agrícola Panamericana El Zamorano. 47 p.
Cleef, A.M., Rangel-Ch. J.O., Van Der Hammen, T., & Jaramillo-M, R. (1984). La vegetación de las selvas del Transecto Buritaca, Sierra Nevada de Santa Marta. En T. van der Hammen y . Ruiz-C. P. (eds.). La Sierra Nevada de Santa Marta, Transecto Buritaca-La Cumbre. Estudios de ecosistemas tropandinos (2:267-406). Berlín: J. Cramer.
Duarte, M., Albert, D., & Hernández, J. (1993). Análisis fenológico de Hibiscus elatus Sw. en el Parque Metropolitano de la Habana. Fontqueria, 36, 391-398.
Delgado, C. (2013). Caracterización florística y estructural de la vegetación xerofitica del departamento del Cesar, Colombia-Cesar. (Tesis de Maestría). . Bogotá D.C: Facultad de Ciencias, Instituto de ciencias Naturales, Universidad Nacional de Colombia
Dugand-G., A. (1941). Estudios geobotánicos colombianos: Descripción de una sinecia típica en la subxerofitia del litoral Caribe. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales, 4(14),135-141.
Eamus, D., & Prior, L. (2001). Ecophysiology of trees of seasonally dry tropics: comparisons among phenologies. Advances in Ecological Research 32,113-197.
Fournier, L. A. (1974). Un método cuantitativo para la medición de características fenológicas en árboles. Turrialba, 24, 422-423.
Fournier, L. A. (1976). The dendrophenograph, a graphic representation of tree phenology. Turrialba, 26(1), 96-97.
García, E. G., & Di Stefano, J. F. (2005). Fenología de árbol Sideroxylon capiri (Sapotaceae) en el bosque seco tropical de Costa Rica. Revista de Biología Tropical, 53(1-2), 5-14.
Gómez-M., D. A., & Macías-P, D. J. (2012). Fenología del palo cruz (Brownea rosa-de-monte Bergius) en un bosque seco de Bolívar, Cauca. Colombia Forestal, 15(1), 105-117.
Gordon, W. F., Baker, H. G.,& Opler, P. A. (1974). Comparative phenological studies of trees in tropical wet and dry forests in the lowlands of Costa Rica. Journal of Ecology, 62(3), 881-919.
Holdridge, L. R. (1982). Ecología Basada en Zonas de Vida. San José de Costa Rica: Instituto Interamericano de Cooperación para la Agricultura. 216 p.
Jackson, P. C., Cavelier,J., Goldstein, G., Meinzer, F. C., & Holbrook, N. M. (1995). Partitioning of water-resources among plants of a lowland tropical forest. Oecologia, 101, 197-203.
Jiménez, L. C. (1992). Climatología de la sierra Nevada de Santa Marta. Zenit, 3,47-64.
Lima, A. L. A., & Rodal, M. J. N. (2010). Phenology and wood density of plants growing in the semi-arid region of northeastern Brazil. Journal of Arid Environments, 74, 1363-1373.
Lozano-C., G. (1984). Comunidades vegetales del flanco Norte del e4rro "El Cielo" y la flora vascular del Parque Nacional Natural Tayrona. En T. Van der Hammen & Ruiz P. (eds,). La Sierra Nevada de Santa Marta (Colombia). Transecto Buritica-La Cumbre. Estudios de ecosistemas tropoandinos 2 (pp. 407-422). Berlín: J. Cramer.
Madrigal-J., T. A. (1996-1997). Fenología y ecofisiología de Quercus oocarpa (Fagaceae), Cartago, Costa Rica. Revista de Biología Tropical, 44(3), 45(1), 117-123.
Mahecha G., Ovalle, A.,Camelo, D., Rozo, A., & Barrero, D. (2004). Vegetación del territorio CAR. 450 especies de sus llanuras y montañas. Bogotá: Corporación autónoma regional de Cundinamarca. 881 p.
Markesteijn, L., Poorter, L., Paz, H., Sack, L., & Bongers, F. (2011). Ecological differentiation in xylem cavitation resistance is associated with stem and leaf structural traits. Plant, Cell and Environment, 34, 137-148.
Ramírez, J.A., Álvarez, R.R. (2000). Estudio fenológico de 28 especies maderables del bosque húmedo tropical de Honduras. Tegucigalpa: PROECEN, ESNACIFOR. 38pp.
Rangel-Ch, J.O., & Velásquez, A. (1997). Métodos de estudios de la vegetación. En J.O. Rangel-Ch. (ed.). Colombia Diversidad Biótica II. Tipos de vegetación en Colombia (pp. 59-87). Bogotá: Instituto de Ciencias Naturales, Universidad Nacional de Colombia.
Rangel-Ch., J.O. (2004). La vegetación del Chocó biogeográfico de Colombia y zonas cordilleranas aledañas -síntesis-. En J.O. Rangel-Ch. (ed.). Colombia Diversidad Biótica IV. El Chocó biogeográfico/Costa Pacífica (pp. 769-815). Bogotá: Instituto de Ciencias Naturales.
Rangel-Ch, J.O., Carvajal, J.E., Cortés, J. & Rivera, O. (2009). Amenazas a la biota (vegetación, fauna, flora y ecosistemas) de la serranía del Perijá. En J.O. Rangel-Ch. (ed.). Colombia diversidad biótica VIII. Media y baja montaña de la serranía de Perijá (pp. 661-676). Bogotá: Instituto de Ciencias Naturales, Universidad Nacional de Colombia.
Rangel-Ch., J.O. (2012). La vegetación de la región Caribe de Colombia: composición florística y aspectos de la estructura. En J.O. Rangel-Ch. (ed.). Colombia Diversidad Biótica XII. La región Caribe de Colombia (pp. 365-476). Bogotá: Instituto de Ciencias Naturales, Universidad Nacional de Colombia.
Rangel-Ch., J. O., & Carvajal-C, J. E. (2012). Clima de la región Caribe colombiana. En: J.O. Rangel-Ch. (ed.). Colombia Diversidad Biótica XII. La región Caribe de Colombia (pp. 67-129). Bogotá: Instituto de Ciencias Naturales, Universidad Nacional de Colombia.
Rodríguez-B., C. (2009). Fenología de Quercus ilex L. y Quercus suber L. en una dehesa del Centro Peninsular. (Proyecto Fin de Carrera. Ingeniería Técnica Forestal). Madrid: Universidad politécnica de Madrid. 100 p.
Sandino, M. T. & Castillo, D.M. (2014). Caracterización florística y estructural de las etapas sucesionales de la vegetación de bosque seco tropical con fines de restauración ecológica en la reserva natural Los Besotes, Valledupar, Cesar. (Trabajo de pregrado, Ingeniería Forestal). Bogotá: Universidad Distrital Francisco José de Caldas. 193 p.
Silva, A. G., Freitas, L. & Pires, J. P. A. (2014). A Fournier Index upgrade as a new approach for quantitative phenological studies in plant communities. Tropical Ecology, 55(1), 137-142.
Vico, G., Thompson, S. E., Manzoni, S., Molini, A., Albertson, J. D., Almeida-Cortez, J. S., Fay, P. A., Feng, X., Guswa, A. J., Liu, H., Wilson, T. G. & Porporato, A. (2014). Climatic, ecophysiological, and phenological controls on plant ecohydrological strategies in seasonally dry ecosystems. Ecohydrology. DOI: 10.1002/eco.1533
Vilchez, B., Chazdon, R.,& Alvarado, W. (2007). Fenología reproductiva de las especies del dosel superior en seis sitios de la región Huetar Norte de Costa Rica. Kurú Revista Forestal, 4(10), 1-16.
Licencia
Colombia Forestal conserva los derechos patrimoniales (copyright) de las obras publicadas, y favorece y permite la reutilización de las mismas bajo la licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional por lo cual se pueden copiar, usar, difundir, transmitir y exponer públicamente, siempre que:
Se reconozcan los créditos de la obra de la manera especificada por el autor o el licenciante (pero no de una manera que sugiera que tiene su apoyo o que apoyan el uso que hace de su obra).