DOI:
https://doi.org/10.14483/udistrital.jour.colomb.for.2017.1.a06Publicado:
01-01-2017Número:
Vol. 20 Núm. 1 (2017): Enero-JunioSección:
Artículos de investigación científica y tecnológicaEvidencia en la direccionalidad del proceso de sucesión temprana del bosque altoandino
Directionality Evidence in High Andean Forest Early Successional Process
Palabras clave:
Bosque secundario, distancia florística, distancia geográfica, diversidad, potreros abandonados (es).Palabras clave:
secondary growth forest, floristic distance, geographic distance, diversity abandoned paddocks (en).Descargas
Referencias
Adobe Systems. (2008). Photoshop CS4 extended versión 11.0.2. Michigan.
Arroyo-Rodriguez, V., Melo, F. P. L., Martinez-Ramos, M., Bongers, F., Chazdon, R. L., Meave, J.A., Norden, N., Santos, B.A., Leal, I. R., & Tabarelli, M. (2015). Multiple successional pathways in human-modified tropical landscapes: new insights from forest succession, forest fragmentation and landscape ecology research. Biological Reviews, 000-000.
Cairns, J., & Wilson, E. O. (1988). Increasing diversity by restoring damaged ecosystems. Washington, D.C., National Academy Press, pp. 333-343.
Cavelier, J., Lizcano, D., & Pulido, M. T. (2001). Colombia. Bosques nublados del neotrópico. Santo Domingo de Heredia, Costa Rica: Instituto Nacional de Biodiversidad (IN Bio), pp. 443-496.
Condit, R., Hubbell, S. P., & Foster, R. B. (1996). Assessing the response of plant functional types to climatic change in tropical forests. Journal of Vegetation Science, 7(3), 405-416. https://doi.org/10.2307/3236284
Dalling, J. W., Swaine, M. D., & Garwood, N. C. (1998). Dispersal patterns and seed bank dynamics of pioneer trees in moist tropical forest. Ecology, 79(2), 564-578. https://doi.org/10.1890/0012-9658(1998)079[0564:DPASBD]2.0.CO;2
Elgar, A.T., Freebody, K., Pohlman, C.L., Shoo, L.P., & Catterall, C.P. (2014). Overcoming barriers to seedling regeneration during forest restoration on tropical pasture land and the potential value of woody weeds. Frontiers in Plant Science, 200(5). https://doi.org/10.3389/fpls.2014.00200
Facelli, J. M., D'Angela, E., & Leon, R. J. (1987). Diversity changes during pioneer stages in a subhumid pampean grassland succession. American Midland Naturalist, 17-25. https://doi.org/10.2307/2425703
Florentine, S. K. & Westbrooke, M. E. (2004). Restoration on abandoned tropical pasturelands—do we know enough? Journal for Nature Conservation, 12(2), 85-94. https://doi.org/10.1016/j.jnc.2003.08.003
Forest Restoration Research Unit. (2008). Research for Restoring Tropical Forest Ecosystems: A Practical Guide. Thailand: Biology Department, Science Faculty-Chiang Mai University, pp. 39-40
Gentry, A. H. (2001). Patrones de diversidad y composición florística en los bosques de las montañas neotropicales. En M. Kapelle & A. Brown (eds.), Bosques nublados del Neotropico. Costa Rica: Instituto Nacional de Biodiversidad (INBio), pp. 84-123.
Guariguata, M. R., & Ostertag, R. (2001). Neotropical secondary forest succession: changes in structural and functional characteristics. Forest ecology and management, 148(1), 185-206. https://doi.org/10.1016/S0378-1127(00)00535-1
Gunaratne, A.M.T.A, Gunatilleke, G.V.S., Gunatilleke, I.A.U.N., Madawala, H.M.S.P., & Burslem, D.G.R.P. (2014) Overcoming ecological barriers to tropical lower montane forest succession on anthropogenic grasslands: Synthesis and future prospects. Forest Ecology and Management, 329, 340-350. https://doi.org/10.1016/j.foreco.2014.03.035
Hallé, F., Oldeman, R. A., & Tomlinson, P. B. (1978). Tropical trees and forests: an architectural analysis. Berlin: Springer-Verlag. https://doi.org/10.1007/978-3-642-81190-6
Hamilton, L. (1995). Una campaña por los bosques nublados, ecosistemas únicos y valiosos en peligro. Serie Focus de la UICN.
Hilera-Lanzos, R., & J. M. Diez-Hernández. (2006). Directrices de restauración ecológica en cuencas hidrográficas andinas. Plan de manejo ambiental de la cuenca hidrográfica La Floresta-La Novita. Bogotá. Colombia. Valladolid: Universidad de Valladolid
Hubbell, S. P. (1979). Tree dispersion, abundance, and diversity in a tropical dry forest. Science, 203(4387),1299-1309. https://doi.org/10.1126/science.203.4387.1299
Oksanen, J., Blanchet, F. G., Kindt, R., Legendre, P., Minchin, P.R., R. B. O'Hara, R. B., G. L. Simpson, G. L., Solymos, P., Henry, M., Stevens, H., & Wagner, H. (2015). Vegan: Community Ecology Package. R package version 2.3-0. Recuperado de http://CRAN.R-project.org/package=vegan
Jost, L. (2006) Entropy and diversity. Oikos,113(2), 363-375. https://doi.org/10.1111/j.2006.0030-1299.14714.x
Kok, K., Verweij, P. A., & Beukema, H. (1995). Effects of cutting and grazing on Andean treeline vegetation. Biodiversity and conservation of neotropical Monatne forests (pp. 527-539). New York: New York Botanical Garden.
Lieberman, D., Lieberman, M., Hartshorn, G., & Peralta, R. (1985). Growth rates and age-size relationships of tropical wet forest trees in Costa Rica. Journal of Tropical Ecology, 1(02), 97-109. https://doi.org/10.1017/S026646740000016X
Lohbeck, M., Poorter, L., Martínez-Ramos, M., Rodríguez-Velázquez, J., van Breugel, M., & Bongers, F. (2014). Changing drivers of species dominance during tropical forest succession. Functional Ecology, 28(4), 1052-1058. https://doi.org/10.1111/1365-2435.12240
Longland, W. S., & Price, M.V. (1991) Direct Observations of Owls and Heteromyid Rodents: Can Predation Risk Explain Microhabitat Use? Ecology, 72(6), 2261-2273. https://doi.org/10.2307/1941576
Matteucci, S.D., & Colma, A. (1982). Metodología para el estudio de la vegetación (pp. 56-62). Washintong D.C.: Secretaría general de la Organización de los Estados Americanos; Programa regional de desarrollo científico y Tecnológico.
Murcia, C. (1997). Evaluation of Andean alder as a catalyst for the recovery of tropical cloud forests in Colombia. Forestry Ecology and Management, 99(1-2), 163-170. https://doi.org/10.1016/S0378-1127(97)00202-8
Norden, N., R. L. Chazdon, et al. (2009). Resilience of tropical rain forests: tree community reassembly in secondary forests. Ecology Letters, 12(5), 385-394. https://doi.org/10.1111/j.1461-0248.2009.01292.x
Norden, N., Angarita, H. A., Bongers, F., Martínez-Ramos, M., Granzow-de la Cerda, I., van Breugel, M., & Chazdon, R. L. (2015). Successional dynamics in neotropical forests are as uncertain as they are predictable. Proceedings of the National Academy of Sciences, 112(26), 8013-8018. https://doi.org/10.1073/pnas.1500403112
Oosterhoorn, M., & Kappelle, M. (2000). Vegetation structure and composition along an interior-edge-exterior gradient in a Costa Rican montane cloud forest. Forest Ecology and Management,126, 291-307. https://doi.org/10.1016/S0378-1127(99)00101-2
Ortega-Pieck, A., López-Barrera, F., Ramírez-Marcial, N., & García-Franco, J. G. (2011). Early seedling establishment of two tropical montane cloud forest tree species: The role of native and exotic grasses. Forest Ecology and Management, 261(7), 1336-1343. https://doi.org/10.1016/j.foreco.2011.01.013
Paine, C. T., & Harms, K. E. (2009). Quantifying the effects of seed arrival and environmental conditions on tropical seedling community structure. Oecologia,1 60(1), 139-150. https://doi.org/10.1007/s00442-008-1269-6
Pedraza, R. A., & Williams-Linera, G. (2003). Evaluation of native tree species for the rehabilitation of deforested areas in a Mexican cloud forest. New forests, 26(1), 83-99. https://doi.org/10.1023/A:1024423511760
Posada, J. M., Aide, T. M., & Cavelier, J. (2000). Cattle and weedy shrubs as restoration tools of tropical montane rainforest. Restoration ecology, 8(4), 370-379. https://doi.org/10.1046/j.1526-100x.2000.80052.x
R Core Team. (2015). R: A language and environment for statistical computing. Vienna: R Foundation for Statistical Computing. ISBN 3-900051-07-0, Recuperado de http://www.R-project.org.
Salamanca, B., & Camargo, G. (2000). Protocolo distrital de restauración ecológica. Bogotá D.C.: Alcaldía Mayor, Departamento Técnico Administrativo del Medio Ambiente(DAMA).
Shoo, L.P., & Catterall, C.P. (2013). Stimulating Natural Regeneration of Tropical Forest on Degraded Land: Approaches, Outcomes, and Information Gaps. Restoration Ecology. 21(6), 670-677. https://doi.org/10.1111/rec.12048
Strayer, D. L., Power, M. E., Fagan, W. F., Pickett, S. T., & Belnap, J. (2003). A classification of ecological boundaries. BioScience, 53(8), 723-729. https://doi.org/10.1641/0006-3568(2003)053[0723:ACOEB]2.0.CO;2
Swaine, M. D., & Whitmore, T. C. (1988). On the definition of ecological species groups in tropical rain forests. Vegetatio, 75(1-2), 81-86. https://doi.org/10.1007/BF00044629
Terborgh, J., & Foster, R. B. (1996). Tropical tree communities: a test of the nonequilibrium hypothesis. Ecology, 77(2), 561-567. https://doi.org/10.2307/2265630
Turner, I. M. (2001). The ecology of trees in the tropical rainforest. Cambridge, UK: Cambridge University Press. https://doi.org/10.1017/CBO9780511542206
Wright, S. J., & Muller-Landau, H. C. (2006). The Future of Tropical Forest Species. Biotropica, 38(3), 287-301. https://doi.org/10.1111/j.1744-7429.2006.00154.x
Young, K. R. (1991). Natural History of an Understory Bamboo (Chusquea sp.) in a Tropical Timberline Forest. Biotropica, 23(4 parte B), 542-554.
Zanne, A. E. & Chapman, C. A. (2001). Expediting reforestation in tropical grasslands: distance and isolation from seed sources in plantations. Ecological Applications, 11(6), 1610-1621. https://doi.org/10.1890/1051-0761(2001)011[1610:ERITGD]2.0.CO;2
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
 |
Lequerica, M., Bernal, M. & Stevenson, P. (2017). Evidencia de direccionalidad del proceso de sucesión temprana del bosque altoandino. Colombia Forestal, 20(1), 63-84. |
Artículo de investigación
EVIDENCIA DE DIRECCIONALIDAD DEL PROCESO DE SUCESIÓN TEMPRANA DEL BOSQUE ALTOANDINO
Directionality evidence in high andean forest early successional process
Manuel Lequerica1, Mauricio Bernal2 & Pablo R. Stevenson3
1 Universidad de los Andes, Bogotá, Colombia. Integrative Ecology Lab, School of Life and Environmental Sciences, Faculty of Science, The University of Sydney. Sydney, Australia. manuel.lequerica@sydney.edu.au. Autor de correspondencia.
2 Jardín Botánico de Cartagena Guillermo Piñeres, Turbaco, Colombia. mauriciobernalro@gmail.com
3Universidad de los Andes, Bogotá, Colombia. pstevens@uniandes.edu.co
Recepción: 14 de enero de 2016 / Aprobación: 24 de octubre de 2016
RESUMEN
Los bosques secundarios han aumentado su extensión en las últimas décadas; a su vez, han sido propuestos como elementos de conservación. El propósito de este estudio fue evaluar la composición vegetal y la diversidad en potreros y bosques en Granada (Cundinamarca, Colombia), para comprobar si los procesos sucesionales demuestran direccionalidad. Se ubicaron seis parcelas de 0.1 Ha del borde del bosque hacia el potrero y hacia el bosque. Para cada parcela se determinó la estructura de la vegetación, diversidad y composición florística. Se encontró que la diversidad de los bosques es significativamente superior a la de los potreros en etapas tempranas de sucesión. Por medio de ordenaciones, el estado sucesional de cada una de las parcelas y se caracterizó observando que la vegetación tiende a agruparse según su edad, evidencia de que la sucesión es un proceso direccional. Dibujando perfiles de vegetación y calculando la densidad de plántulas a lo largo del gradiente bosque-potrero se encontró que el reclutamiento de plántulas no es significativamente diferente entre el borde y el interior del bosque. Por último, se encontró una relación inversamente proporcional entre distancias florísticas y geográficas de las parcelas, señalando la discontinuidad como una barrera a la sucesión del bosque.
Palabras clave: bosque secundario, distancia florística, distancia geográfica, diversidad, potreros abandonados
ABSTRACT
Secondary growth forests have increased their extension in the last decades, and have been suggested as potential conservation reservoirs. The objective of this study was to evaluate diversity and vegetation composition in abandoned pastures and grazing plots at Granada (Cundinamarca, Colombia) to assess if successional processes show evidence of directionality. We placed six 0.1-ha plots in the forest edges, one towards the forest and other to the abandoned paddocks in three locations. We determined average vegetation structure, diversity, and floristic composition for each plot. We found that diversity is significantly higher in forest plots than in paddock plots (at early succession stage) in high Andean cloud ecosystems. The successional stage of each one of the study sites was characterized using non-metric multidimensional scaling. This analysis shows that vegetation tends to group in function of age groups more that it does by geographic location of the plots, suggesting succession is a directional process. Seedling recruitment was not significantly different between forest edge and forest interior. An inverse relation was found between floristic and geographic distances, reflecting the fact that matrix discontinuity is a limiting factor for seed dispersal, thus it is a barrier for high Andean cloud forest succession.
Key words: secondary growth forest, floristic distance, geographic distance, diversity abandoned paddocks
INTRODUCCIÓN
La intervención antrópica sobre la diversidad ha sido fuerte en el territorio colombiano, principalmente por medio de conversión de los bosques a sistemas agrícolas (cafetales, pastizales y cultivos varios) y pecuarios (Cavelier et al., 2001). Aunque, se prevé que en el futuro próximo las migraciones del campo a las ciudades y la estabilización demográfica en los países tropicales se verá reflejada en una recuperación progresiva de los ecosistemas impactados por el desarrollo, es importante comprender cuáles son los mecanismos subyacentes a las dinámicas de sucesión (Wright & Muller-Landau, 2006). Lo anterior ubica los ecosistemas tropicales como potenciales lugares de conservación de la biodiversidad. El estudio de los fenómenos naturales de sucesión se vuelve importante en miras a recuperar la biodiversidad de los sitios perturbados por medio de procesos de restauración (Cairns Jr., 1988). Según Gentry (2001), para 1991 se estimaba que menos del 10 % de los bosques alto-andinos estaba intacto, razón por la cual es apropiado observar con atención los procesos que se llevan a cabo en estos bosques para facilitar su conservación.
Mediante el esfuerzo por disminuir la destrucción de ecosistemas prístinos y el fomento a la conservación y restauración, se puede reparar a gran escala el daño ambiental ocasionado por la transformación a los ecosistemas causado por el hombre (Cairns Jr, 1988). Este estudio se basa en la observación de los fenómenos de sucesión en bosques alto-andinos de niebla. Estos ecosistemas se caracterizan, entre otras cosas, por ser complejos de vegetación capaces de capturar la humedad suspendida en el aire (niebla) que sumada a la precipitación atmosférica permite una alta disponibilidad de agua a lo largo del año (Hamilton, 1995). Lo anterior hace de este ecosistema un importante actor en la regulación hídrica —cabeceras de montaña, nacimiento de ríos y protección de cuencas— además de un reservorio de biodiversidad (Hamilton, 1995).
Una estrategia estudiada en otros lugares para reversar transformaciones antrópicas a ecosistemas más similares a los bosques originales ha sido permitir la sucesión natural de áreas degradadas en proximidad a fuentes de semillas (Murcia, 1997). Esta estrategia, conocida como restauración pasiva, es un indicador del camino natural de la sucesión y ha arrojado evidencias claras que permiten a los investigadores desarrollar planes eficientes de manejo para zonas de explotación agroindustrial abandonadas con miras a ser restauradas (Murcia, 1997). La restauración pasiva del bosque se da en zonas de perturbación que han sido abandonadas por disminución de productividad o devaluación del producto agrícola explotado anteriormente (Guariguata & Ostertag, 2000), como también en zonas aledañas a bosques primarios para aumentar la conectividad entre estos.
Comprender la restauración pasiva como un proceso de sucesión es ventajoso para el estudio y desarrollo de métodos prácticos en sucesión asistida —restauración—. En algunos casos donde la sucesión natural ha sido arrestada bien sea por factores abióticos del suelo (pH, humedad, compactamiento) o bióticos (competencia con especies invasoras de pastos o hierbas, ausencia de banco de semillas y/o lluvia de semillas) se vuelve una prioridad asistir el proceso de sucesión (Zanne & Chapman, 2001; Florentine & Westbrooke, 2004). Para comprender la dinámica de sucesión de un bosque secundario es clave observar con detenimiento los siguientes factores: efectos de borde (Oosterhoorn & Kappelle, 2000; Strayer et al., 2003), composición florística del lote en sucesión (Norden et al., 2009), estado, composición y uso anterior de los suelos en sucesión (Hilera-Lanzos & Diez-Hernandez, 2006) y distancia de los lotes en sucesión al bosque (Oosterhoorn & Kappelle, 2000; Norden et al. 2009).
De acuerdo a lo observado por otros investigadores, la intensidad en la explotación agrícola (Kok et al., 1995), la cercanía del bosque (Florentine & Westbrooke, 2004), la competencia con pastos exóticos (Ortega-Pieck et al., 2011) y la calidad y cantidad de dispersores (Pedraza & Williams-Linera, 2003) juegan importantes papeles al determinar la estructura de la comunidad (Paine & Harms, 2009). Oosterhoorn & Kappelle (2000) sugieren el uso de especies de borde de bosque como impulsoras de la regeneración del bosque y el avance de este hacia zonas de explotación agrícola abandonadas.
Las plantas pioneras, como grupo funcional, se pueden dividir en dos grupos principales: las que permanecen en el banco de semillas de un bosque esperando a que la disponibilidad de luz aumente como consecuencia de un disturbio y aquellas cuyas semillas alcanzan nuevos nichos disponibles (por medio de dispersión) para iniciar el proceso de colonización (o recolonización) (Condit et al., 1996). Las plantas pioneras del primer grupo tienen gran importancia en los procesos de sucesión al tener la posibilidad de permanecer en latencia cuando están en sombra y germinar al ser expuestas a luz directa (Swaine & Whitmore, 1988). Dado que en los bordes la incidencia de luz directa es mucho mayor que en el interior del bosque, es razonable asumir una tasa de reclutamiento mayor de las pioneras hacia el borde y en los potreros (claros) que en el bosque (Dalling et al., 1998). Algunas características de las plantas pioneras son: crecimiento rápido (Lieberman et al., 1985), alta tasa de reclutamiento y de mortalidad (Condit et al., 1996), madera de baja densidad, semillas pequeñas, baja biomasa foliar, alta tasa fotosintética y asociación a los disturbios (Turner, 2001).
La hipótesis del desequilibrio afirma que luego de un disturbio la probabilidad de que la composición florística de un bosque retorne a su estado original (o similar) es muy remota. Sin embargo, esta hipótesis ha sido estudiada con anterioridad (Hubbell, 1979) y puesta a prueba, intercambiando la dimensión temporal por la espacial (Terborgh et al., 1996). Este estudio arrojó evidencia hacia la direccionalidad de la sucesión primaria en los bosques. De acuerdo con esto, es posible afirmar que existen mecanismos biológicos intrínsecos a los bosques que regulan en gran medida la composición de especies, a pesar de los disturbios (Terborgh et al., 1996). Sin embargo, estudios recientes han mostrado que es difícil predecir con exactitud varios atributos de los bosques sucesionales (Norden et al., 2015).
Observar el proceso de sucesión de un bosque en tiempo real sería ideal, pero pasarían décadas antes de extraer suficiente información concluyente sobre la dinámica de intercambio de especies. Para superar este obstáculo temporal es posible observar distintos parches de un mismo bosque que hayan sufrido disturbios en diferentes momentos del pasado. Al realizar dichas observaciones de parches con disturbios de diferentes edades se puede decir que se intercambia la dimensión temporal por la espacial. Examinar la combinación de plantas observadas en cada uno estos parches —en otras palabras, comparar su composición florística— es de gran utilidad para determinar si existe direccionalidad en el proceso de sucesión. En el caso particular de este estudio, se espera que, en caso de haber direccionalidad, las parcelas con edades similares (entiéndase como momentos sucesionales equivalentes), tengan una composición florística parecida y que los individuos jóvenes en estadios sucesionales tempranos sean también similares a los de estadios tardíos. En términos generales, si la sucesión es un proceso direccional se espera que la composición florística de un área particular sea determinada por mecanismos intrínsecos a los bosques y no tanto como consecuencia del azar (Terborgh et al., 1996). La capacidad de dispersión de una planta es un factor importante en la composición florística de un área, por esta razón, es de esperarse que, si el azar es importante, la distancia geográfica juegue un rol importante explicando la composición de especies en distintos lugares (Dalling et al. (1998).
El propósito de este estudio esclarecer las relaciones entre la composición florística y el proceso de sucesión en un bosque húmedo alto andino. Con el ánimo de cumplir con tal propósito, se proponen cuatro preguntas relevantes a los aspectos principales de los procesos ecológicos de este ecosistema. Al pie de cada pregunta se sugiere una hipótesis de estudio:
· Existen diferencias en la composición florística y diversidad entre bosques secundarios y potreros en estados iniciales del proceso de sucesión? Se espera encontrar diferentes especies de plantas en parcelas con diferentes estados del proceso de sucesión, debido a la disparidad de condiciones (p.e. luz solar, nutrientes, humedad del suelo) entre parcelas.
· Es la sucesión un proceso aleatorio o existe evidencia para afirmar que hay patrones direccionales? Es de suponer que la vegetación de cada parcela será determinada por la disponibilidad de nichos, principalmente de luz solar (Lohbeck et al. 2014). Si se tiene en cuenta que las características abióticas de todas las parcelas son relativamente similares (tipo de suelo, precipitación, temperatura, humedad, y altitud) se puede suponer que parcelas con edades similares tendrán una composición florística similar y que la sucesión sigue un patrón direccional.
· Hay mayor reclutamiento de plántulas en los bordes que en el interior de los bosques? El borde del bosque presenta dos características que permiten asumir que tendrán un reclutamiento de plántulas mayor que el observado tanto en el interior del bosque como en el potrero. En primer lugar, hay un gradiente desde el borde del bosque hacia el potrero en donde el número de semillas en el suelo se reduce a medida que se incrementa la distancia con el bosque. Por otro lado, existe un gradiente de luz desde el borde del bosque hacia su interior, siendo menor la disponibilidad de este recurso a medida que aumenta la distancia desde el borde hacia adentro del bosque. Según lo anterior, el borde del bosque es donde estos dos gradientes comparten su punto máximo (mayor luminosidad y mayor cantidad de semillas). Por tanto, se espera que el número de plántulas sea mayor en esta región que en cualquier otra de las parcelas.
· Existe alguna correlación entre la distancia geográfica y la similaridad florística en el bosque altoandino? Si el proceso de sucesión es completamente direccional, y las características abióticas son similares en todas las parcelas, entonces la distancia entre estas no debería afectar de ninguna manera su composición florística.
MATERIALES Y MÉTODOS
Área de estudio
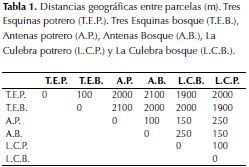
En la finca Sabaneta (municipio de Granada, vereda Sabaneta, departamento de Cundinamarca) tres localidades fueron escogidas (Tres Esquinas 04º31´960” N- 074º18´292” W; Antenas Telecom 04º31´325” N- 074º18´427” W y La Culebra 04º31´372” N- 074º18´437” W) con 2824, 3032 y 3027 m de altitud, respectivamente. Las tres localidades fueron escogidas aleatoriamente dentro de un radio de 3 Km (tabla 1). Este sitio de estudio es particularmente interesante para la investigación de los procesos de sucesión porque en su territorio se han llevado a cabo distintas actividades agrícolas, y también se han abandonado potreros en diferentes tiempos. En la parte superior de la montaña, donde está ubicada la finca, se encuentra un bosque de niebla donde ninguna actividad agrícola se ha realizado.
Para calcular la edad de las parcelas observamos cuatro fotografías aéreas del área (suministradas por el Instituto Geográfico Agustín Codazzi, IGAC). A lo largo de este periodo los sitios han estado en constante cambio. En 1943 todas las parcelas carecían de vegetación boscosa (aunque dado la calidad de la fotografía no es posible determinar el tipo particular de uso que se le daba al suelo en el momento). A partir de 1987, las parcelas de bosque (tanto Tres Esquinas como La Culebra y Antenas) tienen una cobertura arbórea importante, lo cual permitió asumir que la edad máxima de los bosques podría ser 69 años (asumiendo que desde 1943 estas parcelas fueron abandonadas, iniciándose así el proceso de sucesión). Aunque saber las edades exactas es imposible, dada la discontinuidad de las imágenes aéreas, sí es posible afirmar que la parcela de bosque de la Culebra es la más antigua, seguida por Antenas bosque, Tres Esquinas bosque, Antenas potrero y La Culebra potrero. Tres Esquinas potrero, en cambio, es notablemente más joven que las tres parcelas de bosque y también tiene una edad de abandono más reciente que las otras dos localidades de potrero (Antenas y La Culebra) y esto se refleja tanto en las fotografías como en su composición florística.
Análisis de diversidad y composición florística
Cada una de las localidades cumplía con el requisito de tener potreros abandonados adyacentes a remanentes de bosque húmedo altoandino. En cada una de las tres localidades se montaron dos parcelas de 20 x 50 m unidas longitudinalmente. Estas parcelas contiguas fueron ubicadas de forma perpendicular al borde del bosque, de tal forma que una de las parcelas quedara del borde hacia el bosque y la otra del borde hacia el potrero. Para cada parcela se tomaron datos de altura con un clinómetro y circunferencia a la altura del pecho (CAP) con una cinta métrica. Dentro de las parcelas se registraron todos los individuos cuyo CAP fuera mayor a 8 cm. Cada parcela se dividió en subparcelas de forma transversal (de modo que quedaran 5 cuadrantes de 10x20 m) dentro de cada una de las subparcelas de 10x20 se montó un cuadrante de 5x5 m para evaluar la presencia de juveniles (entre 3 y 8 cm CAP), y también un cuadrante de 1x1 para ver cobertura de hierbas y plántulas. Este último muestreo su realizó poniendo una gradilla de 1 m2 sobre el sustrato y muestreando la vegetación debajo de cada una de las 100 intersecciones. Se identificaron in situ las plantas comprendidas en el área muestreada, y aquellas que no, fueron colectadas para posterior identificación taxonómica en el herbario de la Universidad de Los Andes.
La diversidad de cada parcela fue calculada en R por medio del paquete Vegan (Oksanen et al., 2015), incluyendo el índice de Shannon-Wiener, al que se les aplicó la transformación eH` (Jost, 2006). Estos resultados de diversidad fueron sometidos a una prueba t-pareada (R Core Team, 2015) con el fin de determinar si existe o no una diferencia significativa en cuanto a la diversidad del bosque y el potrero.
Direccionalidad de la sucesión
Con el fin de analizar la composición florística (por grupos) se realizaron dos ordenaciones de escalamiento no-métrico multidimensional (NMDS) haciendo uso del paquete Vegan de R. Esta ordenación utiliza el método de Bray-Curtis para encontrar soluciones estables de ordenación dados los datos con una organización inicial aleatoria en iteraciones distintas (Oksanen et al., 2015). La primera ordenación se realizó utilizando los datos de todas las plantas de las parcelas muestreadas. Como la vegetación fue discriminada según su etapa ontogénica —adultos (.tr), juveniles (.sa) o plántulas (.sd)—, estas categorías fueron introducidas en la ordenación. La segunda ordenación tuvo en cuenta únicamente las plantas con tallos mayores a 8 cm de circunferencia a la altura del pecho —CAP—.
Perfiles de vegetación
Para el desarrollo de los perfiles del gradiente se siguieron las metodologías sugeridas por Hallé et al. (1978), además de aquellas establecidas por Oosterhoorn & Kappelle (2000) y por Matteucci & Colma (1982). Primero se analizaron los datos arrojados por las ordenaciones, escogiendo aquellas especies con mayor representación en cada una de las parcelas. Acto seguido, se hizo un dibujo esquemático de cada una de estas, respetando al máximo su arquitectura y morfología. Cada uno de los dibujos se escaneó y luego se procedió a ensamblar los perfiles usando Photoshop CS4® (2008).
La información del muestreo de vegetación para las parcelas de bosque fue resumida en tablas y discriminada en dos categorías: interior y borde. La primera categoría correspondiente a aquellas plántulas observadas en el cuadrante de 1x1 m más lejano del potrero y la segunda a las plántulas observadas en el cuadrante de 1x1 m más cercano al potrero. Para el análisis de los juveniles se usaron las mismas categorías, pero los datos analizados fueron los de las subparcelas 5x5m, en lugar de los de 1x1m. A continuación, se analizó cada uno de estos conjuntos utilizando pruebas t-pareadas y el paquete estadístico básico de R (Oksanen et al., 2015), evaluando así si la densidad de plántulas encontradas en el borde del bosque era diferente a aquellas documentadas en el interior.
Distancias geográficas y florísticas
Se construyeron matrices de composición florística utilizando la información colectada en campo. Estas matrices no solo reflejan ausencia o presencia de especies, sino también abundancia. Dichas matrices fueron analizadas utilizando la función “vegdist” en el paquete Vegan de R (Oksanen et al., 2015). Esta función compara los índices de disimilaridad de Bray-Curtis para dos comunidades diferentes, asumiendo como hipótesis nula que las dos comunidades comparadas tienen una composición florística idéntica. A cada pareja de comunidades le es asignado un valor “vegdist” entre 0 y 1. Estos valores representan la distancia florística entre parcelas, siendo 1 el valor asignado a dos comunidades idénticas y 0 aquel que se le daría a un par de comunidades que no tienen ninguna especie en común. Las distancias geográficas entre parcelas fueron determinadas utilizando fotografías aéreas de la zona, solicitadas al IGAC. A continuación, se procedió a comparar las dos matrices de datos para cada pareja de parcelas (distancia florística y distancia geográfica) con el fin de determinar si existe alguna relación entre estas. Para tal fin, se utilizó el test estadístico de Mantel para disimilaridad entre matrices. Este test encuentra el estadístico de correlación de mantel para dos matrices (valor entre 0 y 1) basándose en 999 permutaciones de las parejas de valores en las matrices.
La comunicación con las personas que tienen conocimiento sobre el lugar fue importante para determinar los usos previos del suelo, tipo de explotación agroindustrial, intensidad de la explotación, tiempos de abandono de los potreros. Con esta información se establecieron los tiempos aproximados de colonización de cada una de las especies presentes en estos espacios de sucesión. Con el fin de confirmar la información recibida, se solicitaron imágenes aéreas de la zona al IGAC. Cuatro fotografías nos fueron entregadas, correspondientes a los años 1943, 1987, 2007 y 2009, lo cual representa un rango temporal de 69 años, dado que el año en el que se realizó el presente estudio fue el 2012. A partir de estas dos fuentes se pudo reconstruir parcialmente la historia del área de estudio, permitiendo de esta manera hacer una aproximación a la edad de los bosques y de los potreros.
RESULTADOS
Análisis de diversidad y composición florística
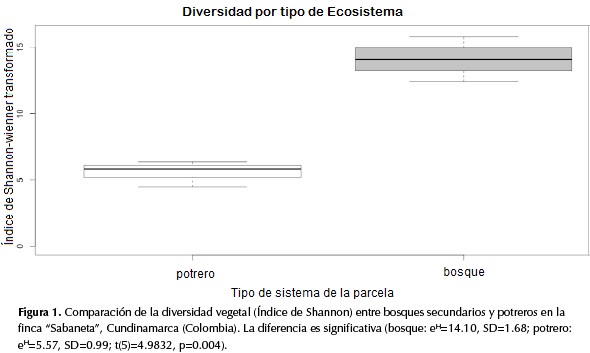
La vegetación de los potreros mostró la tendencia a ser dominada por dos especies de pastos (Pennisetum clandestinum Hochst. Ex Chiov. y Lolium multiflorum Lam). Esta dominancia por parte de dos especies no fue observada en las parcelas de bosque. Estas, por el contrario, contaban con un mayor número de especies de plantas. Estas observaciones se vieron reflejadas en los análisis estadísticos, donde se advirtió que las parcelas de bosque tienen una diversidad más alta que las parcelas de potrero (figura 1)
Las parcelas de potrero con valores de diversidad más altos son Antenas y La Culebra, hecho que concuerda con la edad calculada para estas parcelas por medio de las fotografías aéreas, confirmando que la edad de abandono sí influye directamente en la diversidad de las parcelas.
Direccionalidad de la sucesión
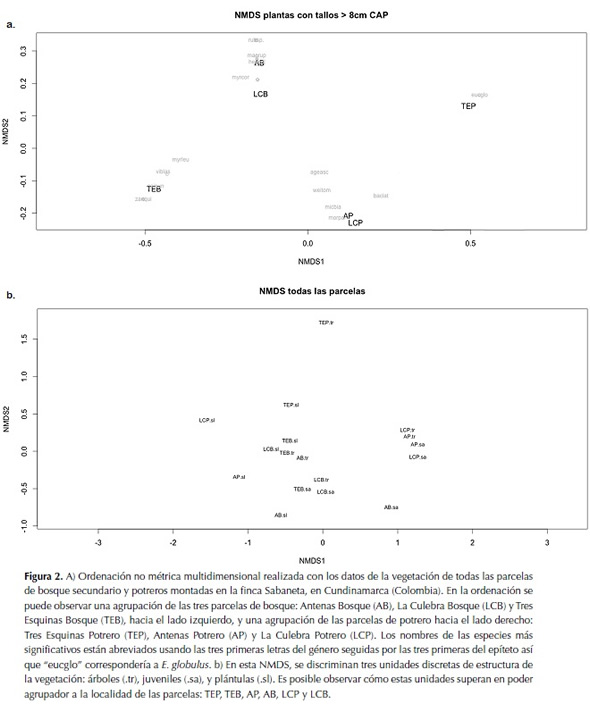
Al observar la ordenación no métrica multidimensional (NMDS) realizada para los árboles de todas las parcelas (figura 2a) es posible notar que las parcelas de bosque (AB, LCB, y TEB) se encuentran agrupadas hacia la esquina superior izquierda de la gráfica, mientras que las parcelas de potrero (AP, LCP, y TEP) se agrupan hacia la esquina inferior derecha de esta. En otras palabras, la vegetación entre parcelas del mismo tipo (bosque con bosque y potrero con potrero) tiene una afinidad mayor que con sus parcelas aledañas (por ejemplo, TEP y TEB). Es interesante observar que hay especies que están exclusivamente en las parcelas de bosque, como: Myrsine coriacea (Sw.) R.Br. ex Roem. & Schult. y Clusia multiflora Kunth (entre otras); algunas que son exclusivas de potrero, Baccharis latifolia (Ruiz & Pav.) Pers. y Eucalyptus globulus Labill.; y otras que se caracterizan por aparecer en ambos tipos de hábitat (llamadas acá especies de borde) tales como Miconia biappendiculata (Naudin) L. Uribe, Morella parvifolia (Benth.) Parra-Os. y Weinmannia tomentosa L.f.
Otra NMDS se llevó a cabo utilizando las diferentes etapas ontológicas —árboles (.tr), juveniles (.sa), y plántulas (.sl)— de las plantas muestreadas (figura 2b). Es posible ver que se forman tres grupos en la gráfica. El primero, hacia el lado inferior izquierdo, congrega a todas las parcelas en etapa de plántulas (.sl). El segundo grupo visible, hacia la esquina inferior derecha de la gráfica, concentra las parcelas en etapa de juveniles (.sa), y la última, también donde menos concentradas están las parcelas, agrupa a los árboles (.tr). Este análisis permite observar que las comunidades tienden a agruparse según su categoría ontológica y no por su ubicación geográfica.
Perfiles de vegetación
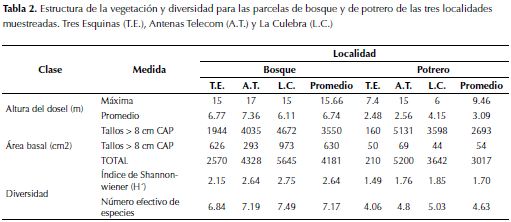
Para la altura promedio de las parcelas de bosque los resultados fueron muy homogéneos, oscilando entre los 6.1 y los 7.3 m. La altura máxima también fue muy parecida para las tres localidades de bosque (15 m), excepto para la localidad de Antenas, cuyo valor máximo fue de 17 m (tabla 2). A diferencia de lo anterior, las parcelas de potrero tuvieron una oscilación muchísimo mayor en las alturas máximas (entre 6 y 15 m). Con el fin de visualizar las diferencias entre las tres parcelas, se dibujaron los perfiles de vegetación de cada una: Tres Esquinas (figura 3a), La Culebra (figura 3b) y Antenas (figura 3c). El área basal media de las parcelas de bosque tuvo mayores valores que aquellas de potrero, particularmente la de la localidad Antenas (tabla 2).
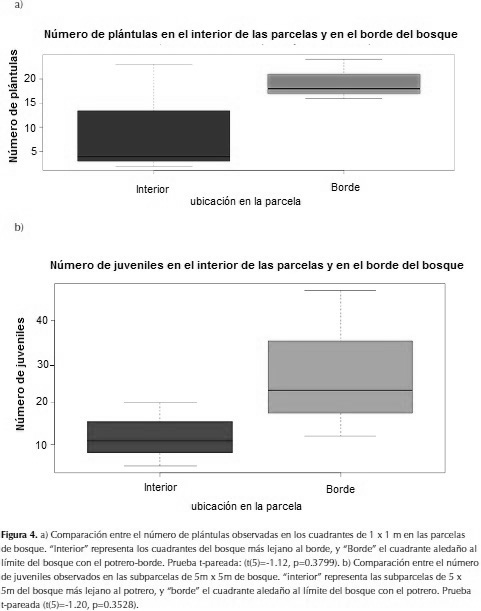
El promedio de plántulas (figura 4a) y de juveniles (figura 4b) encontradas en el borde del bosque fue mayor que el de aquellas encontradas en el interior del bosque.
Distancias geográficas y florísticas
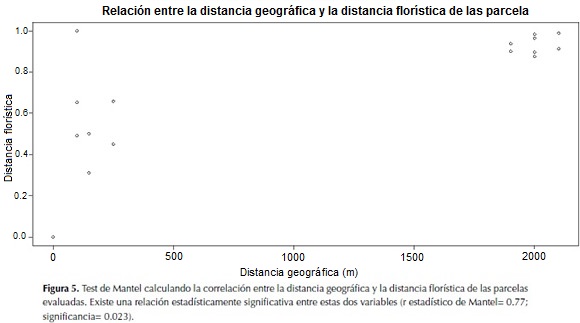
Para determinar si la distancia geográfica entre las parcelas estaba relacionada con la diferencia en composición florística de estas, se desarrolló un test de Mantel (figura 5). Este análisis mostró que a medida que la distancia entre parcelas se hace mayor, su similaridad florística disminuye (r estadístico de Mantel: 0.77). Se puede observar que aquellas parcelas que están cerca tienen flora similar, mientras que las que están alejadas geográficamente tienen menos especies en común.
DISCUSIÓN
Análisis de diversidad y composición florística
La altura promedio, área basal y diversidad de las parcelas de bosque en las localidades de La Culebra y Antenas tiende a ser homogénea dado que los bosques tienen edades e historia de usos similares. Según los resultados del test de Mantel se logró determinar que la distancia geográfica puede ser un factor importante en el momento de determinar la composición florística.
Se encontraron algunas diferencias entre la composición florística de las parcelas de potrero y las de bosque. Tanto P. clandestinum como L. multiflorum han sido sugeridas como especies dominantes de los potreros, lo cual representa una barrera para la germinación de semillas de otras especies en estos hábitats (Facelli et al., 1987; Salamanca & Camargo, 2000; Elgar et al. 2014). En general, muchas especies invasoras son fuertes limitantes tanto a la germinación como al establecimiento de plántulas nativas (Florentine & Westbrooke,2004; Gunaratne et al. ,2014). Chusquea scandens Kunth, al ser una especie monocárpica y de floración masiva, juega un papel importante en la transición entre potrero y bosque, dominando durante el periodo previo a su florecimiento y luego de que este se lleva a cabo, dando paso a otras especies de plantas como M. biappendiculata, M. parvifolia, y W. tomentosa (Young, 1991).
Por el contrario, en los bosques existe una estratificación más clara de la vegetación, favorecida por la diferencia de alturas y tipos de copas de las plantas que componen el dosel. Esta heterogeneidad en el dosel permite a diferentes grupos funcionales de plantas colonizar nichos únicos dentro de ese ambiente. Esta variedad de recursos disponibles (presumiblemente la luz solar sea el factor determinante) implica un aumento en la diversidad de plantas en las parcelas de bosque en comparación a las de potrero (Posada et al.,2000; Shoo & Catterall, 2013). Estos resultados son acordes a la hipótesis planteada en la introducción: parcelas en diferentes momentos sucesionales presentan diferencias en su composición florística.
Direccionalidad de la sucesión
Según la ordenación NMDS de todas las parcelas (figura 2a) se puede notar que las parcelas de bosque (AB, LCB, y TEB) están agrupadas hacia la esquina superior izquierda de la gráfica, y las de potrero (AP, LCP, y TEP) hacia la esquina inferior. Esta observación permite deducir que el tipo de ecosistema (bosque o potrero) tiene mayor poder agrupador que la ubicación de las parcelas.
En general, se pudo observar que ninguno de los bosques es primario. Todos ellos, según la vegetación estudiada, están en la actualidad en un proceso intermedio-avanzado de sucesión. Se deduce, a partir del área basal (tabla 2) y de la composición florística de nuestro estudio (anexo 1), que este proceso está más avanzado en los bosques de La Culebra y de Antenas que en el de Tres Esquinas. Esto concuerda con observaciones hechas en el pasado, donde la composición florística, similar en ambos estudios a la encontrada en las parcelas de bosque analizadas en este estudio, es tratada como precursora de bosques maduros. Por ejemplo, M. parvifolia y W. tomentosa (Salamanca & Camargo, 2000). Esta observación también es congruente con los resultados obtenidos del estudio de las fotografías aéreas, donde se calculó que la edad máxima de los bosques no podía ser mayor a los 69 años. Esto es importante porque apunta a que los procesos de sucesión obedecen a cierta direccionalidad, determinada principalmente por las características intrínsecas de un área, dejando la variabilidad geográfica como un factor secundario.
La relevancia de estas dos especies, y adicionalmente M. biappendiculata, es alta para fines de restauración ecológica. El hecho de aparecer tanto en potreros como en los bosques permite deducir que las semillas de estas plantas tienen la capacidad de germinar en potreros, crecer bajo condiciones características de plantas pioneras y, además, permanecer allí a medida que el proceso de sucesión continúa con otras plantas. Esta última especie tiene una propiedad adicional que la hace sumamente atractiva para los procesos de restauración asistida: sus frutos carnosos atraen aves, acelerando de esta manera el proceso de colonización, por medio de la dispersión de semillas (Forest Restoration Research Unit, 2008).
Según esto, se puede inferir que la ubicación geográfica no es un factor determinante de la composición florística de las parcelas. Por el contrario, sugiere que existe direccionalidad en el proceso de sucesión del bosque. Esto se puede argumentar al observar que la categoría bajo la cual es agrupada la vegetación —árboles (.tr), juveniles (.sa) o plántulas (.sd)— sumado a la composición florística de cada una de las parcelas, se asemejan entre sí mucho más que por la ubicación geográfica de las parcelas.
Perfiles de vegetación
En cuanto a la altura máxima de los árboles en las parcelas de potrero de las tres localidades, se observa que difiere mucho de la altura promedio. Esto sucede porque en el pasado, al talar el bosque para hacer potreros, algunos árboles se dejaron en pie, bien sea por razones prácticas (sombra para el ganado) o simplemente por cuestiones ornamentales del paisaje. El paso del tiempo hace que estos individuos sobrepasen el promedio de altura (dada la diferencia de edad de estos con los individuos que comenzaron a crecer una vez abandonados los potreros).
En Tres Esquinas y Antenas el número de plántulas encontradas en el borde (24 y18) fue mayor al de plántulas encontradas en el interior (2 y 4). Esto concuerda con lo esperado, ya que el borde presenta tanto un gran número de semillas en el suelo, como una mayor disponibilidad de luz solar que el interior del bosque. En la parcela de La Culebra se observó el fenómeno opuesto, registrándose 16 plántulas en el borde y 23 en el interior. Es probable que este fenómeno aislado sea la respuesta a un disturbio en el interior del borde, o a un evento no registrado en este estudio.
Distancias geográficas y florísticas
Una observación correspondiente a la relación inversa entre distancia geográfica y similaridad florística es que, para este sistema ecológico, la dispersión de semillas parece tener alguna limitación a grandes distancias. Probablemente la heterogeneidad de la matriz disuade a los dispersores bióticos (animales) al representar un riesgo (Longland & Price, 1991). Como consecuencia de lo anterior, es factible que el mayor dispersor activo en este sistema sea el viento.
La correlación entre las dos matrices (distancia geográfica y distancia florística entre parcelas) confirma que la distancia juega un papel importante en la composición florística de estos bosques, apuntando hacia un fenómeno relacionado con la dispersión de semillas.
Es posible observar que la sucesión del bosque altoandino obedece un patrón de direccionalidad. Sin embargo, debe tenerse en cuenta que hay otros factores que pueden alterar estos patrones, como la dispersión de semillas (por tanto, la distancia geográfica) o las barreras a la germinación y la competencia impuestas por especies invasoras (Arroyo-Rodríguez et al., 2015).
CONCLUSIONES
Se encontró una diferencia significativa entre la diversidad de parcelas de potrero con respecto a las de bosque. Sugerimos que P. clandestinum y L. multiflorum generan barreras efectivas a la colonización y establecimiento de potenciales colonizadores nativos, debido a su alta capacidad competitiva. El estudio de estrategias para superar esta barrera a la sucesión debe ser una prioridad en la lista de trabajos futuros en biología de la conservación del bosque altoandino.
Este estudio encontró evidencia para afirmar que la sucesión no es un proceso aleatorio, ya que obedece a cierto tipo de direccionalidad, favorecida, principal pero no exclusivamente, por características intrínsecas a los ecosistemas.
No es posible determinar si el borde del bosque tiene una mayor tasa de reclutamiento que el interior. Sin embargo, dos de las parcelas mostraron este patrón, mientras en la tercera se observó un mayor reclutamiento al interior que en el borde. Es posible que esta tercera parcela hubiera sufrido un disturbio en el interior, y que el mayor reclutamiento fuera una consecuencia de esto, pero le presente estudio carece de evidencia para afirmarlo.
M. biappendiculata, M. parvifolia, y W. tomentosa son las tres especies de plantas que, según este estudio, son llamativas en términos de restauración asistida del bosque altoandino en potreros abandonados, especialmente en aquellos sin fuentes de semillas cercanas (remanentes de bosque). Estas tres especies de plantas al estar juntas contribuyen a la restauración del bosque, cada una de manera singular. W. tomentosa es una especie con alta durabilidad en el bosque y de fácil propagación. M. parvifolia es una fijadora de nitrógeno, resistente a los suelos erosionados y precursora de otras especies como W. tomentosa y Oreopanax floribundum. Por último, M. biappendiculata es una planta atractiva para aves por sus frutos, lo cual favorece a la dispersión de sus semillas alrededor de los árboles maduros
La distancia geográfica está inversamente relacionada con la afinidad florística en ecosistemas de bosque altoandino, sugiriendo que la dispersión juega un papel importante y evidenciando que la discontinuidad de la matriz estudiada genera una importante limitación a la dispersión de semillas. El rol de dispersores bióticos y abióticos en el bosque altoandino y los efectos de la discontinuidad de la matriz de bosque deben ser estudiados con mayor atención. Únicamente si las dinámicas de dispersión son comprendidas a profundidad, se podrán llevar a cabo planes de restauración ecológica holísticos, donde tanto la flora y la fauna como los factores abióticos sean tratados con sus respectivas importancias en este proceso.
AGRADECIMIENTOS
Los autores del artículo agradecen a Alfredo Navas, quien facilitó el acceso del equipo investigador al área de estudio y nos suministró ayudas logísticas a lo largo de la temporada de trabajo de campo. A los asistentes de campo Carlos Fajardo, Sebastián Ramírez, Juan Pablo Bueno, Juan Diego Martínez, Inés Támara y, especialmente, a Mariana Fajardo.
A los laboratorios de Botánica sistemática y de Ecología de bosques tropicales y primatología de la Universidad de Los Andes.
REFERENCIAS BIBLIOGRÁFICAS
Adobe Systems. (2008). Photoshop CS4 extended versión 11.0.2. Michigan.
Arroyo-Rodriguez, V., Melo, F. P. L., Martinez-Ramos, M., Bongers, F., Chazdon, R. L., Meave, J.A., Norden, N., Santos, B.A., Leal, I. R., & Tabarelli, M. (2015). Multiple successional pathways in human-modified tropical landscapes: new insights from forest succession, forest fragmentation and landscape ecology research. Biological Reviews, 000-000.
Cairns, J., & Wilson, E. O. (1988). Increasing diversity by restoring damaged ecosystems. Washington, D.C., National Academy Press, pp. 333-343.
Cavelier, J., Lizcano, D., & Pulido, M. T. (2001). Colombia. Bosques nublados del neotrópico. Santo Domingo de Heredia, Costa Rica: Instituto Nacional de Biodiversidad (IN Bio), pp. 443-496.
Condit, R., Hubbell, S. P., & Foster, R. B. (1996). Assessing the response of plant functional types to climatic change in tropical forests. Journal of Vegetation Science, 7(3), 405-416. https://doi.org/10.2307/3236284
Dalling, J. W., Swaine, M. D., & Garwood, N. C. (1998). Dispersal patterns and seed bank dynamics of pioneer trees in moist tropical forest. Ecology, 79(2), 564-578. https://doi.org/10.1890/0012-9658(1998)079[0564:DPASBD]2.0.CO;2
Elgar, A.T., Freebody, K., Pohlman, C.L., Shoo, L.P., & Catterall, C.P. (2014). Overcoming barriers to seedling regeneration during forest restoration on tropical pasture land and the potential value of woody weeds. Frontiers in Plant Science, 200(5). https://doi.org/10.3389/fpls.2014.00200
Facelli, J. M., D'Angela, E., & Leon, R. J. (1987). Diversity changes during pioneer stages in a subhumid pampean grassland succession. American Midland Naturalist, 17-25. https://doi.org/10.2307/2425703
Florentine, S. K. & Westbrooke, M. E. (2004). Restoration on abandoned tropical pasturelands—do we know enough? Journal for Nature Conservation, 12(2), 85-94. https://doi.org/10.1016/j.jnc.2003.08.003
Forest Restoration Research Unit. (2008). Research for Restoring Tropical Forest Ecosystems: A Practical Guide. Thailand: Biology Department, Science Faculty-Chiang Mai University, pp. 39-40
Gentry, A. H. (2001). Patrones de diversidad y composición florística en los bosques de las montañas neotropicales. En M. Kapelle & A. Brown (eds.), Bosques nublados del Neotropico. Costa Rica: Instituto Nacional de Biodiversidad (INBio), pp. 84-123.
Guariguata, M. R., & Ostertag, R. (2001). Neotropical secondary forest succession: changes in structural and functional characteristics. Forest ecology and management, 148(1), 185-206. https://doi.org/10.1016/S0378-1127(00)00535-1
Gunaratne, A.M.T.A, Gunatilleke, G.V.S., Gunatilleke, I.A.U.N., Madawala, H.M.S.P., & Burslem, D.G.R.P. (2014) Overcoming ecological barriers to tropical lower montane forest succession on anthropogenic grasslands: Synthesis and future prospects. Forest Ecology and Management, 329, 340-350. https://doi.org/10.1016/j.foreco.2014.03.035
Hallé, F., Oldeman, R. A., & Tomlinson, P. B. (1978). Tropical trees and forests: an architectural analysis. Berlin: Springer-Verlag. https://doi.org/10.1007/978-3-642-81190-6
Hamilton, L. (1995). Una campaña por los bosques nublados, ecosistemas únicos y valiosos en peligro. Serie Focus de la UICN.
Hilera-Lanzos, R., & J. M. Diez-Hernández. (2006). Directrices de restauración ecológica en cuencas hidrográficas andinas. Plan de manejo ambiental de la cuenca hidrográfica La Floresta-La Novita. Bogotá. Colombia. Valladolid: Universidad de Valladolid
Hubbell, S. P. (1979). Tree dispersion, abundance, and diversity in a tropical dry forest. Science, 203(4387),1299-1309. https://doi.org/10.1126/science.203.4387.1299
Oksanen, J., Blanchet, F. G., Kindt, R., Legendre, P., Minchin, P.R., R. B. O'Hara, R. B., G. L. Simpson, G. L., Solymos, P., Henry, M., Stevens, H., & Wagner, H. (2015). Vegan: Community Ecology Package. R package version 2.3-0. Recuperado de http://CRAN.R-project.org/package=vegan
Jost, L. (2006) Entropy and diversity. Oikos,113(2), 363-375. https://doi.org/10.1111/j.2006.0030-1299.14714.x
Kok, K., Verweij, P. A., & Beukema, H. (1995). Effects of cutting and grazing on Andean treeline vegetation. Biodiversity and conservation of neotropical Monatne forests (pp. 527-539). New York: New York Botanical Garden.
Lieberman, D., Lieberman, M., Hartshorn, G., & Peralta, R. (1985). Growth rates and age-size relationships of tropical wet forest trees in Costa Rica. Journal of Tropical Ecology, 1(02), 97-109. https://doi.org/10.1017/S026646740000016X
Lohbeck, M., Poorter, L., Martínez-Ramos, M., Rodríguez-Velázquez, J., van Breugel, M., & Bongers, F. (2014). Changing drivers of species dominance during tropical forest succession. Functional Ecology, 28(4), 1052-1058. https://doi.org/10.1111/1365-2435.12240
Longland, W. S., & Price, M.V. (1991) Direct Observations of Owls and Heteromyid Rodents: Can Predation Risk Explain Microhabitat Use? Ecology, 72(6), 2261-2273. https://doi.org/10.2307/1941576
Matteucci, S.D., & Colma, A. (1982). Metodología para el estudio de la vegetación (pp. 56-62). Washintong D.C.: Secretaría general de la Organización de los Estados Americanos; Programa regional de desarrollo científico y Tecnológico.
Murcia, C. (1997). Evaluation of Andean alder as a catalyst for the recovery of tropical cloud forests in Colombia. Forestry Ecology and Management, 99(1-2), 163-170. https://doi.org/10.1016/S0378-1127(97)00202-8
Norden, N., R. L. Chazdon, et al. (2009). Resilience of tropical rain forests: tree community reassembly in secondary forests. Ecology Letters, 12(5), 385-394. https://doi.org/10.1111/j.1461-0248.2009.01292.x
Norden, N., Angarita, H. A., Bongers, F., Martínez-Ramos, M., Granzow-de la Cerda, I., van Breugel, M., & Chazdon, R. L. (2015). Successional dynamics in neotropical forests are as uncertain as they are predictable. Proceedings of the National Academy of Sciences, 112(26), 8013-8018. https://doi.org/10.1073/pnas.1500403112
Oosterhoorn, M., & Kappelle, M. (2000). Vegetation structure and composition along an interior-edge-exterior gradient in a Costa Rican montane cloud forest. Forest Ecology and Management,126, 291-307. https://doi.org/10.1016/S0378-1127(99)00101-2
Ortega-Pieck, A., López-Barrera, F., Ramírez-Marcial, N., & García-Franco, J. G. (2011). Early seedling establishment of two tropical montane cloud forest tree species: The role of native and exotic grasses. Forest Ecology and Management, 261(7), 1336-1343. https://doi.org/10.1016/j.foreco.2011.01.013
Paine, C. T., & Harms, K. E. (2009). Quantifying the effects of seed arrival and environmental conditions on tropical seedling community structure. Oecologia,1 60(1), 139-150. https://doi.org/10.1007/s00442-008-1269-6
Pedraza, R. A., & Williams-Linera, G. (2003). Evaluation of native tree species for the rehabilitation of deforested areas in a Mexican cloud forest. New forests, 26(1), 83-99. https://doi.org/10.1023/A:1024423511760
Posada, J. M., Aide, T. M., & Cavelier, J. (2000). Cattle and weedy shrubs as restoration tools of tropical montane rainforest. Restoration ecology, 8(4), 370-379. https://doi.org/10.1046/j.1526-100x.2000.80052.x
R Core Team. (2015). R: A language and environment for statistical computing. Vienna: R Foundation for Statistical Computing. ISBN 3-900051-07-0, Recuperado de http://www.R-project.org.
Salamanca, B., & Camargo, G. (2000). Protocolo distrital de restauración ecológica. Bogotá D.C.: Alcaldía Mayor, Departamento Técnico Administrativo del Medio Ambiente(DAMA).
Shoo, L.P., & Catterall, C.P. (2013). Stimulating Natural Regeneration of Tropical Forest on Degraded Land: Approaches, Outcomes, and Information Gaps. Restoration Ecology. 21(6), 670-677. https://doi.org/10.1111/rec.12048
Strayer, D. L., Power, M. E., Fagan, W. F., Pickett, S. T., & Belnap, J. (2003). A classification of ecological boundaries. BioScience, 53(8), 723-729. https://doi.org/10.1641/0006-3568(2003)053[0723:ACOEB]2.0.CO;2
Swaine, M. D., & Whitmore, T. C. (1988). On the definition of ecological species groups in tropical rain forests. Vegetatio, 75(1-2), 81-86. https://doi.org/10.1007/BF00044629
Terborgh, J., & Foster, R. B. (1996). Tropical tree communities: a test of the nonequilibrium hypothesis. Ecology, 77(2), 561-567. https://doi.org/10.2307/2265630
Turner, I. M. (2001). The ecology of trees in the tropical rainforest. Cambridge, UK: Cambridge University Press. https://doi.org/10.1017/CBO9780511542206
Wright, S. J., & Muller-Landau, H. C. (2006). The Future of Tropical Forest Species. Biotropica, 38(3), 287-301. https://doi.org/10.1111/j.1744-7429.2006.00154.x
Young, K. R. (1991). Natural History of an Understory Bamboo (Chusquea sp.) in a Tropical Timberline Forest. Biotropica, 23(4 parte B), 542-554.
Zanne, A. E. & Chapman, C. A. (2001). Expediting reforestation in tropical grasslands: distance and isolation from seed sources in plantations. Ecological Applications, 11(6), 1610-1621. https://doi.org/10.1890/1051-0761(2001)011[1610:ERITGD]2.0.CO;2
Anexos
Licencia
Colombia Forestal conserva los derechos patrimoniales (copyright) de las obras publicadas, y favorece y permite la reutilización de las mismas bajo la licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional por lo cual se pueden copiar, usar, difundir, transmitir y exponer públicamente, siempre que:
Se reconozcan los créditos de la obra de la manera especificada por el autor o el licenciante (pero no de una manera que sugiera que tiene su apoyo o que apoyan el uso que hace de su obra).