DOI:
https://doi.org/10.14483/2256201X.22653Publicado:
01-07-2025Número:
Vol. 28 Núm. 2 (2025): Julio-diciembreSección:
Artículos de investigación científica y tecnológicaDistribución de musgos en sustratos del Concejo de Proaza, España
Distribution of Mosses in the Substrates of the Proaza Council, Spain
Palabras clave:
high Cantabrian mountains, horizontal rainfall, disturbance, natural physical features, forest trails (en).Palabras clave:
altas montañas Cantábricas, lluvia horizontal, perturbación, rasgos físico-naturales, senderos forestales (es).Descargas
Referencias
Alcala, A. (2019). Diversity of mosses in Mt. Makiling forest reserve, Philippines. Biodiversitas, 20(6), 1729-1734. https://doi.org/10.13057/biodiv/d200632
Baselga, A., & Gómez, C. (2019). Diversidad alfa, beta y gamma: ¿cómo medidos diferencias entre comunidades biológicas? Nova Acta Científica Compostelana (Bioloxía), 26, 39-45. https://revistas.usc.gal/index.php/nacc/article/view/6413
Braun-Blanquet, J. (1979). Fitosociología. Editorial Blume.
Bullock, J. M. (2006). Plants 4. (2a ed.) En W. J. Sutherland (Ed.), Ecological Census Techniques: A Handbook (pp.186-212). Cambridge University Press. https://www.cambridge.org/9780521844628
Calzadilla, E., Aldana, C., & Churchill, E. (2010). Las briofitas. Bolivia Ecológica, 59, 1-28.
Casas, C., Brugués, M., Cros, R., & Sérgio, C. (2020). Handbook of mosses of the Iberian Peninsula and the Balearic Islands. Editorial Institut d’Estudis Catalans.
Coffin, A. W. (2007). From roadkill to road ecology: A review of the ecological effects of roads. Journal of Transport Geography 15(5), 396-406. https://doi.org/10.1016/j.jtrangeo.2006.11.006
Fernández, M. C., & Collado, M. (2003). Briófitos de la Reserva Natural Integral de Muniellos. Editorial Consejería de Medio Ambiente del Principado de Asturias.
Frahm, J. (2003). Manual of Tropical Bryology. Tropical. Bryology, 23, 1-196.
García, X. (1998). Asturias a través de sus Concejos. Editorial La Nueva España.
Garilleti, R., & Albertos B. (2012). Atlas y libro rojo de los briófitos amenazados de España. Editorial Organismo Autónomo Parques Nacionales.
Glime, J. M., & Bisang, L. (2017). Sexuality: Sexual strategies. En J. M. Glime (Ed.), Bryophyte Ecology (cap. 3). International Association of Bryologists. https://digitalcommons.mtu.edu/bryophyte-ecology1/2/
Gimingham, C., & Birse, E. (1957). Ecological studies on growth in bryophytes. I correlation between growth-form and habitat. Journal Ecology, 45, 533-545.
González, S. (2007). Los musgos, una reliquia colonizadora, activa y protegida. Curso avanzado en bioquímica del suelo. Biomasa del suelo. https://www.madrimasd.org/blogs/universo/2007/06/09/67365
Hammer, Ø. (2020). PAST. Paleontological statistics (versión 4.13). https://www.nhm.uio.no/english/research/resources/past/
Hassel, K., & Söderström, L. (2005). The expansion of the neophytes Orthodontium lineare and Campylopus introflexus in Britain and continental Europe. Journal of the Hattori Botanical Laboratory, 97, 183-193.
Herben, T. (1994). The role of reproduction for persistence of bryophyte populations in transient and stable habitats. Journal of the Hattori Botanical Laboratory, 76, 115-126.
Hernández, R., Kluge, J., Ah-Peng., C., & González-Mancebo, J. (2019). Natural and human-impacted diversity of bryophytes along an elevational gradient on an oceanic island (La Palma, Canarias). PLoS ONE, 14(4), e0213823. https://doi.org/10.1371/journal.pone.0213823
Instituto Geográfico Nacional (IGN) (2021). Proaza, Asturias. 1:136.500. https://www.ign.es/
Instituto Geológico y Minero de España (IGME) (1976). Proaza Mapa Geológico de España. 1:50.000. Editorial Ministerio de Industria.
Lloret, F. (1994). Estructura y dinámica de las comunidades de briofitos. Boletín de la Sociedad Española de Briología, 4, 3-6.
Mägdefrau, K. (1982). Life-forms of Bryophytes. En A. J. E. Smith (Ed.), Bryophyte Ecology (pp. 45-58). Editorial Chapman and Hall.
Martínez, J. (2020). Musgos liliputienses. Jugando sus cartas. Lección Inaugural del Curso Académico: 2020-2021. Editorial Universidad de la Rioja.
Martínez de Pisón, E., & Molina, P. (2002). Diversidad del paisaje natural. En F. Díaz Pineda, J. De Miguel & M. Casado (Eds.), La Diversidad Biológica de España (pp. 33-44). Editorial Prentice Hall.
Matteucci, S., & Colma, A. (1982). Metodologías para el estudio de la vegetación. Editorial D.C., Secretaría de la Organización de los Estados Americanos.
Moreno, C. (2001). Métodos para medir la biodiversidad. Editorial M&T-Manuales y Tesis SEA.
Muñoz, J. (2023). Guía de Campo. Briófitos de los bosques Ibéricos. Editorial Consejo Superior de Investigaciones Científicas.
Naturaspain.com (s.f.). Naturaleza, espacios naturales, flora y fauna de Proaza (Asturias). https://www.naturaspain.com/naturaleza-flora-y-fauna-en-el-municipio-de-proaza.html
Osorio, F., Riffo, V., & Fontúrbe, F. (2019). Los musgos como componente clave en interacciones y organización comunitaria del bosque templado lluvioso. En C. Smith Rámirez & F. Squeo, (Eds.), Biodiversidad y Ecología de los Bosques Costeros de Chile (pp. 211-221). Universidad de los Lagos.
Pascal, M., Payton, I. J., Lee, W. G., & During, H. (2013). Impact of disturbance on above-ground water storage capacity of bryophytes in New Zealand indigenous tussock grassland ecosystems. New Zealand Journal of Ecology, 37(1), 114-126.
Porras, A. (2017). Tipos de muestreo. Centro de Investigación en Geografía y Geomática Ing. Jorge L. Tamayo. https://centrogeo.repositorioinstitucional.mx/jspui/bitstream/1012/163/1/19 Geoespacial.pdf
Proctor, M., Melvin, J. O., Wood, A. J., Alpert, P., Stark, L., Cleavitt, N., & Mishler, B. (2007). Desiccation tolerance in bryophytes: A review. The Bryologist, 110(4), 595-621. https://doi.org/10.1639/0007-2745(2007)110[595:DIBAR]2.0.CO;2
Rydin, H. (2009). Population and community ecology of bryophytes. En B. Goffinet & J. Shaw (Eds.), Bryophyte Biology (pp. 487-532). Editorial University Press.
Soria, A. (1993). Ensayo para una caracterización de briófitas como indicadores de urbanización mediante el estudio de la brioflora de ciudades españolas [Tesis de doctorado]. Universidad Complutense de Madrid, Facultad de Ciencias Biológicas, Departamento de Biología Vegetal. https://hdl.handle.net/20.500.14352/62277
Toledo, V. (2021). Análisis e interpretación del mapa topográfico. Editorial Letrame.
Toledo, V., & Cires Rodríguez, E. (2024). La diversidad de los musgos en el Concejo de Proaza (Principado de Asturias), España. Boletín de Ciencia y Tecnología RIDEA, 58, 41-60. https://dialnet.unirioja.es/servlet/articulo?codigo=10089567
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Recibido: 4 de septiembre de 2024; Aceptado: 3 de abril de 2025
Resumen
El propósito de esta investigación fue evaluar la abundancia de musgos en sustratos de 11 senderos forestales en el Concejo de Proaza, España. Se realizaron 100 levantamientos y registros de datos de cobertura utilizando una cuadrata de 25 x 20 cm2. Se determinó la diversidad biológica (alfa y beta) y la distribución en los sustratos de diferentes hábitats. Se reconocieron 41 especies distribuidas en 31 géneros y 16 familias. El sustrato con mayor uniformidad en la distribución de especies fue la roca, y el suelo-roca fue el de mayor diversidad. Los resultados evidenciaron las similitudes de la flora muscinal sensible a la abundancia por los rasgos físico-naturales de los sitios estudiados. Se recomienda realizar estudios similares en otros Concejos de Asturias para ir conociendo en más detalle los musgos de la región.
Palabras clave:
altas montañas Cantábricas, lluvia horizontal, perturbación, rasgos físico-naturales, senderos forestales.Abstract
The purpose of this research was to assess the abundance of mosses in substrates of 11 forest trails in the Proaza Council in Spain. 100 surveys and cover data recordings were carried out using a 25 x 20 cm2 quadrat. Biological diversity (alpha and beta) and the distribution in substrates of different habitats were determined. 41 species were recognized, distributed among 31 genera and 16 families. The substrate with the highest species distribution uniformity was rock, and soil-rock was the one with the greatest diversity. The results evidenced the similarities of moss flora that is sensitive to abundance due to the natural physical features of the studied sites. We recommend conducting similar studies in other Councils of Asturias in order to learn more details about the mosses in the region.
Keywords:
high Cantabrian mountains, horizontal rainfall, disturbance, natural physical features, forest trails.INTRODUCCIÓN
Los musgos son plantas pequeñas que carecen de tejido vascular y leñoso, crecen en una amplia variedad de sustratos y hábitats (Frahm, 2003) y tienen un papel muy importante dentro de los bosques, ya que el revestimiento que forman preserva el suelo del enfriamiento superficial y de la desecación excesiva (Proctor et al., 2007). Asimismo, son capaces de absorber y retener una parte importante de la humedad de las nieblas (Calzadilla et al., 2010).
Por su pequeño tamaño y su simplicidad estructural, proporcionan un material de gran interés para validar numerosos conceptos ecológicos. Al respecto, Lloret (1994) enfatiza que los biólogos pueden utilizar el bagaje conceptual y metodológico de la ecología para conocer mejor la biología de estos organismos en lo que respecta a sus relaciones con el medio.
Además, los musgos están presentes en la mayoría de los ecosistemas terrestres, en aguas dulces -pero no en el mar- e inclusive en lugares alterados por actividades antrópicas (Hernández et al., 2019). Por lo tanto, no resulta tan simple describir la selección de hábitat, la competencia, las perturbaciones y/o los establecimientos que explican su distribución en una determinada área, más aún cuando los senderos forestales presentan una gran variedad de condiciones ambientales (humedad, luz y tipo de suelo, entre otros), lo que dificulta la generalización de los resultados. Las perturbaciones que ocurren en los diferentes senderos forestales a pequeña escala y la generación de sustratos coinciden con lo expresado por Rydin (2009): ambas situaciones son fuertes determinantes de la riqueza y composición de especies de la comunidad. Por el contrario, Glime y Bisang (2017) señalan que, en muchos casos, la producción de propágulos vegetativos es suficiente para asegurar la persistencia de las especies.
Por otro lado, diversas son las interacciones descritas de los musgos en las zonas de bosques, incluyendo su importancia ecológica, su rol de indicadores ambientales y su protagonismo como agentes activos de retención de agua y estabilizadores del suelo (González, 2007; Osorio et al., 2019; Martínez, 2020). De igual manera, es necesario monitorear cambios en el ambiente con información sobre diversidad biológica (Moreno, 2001; Baselga & Gómez, 2019) y reconocer a los musgos como una de las partes esenciales de la diversidad de los ecosistemas (Gimingham & Birse 1957; Alcala, 2019).
La distribución de musgos en senderos forestales a menudo pasa desapercibida, especialmente cuando estos se encuentran entremezclados con otros tipos de vegetación o sustratos. En el Concejo de Proaza (Principado de Asturias, España) es notoria la presencia de musgos en los senderos forestales, a pesar de las labores de mantenimiento y de su uso frecuente, pues dichos senderos facilitan la conexión entre aldeas y pueblos, así como el paso de personas, animales, vehículos (tractores pequeños) y rutas recreativas.
Sin embargo, a la fecha se registran pocos estudios de briófitos en Asturias. La información brioflorística se destaca en el trabajo de ecología de los briófitos de la Reserva Natural Integral de Muniellos (Fernández & Collado, 2003). Otro tipo de publicación es el Atlas de los briófitos amenazados de España (Garilleti & Albertos, 2012), que recoge los taxones que se encuentran bajo algún grado de amenaza. Además, está el material de Muñoz (2023), una guía que facilita reconocer algunas especies en campo, así como el trabajo de Toledo y Cires (2024) , que reporta la diversidad de musgos de los componentes alfa y beta considerando una matriz de datos de presencia/ausencia.
Por consiguiente, y como parte de una iniciativa para conocer en más detalle la flora muscinal de la región, esta investigación confiere continuidad al trabajo de Toledo y Cires (2024). En este sentido, el objetivo es evaluar la abundancia de musgos en sustratos de los senderos forestales del área del Concejo de Proaza (Asturias).
MATERIALES Y MÉTODOS
Descripción del área de estudio
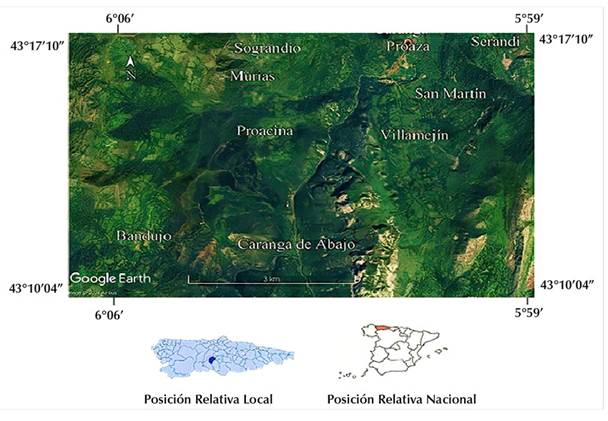
La zona montañosa en la que se encuentra inmersa el Concejo de Proaza está conformada por una serie de cordales de gran desarrollo y perpendiculares a la cordillera Cantábrica. En ellos se abre paso el río Trubia. Los dos ramales que lo forman, el Quirós y el Teverga, se unen en Caranga de Abajo, cubriendo una superficie de 76.79 km2. El área de trabajo se localiza a 43º10’04”-43º17’10” norte y 6º59’"-6º06’ oeste (Figura 1) (ING, 2021). La zona de estudio se encuentra en la unidad de paisaje denominada Altas Montañas Cantábricas, en la España de clima atlántico, y forma parte del dominio de los bosques caducifolios de robles, abedules, hayas y avellanos, entre otros (Martínez de Pisón & Molina, 2002). Considerando la geología, domina la formación la caliza de Candamo, producto de una sedimentación netamente carbonatada (IGME, 1976). Sobre el mismo mapa, se identificaron calizas, dolomías y pizarras en las localidades de Fabar, Bandujo y Sograndio; la presencia de areniscas ferruginosas y pizarras en Caranga de Abajo y Proacina; pizarras con alternancia de areniscas en Serandi, San Martín y Villamejín; calizas grises en Traslavilla; y calizas en Proaza. Esto quiere decir que se observaron rocas metamórficas dentro de una unidad mayor de rocas sedimentarias de carácter básico.
Figura 1: Localización de los senderos forestales en el área del Concejo de Proaza
Trabajo de campo y laboratorio
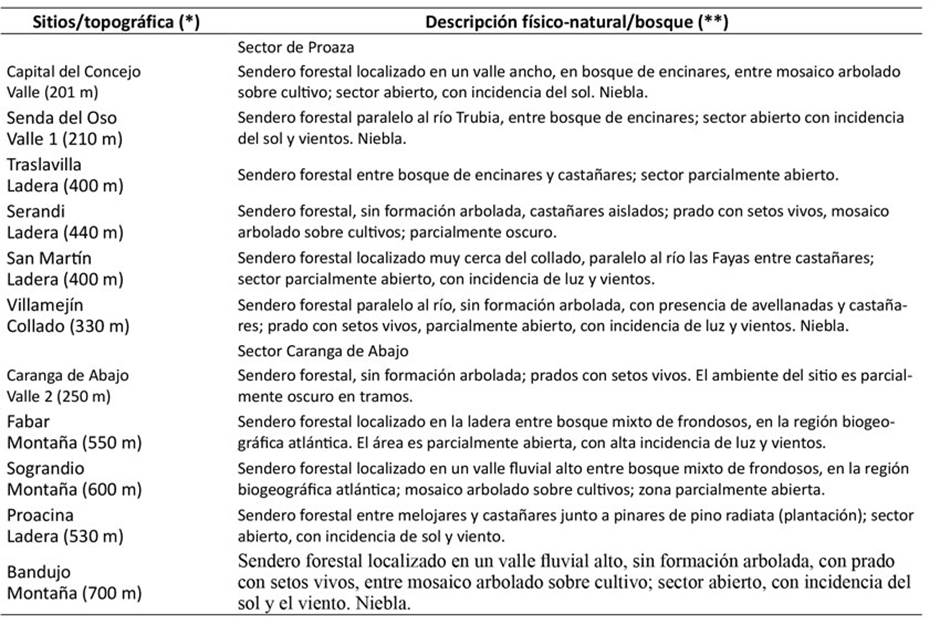
El Concejo de Proaza abarca ocho parroquias. Se tomaron muestras de musgos en 11 senderos forestales entre abril y septiembre de 2022. En la Tabla 1 se describen los aspectos físico-naturales de los sectores donde se localizan los senderos.
Tabla 1: Rasgos físico-naturales donde se encuentran emplazados los senderos forestales
Con la aplicación móvil Mapas de España del Instituto Geográfico Nacional (IGN, 2021) y un sistema GPS modelo Etrex 32x, cada punto de muestreo fue referenciado. El muestreo fue aleatorio estratificado (Matteucci & Colma, 1982). Según Porras (2017), en el muestreo espacial, los individuos (especies) que pertenecen a un estrato tienen como elemento común un espacio delimitado, por lo cual no son necesarios los valores homogéneos de otras variables. En este sentido, se evaluaron 11 sustratos, i.e., muro/roca, roca, suelo, taludes, humus, suelo/roca, humus/roca, muro de hormigón, hormigón, tejas y tronco de árboles caídos, localizados en diferentes espacios verdes o topónimos (hábitats) como senderos, arroyos, plazas, parques, casas, fincas y vialidades principales. También se diseñó una matriz de rasgos físico-naturales de los sitios. Se realizaron 100 levantamientos y se registraron datos de cobertura utilizando una cuadrata de acetato de 25 x 20 cm2, i.e., el número de celdas ocupadas por cobertura de una especie, según Bullock (2006), y por observación según la escala propuesta por Braun-Blanquet (1979), con las siguientes categorías: 1 = muy escaso (0-5 %), 2 = escaso (6-20 %), 3 = poco abundante (21-50 %), 4 = medianamente abundante (51-70 %), 5 = abundante (71-95 %) y 6 = muy abundante (96-100 %). Se incluyeron datos de hábito. Se utilizó espátula para el desprendimiento de las muestras, las cuales se trasladaron en bolsa de papel, debidamente identificadas y rotuladas.
Los ejemplares fueron estudiados en el laboratorio, empleando técnicas de micromorfología y microanatomía, mediante el uso de equipos ópticos como una lupa binocular modelo SMZ-2B, un microscopio óptico modelo CX31RBSF, una clave especializada (Casas et al., 2020), material bibliográfico y originales de referencia. También se contó con la colaboración de especialistas que corroboraron el material. Los especímenes se encuentran depositados en el Herbario de la Facultad de Ciencias de la Universidad de Oviedo (Herbario FCO), adscrito al Departamento de Biología de Organismos y Sistemas de dicha universidad.
Análisis de los datos
A partir del registro de cobertura de cada una de las especies, se evaluó la estructura por medio de dos índices de abundancia proporcional: Simpson (1-D) como parámetro de dominancia y Shannon-Wiener (H) como parámetro de equidad. Ambos índices corresponden a la diversidad alfa. La diversidad beta se midió con el índice de similaridad de Morisita para los los sitios de muestreo (Moreno, 2001). Se utilizó el programa estadístico PAST (Paleontological Statistics), versión 4.13 (Hammer, 2020).
RESULTADOS
Composición florística
A partir de 100 levantamientos, la flora muscinal recolectada reveló un total de 41 especies distribuidas en 31 géneros y 16 familias. De las presentes, el 61.5 % tienen hábito acrocárpico y el 38.5 % pleurocárpico. La familia más diversa es Pottiaceae (nueve especies) con el 21.9 %, seguida de Brachytheciaceae (ocho) y Grimmiaceae (cinco), con 19.5 y 13.0 % respectivamente, abarcando una proporción del 54.4 %. Entretanto, el 45.6 % restante está distribuido en seis familias con dos especies (28.8 %) y siete familias con una sola (16.8 %).
Distribución por sustratos
En cuanto a la cobertura de especies, según el tipo de sustrato (Figura 2), el análisis revela patrones de abundancia distintivos. En muro/roca, de las 78 muestras analizadas, se identificaron 24 especies. La mayoría de ellas (17 especies) presentaron una abundancia entre muy escasa y poco abundante (0-50 %), mientras que siete especies se clasificaron como abundantes o muy abundantes (71-100 %). Los taludes albergaron 11 especies, distribuyéndose cinco de ellas en el rango de escasa a poco abundante (6-50 %) y seis entre medianamente abundante y muy abundante (51-100 %). Sobre roca, se encontraron diez especies, con ocho mostrando una abundancia entre muy escasa y poco abundante (0-50 %) y dos clasificándose como medianamente abundante o muy abundante (51-100 %). El sustrato humus registró ocho especies, con dos en el rango de escasa a muy poco abundante (6-50 %) y seis entre abundante y muy abundante (71-100 %). En suelo/roca, se identificaron seis especies con una de abundancia muy escasa, y las cinco restantes presentaban abundancia medianamente abundante y muy abundante (51-100 %). Finalmente, en el sustrato humus/roca, crecieron cuatro especies, una con abundancia escasa (6-20 %) y tres con una abundancia muy alta (96-100 %). En conjunto, estos seis tipos de sustrato comprenden el 81 % de las especies encontradas.
Figura 2: Distribución de especies por tipo de sustrato en el área del Concejo de Proaza
Con relación a los taxones que colonizan dos o más tipos de sustratos, se observó que 63 especies se distribuyen en roca, muro/roca, humus, suelo/roca, humus/roca y taludes. Dentro de este grupo de taxones, la mayor diversidad se encontró en las combinaciones que incluyen roca. No obstante, existen 15 taxones restringidos a un único tipo de sustrato: hormigón (tres especies), muro de hormigón (dos), tejas (dos) y tronco descompuesto (cuatro), todos ellos con una abundancia entre muy escasa y poco abundante (0-50 %). Adicionalmente, se encontraron cuatro especies exclusivas del suelo, con una distribución polarizada en cuanto a abundancia: dos muy escasas (0-5 %) y dos muy abundantes (96-100 %).
Los muros (roca) presentaron la mayor cobertura de musgos, con 5403.1 cm2, seguidos por el humus con 4237.5 cm2, el suelo/roca con 3964.0 cm2, el humus/roca con 3231.5 cm2, los taludes con 2587.5 cm2, las rocas con 1831.2 cm2, el suelo 1715 cm2, los troncos descompuestos con 312.5 cm2, las tejas 206.2 cm2, el hormigón 50 cm2 y el muro de hormigón con 37.5 cm2.
Diversidad
De acuerdo con el índice de Shannon-Wiener (Tabla 2), el sustrato con mayor uniformidad en la distribución de especies fue la roca, con un valor de 2.807, seguido del suelo/roca con 2.733, el muro/roca con 2.645, el tronco descompuesto con 2.541, el talud con 2.13 y el humus con 2.021. Los sustratos con menor uniformidad fueron el suelo con 1.861, el muro de hormigón y la tejas, con igual valor de 1.361, y por último el humus/roca con 0.991.
Tabla 2: Índices de diversidad para las especies de musgos en diferentes sustratos del área del Concejo de Proaza

En cuanto a la dominancia, el valor más alto fue el del humus/roca, con 0.5, mientras que el más bajo fue el del suelo/roca, con 0.066. Esto significa que el sustrato con mayor diversidad, según lo expresa el índice de Simpson, fue el suelo/roca con 0.933, seguido de la roca con 0.888, el suelo con 0.833 y el muro/roca con el 0.81. Los sustratos con menor diversidad fueron el humus y el talud, con 0.75 y 0.709.
Preferencia de las especies por rasgos físico-naturales de los sitios
Hacia la zona de Caranga de Abajo, Fabar y Sograndio, las especies de musgos presentaron valores de similitud elevados (93-92 %) según el índice de Morisita (Figura 3). Cabe aclarar que en estos sitios se registró un número menor de especies, lo que puede haber influido en la similitud obtenida y quizás responde al tipo de sustrato. En cambio, la ubicación topográfica que ocupan Bandujo, i.e., montaña (valle fluvial alto), y Proacina, ubicada en una ladera, puede haber tenido efecto en la particularidad de las especies -y por ende en la muy escasa similitud. Hacia el sector de Proaza se registró un 73 % de similitud entre especies para los sitios de Traslavilla y Serandi, en laderas abiertas al valle principal de altitudes medias. Las especies presentes en San Martín/Villamejin y Valle 2 (Senda del Oso), en valle y collado (valle alto), con altitudes de 200 y 400 m, mostraron valores de similitud del 68 %. Finalmente, en el Valle de Proaza y Valle 1 (Senda del Oso), el valor de similitud entre especies fue del 12 %.
Figura 3: Dendrograma de la similitud entre especies, obtenida mediante el índice de Morisita con el algoritmo UPGMA
Si bien es cierto que este índice, como lo señala Moreno (2001) , se ve afectado por la riqueza de especies y el tamaño de las muestras y es altamente sensible a los valores de la especie más abundante, su uso fue ventajoso para la investigación, pues permitió representar la similitud de las especies a la vez que consideró la abundancia por los rasgos físico-naturales de los sitios.
En Caranga de Abajo, Fabar y Sograndio, la especie Polytrichum formosum Hedw. se observó tanto en lugares sin formación de arbolada como en el bosque mixto de frondosos de la región biogeográfica atlántica. Esta especie se muestreó en suelos con abundante materia orgánica en descomposición (humícola), suelo ácido (tipo de roca) y cierto grado de humedad, siendo uno de los sustratos con menor diversidad según el índice de Simpson. En Traslavilla y Serandi, la presencia de las especies Anomodon viticulosus (Hedw.) Hook & Taylor., Homalothecium sericeum (Hedw.) Schimp. y Rosulabryum capillare (Hedw.) J. R. Spence. fue registrada en muros de rocas que separan casas y/o fincas, donde se acumula una capa de tierra delgada (terrisaxícola). Estos musgos se encuentran en bosques con especies castañares, encinares y sin formación de arbolada. Según el índice de Shannon-Wiener (2.645), este es uno de los sustratos con mayor uniformidad en la distribución de especies.
En los sitios de San Martín, Villamejín y Valle 2, las especies Hylocomiadelphus triquetrus (Hedw.) Ochyra & Stebel y Thamnobryum alopecurum (Hedw.) Gangulee fueron identificadas sobre tierra mezclada con una delgada capa de materia orgánica en descomposición (terrihumícola/talud), mientras que Pseudoscleropodium purum (Hedw.) M. Fleisch. fue observada sobre tierra (terrícola/suelo). Todas estas especies fueron observadas en bosques con castañares cerca de cursos de agua. En consecuencia, el talud (equivalente terrihumícola) fue el sustrato con menor diversidad (0.709), y el suelo presentó la menor uniformidad (1.861). Finalmente, en el Valle de Proaza y Valle 1 se identificó la especie Schistidium helveticum (Schkuhr.) Deguchi., en un bosque de encinares sobre roca caliza (saxícola). Por tanto, según el índice de Shannon-Wiener, la roca es el sustrato con mayor uniformidad en la distribución de especies (2.807), y también es el segundo en diversidad de acuerdo con el índice de Simpson (0.888).
DISCUSIÓN
Este estudio muestra una riqueza de especies musgos distribuidas en diferentes microhábitats (sustratos). En los senderos forestales más protegidos y perdurables, restringidos en las cercanías de arroyos, taludes, suelos y afloramientos rocosos, se registran especies como Brachythecium albicans (Hedw.) Schimp., Hypnum cupressiforme Hedw., Sciuro-hypnum starkei (Brid.) Ignatov & Huttunen, Thamnobryum maderense (Kindb.) Hedenäs y T. alopecurum.
Sobre los muros de roca de diferentes casas y fincas, son frecuentes las especies Ceradoton purpureus (Hedw.) Brid. y Tortula muralis Hedw., todas de hábito acrocárpico. En los muros de casas abandonadas, la especie Anomodon viticulosus es abundante. Además, aparecen otras familias como Brachytheciaceae, Neckeraceae, Ditrichaceae y Hypnaceae.
Una particular referencia es el sendero paralelo al arroyo Las Fayas (San Martín/Villamejín), donde algunos tramos muestran síntomas de un abandono de más de 20 años, con alto crecimiento de matorral. Se encontraron especies de musgos en cinco sustratos diferentes: rocas, suelo/roca, muro/roca, suelo y tronco descompuesto. Entre estas especies, se destacan Homalothecium sericeum, Pseudoscleropodium purum, Hylocomiadelphus triquetrus y Hylocomium splendens (Hedw.) Schimp., todas con hábito pleurococárpico. Las dos primeras pertenecen a la familia Brachytheciaceae y las dos últimas a Hylocomiaceae. También se observan otras especies, como Plasteurhynchium striatulum (Spruce.) M. Fleisch. y Eurhynchium striatum (Schreb. ex Hedw.) Schimp. -ambas de la familia Brachytheciaceae-, y Grimmia funalis (Schwägr.) Bruch & Schimp., Orthotrichum pulchellum Brunt. y Thamnobryum alopecurum.
En los senderos forestales con presencia de cursos de agua y zonas más húmedas, localizados tanto en el collado como hacia la Senda del Oso, y donde aflora caliza gris, se evidencia una alternancia de especies de hábito acrocárpico y pleurocárpico. Las especies presentes son Hylocomiadelphus triquetrus y Pseudoscleropodium purum, ya reportadas en San Martín/Villamejín, y una tercera: Thamnobryum alopecurum, previamente registrada en el arroyo Las Fayas. Adicionalmente, se observan las especies Mnium stellare Hedw., Tortella humilis (Hedw.) Jenn., T. tortuosa (Schrad. ex Hedw.) Limpr. y Trichostomum tenuirostre (Hook. & Taylor) Lindb., todas acrocárpicas y pertenecientes a la familia Pottiaceae. Los hábitats que más comparten especies están ubicados en los senderos forestales de Traslavilla-Serandi, entre los 400 y los 440 m, seguidos de aquellos en San Marín/Villamejín y Valle 2, entre los 250 y los 440 m.
Una parte de los musgos mencionados se encuentra en los senderos forestales de media ladera, ocupación aprovechada para los pastos medios y de altura, con reticulados a base de cercas, setos, y cultivos frutales. Estas ubicaciones también se utilizan para el paso de ganado vacuno, de cabras y de ovejas. Sin embargo, no se observa una diversidad reducida; se identifican especies terrisaxícolas como el musgo Homalothecium sericeum de la familia Brachytheciaceae, abundante en los bordes de camino y las construcciones humanas (Figura 4). Según Muñoz (2023), esta especie soporta impactos humanos intensos. Además, las nieblas matinales son frecuentes en Proaza (García, 1998), lo que favorece la mojadura de los musgos y otros estratos, siendo esta la manera en que aprovechan el agua que obtienen por captación. Este podría ser uno de los factores que promueve la diversidad de musgos en estos sectores.
Figura 4: Identificación de taxones. Ejemplo para Homalothecium sericeum: a) hábito, b) detalle del caulidio, c) detalle de los filidios, d) filidios caulinares, e) detalle de los filidios caulinares, f) células medias de un filidio, g) células alares de un filidio, h) filidios rameales y células basales, i) hábito en individuo hidratado
Por otro lado, en los senderos forestales más próximos a la Capital del Concejo comienzan a observarse más especies de hábito acrocárpico, pero sin faltar algunas pleurocárpicas. Esto se extiende hacia el propio valle de Proaza, donde la cobertura (cm2) de las mismas disminuye y son más frecuentes las especies de las familias Grimmiaceae (13.0 %) y Pottiaceae (21.9 %). Esto puede estar relacionado con el sustrato disponible y factores ambientales como el agua y la luz (Mägdefrau, 1982) y la niebla (Toledo & Cires, 2024).
Representativas de lo anterior son las especies Schistidium helveticum, S. papillosum Culm., Pulvigera lyellii (Hook & Taylor) Plášek, Sawicki & Ochyra, Syntrichia calcicola J. J. Amann, Trichostomum crispulum Bruch y Tortula muralis, así como Grimmia pulvinata (Hedw.) Sm., Homalothecium sericeum, Tortula israelis Bizot & F. Bilewsky, Rosulabryum capillare, Roaldia revoluta (Mitt.) P. E. A. S. Câmara & Carv.-Silva y Homalothecium aureum (Spruce) H. Rob. El valle de Proaza y el Valle 1, ubicados a 200-210 m, tienen pocas especies en común. Constituyen el fondo de valle, donde se encuentran los focos de comunicación y de aprovechamiento de la vega.
Alternativamente, los senderos forestales provistos de carreteras de hormigón, que atraviesan la loma y la montaña y se extienden a través del espacio agrario en una ladera abrupta, se localizan tanto en Bandujo como en Proacina. Las especies registradas en el pueblo de Bandujo son Hypnum cupressiforme, Syntrichia montana Nees, Schistidium crassipilum H.H.Blom. y Dicranum fuscescens Sm. Cerca al fin de la vialidad se registra la especie Polytrichum piliferum Hedw., muestreada a ras del suelo, formando un abundante césped vegetal, así como en zonas soleadas por encima del mar de nubes.
En Proacina, los musgos presentes son Brachythecium albicans, junto con Campylopus introflexus (Hedw.) Brid. Esta última, según lo indica Muñoz (2023), se distribuye en zonas con impacto humano intenso. Quizás por esta razón presenta menor cobertura y vigor en comparación con la primera. No obstante, Hassel y Söderstrom (2005) reportan a C. introflexus como una especie exótica que tiene una gran capacidad competitiva y puede por tanto poner en riesgo a las especies autóctonas.
La presencia de carreteras puede alterar drásticamente las condiciones microclimáticas mediante variaciones en la cobertura del dosel vegetal y la cantidad de luz que penetra a través de él (Coffin, 2007). Aun así, las especies reportadas en ambos sitios presentan puntos de pelo hialino, si no la Hypnum cupressiforme, que crece abundantemente en zonas abiertas y soleadas. La flora muscinal en estas dos localidades pareciera expandirse y/o adaptarse con las modificaciones del paisaje vegetal, i.e., por las zonas condicionadas por la antropización (Pascal et al., 2013).
Finalmente, con las áreas más conservadas y boscosas a 500-600 m de altitud, están los senderos forestales de Fabar y Sograndio, donde resalta la especie Polytrichum formosum por su frecuencia (Toledo & Cires, 2024). También se registran otras especies como Amphidium mougeotii (Bruch & Schimp.) Schimp., Barbula unguiculata Hedw., Tortula muralis, Trichostomum crispulum, Leucobryum glaucum (Hedw.) Ångstr. y Dicranum scoparium Hedw., las dos últimas en Sograndio y Caranga de Abajo.
Los hallazgos de esta investigación parecen guardar relación con la habilidad que tienen algunas especies de musgos de formar propágulos con regularidad (Fernández et al., 2003; Glime & Bisang, 2017) y su forma de vida cespitosa corta -o incluso pulviniforme-, lo que que les permite sobrellevar el ambiente seco en ciertos microhábitats (Soria, 1993).
Al respecto, Herben (1994) señala que los hábitats de muy corta duración o perturbación anual (campos cultivables) tienen entre el 95 y el 100 % de especies oportunistas. En hábitats con una duración algo mayor (madera y troncos de árboles en descomposición), este valor es de 60-70 %, mientras que, para los hábitats de larga duración (pastizales, brezales, turberas), la proporción es solo entre el 25 y el 30 %.
No obstante, la presencia de carreteras o pistas de hormigón en los senderos forestales, su mantenimiento y su uso, tanto en el valle como en la ladera media, no parecen contribuir a una disminución de la diversidad local. Más bien, existen espacios mixtos de especies características de hábitats forestales en zonas más perdurables, algunos con sustratos muy específicos (tejas, hormigón, muro de hormigón), las cuales forman parte del entorno de las viviendas junto con otras típicas de hábitats más abiertos, representadas por tres familias (Pottiaceae, Brachytheciaceae y Grimmiaceae), abarcando una proporción del 54.4 %. Los resultados de esta investigación confirman las observaciones de Gimingham y Birse (1957), Soria (1993) y Toledo y Cires (2024), quienes han señalado la relación que existe entre las adaptaciones morfológicas, las formas de vida y las condiciones particulares del ambiente.
CONCLUSIONES
Este estudio, realizado en los senderos forestales del área del Concejo de Proaza, muestra una riqueza de especies de musgos distribuidas en diferentes microhábitats. El microhábitat que presenta mayor diversidad es el suelo/roca, seguido de todos aquellos en los que el sustrato es rocoso.
Las especies de musgos reportadas evidencian las similitudes de la flora muscinal sensible a la abundancia por los rasgos físico-naturales de los sitios. Se recomienda realizar más estudios similares en otros concejos de Asturias, en aras de conocer con más detalle los musgos de la región. También se recomienda promover el uso de tecnologías para el registro de precipitación de nieblas.
Acknowledgements
AGRADECIMIENTOS
Al Herbario FCO del Departamento de Biología de Organismos y Sistemas de la Universidad de Oviedo, especialmente a Miguel A. Fernández Márquez por las facilidades y soportes ofrecidos durante el desarrollo del trabajo de laboratorio.
REFERENCIAS
Licencia
Derechos de autor 2025 Colombia forestal

Esta obra está bajo una licencia internacional Creative Commons Atribución-CompartirIgual 4.0.
Colombia Forestal conserva los derechos patrimoniales (copyright) de las obras publicadas, y favorece y permite la reutilización de las mismas bajo la licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional por lo cual se pueden copiar, usar, difundir, transmitir y exponer públicamente, siempre que:
Se reconozcan los créditos de la obra de la manera especificada por el autor o el licenciante (pero no de una manera que sugiera que tiene su apoyo o que apoyan el uso que hace de su obra).