DOI:
https://doi.org/10.14483/2256201X.13237Published:
2018-12-26Issue:
Vol. 22 No. 1 (2019): January-juneSection:
Scientific articleEstudio florístico y estructural de un zural boscoso en el municipio de Arauca, Colombia
Floristic and structural study of a forest with zurales in the Arauca municipality, Colombia
Keywords:
forest, Orinoquia, savanna, vegetation, zuro (en).Keywords:
bosque, Orinoquía, sabana, vegetación, zuro (es).Downloads
How to Cite
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Download Citation
Recibido: 12 de abril de 2018; Aceptado: 29 de octubre de 2018
Resumen
Se determinó la composición florística y estructural de un zural boscoso con montículos de en promedio 1.36 m de altura y 2.7 m de diámetro localizado en la llanura aluvial del municipio de Arauca. Se muestreó un área de 0.1 ha con diez transectos de 50 x 2 m para estudiar vegetación leñosa y herbácea. Se registraron 849 individuos de 29 familias, 36 géneros y 40 especies. Por sus características de clases diamétricas y aspectos sociológicos del zural boscoso se considera que este tipo de bosques no podría ser usado con fines de extracción de madera a gran escala y posiblemente los servicios ecosistémicos que provee son de regulación. De las especies registradas se destacan: Sarcoglottis acaulis (Sm.) Schltr (Orchidaceae), como nuevo registro para el departamento de Arauca; Guapira cf. pubescens (Kunth) Lundell (Nyctaginaceae) y Pouteria cf. stipitata Cronquist (Sapotaceae), como posibles nuevos registros para Colombia.
Palabras clave:
bosque, Orinoquía, sabana, vegetación, zuro.Abstract
We described the structure and floristic composition of a zurales forest with earth-mounds presenting average heights of 1.36 m and average diameters of 2.7 m. This area was located in an alluvial savanna of the Arauca Department. We sampled 0,1 ha plot by setting 10 transects (50 x 2 m each) to survey all woody and herbaceous plant species. It was found 849 individuals from 29 families, 36 genera and 40 species. Based on their attributes such as the tree diametric distribution and sociological aspects, the zural forest does not seem appropriate for wood commercial extraction, but it is likely to provide regulation ecosystem services. From the recorded species, three were notable; Sarcoglottis acaulis (Sm.) Schltr (Orchidaceae), considered a new record for the Arauca department, and Guapira cf. pubescens (Kunth) Lundell (Nyctaginaceae) and Pouteria cf. stipitata Cronquist (Sapotaceae) probably new records for the Colombian flora.
Keywords:
forest, Orinoquia, savanna, vegetation, zuro.INTRODUCCIÓN
La cuenca del Orinoco colombiano abarca el 30.4% del territorio nacional y está constituida por un mosaico de ecosistemas embebidos en una matriz de sabanas de altillanura e inundables, las cuales ocupan la mayor extensión de la región (Rippstein, Escobar y Motta, 2001; Romero, Galindo, Otero y Armenteras, 2004; Cárdenas, Mendoza, González y Sua, 2016). Debido a la gran diversidad de ambientes y posiblemente por la elevada extensión de la región aún existen ecosistemas o formaciones vegetales y especies de plantas que han sido escasamente documentadas (Fernández, Bedoya y Madriñán, 2015). Por ejemplo, recientemente fue incluida la distribución espacial de Bosque Seco Tropical, un ecosistema que previamente se consideraba ausente en la región de la Orinoquia (Pizano y García, 2014). Uno de los ambientes naturales poco documentados de la Orinoquia en Colombia se conoce regionalmente como zurales (FAO, 1966; Lasso et al., 2014), pero recibe nombres como lombrizales o tatucos en Venezuela Stagno y Steegmayer, 1972), canaletes en Brasil y sartenejales en Bolivia (IGAC, 2005). Esos términos se usan indistintamente en diferentes regiones con sabanas neotropicales para referirse a terrenos con topografía irregular, con cárcavas o montículos que dificultan caminar y cabalgar, que se desarrollan bajo diferentes condiciones de suelo y clima (Renard et al., 2012; Rial, 2014).
Los zurales fueron documentados por primera vez en Colombia en el Informe de Suelos de los Llanos Orientales realizado por FAO (1964), donde los describen como un terreno con montículos (i.e. zuros) separados por zanjas: los montículos representan el nivel original del terreno y las zanjas o canales son producto de la erosión. La profundidad de las zanjas fluctúa entre 0.20 y 1.50 m, y el diámetro de los zuros entre 0.30 y 2 m. Esta topografía es frecuente en la sabana inundable y está asociada a terrazas bajas, diques y orillares, con bajos niveles de drenaje especialmente en invierno, induciendo la formación de montículos de vegetación aislada, en general de pastos dispuestos en macolla, con aspecto redondeado. Posteriormente, Goosen (1971) los describe desde el punto de vista edafológico como redes de cárcavas formadas a consecuencia de procesos de erosión reticular característicos de áreas pobremente drenadas en la sabana inundable. Los zurales bien estructurados por su tamaño y configuración (altura de los montículos >1.2 m) crean un patrón de laberinto desde la perspectiva de un ser humano (Zangerlé et al., 2016). En años recientes, los zurales fueron considerados ambientes acuáticos en el microrelieve de llanura inundable generados por el ciclo de erosión reticular, originando topes (zuros-tatucos) de 0.2 a 2 m de altura (Lasso et al., 2014). Se han propuesto varias hipótesis sobre la génesis y evolución de los zurales relacionadas con factores como la pendiente del terreno, el material parental del suelo, la vegetación y la actividad biológica por parte de lombrices de tierra (Stagno y Steegmayer, 1972; Lasso et al., 2014). Zangerlé et al. (2016) postularon con base en análisis de fitolitos producidos por lombrices de tierra que el origen de los zurales podría ser debido a la actividad biológica de estos organismos.
Los zurales pueden ser un problema para los productores agropecuarios locales, ya que limitan la agricultura y la ganadería: dificultan la mecanización del terreno y el ganado puede quedar atrapado en los zuros y morir de hambre o ahogamiento (FAO, 1964; Stagno y Steegmayer, 1972; Montenegro, 1987). Esta situación hace que los zurales sean susceptibles a ser drásticamente transformados mediante la mecanización de terreno para ser nivelados en la agricultura de arroz intensificada o la ganadería extensiva. Por ello, el riesgo de que los zurales puedan desaparecer antes de ser adecuadamente documentados es alto (Zangerlé et al., 2016). Algunos estudios sugieren que los zurales proveen servicios ecosistémicos a la región como la regulación del clima regional y local, el control de sedimentos y como sumideros de carbono (Lasso et al., 2014), por lo que deberían ser incluidos en el análisis ecológico de la ecorregión de la Cuenca del Orinoco (Zangerlé et al., 2016).
La vegetación documentada en zurales bajos poco estructurados (montículos de 40-60 cm de altura y diámetros entre 1.5-2 m) es en general de herbazales y juncales compuestos por gramíneas (Montenegro, 1987; Salamanca, 1983; Rangel-Ch, Aguilar-P. y Lowy-C., 1997; Renard et al., 2012; Rangel-Ch. y Minorta-C., 2014). En la llanura aluvial conocida como Selvas de Arauca en zurales con alturas >1.2 m y diámetros >2.5 m se mencionaron especies arbóreas de gran porte como la palma de vino o palma real Attalea butyracea (Mutis ex L. f.) Wess. Boer, yarumos Cecropia sp, guácimos Guazuma ulmifolia Lam. y la ceiba Ceiba pentandra (L.) Gaertn. (FAO, 1966; Betancourt, 1997).
En el estudio detallado de los zurales realizado por Zangerlé et al. (2016) estimaron su extensión en sabanas de la Orinoquia y propusieron mecanismos para explicar la variación estructural (i.e. altura de los montículos y profundidad de las zanjas). Además, documentaron la composición florística de seis zurales en diferentes niveles de evolución y, en particular, en zurales muy estructurados (alturas >1.2 m y >2.5 m diámetros) registraron la presencia de diez especies arbóreas y tres herbáceas.
Teniendo como base lo anterior, el objetivo de este estudio fue documentar la composición florística y estructural de un bosque bajo denso, estacionalmente inundable localizado en un zural con altura de montículos >1 m en el municipio de Arauca (Arauca, Colombia).
MATERIALES Y MÉTODOS
Área de estudio
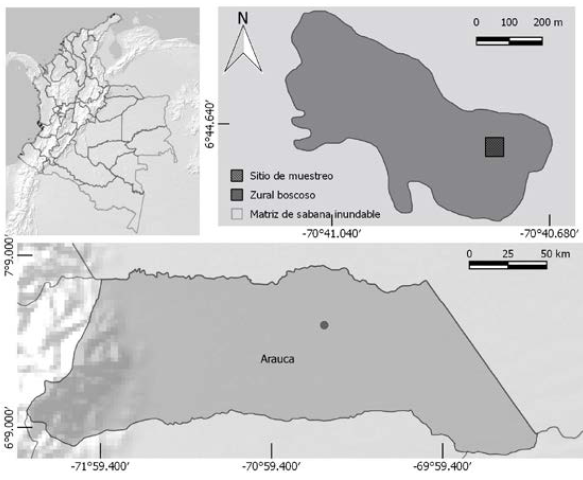
El estudio se realizó en un fragmento de 21.3 ha de un zural boscoso ubicado en el paisaje fisiográfico de sabana inundable en la zona rural del municipio de Arauca, Colombia (figura 1).
Figura 1: Área de estudio.
La altitud oscila entre los 128 y 130 m y presenta temperatura promedio de 27°C (Minorta, 2014). La precipitación media anual es de 1724 mm, con presencia de un periodo seco que se extiende desde noviembre hasta marzo y una época lluviosa que se presenta entre abril y octubre. El clima está clasificado como húmedo con régimen de distribución de lluvias bimodal-tetraestacional (Rangel, Gopar-M. y Minorta, 2017).
Protocolo de muestreo
El muestreo se realizó entre el 26 y 28 de febrero de 2015 (época seca), siguiendo la metodología de levantamientos florísticos a través de transectos (Villarreal et al., 2004). Se instalaron 10 transectos de 50 x 2 m (0.1 ha) con orientación este-oeste en la parte central, en un área en buen estado de conservación del bosque. Se evitó el traslape entre transectos, que además fueron georreferenciados en sus puntos extremos.
Dentro de cada transecto se examinó toda la vegetación arbórea y arbustiva cuyos tallos presentaban un diámetro a la atura del pecho (DAP) ≥ 2.5 cm medido a 1.3 m de la superficie del suelo. Para evaluar la riqueza de especies con forma de vida herbácea y rasante se instalaron aleatoriamente 10 parcelas de 1 m2 al interior de cada transecto. Se registraron todas las especies encontradas, el número de individuos, la altura y el porcentaje de cobertura. Para cada individuo de los estratos arbóreos y arbustivos se documentó el hábito de crecimiento, se estimó la altura de la primera ramificación y la altura total. Además, en cada transecto se midió la altura de los zuros y el diámetro de los mismos con una cinta métrica y la distancia entre uno y otro.
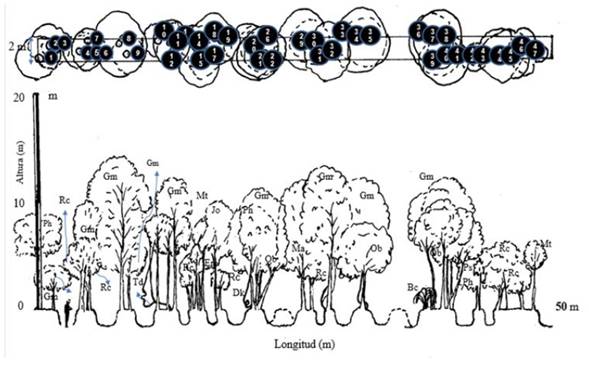
Se recolectaron muestras botánicas de las plantas encontradas en los transectos, que fueron herborizadas y depositadas en el Herbario Orinocense (Hori) de la sede Orinoquía de la Universidad Nacional de Colombia. Para la determinación taxonómica se emplearon claves, catálogos ilustrados, listas de especies y recursos virtuales (Gentry 1996; Mendoza y Ramírez, 2006; Duno de Stefano, Aymard y Huber, 2007; Hokche, 2008; Bernal, Gradstein y Celis, 2015; The Field Museum, 2018; JSTOR, 2018; The Plant List, 2018; Tropicos, 2018). Se elaboró el perfil de vegetación para representar la estructura vertical del estrato arbustivo y arbóreo del bosque a partir de información de un transecto en el que se estimaron los diámetros de las copas, las alturas totales y fustales, las coordenadas X y Y de los individuos encontrados al interior del transecto y observaciones propias para cada individuo (figura 2). Se calculó el índice de diversidad alfa de Shannon-Wiener (H´) y a partir de este valor se estimó el número efectivo de especies (Melo, 2002; Jost, 2006). Además, se calculó el índice de valor de importancia (IVI), el cual da a conocer la estructura forestal empleando los registros de abundancia, frecuencia y dominancia de cada especie para los estratos arbustivo y arbóreo; e independientemente para el estrato rasante usando la cobertura como medida de la dominancia (Finol, 1976). Por último, se empleó el programa Estimates para evaluar la calidad del muestreo (Colwell, 2013).
Figura 2: Perfil de vegetación del zural boscoso. Arauca. Arauca. Vereda San Ramón. 6°44’35.18”N 70°40’45.48”O. Especies presentes en transecto 50 x 2 m: Bromelia chrysantha Bc (36), Clitoria dendrina Cd (13 y 38), Davilla kunthii Dk (26 y 33), Erythroxylum macrophyllum Em (17), Garcinia madruno Gm (2, 3, 8, 9, 11, 24, 32, 34 y 40), Genipa americana Ga (10), Jacaranda obtusifolia Jo (7, 19, 29 y 37), Mabea trianae Mt (15, 18, 23, 45 y 47), Matayba cf. arborescens Ma (28), Ocotea bofo Ob (22, 35 y 39), Passiflora cf. coccinea Pc (31), Pouteria cf. stipitata Ps (43), Protium heptaphyllum Ph (1, 6, 20, 27 y 42), Rudgea crassiloba Rc (4, 5, 14, 30, 44 y 46), Tetrapterys cf. discolor Td (12 y 16).
Se emplearon los estratos vegetales propuestos por Rangel y Lozano (1986), donde el estrato rasante (r) corresponde a alturas menores a 0.3 m; el herbáceo (h) entre 0.3-1.5 m; el arbustivo (ar) de 1.5-5 m; el sub arbóreo (Ar) de 5-12 m; el arbóreo inferior (Ai) de 12-25 m, y el arbóreo superior (As) >25 m.
Se realizó una clasificación de siete clases diamétricas para las especies leñosas, incluyendo rangos desde 2.5 cm hasta mayores de 60 cm, como indicadores del estado ecológico y de conservación del zural boscoso (Ajbilou, Marañon y Arroyo, 2003).
RESULTADOS
En el área de 0.1 ha se calculó una densidad de 97 zuros con un promedio de 9.7 zuros por cada 50 m de transecto. La altura promedio de los zuros fue 1.36 m (± 0.06 m, rango: 1.20-1.60, n = 97) y un diámetro promedio de 2.70 m (± 1.18 m, rango: 0.9-6.3, n = 97), separados por zanjas de 2.42 m (± 2.9 m, rango: 1.1-12.1, n = 97). En los montículos predominó vegetación leñosa (árboles, arbustos y lianas) y vegetación herbácea de poco tiempo de establecimiento, generalmente plántulas de las especies arbóreas y algunos helechos del género Adiantum (figura 3). En los canales o zanjas no se observaron plantas (figura 3a y 2b). Algunos zuros presentaban evidencia de actividad de lombrices y de hormigas acumulando tierra sobre los montículos lo que podría ser uno de los mecanismos que induce el levantamiento gradual del zuro (figura 3c).
En el área muestreada de 0.1 ha se registraron 849 individuos, de los cuales 396 (46.6%) fueron plantas leñosas con DAP ≥2.5 cm representados en 22 familias, 28 géneros y 31 especies (tabla 1). En el estrato rasante y herbáceo se registraron 453 (53.4%) individuos de siete familias, ocho géneros y nueve especies. Las familias mejor representadas fueron Rubiaceae, con cuatro géneros y cuatro especies; Fabaceae (Leguminosae), con tres géneros y tres especies; Lauraceae, Bignoniaceae, Myrtaceae y Erythroxylaceae, con dos géneros y dos especies cada una. Las 16 familias restantes estuvieron representadas por un género y una especie lo cual indica una baja representación de ambas categorías taxonómicas para la mayoría de las familias encontradas. El hábito de crecimiento arbóreo fue el más abundante con el 47.5% de los individuos censados, seguido del arbustivo con el 25%, herbáceas y lianas con 12.5% cada una, y palmas con 2.5%.
Tabla 1: Lista de especies registradas en un zural boscoso en el municipio de Arauca.
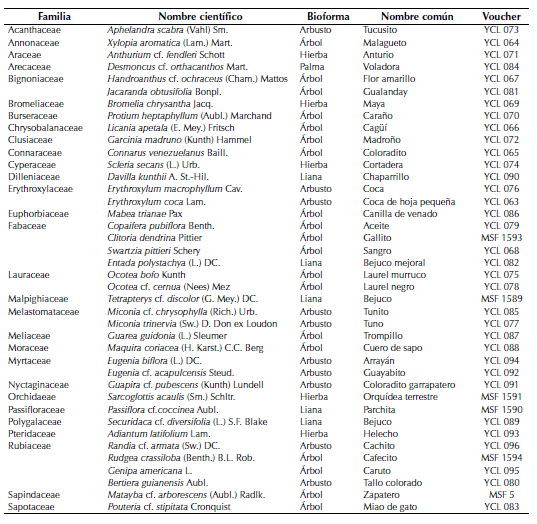
Las especies arbóreas con mayores abundancias relativas fueron Mabea trianae Pax con 25.9%, seguida de Garcinia madruno (Kunth) Hammel con 10.9%, Ocotea bofo Kunth con 8.6% y Jacaranda obtusifolia Bonpl. con 8.1%. En cuanto a la dominancia relativa, el 56.6% se concentró en cuatro especies arbóreas: J. obtusifolia con 23.7%, M. trianae con 13.1%, G. madruno con 11.7%, y O. bofo con 8.1%. También destaca Sarcoglottis acaulis (Sm.) Schltr (Orchidaceae) como nuevo registro para el departamento de Arauca y las especies leñosas Guapira cf. pubescens (Kunth) Lundell (Nyctaginaceae) y Pouteria cf. stipitata Cronquist (Sapotaceae), taxones que previamente no habían sido documentados para Colombia y que ocurren en el Estado de Apure en los llanos de Venezuela (Duno Stefano et al., 2007).
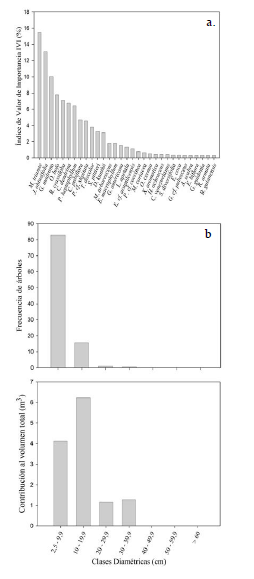
El índice de valor de importancia se concentró en un bajo número de especies. Las cuatro más destacadas fueron: M. trianae con 15.5%, J. obtusifolia con 13.1%, G. madruno con 10% y O. bofo con 7.8% (figura 3a). La curva de acumulación de especies mostró que la representatividad del muestreo fue del (65.6%) no logrando alcanzar la asíntota. El índice de diversidad alfa de Shannon-Wiener (H´) fue 2.56, a partir del cual se obtuvo un número efectivo de especies de 12.9.
Figura 3: Mosaico de imágenes del zural boscoso en el municipio de Arauca, Colombia. a. Vista panorámica de los zuros (montículos) en un estado avanzado de evolución por erosión reticular. b. Vegetación sobre los zuros. c. Zuros donde se evidencia la actividad de hormigas elevando el nivel del terreno. d. Oso hormiguero detectado en fototrampeo en la zona de canales o zanjas.
Respecto a las clases diamétricas en el zural boscoso el mayor número de árboles, lianas y arbustos se concentró en la clase diamétrica I (2.5 cm-9.9 cm) con 328 individuos (83%) (figura 4b). El restante 17% (68 individuos) fue para árboles con diámetros mayores o iguales a 10 cm. No se encontraron individuos con diámetros por encima de 40 cm. Respecto a la contribución del volumen total de madera en el zural boscoso, los 62 individuos de la clase diamétrica II (10-19.9 cm) contribuyeron con el 48.7% (6.23 m3), seguidos por los 328 individuos de la clase I (2.5-9.9 cm) que aportaron el 43.6% (4.12 m3). Los restantes individuos arbóreos (clases III y IV) aportaron el 19% del volumen total (1.16 m3, 1.26 m3 , respectivamente). En relación al área basal, la clase diamétrica I con 328 individuos tuvo una contribución del 43.6%, seguido por la clase II de 62 individuos y un aporte del 41.1%.
Figura 4: a. índice de valor de importancia para las especies leñosas con d ≥2.5 cm encontradas en el zural boscoso en Arauca, Arauca - Colombia; b. Frecuencia de árboles y aporte al volumen total según las clases diamétricas del componente arbóreo encontradas en el zural boscoso en el municipio de Arauca.
A nivel sociológico, como variable descriptora de la estratificación vertical, la clase predominante fue el estrato subarbóreo (5-12 m) con un 65.1% de los individuos, seguido del estrato arbustivo (1.5-5 m) con 30.1% y el menos representado fue el estrato arbóreo inferior (12-25 m) con 4.8%. En el estrato arbustivo la especie más importante fue M. trianae; en el estrato subarbóreo J. obtusifolia, y en el estrato arbóreo inferior Copaifera pubiflora Benth. En particular, C. pubiflora suele ocupar el dosel en bosques de galería (Cabrera, 2016) y matas de monte en avanzado estado de sucesión pero en el zural boscoso no alcanzó los 18 m de altura. El cociente de mezcla para el conjunto de plantas leñosas con diámetro superior o iguales a 2.5 cm fue de 1:12, lo cual indica que el bosque es relativamente homogéneo, cada especie representada por 12 individuos/0.1 ha en promedio.
DISCUSIÓN
Las dimensiones de los zuros de este estudio corresponden a lo que se consideraría como “bien estructurados”, con alturas >1.2 m y diámetros >2.5 m según Stagno y Steegmayer (1972). Adicionalmente, se observó evidencia indirecta de presencia de lombrices (i.e. fitolitos), como ha sido documentado previamente (Zangerlé et al., 2016), y directa de hormigas arrieras (Atta cf. cephalotes). Por otra parte, el zural muestreado no se encuentra localizado cerca de la cordillera como fue planteado por FAO (1964) en las descripciones tempranas de este tipo de formación (Zangerlé et al., 2016).
En la base de los canales no se encontraron plantas jóvenes ni adultas durante la época seca en la que se realizó el muestreo. Esto podría deberse a que la vegetación en los canales está expuesta a dos condiciones contrastantes relacionadas con el recurso hídrico. Por un lado, durante el periodo de lluvias los canales se inundan con una columna de agua mayor a 60 cm lo que ocasiona estrés hídrico por inundación y tiene efecto negativo para el establecimiento y desarrollo de la mayoría de plantas terrestres (Jiménez, Moreno, y Magnitskiy, 2012). Por otro lado, los cuatro meses de sequía pueden ser un factor que limita la presencia de especies de plantas que requieren un elevado nivel de humedad en el suelo para sobrevivir durante la época seca (Pizano y García, 2014). Este carácter anfibio drástico en los canales del zural reduce el área disponible para colonización y establecimiento, y probablemente repercute en la riqueza de especies de plantas vasculares que el zural puede albergar. En general, bosques sujetos a inundaciones tienen menor riqueza que los bosques que no, debido a que el nivel del agua restringe la presencia de especies que no toleran la hipoxia del suelo (Díaz y Rosales, 2006; Macía, 2008). Sin embargo, en los montículos se encontraron especies como O. bofo, J. obtusifolia, Protium heptaphyllum (Aubl.), Marchand y Rudgea crassiloba (Benth.) B.L.Rob. las cuales suelen crecer en terrenos no inundables, posiblemente debido a que sobre el montículo se crea un microhábitat que permanece bien drenado todo el año.
En el zural estudiado se registraron 40 especies (arbóreas y arbustivas 31 y 9 herbáceas). La literatura respecto a la composición florística de coberturas boscosas en zurales bien estructurados y boscosos es escasa, pero Zangerlé et al. (2016) registraron en el departamento de Casanare ocho especies arbóreas y siete especies herbáceas. Las diferencias en riqueza de especies pueden ser atribuidas a que Zangerlé et al. (2016) realizaron levantamientos florísticos en áreas de 100 m2, documentaron árboles con diámetro mayor a 10 cm, y algunas identificaciones taxonómicas solo se realizaron a nivel de género. En contraste, el área muestreada en el presente estudio fue de 0.1 ha, se incluyeron diámetros para especies arbóreas ≥ a 2.5 cm y la identificación taxonómica fue a nivel de especie.
Comparaciones adicionales a nivel local con otros tipos de coberturas boscosas como bosques riparios, matas de monte o bosque seco son limitadas debido a que aún no resulta obvio en qué categoría puede ser incorporado el zural boscoso. El zural documentado no podría ser considerado como un bosque húmedo, ya que la zona presenta un periodo de sequía muy marcado, de más de cuatro meses, un factor que limita la presencia de plantas que requieren humedad permanente y, en este sentido, podría ser más comparable con un bosque seco o estacionalmente seco. Estudios previos en bosques estacionalmente secos y secos neotropicales han registrado entre 50 y 70 especies (Gentry, 1995; Phillips y Miller, 2002) con valores mínimos de 24 especies (Macía, 2008; Alvarado, 2010).
En bosques de galería inundables y no inundables en Arauca se registraron 24 y 27 especies usando área de muestreo de 0.1 ha y diámetro mayores o iguales a 2.5 cm (Aymard y Vélez, 2015). Sin embargo, en estudios con mayores áreas de muestreo en Arauca, Casanare y Vichada han sido detectados entre 47 y 185 especies (Alviz, 2015; Cabrera, 2016; Trujillo y Henao, 2018). Así, el zural boscoso presenta valores comparables de riqueza con otros bosques de la Orinoquía. No obstante, un factor que podría estar limitando la riqueza vegetal en el zural es, posiblemente, la alta competencia que se da en los montículos entre las especies que logran colonizarlos, lo que excluye las menos competitivas en la comunidad.
En este estudio las familias mejor representadas fueron Fabaceae (Leguminosae) y Rubiaceae, similar a lo mencionado por Veneklaas, Fajardo, Obregón y Lozano (2005); Díaz y Rosales (2006) y Pinzón, Rangel-Ch. Minorta-C. y Aymard (2017). En el caso de Leguminosae, Gentry (1988) menciona que es la familia más representativa en los bosques del Neotrópico. Otras familias bien representadas como Lauraceae y Euphorbiaceae son dominantes en bosques no ribereños, mientras Myrtaceae lo es en bosques ribereños (Cabrera, 2016).
En este estudio pocas especies arbóreas como M. trianae, J. obtusifolia, G. madruno, O. bofo, R. crassiloba, Clitoria dendrina Pittier, P. heptaphyllum y C. pubiflora registraron valores altos para el índice de valor de importancia, un patrón que se considera frecuente en bosques neotrópicales (Dezzeo, Flores, Zambrano, Rodgers y Ochoa, 2008). M. trianae es de hábito arbustivo o arbóreo y es común en formaciones boscosas de Arauca y Casanare, mientras que J. obtusifolia, O. bofo y C. pubiflora están presentes en afloramientos rocosos (Parra, 2006; Mora, 2013). P. heptaphyllum fue considerada de gran importancia ecológica en un bosque ribereño de Cuao-Sipapo en el Estado Amazonas, Venezuela (Alvarado, 2008) y en bosques sobre terrazas en los Llanos de Venezuela (Aymard, 2013; Aponte, Cuello, y Falcón, 2017). Lopes (2007) planteó que por su carácter pionero P. heptaphyllum es frecuente en estadios iniciales de sucesión de bosques.
La curva de acumulación de especies evidenció que la representatividad del muestreo fue baja (65.6%), por lo que para incrementar el porcentaje de completitud se considera conveniente aumentar el número de transectos y cuantificar de forma más precisa la riqueza de especies que los zurales boscosos albergan.
El índice de Shannon (H´=2.56) y el número efectivo de especies (12.9) indican que el zural es un ecosistema boscoso con baja diversidad y alta dominancia de pocas especies, lo que coincide con otros estudios realizados en la Orinoquia (Correa-Gómez, 2010; Trujillo y Henao-Cárdenas, 2018).
Ahora bien, al evaluar las clases diamétricas, la mayor abundancia de individuos se registró en la clase I (2.5-9.9 cm). Esto coincide con otros bosques situados en los Llanos de Venezuela y en Colombia en bosques de la cuenca del río Pauto (Casanare), donde predominan individuos con diámetros menores a 30 cm (Alvarado, 2008; Dezzeo et al., 2008; Alvarado, 2010; Cabrera, 2016). Esto denota que probablemente es un bosque joven, con especies con ciclos de vida corto como M. trianae y J. obtusifolia. Aun así, algunas especies arbóreas registradas pueden alcanzar diámetros mayores en otros bosques no inundables como C. pubiflora, Handroanthus ochraceus (Cham.) Mattos y Licania apetala (E. Mey.) Fritsch, ratificando que debe haber factores limitando el tamaño máximo que los árboles pueden alcanzar en el zural. Posibles hipótesis no excluyentes para el bajo porte de los árboles es que los mismos tienen poco tiempo de establecimiento y/o la competencia por recursos en los montículos limita la disponibilidad de nutrientes para alcanzar mayores tamaños, o las dimensiones de los montículos no podrían soportar individuos de mayor porte a los registrados.
Basado en los aspectos forestales de distribución por clases diamétricas, el volumen total de madera, el bajo porte de los árboles y la estratificación vertical, es posible sugerir que el zural boscoso estudiado carece de las condiciones óptimas para ser utilizado en la extracción maderera bajo modelos de aprovechamiento forestal convencional donde se utilizan especies con diámetros mayores a 40 cm (Ministerio de Ambiente, 1996; IDEAM, 2018), que no se encontraron en el muestreo realizado. El zural boscoso probablemente provee beneficios importantes para la sustentabilidad de los sistemas productivos locales, suministro de leña para autoconsumo y productos naturales no maderables, pero no podría proporcionar beneficios económicos altos basados únicamente en la producción de madera. Este tipo de bosque alberga flora autóctona y provee servicios ecosistémicos de regulación, contribuyendo a mantener la integridad funcional de los ecosistemas que coexisten en las sabanas de la Orinoquía.
CONCLUSIONES
En este estudio se documentó un zural boscoso conformado por elementos leñosos con alturas menores a 16 m, diámetros inferiores a 40 cm y una riqueza de 40 especies de plantas, valor más elevado que el que se mencionaba previamente en la literatura existente. Sin embargo, los estimadores utilizados sugieren que la diversidad podría ser mayor, esto implica que se requieren estudios adicionales para conocer con detalle la riqueza de especies vegetales que los zurales albergan. La presencia de las especies leñosas G cf. pubescens (Nyctaginaceae) y P cf. stipitata (Sapotaceae) como nuevos registros para la región validan este planteamiento. En adición, se hacen necesarios estudios acerca de zurales boscosos para entender su dinámica funcional, evaluar los servicios ecosistémicos que prestan y los potenciales riesgos a los que están expuestos. Esto es particularmente relevante si se tiene en cuenta que su distribución geográfica se concentra principalmente en los departamentos de Arauca y Casanare, lo que expone a los zurales a ser transformados como consecuencia de la expansión de la frontera agrícola asociada a los cultivos de arroz y ganadería, actividades que predominan en estos departamentos.
Acknowledgements
AGRADECIMIENTOS
Los autores de este trabajo agradecen a la Universidad Nacional de Colombia sede Orinoquía por el apoyo dado a las colecciones biológicas. A Richard Jiménez Cisneros por la ayuda en el trabajo de campo y por la hospitalidad de su familia durante los días de muestreo. A Elsi Yaneth Corredor Lara, quien como pasante de Biología aportó al trabajo en campo.
REFERENCIAS
License
Colombia Forestal retains the patrimonial rights (copyright) of the published works, and favors and allows the reuse of the same under the Creative Commons Attribution-ShareAlike 4.0 International license, so they can be copied, used, disseminated, transmitted and exhibited publicly, provided that:
You acknowledge the credits of the work in the manner specified by the author or licensor (but not in a way that suggests that you have their support or that they endorse your use of their work).