DOI:
https://doi.org/10.14483/udistrital.jour.colomb.for.2008.1.a13Published:
2008-01-01Issue:
Vol. 11 No. 1 (2008): January-DecemberSection:
Scientific articleTamizaje Fitoquímico y Cálculo de Rendimiento de Sapogeninas Esteroidales de Tres Procedencias de Solanum Quitoense Var. Septentrionale "Naranjillo"
Physiochemical screening and performance calculation of steroidal saponins from three provenances of Solanum quitoense var. septentrionale - Naranjillo
Keywords:
Solanaceae, alkaloidal sapogenins, steroidal sapogenins, hormones, corticoids, elucidation, spectroscopic. (en).Keywords:
Solanaceae, sapogeninas alcaloidales, sapogeninas estereoidales, hormonas, corticoide, elucidación, espectroscópicas (es).Downloads
References
Bilbao, M. 1997. Análisis fitoquímico preliminar. Universidad del Quindío. Editorial Norma, Armenia. Pg. 185.
Ciulei, I. 1982. Metodología de análisis de productos vegetales con fines farmacológicos. Facultad de Farmacia, Bucarest, Rumania.
Fanor, R. C. 2001. Cálculo de la humedad y otros factores en la extracción de compuestos activos. Industrialización de metabolitos secundarios 3: 28-31.
Fontan, J. I. 1973. Las saponinas y la botánica. Instituto Español de Fisiología y Bioquímica. McGraw-Hill, Madrid. Pg. 367.
Ibáñez, T. 1981. Industrialización de las plantas medicinales de Colombia. Universidad de Santiago. Revista Creces 25: 21-31.
Martínez, M. A. 2001. Saponinas esteroides. Revista udea 3: 2-19.
Pradilla, A., H. Laverde & J. C. Pabón. 2006. Prospectiva tecnológica de la cadena productiva agroindustrial del fique en el departamento del Santander. cbe y Colciencias. Págs. 25-32.
Sanabria, A. 1983. Análisis fitoquímico preliminar, metodología y su aplicación en la evaluación de 40 plantas de la familia compositae. Universidad Nacional de Colombia. Fitochem: 21-23.
Schafer, G., S. Urrego & G. Palacio. 2006. Extracción, purificación e identificación de sapogeninas de plantas del género Solanum. Eafit, Revista Ingeniería y Ciencia 5: 2-10.
How to Cite
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Download Citation
TAMIZAJE FITOQUÍMICO Y CÁLCULO DE RENDIMIENTO DE SAPOGENINAS ESTEROIDALES DE TRES PROCEDENCIAS DE Solanum quitoense var. septentrionale “NARANJILLO”
Physiochemical screening and performance calculation of steroidal saponins from three provenances of Solanum quitoense var. septentrionale �Naranjillo�
Tamizajem fitoquímico e cálculo do rendimento das sapogeninas esteroidais de três procedências de Sonalum quitoense var septentrionale “naranjillo”
Henry Flechas1, Laura Sánchez2 & Jairo Silva3
1Pontificia Universidad Javeriana, Bogotá, Colombia, hflechascorredor@gmail.com.
2Universidad Distrital Francisco José de Caldas, Bogotá, Colombia, anais252001@yahoo.com.
3Universidad Distrital Francisco José de Caldas, Bogotá, Colombia, lsilvaherrera@gmail.com.
Recepción: Septiembre 25 de 2008/Aprobación: Octubre 31 de 2008
RESUMEN
Esta investigación comprendió el estudio de las partes aéreas (frutos) del lulo de monte (Solanum quitoense var. Septentrionale), cuyo objetivo principal fue determinar los metabolitos secundarios y enespecial la presencia y cantidad de saponinas alcaloidales, comunes en la familia Solanaceae. Estassustanciassonutilizadascomoprecursorespara la fabricación de varias drogas de tipo corticoide, hormonas y antiinflamatorios.
Elestudio se llevóa cabo con especies de tres procedencias y tres estados de maduración recolectadas en Departamento de Cundinamarca, Colombia, entre 2.400 y 2.600 msnm durante los meses de marzo a junio. Las sapogeninas fueron extraídas, aisladas y purificadas mediante diversas técnicas utilizadas para tal fin. La presencia de saponinas se comprobó mediante análisis físicos y químicos, y la elucidación estructural por medio de técnicas espectroscópicas de NMR e IR.
Se determinó la presencia de hecogenina en frutos verdes de las tres procedencias. Esta estructura molecular corresponde a una sapogenina esteroidal no reportada en esta especie.
Palabras clave: Solanaceae, sapogeninas alcaloidales, sapogeninas estereoidales, hormonas, corticoide, elucidación, espectroscópicas.
ABSTRACT
This research includes the study of aerial parts (fruits) of lulo de monte (Solanum quitoense var. Septentrionale).The main objective of this research was to determine the secondary metabolites and especially the presence and quantity of alkaloidal saponins, which are common in the Solanaceae family. These substances are used as precursors for the manufacture of several steroid-type drugs, hormones and anti-inflammatories.
The study was conducted with species of three different origins and three different maturing stages gathered in the department of Cundinamarca, Colombia between 2.400 and 2.600 meters above sea level during the period from March to June. Sapogenins were extracted, isolated and purified through various techniques used for this purpose. The presence of saponins was proved through physical and chemical analysis, and the structural elucidation through NMR and IR spectroscopic techniques.
The presence of hecogenin in green fruits from the three sources was determined. This molecular structure corresponds to a non-steroidal sapogenin reported inthis species.
Key Words: Solanaceae, alkaloidalsapogenins, steroidal sapogenins, hormones, corticoids, elucidation, spectroscopic.RESUMO
Esta investigação compreendeu o estudo das partes aéreas (frutas) do lulo de montanha (Solanum quitoense var. septentrionale), cujo objetivo principal foi determinar os metabólitos secundários e em especial a presença e quantidade de saponinasalcaloidais, comuns na família Solanaceae. Estas substâncias são utilizadas como precursores para a fabricação de vários remédios tais como: corticóide, hormônios e antiinflamatórios.
Este estudo se levou a cabo com as espécies de três procedências em três estados de maturação, recolhidas na região de Cundinamarca, Colômbia, entre 2.400 y 2.600 msnm durante os meses de março a junho. As sapogeninas foram extraídas, isoladas e purificadas mediante diversas técnicas utilizadas para tal fim. A presença de saponinas se comprovou mediante análises físicas e químicas, a clareza estrutural por meio de técnicas espectroscópicas de NMR e IR.
Determonou-se a presença de hecogenina em frutas verdes das três procedências. Esta estrutura molecular corresponde a uma sapogeninaesteroidal não reportada desta espécie.
Palavras chave: Solanaceae, sapogeninas alcaloidales, sapogeninas estereoidais, hormônios, corticóide, elucidação, espectroscópicas.INTRODUCCIÓN
Las sapogeninas esteroidales obtenidas en general a partir de especies del género Solanum son de importancia farmacéutica, porque se utilizan como materia prima para la producción de medicamentos esteroidales (Fontan 1973). Dentro de este género existen plantas nativas y poco estudiadas, las cuales constituyen no sólo una fuente de sapogeninas esteroidales sino también una alternativapara recuperar zonas aptas para su cultivo. Éstas son de crecimiento rápido, producen todo el año, no requieren suelos ricos ni cuidados especiales y presentan una amplia distribución en todo tipo de climas. Debido al gran consumo a nivel mundial, se hace necesaria la obtención de esteroides por métodos más eficientes, económicos y a partir de fuentes de origen vegetal, cumpliendo con las nuevas tendencias ambientales para el uso de recursos locales y plantasnativas.
Los extractos naturales estandarizados ricos en sapogeninas tienen muchas aplicaciones en varios sectores de la industria. En farmacéutica los mayores usos de estos productos están en la síntesis de hormonas, drogas para el tratamiento contra el cáncer y el alzheimer, control del colesterol e investigación de vacunas humanas (herpes y HIV), entreotros.En cosmética se emplean para preparar champús, acondicionadores, cremas para cuidar la piel, pomadas hidratantes, tónicos para estimular el crecimiento del cabello, tratamientos para la seborrea y jabones. Las sapogeninas en la industria nutracéutica han demostrado ser útiles como potenciadoras del sistema inmunológico humano, además tienen propiedades antioxidantes y surfactantes, sirven como preservativos solubles en agua y espumantes para licores. En veterinaria las sapogeninas se emplean como adyuvante para vacunas animales, para potenciar el sistema inmunológico de los animales sin tener el efecto nocivo de los antibióticos, reducen los niveles de amoniaco en la cría de cerdos, así como también reducen el colesterol en huevos de gallina y carne de bovinos; también se emplean para el aumento de la rata de crecimiento del cultivo depeces ycrustáceos (Ibáñez1981).El mercado de extractos vegetale smedicinales se calcula en 16.5 millardos, asímismo, las ventas de estas medicinas vienen creciendo aproximadamente un 25% en los últimos años, lo que muestra que el material médico vegetal es utilizado cada vez más por un gran número de industrias. Los recursos naturales renovables en Colombia no han sido explotados comercialmente en forma adecuada y los recursos vegetales como fuente de metabolitos secundarios han sido estudiados tímidamente. Con este trabajo se pretende continuar la investigación en el aspecto fitoquímico y crear las bases para el mercadeo y desarrollo de un proyecto productivo de sapogeninas a partir de la biodiversidad colombiana en pro de la salud humana.
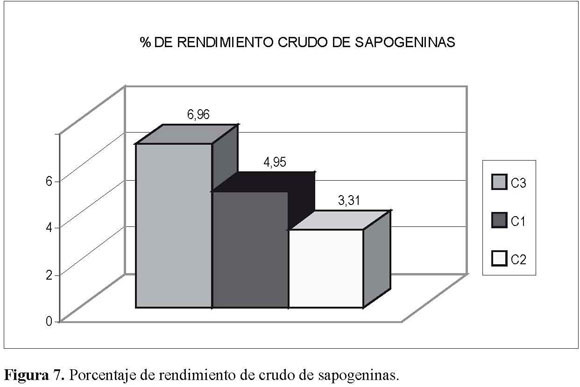
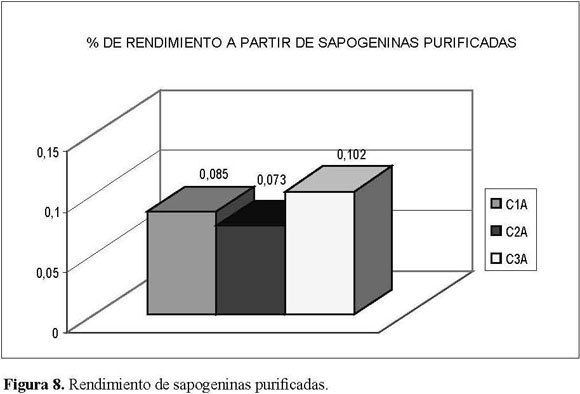
La importancia de estetrabajoradicóen contribuir como estudio exploratorio de la especie, para lo cual se determinaron los principales componentes químicos y se obtuvieron las sapogeninas esteroidales pormedio de una metodología eficiente y rentable – con rendimientos superiores a los reportados para la familia solanaceae, que oscilan entre 3.31 y 6.96% en peso, a partir del crudo y entre 0.073 y 0.102% a partir de sapogeninas en alto estado de pureza–, con el fin de ofrecer mayor cantidad de ellas, obtenidas a partir de productos naturales.
METODOLOGÍA
La recolección del material vegetal se realizó en Granada, Nazareth y el Alto de San Miguel, Cundinamarca, a una altura de 2.400-2.600 msnm,con temperaturas entre 18 y 23 ºC, y se escogieron frutos de árboles en sus diferentes estados de maduración: verdes, ¾ de maduración y maduros.
Al material frutal seco se le determinó la cantidad de humedad, de acuerdo al método (Fanor 2001), después se realizó el tamizaje fitoquímico para los tres estados de maduración (Ciulei 1982), lixiviándolos a través de etanol, éter y agua (Figura 1). Las fracciones se concentraron a 200 ml, el extracto etéreo se dividió en dos alícuotas de 20 y 180, las cuales corresponden a la fracción A y B. A se sometió a pruebas para triterpenos y esteróles, ácidos grasos y carotenoides, y B para alcaloides, carotenoides, flavonoides, cumarinas y emodinas. El extracto etanólico se concentró a 200 ml, se dividió en dos alícuotas de 100 ml, se concentró una de ellas a 30 ml (fracción E1) y la otra a 50 ml (fracción E2).AE1 se le hicieron pruebas para taninos catéquicos y compuestos reductores y a E2 cumarinas, antocianinas y antracenósidos. Para el extracto acuoso se dividió en dos alícuotas de 100 ml.Una de las alícuotas se utilizó en las pruebas de almidón, taninos catéquicos y taninos gálicos y la otra para las pruebas de polisacáridos y saponinas.

La extracción de sapogeninas se realizó de acuerdo al protocolo (Schafer et al. 2006) utilizado para varias especies del género Solanum. Se lixivió el material en etanol frío (3 días) y en caliente (6 horas), y luego se reunieron los extractos.
Obtención del crudo de saponinas. Los extractos A se pasaron por carbón activado, tierra de diatomeas y bentonita (1:2:3, Figura 2). Se fraccionaron con butanol hasta máximo agotamiento, obteniendo seisfracciones.Seunieronlasfracciones(B1,B2y B3) y se dejó en reposo aproximadamente por una horay seformaron unos cristales que tenían forma de aguja. Éstos fueron filtrados para realizar pruebas de saponinas. El extracto B1 se concentró y se observaron los mismos cristales que los obtenidos inicialmente de coloración parda.A los cristales y crudo de saponinas se le realizaron pruebas cualitativas para dicho grupo fitoquímico. Se realizó lo mismo conB2 y B3.

Los extractos B1, B2 y B3 se hidrolizaron con H2SO4 diluido, en vez de HCL, debido a que algunos autores lo recomiendan (Sanabria 1983). Se observaron dos fases, una de color oscuro y la otra líquida de color amarillo. Esta última con olor dulce característico de los azúcares. La mezcla se dejó en reposo por doce horas en un embudo de decantación. Para comprobar la hidrólisis completa de los extractos, se realizaronpruebasa las dos fases. Se llevóa sequedad y se fraccionó con cloroformo analítico a reflujo durante una hora, hasta máximo agotamiento. Se observaron varios cristales al concentrar los extractos C1, C2 y C3.
Los cristales de C1, C2 y C3 fueron analizados por CCD, utilizando como fase estacionaria sílica gel 60H y como fase móvil cloroformo: etanol (0.5:12.5) revelándose con vainillina-ácido sulfúrico, teniendo como patrón hecogenina para confirmar la presencia de sapogeninas en dicho sólido. Lo anterior se complementó con pruebas cualitativas parala determinación de sapogeninas.
Métodos espectroscópicos de las fracciones C1A, C2A y C3A. Los espectros IR de las fracciones se determinaron en un equipo ATI Mattson Génesis Serie FTIR. Las muestras se solubilizaron en cloroformo. Luego se realizaron pruebas espectrométricas de resonancia magnética nuclear, para lo cual se usaron 10 mg y 4 mg de cada una de las muestras en 0.7 ml de cloroformo deuterado. Sobre esta solución se tomaron los espectros unidimensionales (1H, 13C, DEPT 135) y luego los espectros bidimensionales HMQC, HMBC y COSY. Para realizar el análisis se utilizó un equipo Bruker 400 MHz.
RESULTADOS
GRUPOS FITOQUÍMICOS PRESENTES EN LA ESPECIE POR ESTADO DE MADURACIÓN
Después de realizar el tamizaje fitoquímico se observó,para las tres procedencias, una incidencia de los grupos de interés (sapogeninas esteroidales) en los frutos verdes. En cuanto al resto de especies químicas se observaron resultados positivos para triterpenos,esteroles y saponinas en CCD y en placa gelatina-sangre, donde se hallaron zonas hemolizadas en los tres estados de maduración.
SAPOGENINAS ESTEROIDALES A PARTIR DEL TAMIZAJE FITOQUÍMICO PRELIMINAR
Se utilizaron los frutos verdes de cada procedencia, porque fue donde se encontraron evidencias cualitativas de la presencia de dichas especies químicas.
Las saponinas que cristalizaron de C, tenían la apariencia de gruesos cristales o grumos, de color pardo oscuro, sin olor característico y en concentraciones similaresalas utilizadasenla prueba hemolítica; una fuerte positividad se manifestó en la prueba de espuma y en las pruebas para azúcares antrona y molish, en la cuales el producto formado fue azul verdoso y violeta, respectivamente.
OBTENCIÓN DE SAPOGENINAS
Posterior a la hidrólisis el producto obtenido presentó una coloración amarilla clara y olor dulce característico. Al concentrar el extracto, un sólido de color amarillo claro precipitó (C1 C2 y C3, Figura 4). Lo mismo serealizó con B2 y B3.
El porcentaje total de sapogeninas obtenidas, calculado en forma proporcional a la cuantía de material inicial procesado(4.95, 3.31 y 6.96%),fuemuy similar al rendimiento obtenido cuando se partió directamente de éstos para obtener los crudos de saponinas (rendimiento 0.085, 0.073 y 0.102%) paralaprimera(C1),segunda(C2)yterceraprocedencia(C3) respectivamente.
PURIFICACIÓN DE LAS FRACCIONES C1, C2 Y C3
Se preparó una cámara de cromatografía con el sistema de solventes cloroformo: acetato de etilo: metanol(3:2:1), que fue el mejor sistema de solventes para las placas W y X, dejando saturar por 30 minutos. Para la placa Y, se utilizaron dos solventes cloroformo: acetato de etilo (1:3). Sobre una placa de cromatografía sílica gel 60 con soporte de aluminio, se realizaron siembras de aproximadamente 20μL. De igual manera se aplicaron los patrones de hecogenina y tigogenina sobre la placa. Después de correr la placa se retiró y secó para su detección. Ésta se reveló con un aspersor(Pirex), que contenía la mezcla ácido sulfúrico-vainillina y colocada en una estufa a 110 ºC, detectando así tres manchas, dos decolor amarillo y una de color café.
Se corrieron las mismas placas para las fracciones C2A y C3A, mostrando las más representativas a continuación, donde se detectó que a pesar de usar la misma proporción de solventes para la placa X de la fracción (C2A), ésta se diferenció en el Rf (0.58) de la primera placa, donde su Rf (0.45) fue similar al de la fracción C1A, razón por la cual se decidió correr la placa Y de la fracción C3A con dos de los solventes ya mencionados, mostrándonos un Rf (0.7) muy cercano al patrón de tigogenina, a pesar de que la coloración de la mancha siguiósiendo amarilla.
Las fracciones puras obtenidas de C1A, C2A y C3A se identificaron como cristales blancos amorfos con punto de fusión entre 253-269º C (tomados en fusiometro MEL-TEMP), pruebas positivas para sapogeninas esteroidales, solubles en cloroformo de coloración característica en placa con vainillina ácido sulfúrico, Rf similar al patrón de hecogenina (placas W y X) y tigogenina (placa Y), por lo que puede haber una sustancia en común, que puede ser hecogenina o tigogenina, para las tres fracciones.
MÉTODOS ESPECTROSCÓPICOS
La elucidación estructural de la fracción C1A mostró en el espectro IR (Figura 3) una banda ancha y puntiaguda, entre 3.527-3.266 cm-1, característica del grupo OH. Entre 1.708-1.663cm-1, presentó dos bandas de hombro ancho que indicaron la presencia de un grupo carbonilo. Entre 1.075-1.008 cm-1 se observaron varias bandas características de enlaces C-O simples y finalmente, corroborando el análisis cromatográfico previo, la presencia de cuatro bandas características de sapogeninas esteroidales, debidas a la presencia del anillo F dentro de la aglicona. Estas últimas nos dieron la estereoquímica del C25 dentro de la molécula (Martínez 2001), donde la banda 900cm-1 es más intensa que la última de ellas, 919 cm-1.
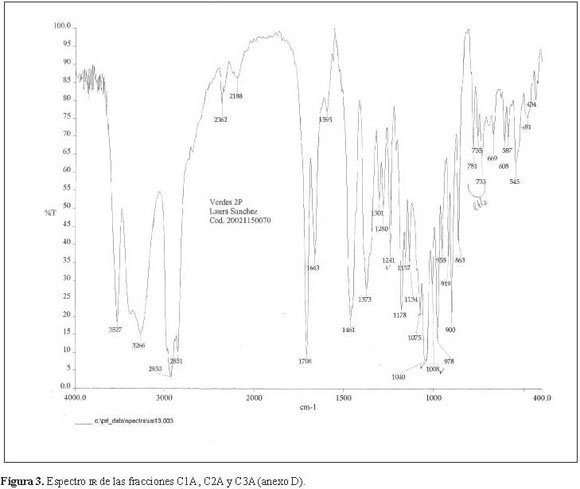
De acuerdo al análisis IR se concluyó que se trata de una sapogenina esteroidal con la presencia de un grupo carbonilo, enlaces C-O simples, grupos hidroxilos y grupos metilos geminales.
En el espectro 1H-RMN de (C1A), registrado a 400 MHz, la mayoría de las señales se encontraron en el rango de δ=0.5 – 2.5ppm (Figura 4), una alrededor de 4.4 ppm y tres alrededor de 3.5 ppm. De estas últimas la primera correspondió a hidrógenos asociados a carbonos electronegativos como el oxígeno quepuedetratarsedeenlacesC-Osimplesylas segundas a carbonos asociadosa grupos OH.
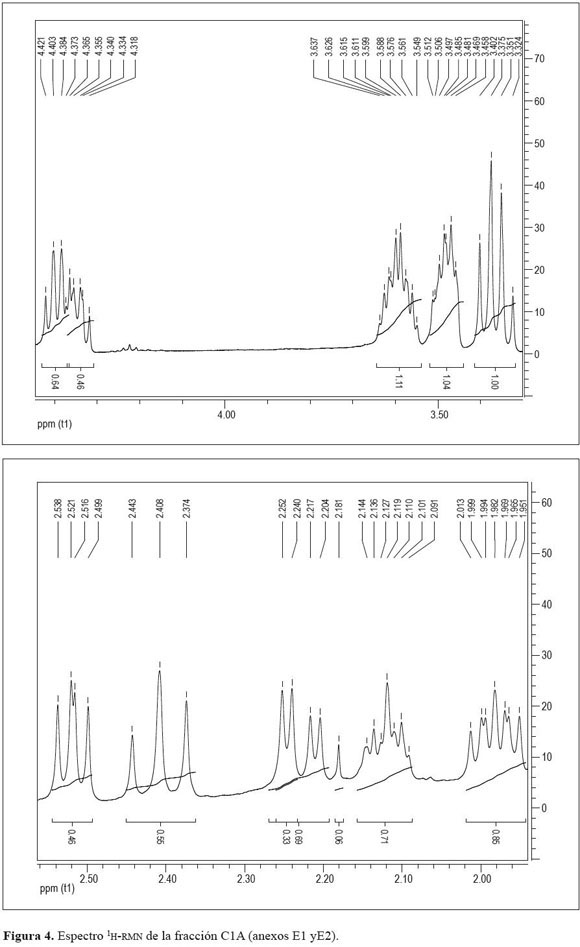
El espectro mostró múltiples señales solapadas entre 1.2 y 1.7 ppm, que no permitieron distinguir la cantidad de hidrógenos posibles en la molécula. Sólo se pudo deducir que correspondía a protones CH y CH2. Los protones de grupos metilo se observaron entre 0.7 y 1.06 ppm.
El espectro 13C-RMN mostró 54 señales con las cuales, según los análisis del trabajo previo, podríamos esperar que el aglicón fuera un esqueleto esteroidal (27 átomos de carbono), por lo cual la sustancia corresponde a una mezcla de dos aglicones esteroidales. Esto es apoyado por el experimento DEPT 135quepresenta18 CH (desplazamientos mayores a 35 ppm, parte positiva del espectro), 7 ch3 (desplazamientos menores a 35 ppm,partepositivadelespectro,20 CH2(partenegativa del espectro) y 6 señales que no se encuentran en el DEPT 135 (δ = 35.544, 36.061, 55.078, 40.532, 102.9, 213.59), pero sí en 13C-RMN: son loscarbonoscuaternarios quefueronconfirmados en el experimento HMBC (donde 102.9 ppm se encuentra solapada).
Para identificar las estructuras de los aglicones esteroidales utilizamos el experimento HMBC , que es el más adecuado para obtener la asignación de los anillos y la de los 20 grupos CH2. De esta forma la correlación a 2 y 3 ligaduras hizo posible la asignación de la mayoría delos carbonos del esqueleto.
El desplazamiento elevado de C16 (δ = 79.162 y 80.816 para a y b respectivamente), que es la señal más cercana al grupo carbonilo C12a en 13C-RMN a campos bajos del espectro, nos permite asignara éste la unión con un átomo de oxigeno, que de acuerdo al análisis IR debe ser un enlace C-O simple (1.075-1.008cm-1)y que muestra en 1H-RMN(δ =4.32 y 4.4 J= 6.4 y 7.2 Hz para a y b) un doble doblete y un cuarteto, respectivamente (Figura 5 y 6).
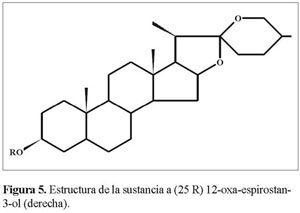
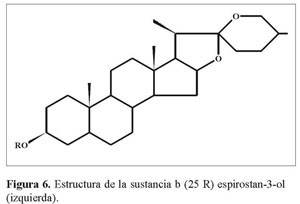
Los fragmentos I y II se interconectan a través de C13a y C14a, como mostró el punto de cruce en HMBC , lo mismo sucedió para la estructura b. La estereoquímica de C25(δ=30.148 y 30.255 para a y b respectivamente), según el análisis IR, corresponde a R y se corrobora por el desplazamiento químico de los protones de los metilos 21 (δ = 1.06 y 0.96, J= 7.2 y 6.8 Hz) y 27 (δ = 0.8y 0.75, J= 6.4 y 6.2 Hz), que resuenan dobletes entre 0.75-1.06 ppm, según la literatura (Martínez2001).
CÁLCULO DE RENDIMIENTO APROXIMADO DE SAPOGENINAS ESTEROIDALES
La procedencia que presentó el mayor rendimiento tanto en el crudo de sapogeninas (6.96, Figura 7), como en la fracción purificada C3A (0.102, Figura 8), fue la del Alto de San Miguel. En las otras dos procedencias no se encontraron diferencias significativas entre los porcentajes de rendimiento de las primeras y segundas apogeninas purificadas (0.085-0.073 respectivamente), pero sí de la tercera procedencia (0.102).
Los rendimientos a partir del material inicial para el crudo de sapogeninas esteroidales (Figura 7) y después del proceso de purificación (Figura 8) estuvieron entre 3.31 y 6.96% y 0.073 y 0.102 por mil respectivamente.
DISCUSIÓN
COMPARACIÓN DE ACUERDO CON LOS ESTADOS DE MADURACIÓN
El mejor estado de maduración correspondió al verde pues, de acuerdo al tamizaje fitoquímico, en éste se reveló la presencia de triterpenos, esteroles y saponinas, como se mostró en la cromatografía en capa delgada, que de acuerdo a la bibliografía (Bilbao 1997) son coloraciones establecidas para esteroides y 3 zonas hemolizadas, que corresponden a un resultado efectivo para saponinas (Bilbao 1997). Se descarta cualquier presencia de alcaloides en la planta, de lo cual se concluye que las sapogeninas presentes en ella son esferoidales y no alcaloidales.
SAPOGENINAS ESTEROIDALES
Las sapogeninas se hidrolizaron dos veces con H2SO4,hasta que la prueba para saponinas fue negativa, lo que nos permitió deducir que hay gran presencia de polisacáridos, que no son fácilmente hidrolizados por efecto del ácido. Los productos obtenidospresentaron una coloración amarilla clara, por lo cual fue necesario un proceso de purificación por medio de lavados con cloroformo.
De los colores característicos obtenidos en CCD y de acuerdo a la bibliografía citada (Bilbao 1997), la especie sólo presentó sapogeninas esteroidales, lo cual confirmó lo expresado por Fontan (1973), uesnosehan encontrado sapogeninas triterpenoidales (coloración violeta característica) en la familia Solanaceae.
CÁLCULO DE RENDIMIENTO DE LAS SAPOGENINAS ESTEROIDALES
El porcentaje total de sapogeninas obtenidas, calculado en forma proporcional a la cuantía de material inicial procesado (4.95, 3.31 y 6.96%), fue muy similar al rendimiento obtenido cuando se partió directamente de éstos para obtener los crudos de saponinas (rendimiento 0.085, 0.073 y 0.102%) para la primera (C1), segunda (C2) y terceraprocedencia(C3)respectivamente. Esto indica una presencia proporcional tanto de saponinas como de sapogeninas para las tres procedencias.
MÉTODOS ESPECTROSCÓPICOS
De acuerdo al análisis IR se concluyó que se trata de una sapogenina esteroidal con la presencia de un grupo carbonilo, enlaces C-O simples, grupos hidroxilos y gruposmetilos geminales.
El desplazamiento elevado de C16 (δ = 79.162 y 80.816 para a y b respectivamente),que es la señal más cercana al grupo carbonilo C12a en 13C-RMN a campos bajos del espectro, nos permitió asignar a éste la unión con un átomo de oxígeno, que de acuerdo al análisis IR, debe ser un enlace C-O simple (1.075-1.008 cm-1) y que muestra en 1H-RMN (δ=4.32 y 4.4,J=6.4 y 7.2Hz para a y b)un doble doblete y un cuarteto, respectivamente.
Los fragmentos I y II se interconectan a través de C13a y C14a, como mostró el punto de cruce en HMBC , lo mismo sucedió para la estructura b. La estereoquímica de C25 (δ= 30.148 y 30.255 para a y b respectivamente),según el análisis IR, correspondió a R y se corroboró por el desplazamiento químico de los protones de los metilos21(δ =1.06 y 0.96, J = 7.2 y 6.8 Hz) y 27 (δ = 0.8 y 0.75, J = 6.4 y 6.2 Hz)que resuenan dobletes entre 0.75-1.06 ppm, según la literatura (Martínez2001).
CÁLCULO DE RENDIMIENTO APROXIMADO DE SAPOGENINAS ESTEROIDALES
El rendimiento fue superior al reportado en la literatura revisada (Schäfer et al. 2006) para la realización de este proyecto, en ella se obtuvieron rendimientos entre 0.003 y 0.027% en alto estado depurezaparacuatrodiferentesplantasdeestegénero. Lo cual expresó la confiabilidad del método empleadoylasemejanzaencontenidodelosdiversos procesos utilizados, así como la viabilidad que tendría el fruto en el mercado para la obtención de diferentes productos farmacológicos como hormonas sexuales (progesterona), hormonas corticoides (prednisolona y cortisona) y hormonas anabólicas (stanozolol y methadienona, Pradilla et al. 2006).
CONCLUSIONES
Teniendo en cuenta el tamizaje fitoquímico realizado y las pruebas cualitativas para los metabolitos de interés, los siguientes son los grupos fitoquímicos encontrados para la especie: carotenoides, ácidos grasos, cumarinas,taninos,saponinas, esteroides y triterpenos y polisacáridos. Estos metabolitos, así como los de sapogeninas esteroidales, se encontraron en el estado de maduración verde, razón por la cual son los más apropiados para la extracción de dichas sustancias, siendo la mejor procedencia el Alto de San Miguel. Sin embargo las tres procedencias mostraron presencia de las sapogeninas esteroidales, punto de fusión entre 253-269 ºC, solubilidad alta en cloroformo, coloración característica en placa para sapogeninas esteroidales y, de acuerdo a los análisis espectroscópicos, estructuras análogas a hecogenina y tigogenina.
Los rendimientos aproximados de sapogeninas en alto estado de purificación obtenidos para las tres procedencias se encontraron entre 0.073 y 0.102% enpeso.Laterceraprocedencia,elAltodeSanMiguel, fue la que presentó mayor rendimiento, no sólo a partir del crudo de sapogeninas, sino también después de la purificación de los cristales obtenidos.Lo cual seatribuyóprincipalmenteal sitio donde se encontraron los frutos, pues allí estaban al cuidado de la población de la zona, donde ellos son utilizados para elaborar luladas, además de las condiciones de altura, pues presentaban condiciones entre 2.400 y 2.460 msnm y temperaturas más bajas con respecto alas otras procedencias.
El porcentaje determinado es mayor en comparación a estudios paralelos con especies de la misma familia utilizando el mismo método, lo cual hace delfrutodeSolanum quitoense var.Septentrionale, dentro del marco de especies andinas y de páramo, una especie de interés para la extracción de sapogeninas esteroidales.
La relevancia de encontrar resultados tan positivos en esta investigación hace que un campo disciplinar como la fitoquímica nos muestre nuevas opciones para buscar especies químicas que son de gran importancia para la salud, la alimentación y las nuevas tecnologías, obtenidas nosólo de la explotación primaria de las plantas sino de otros recursos potencialmente mejores.
AGRADECIMIENTOS
Estainvestigaciónserealizóconelapoyofinanciero y la dotación de algunos de los materiales biológicos del Jardín Botánico José Celestino Mutis. Al profesor Jairo Silva por su invaluable labor y compromiso con el presente trabajo, su constancia y confianza.
REFERENCIAS BIBLIOGRÁFICAS
Bilbao, M. 1997. Análisis fitoquímico preliminar. Universidad del Quindío. Editorial Norma, Armenia. Pg. 185.
Ciulei, I. 1982.Metodología de análisis deproductos vegetales con fines farmacológicos. Facultad de Farmacia, Bucarest, Rumania.
Fanor, R. C. 2001. Cálculo de la humedad y otros factores en la extracción de compuestos activos. Industrialización de metabolitos secundarios 3: 28-31.
Fontan, J. I. 1973. Las saponinas y la botánica. Instituto Español de Fisiología y Bioquímica. McGraw-Hill, Madrid. Pg.367.
Ibáñez, T. 1981. Industrialización de las plantas medicinales de Colombia. Universidad de Santiago. Revista Creces 25: 21-31.
Martínez, M. A. 2001. Saponinas esteroides. Revista UDEA 3: 2-19.
Pradilla, A., H. Laverde & J. C. Pabón. 2006. Prospectiva tecnológica de la cadena productiva agroindustrial del fique en el departamento del Santander. COLCIENCIAS. Págs. 25-32.
Sanabria, A. 1983. Análisis fitoquímico preliminar, metodología y su aplicación en la evaluación de 40 plantas de la familia compositae. UniversidadNacional deColombia. Fitochem: 21-23.
Schafer, G., S. Urrego & G. Palacio. 2006. Extracción, purificación e identificación de sapogeninas de plantas del género Solanum. Eafit, Revista Ingeniería y Ciencia 5: 2-10.
License
Colombia Forestal retains the patrimonial rights (copyright) of the published works, and favors and allows the reuse of the same under the Creative Commons Attribution-ShareAlike 4.0 International license, so they can be copied, used, disseminated, transmitted and exhibited publicly, provided that:
You acknowledge the credits of the work in the manner specified by the author or licensor (but not in a way that suggests that you have their support or that they endorse your use of their work).