DOI:
https://doi.org/10.14483/2256201X.13453Publicado:
26-12-2018Número:
Vol. 22 Núm. 1 (2019): Enero-junioSección:
Artículos de investigación científica y tecnológicaRespuesta fisiológica de especies arbóreas al anegamiento. Nuevo conocimiento sobre especies de interés en el arbolado urbano de Bogotá
Physiological responses of tree species to waterlogging condition. New Knowledge about species of interest in the urban trees of Bogota
Palabras clave:
adaptation, stress in plants, Fv/Fm, photosynthesis, flood, electrolyte leakage, climate change (en).Palabras clave:
adaptación, estrés en plantas, Fv/Fm, fotosíntesis, inundación, fuga de electrolitos, cambio climático (es).Descargas
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Recibido: 7 de junio de 2018; Aceptado: 29 de octubre de 2018
Resumen
Los efectos del calentamiento global en las zonas urbanas hacen preponderante el estudio de especies arbóreas en diferentes condiciones de estrés abiótico, como el anegamiento. En este estudio se analizó el comportamiento fisiológico de seis especies nativas con cuatro niveles de anegamiento, determinando el estado hídrico, el comportamiento fotosintético y la pérdida de electrolitos. De acuerdo a los parámetros evaluados, se recomienda establecer Quercus humboldtii y Ficus tequendamae en zonas con altas precipitaciones y con tendencia al anegamiento debido a la tolerancia que se evidenció. Esto permite que estas zonas en Bogotá mantengan el arbolado urbano bajo escenarios de cambio climático. La estabilidad de las membranas celulares y la eficiencia máxima fotosintética del fotosistema II pueden ser usados como marcadores de tolerancia a condiciones de anegamiento en árboles.
Palabras clave:
adaptación, estrés en plantas, Fv/Fm, fotosíntesis, inundación, fuga de electrolitos, cambio climático.Abstract
The global warming effects in urban areas make preponderant the study of tree species at different conditions of abiotic stress, such as waterlogging. Therefore, it is important to conduct research to select species tolerating these environmental conditions and to find physiological markers for these selection processes. In this study, we analyzed the physiological behavior of six native species with four levels of waterlogging, determining the hydric state, the photosynthetic behavior and loss of electrolytes. According to the parameters evaluated, it is recommended to establish Quercus humboldtii and Ficus. tequendamae in areas with high rainfall and with a tendency to waterlogging. This recommendation arises due to the evident tolerance, allowing these areas in Bogota to maintain urban trees under climate change scenarios. The stability of the cell membranes and the maximum photosynthetic efficiency of photosystem II can be used as markers for tolerance under waterlogging conditions in trees.
Key words:
adaptation, stress in plants, Fv/Fm, photosynthesis, flood, electrolyte leakage, climate change.INTRODUCCIÓN
El surgimiento del arbolado urbano ha sido preponderante en las ciudades, debido a su papel ornamental, a los múltiples servicios ecosistémicos que brinda a los ciudadanos y a su contribución en la adaptación al cambio climático (Jim y Zhang, 2013; Kirkpatrick, Davison y Daniels, 2013; Ordoñez, 2015). Sin embargo, las complejas condiciones ambientales que se presentan en las zonas urbanas (temperaturas elevadas, reducción de la humedad relativa y altos niveles de contaminación atmosférica), se consideran como los principales factores que condicionan la susceptibilidad del arbolado a otros factores como los bióticos (Sjöman y Nielsen, 2010; Swoczyna, Klaji, Pietkiewicz y Borowsky, 2015; McPherson, Berry y Svan, 2018). Se ha reportado que numerosas especies arbóreas nativas no tienen la capacidad de enfrentar los efectos causados por estrés de tipo ambiental, que se generan en las zonas urbanas (Cekstere, Nikodemus y Osvalde, 2008; Borowski y Pstragowska, 2010) y que se esperan intensificar debido al efecto del calentamiento global en una gran variedad de ecosistemas, incluyendo los urbanos (Wilby, 2008).
En diferentes investigaciones se ha reportado que una de las limitantes que presenta el arbolado urbano para establecerse y prosperar es el anegamiento: la escorrentía generada por las superficies pavimentadas, la topografía del terreno, las fuertes precipitaciones, el sistema de acueducto y alcantarillado y a los eventos climáticos extremos (Hundecha y Bardossy, 2004; Bailey-Serres y Voesenek, 2008; Salazar et al., 2012). Así mismo, el efecto negativo del anegamiento en los árboles se puede incrementar dependiendo de las condiciones edafológicas que presente el sitio de siembra (compactación, textura fina, profundidad efectiva limitada, mal drenaje) y por decisiones equivocadas con respecto al establecimiento (siembra de especies arbóreas en lugares inapropiados).
El estrés de las plantas por anegamiento se genera cuando el suelo está saturado con agua y, por lo tanto, el aire contenido en los poros es desplazado, generando una disminución de oxígeno (O2) disponible para las raíces (Caudle y Maricle, 2014; Bhatt et al., 2015). Esto propicia condiciones de hipoxia (Dat et al., 2004) y, en consecuencia, una disminución en el metabolismo de la raíz causando daño al sistema radical de la planta. Lo anterior acompañado de la acumulación de fitotoxinas en el suelo como manganeso, hierro reducido, súlfidos y amonio, así como altas concentraciones de CO2 y etileno, causa senescencia prematura, clorosis y necrosis foliar, pérdida del rendimiento y hasta la muerte de la planta (Dell´Amico, Torrecillas, Rodríguez, Morales y Sánchez-Blanco, 2001; Lucassen et al., 2002; Bailey-Serres y Voesenek, 2008). Una reducción del O2 en el suelo por anegamiento genera una disminución en la tasa de respiración y limita así la producción de adenosín trifosfato (ATP) (Pardos, 2010). Por consiguiente, la respiración aeróbica bajo esta condición se ve limitada ocasionando acumulación de piruvato, lactato y etanol (Colmer et al., 2006) y desencadena una serie de efectos fisiológicos y metabólicos en las plantas (Bailey-Serres y Voesenek, 2008).
La primera respuesta de las plantas a condiciones de anegamiento es el cierre de sus estomas, lo cual afecta los procesos de conductancia estomática y la asimilación de CO2 (King, Robinson y Cameron, 2012). Debido al cierre estomático, se reducen los procesos fotosintéticos en las plantas, tanto por la disminución de dióxido de carbono en el espacio intercelular, como por el desacople generado entre las dos fases de la fotosíntesis, aumentando la formación de especies reactivas de oxígeno y el daño a nivel de las membranas celulares y los fotosistemas. (King, Robinson y Cameron, 2012; Kissmann, Veiga, Eichemberg y Habermann, 2014). La disminución en el intercambio de gases acompañado de la limitación en la absorción de elementos esenciales como nitrógeno (N), fósforo (P) y potasio (K) como consecuencia de cambios en el pH y relaciones iónicas en el suelo bajo condiciones de anegamiento, afectan el crecimiento y desarrollo de la planta (Banach et al., 2009; Baracaldo et al., 2014; Moreno y Fischer, 2014; Nyman y Lindau 2016).
Sin embargo, las especies tolerantes tienen la capacidad de responder al anegamiento sobreviviendo y creciendo bajo esta condición, debido a diferentes factores que incluyen adaptaciones de tipo fisiológicas, morfológicas y anatómicas (Kreuzwieser et al., 2009). Entre los procesos más reportados en la literatura científica se encuentra la rápida disminución de la conductáncia estomática, aumentando el uso eficiente del agua (Du, Xu, Wu, Tu y Zheng, 2012), la formación de hojas epinásticas y la inducción de raíces adventicias (Aldana, García y Fischer, 2014; Yetisir, Caliskan, Soylu y Sakar, 2006) y la acumulación de osmolitos compatibles para realizar ajuste osmótico (Du et al., 2012; Voesenek y Serres, 2013).Otro mecanismo de aclimatación consiste en la rápida degradación de las clorofilas para evitar la absorción excesiva de energía lumínica y por ende el daño en el fotosistema II (PSII) (Du et al., 2012).
Las seis especies nativas arbóreas y arbustivas seleccionadas para la presente investigación se encuentran ampliamente distribuidas en la ciudad de Bogotá, representan el 6.4% del arbolado urbano (70 968 plantas). A la fecha se encuentran establecidos 3607 árboles de Ficus tequendamae, 15 616 árboles de Quercus humboldtii, 7561 árboles de Junglas neotropica, 1624 arbustos de Dalea coerulea, 29 423 arbustos de Dodonaea viscosa y 13 137 arbustos de Senna viarum (Sigau, 2018).
Las especies seleccionadas tienen gran potencial en diferentes áreas. A nivel ambiental son usadas en repoblamiento forestal, restauración de tierras degradadas, protección de nacimientos, enriquecimiento de hábitat, corredores lineales, corredores multiestrato, corredores riparios, puntos de paso, controladores de la erosión y restauración ecológica (Tullah, Hussain y Ibrar, 2010; Paz, 2012; Pérez, Villalba y Almanza, 2013; Campoe et al., 2014; Rowshan, Farhadi y Najafian, 2014). En la economía tienen usos en la industria maderable, generación de productos medicinales, alimenticio (forraje), además de tener propiedades antimicrobianas, antimicóticas e insecticidas (Kamdem et al., 2012; Hussain et al., 2013; Mostafa et al., 2014; Ali et al., 2014).
En la actualidad existe poca información sobre la respuesta de estas especies a diferentes condiciones ambientales limitantes para su desarrollo (Glenz, Lougulescu, Kienast y Schalaepfer, 2008; Almeida, Pinto, Correia, Santos y Concalves, 2013; Hill, Guerin, Hill y Watling, 2014; Sepulveda, Diez, Moreno, León y Osorio, 2014; Corcobado, Cubera, Juárez, Moreno y Solla, 2014). No obstante, la información multidisciplinaria que se ha realizado entorno a estas especies, la generación de nuevo conocimiento, permitirá obtener información sobre la selección de árboles. Si se desea hacer una transición del arbolado urbano de la ciudad a una estructura forestal urbana más estable y resistente a los efectos del calentamiento global, este es un aspecto importante para los que toman las decisiones (Quintero y Jaramillo, 2012; Sghaier-Hammami et al., 2013; McPherson et al., 2018).
El objetivo de la investigación fue conocer la respuesta fisiológica a nivel del estado hídrico, el comportamiento fotosintético y la pérdida de electrolitos de seis especies arbóreas nativas de Colombia a diferentes periodos de anegamiento, para que sean usadas en el arbolado urbano de la ciudad de Bogotá e identificar marcadores fisiológicos que permitan seleccionar especies arbóreas tolerantes a dichas condiciones.
MATERIALES Y MÉTODOS
El ensayo se realizó en una parcela experimental bajo condiciones semicontroladas en el vivero La Florida (7º43’34”N y 74º06’00”O, 2640 m de altitud) del Jardín Botánico de Bogotá José Celestino Mutis, ubicado en la localidad de Engativá, Cundinamarca. Allí se registró una temperatura diurna promedio de 21.8°C, humedad relativa promedio de 58% y temperatura de suelo promedio de 23.4°C.
Se seleccionaron seis especies nativas, tres arbóreas (Quercus humboldtii, Juglans neotropica y Ficus tequendamae) y tres arbustivas (Dalea coerulea, Dodonaea viscosa y Senna viarum) proporcionadas por el vivero La Florida. Se utilizaron 140 plantas por especie, las cuales se encontraban en estado juvenil y en buenas condiciones fitosanitarias.
Las plantas de las seis especies se dejaron durante 20 días en proceso de aclimatación a las condiciones del semitecho y se generaron cuatro niveles de estrés por anegamiento: 7, 14, 21 y 28 días de anegamiento (dda). El anegamiento se generó en tres camas de 10 m de longitud, 1 m de ancho y 0.6 m de profundidad. Las camas fueron permeabilizadas con plástico negro y llenadas con agua potable. El nivel del agua siempre se mantuvo 10 cm por encima de la superficie del suelo de las plantas, que se ubicaron en las camas en sus respectivas bolsas de trasplante. El suelo contenido en las bolsas de trasplante tenía las mismas características físico-químicas en todos los tratamientos evaluados: presentaba una textura franco arcillosa y un contenido de carbono orgánico de 4.6%. Los muestreos se realizaron de forma aleatoria en cuatro plantas por tratamiento, con diferencial número de hojas analizadas dependiendo del tipo de parámetro a medir.
Estado hídrico de las plantas
Para determinar el estado hídrico de las plantas se realizó mediciones del contenido relativo de agua (CRA), tomando tres muestras por planta de cuatro plantas por tratamiento. Las muestras fueron retiradas de las plantas y pesadas inmediatamente, lo cual se registró como el peso fresco (PF). Posteriormente, se colocaron en una cámara húmeda para que el tejido llegase a su capacidad máxima de hidratación y se tomó el peso de saturación 24 horas después (PSat). Luego de tomar este peso, la muestra se ubicó en una bolsa de papel y fue llevada al horno por 36 horas a 80°C, donde posteriormente se tomó el peso seco (PS). Con los valores de los tres pesos anteriores se utilizó la siguiente fórmula para conocer el contenido relativo de agua de las plantas: CRA= (PF-PS)/(PSat-PS) x100 (Liu, Shahanzari y Andersen, 2005).
Respuesta fotosintética
Las variables fisiológicas para determinar el intercambio gaseoso de las plantas fueron tasa fotosintética (A) y conductancia estomática (gs). Se utilizó una densidad de flujo fotónico diferencial para cada una de las especies evaluadas de acuerdo a los puntos de saturación generados en las curvas de luz. Se midió la fluorescencia de la clorofila a, determinando la eficiencia máxima del PSII (Fv/Fm), oscureciendo las hojas con bolsas de papel aluminio durante 60 minutos y realizando las mediciones bajo condiciones de oscuridad. Estas mediciones se realizaron en tres hojas por planta de cuatro plantas por tratamiento, en hojas desarrolladas y completamente expandidas del tercio medio. Tanto el intercambio gaseoso como la fluorescencia de la clorofila a fueron determinados con un IRGA GFS-3000 (Portable Gas Exchange-Fluorescence System).
Pérdida de electrolitos
Este parámetro se midió a partir de 10 discos con un diámetro de 2.5 mm de hojas del tercio medio de las plantas, que fueron lavadas con agua desionizada para remover los electrolitos adheridos a la superficie. Los discos de hoja se colocaron en tubos falcon con 4 ml de agua desionizada a temperatura ambiente. La conductividad eléctrica (CE) fue determinada a las 22 horas usando un conductivímetro (HI 9835, HANNA instruments). Después de la medición de las 22 horas la muestra se calentó a 90°C por 15 minutos y se determinó la CE, tomando este valor como la máxima pérdida de electrolitos. Los valores de CE presentados se expresaron como porcentaje respecto al mayor valor mediante la fórmula PE= (EC1/EC2)X100, donde PE= % de pérdida de electrolitos; EC1= pérdida de electrolitos a las 22 horas; EC2= pérdida de electrolitos después de calentar a 80°C (Rodríguez et al., 2005).
Análisis estadístico
Se realizaron pruebas de supuestos de normalidad (Shapiro-Wilk) y de homogeneidad de varianzas. Así mismo, la prueba de comparación múltiple de Tukey con un nivel de confianza del 95% (P ≤ 0.05) con el software estadístico Statistical Analysis System (SAS®) versión 9.2.
RESULTADOS
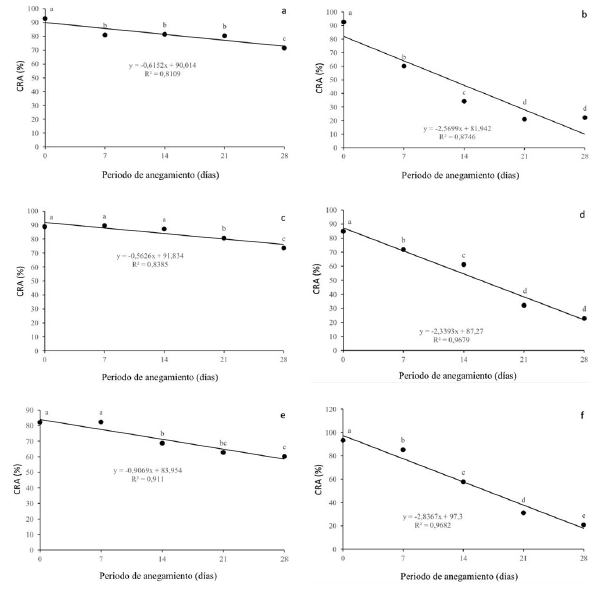
El contenido relativo de agua (CRA) varió diferencialmente de acuerdo a la especie y al nivel de estrés. Para Q. humboldtii (figura 1a), el CRA disminuyó ligera pero significativamente desde los 7 dda hasta los 21 dda, presentó una disminución significativamente mayor a los 28 dda y alcanzó un CRA del 71% al momento de mayor estrés. F. tequendamae (figura 1c) presentó un comportamiento similar a la especie anterior, disminuyendo su CRA ligeramente y solo con diferencias significativas hasta los 21 y 28 dda, alcanzando valores del 73% a los 28 dda. J. neotropica (figura 1b) disminuyó drásticamente el CRA, alcanzando valores del 22% a los 21 y 28 dda, con diferencias significativas en su disminución entre los 0 y los 21 dda. Este parámetro presentó una disminución en D. coerulea (figura 1d) a medida que el nivel de estrés era mayor, presentando valores del 22% a los 28 dda. Para D. viscosa (figura 1e), el CRA se vio ligeramente disminuido sin diferencias estadísticas a los 7 dda y presentando un valor del 60% al momento de mayor estrés. El CRA presentó una gran disminución en S. viarum (figura 1f) con diferencias significativas entre todos los momentos de estrés con respecto al control, llegó a valores cercanos al 20% a los 28 dda.
Figura 1: Efecto de diferentes periodos de anegamiento sobre el contenido relativo de agua (CRA) en plantas de (a) Q. humboldtii, (b) J. neotropica, (c) F. tequendamae, (d) D. coerulea, (e) D. viscosa, (f) S. viarum. Promedios seguidos de letras iguales no presentan diferencias estadisticas de acuerdo con la prueba de Tukey (5%).
Intercambio gaseoso
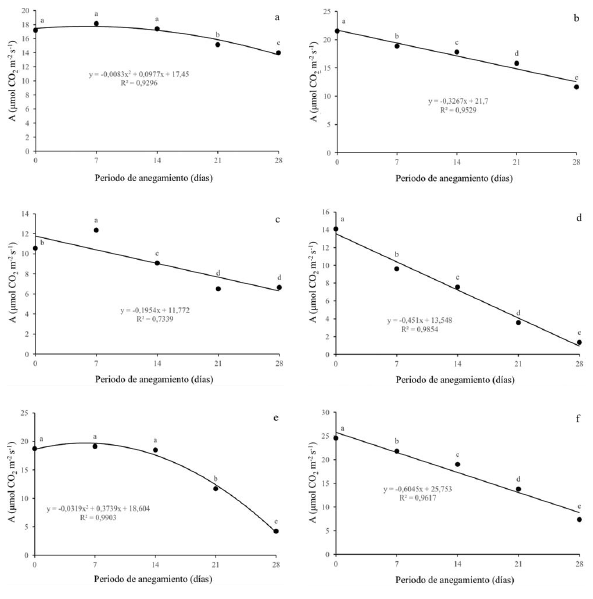
La fotosíntesis (A) presentó una ligera disminución para Q. humboldtii (figura 2a) variando desde 17 μmoles CO2 m-2s-1 hasta 14 μmoles CO2 m-2s-1, al momento de mayor estrés, con diferencias significativas. Para J. neotropica (figura 2b) se observó una disminución en la fotosíntesis, presentó diferencias estadísticas entre todos los niveles de estrés y redujo en un 50% su capacidad fotosintética a los 28 dda. Con respecto a F. tequendamae (figura 2c), se observó una disminución de la fotosíntesis a partir de los 14 dda y hasta los 28 dda con diferencias significativas con valores desde 11 hasta 6 μmoles CO2 m-2s-1. Con respecto a los arbustos, se pudo observar que hubo una mayor disminución en la tasa fotosintética comparado con los árboles, llegando a valores de 1 μmol CO2 m-2s-1 para D. coerulea (figura 2d) y de 4 μmoles CO2 m-2s-1 para D. viscosa (figura 2e). S. viarum (figura 2f) fue menos afectada, disminuyó su fotosíntesis hasta 7 μmoles CO2 m-2s-1. Tanto para D. coerulea como para D. viscosa se observaron diferencias significativas para todos los momentos de estrés, sin embargo, para S. viarum solo se presentó diferencias a partir de los 21 dda.
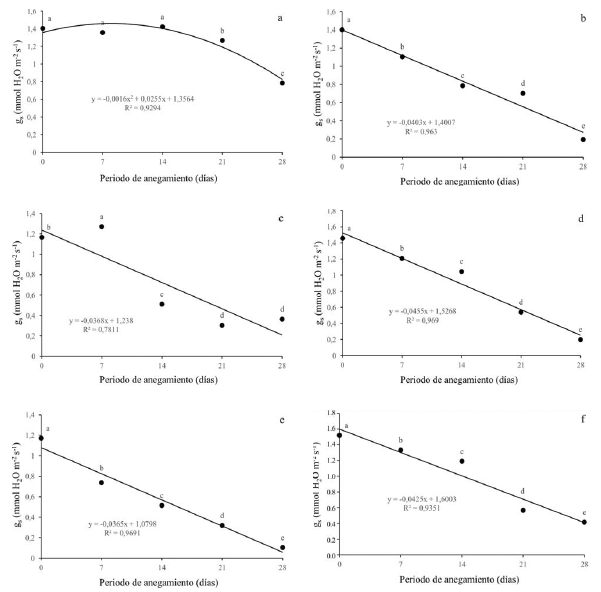
Con respecto a la conductancia estomática (gs), se presentó una disminución para todas las especies evaluadas a medida que el estrés aumenta. Para Q. humboldtii (figura 3a) y F. tequendamae (figura 3c), se presentaron diferencias estadísticas a partir de los 21 dda y los 14 dda respectivamente. Para J. neotropica (figura 3b), D. coerulea (figura 3d), D. viscosa (figura 3e) y S. viarum (figura 3f) se dieron diferencias estadísticas a partir de los 7 dda y en cada uno de los diferentes niveles de estrés por anegamiento. La conductancia estomática disminuyó drásticamente para todas las especies alcanzando valores de alrededor 0.2 mmoles H2O m-2s-1 en el momento de mayor estrés, excepto para Q. humboldtii, que presentó valores de 0.8 mmoles H2O m-2s-1 a los 28 dda.
Figura 2: Efecto de diferentes periodos de anegamiento sobre la tasa fotosintética (A) en plantas de (a) Q. humboldtii, (b) J. neotropica, (c) F. tequendamae, (d) D. coerulea, (e) D. viscosa, (f) S. viarum. Promedios seguidos de letras iguales no presentan diferencias estadísticas de acuerdo con la prueba de Tukey (5%).
Figura 3: Efecto de diferentes periodos de anegamiento sobre la conductancia estomática (gs) en plantas de (a) Q. humboldtii, (b) J. neotropica, (c) F. tequendamae, (d) D. coerulea, (e) D. viscosa, (f) S. viarum. Promedios seguidos de letras iguales no presentan diferencias estadísticas de acuerdo con la prueba de Tukey (5%).
Fluorescencia de la clorofila a
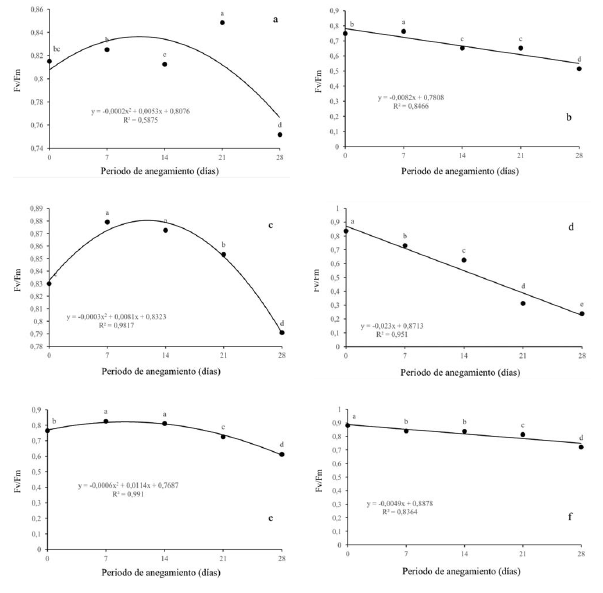
La eficiencia máxima del PSII disminuyó significativamente en todas las especies evaluadas a medida que se intensificaba la condición de estrés por anegamiento. Q. humboldtii (figura 4a), F. tequendamae (figura 4c) y S. viarum (figura 4f) disminuyeron Fv/Fm por debajo de 0.8 a los 28 dda (0.75, 0.79 y 0.72 respectivamente). Se evidenció una posible fotoinhibición dinámica. En contraste, J. neotropica (figura 4b) y D. viscosa (figura 4e) disminuyeron aún más la eficiencia máxima del fotosistema II, con valores de 0.51 y 0.61 para cada uno de ellas, mostraron daños fuertes en el PSII. Por último, la especie que manifestó más daño a nivel del aparato fotosintético fue D. coerulea (figura 4d), tuvo diferencias significativas entre todos los tratamientos llegando a valores de Fv/Fm de 0.24 a los 28 dda.
Figura 4: Efecto de diferentes periodos de anegamiento sobre la eficiencia máxima del PSII (Fv/Fm) en plantas de (a) Q. humboldtii, (b) J. neotropica, (c) F. tequendamae, (d) D. coerulea, (e) D. viscosa, (f) S. viarum. Promedios seguidos de letras iguales no presentan diferencias estadísticas de acuerdo con la prueba de Tukey (5%).
Pérdida de electrolitos
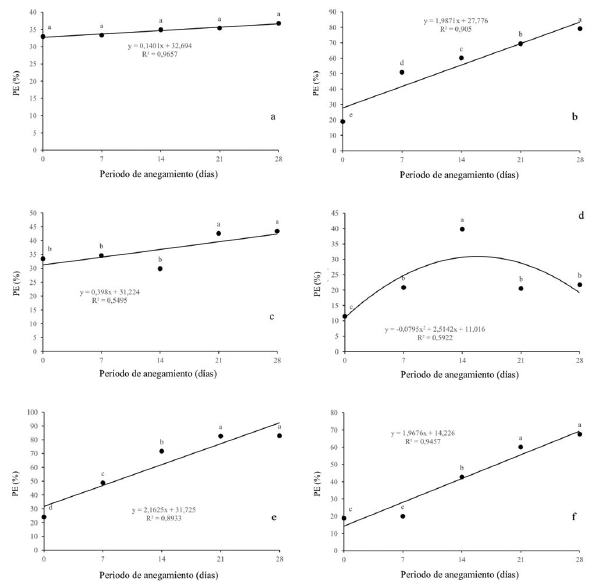
Con respecto a la pérdida de electrolitos se pudo evidenciar que no hubo diferencias estadísticas para Q. humboldtii (figura 5a). Para F. tequendamae (figura 5c), se presentó un leve aumento en la PE a partir de los 21dda. Con respecto a D. coerulea (figura 5d) se observó un aumento hasta los 14 dda pero la PE se disminuyó tanto a los 21 como a los 28 dda significativamente. Por otro lado, con respecto a J. neotropica (figura 5b), D. viscosa (figura 5e) y S. viarum (figura 5f), se presentó un aumento gradual con diferencias significativas entre los diferentes periodos de anegamiento, alcanzando valores superiores al 70 y 90% cuando las plantas fueron sometidas a 28 dda.
Figura 5: Efecto de diferentes periodos de anegamiento sobre la pérdida de electrolitos en plantas de (a) Q. humboldtii, b) J. neotropica, (c) F. tequendamae, (d) D. coerulea, (e) D. viscosa, (f) S. viarum. Promedios seguidos de letras iguales no presentan diferencias estadísticas de acuerdo con la prueba de Tukey (5%).
DISCUSIÓN
El CRA presentó una disminución significativa y severa para J. neotropica (figura 1b), D. coerulea (figura 1d) y S. viarum (figura 1f), el anegamiento para estas tres especies afectó el contenido de agua celular de las plantas, debido posiblemente a su incapacidad para retener y absorber las moléculas de agua y generó una pérdida de turgencia celular, lo que limita numerosos procesos en el metabolismo de las plantas (Azhar, Makihara, Naito y Ehara, 2018; Tan et al., 2018; Yan, Zhao, Cui, Han y Wen, 2018). Por otro lado, el contenido relativo de agua disminuyó en una proporción menor para las especies Q. humboldtii (figura 1a), F. tequendamae (figura 1c) y D. viscosa (figura 1e), posiblemente debido a los múltiples mecanismos que tienen estas especies para disminuir el potencial hídrico a nivel celular por medio de la síntesis de osmolitos compatibles como prolina, glicina betaína y azúcares solubles, intentando mantener un gradiente de potencial hídrico a favor de la toma de agua (Xiao-Shan y Jian-guo, 2009; MyeongWon y Setsuko, 2015).
Con respecto a los parámetros de intercambio gaseoso, se observó que la primera respuesta que tienen las seis especies a condiciones de anegamiento es el cierre estomático, el cual es gradual y se incrementa ante condiciones de mayor estrés. Para las seis especies se pudo evidenciar que la limitación estomática es la principal causa de la disminución de la fotosíntesis debido a que la planta para evitar la pérdida de agua al interior de sus células y tejidos genera el cierre estomático, lo cual impide, además de la salida de agua, la entrada de CO2, que es fundamental para los procesos fotosintéticos y por lo tanto la planta no tiene suficiente materia prima para la generación de carbohidratos (Rodríguez-Gamir et al., 2011; Duan et al., 2018; Yan et al., 2018); por esta razón, se puede mermar el crecimiento y desarrollo de la misma, al no poder acumular masa seca a través del tiempo (Baracaldo et al., 2014; Nyman y Lindau 2016; Sun, Xu, Zhang, Li y Yan, 2018).
La conductancia estomática se ve afectada por el cierre de estomas, lo que genera menor toma de agua y nutrientes por las plantas y finalmente disminuye la capacidad fotosintética de las mismas (King et al., 2012; Kissmann et al., 2014; Duan et al., 2018). Lo anterior está en concordancia con lo que afirman Anderson y Pezeshki (2001), que evidenciaron en dos especies de Quercus que bajo condiciones de anegamiento se disminuye la conductancia estomática y por ende la concentración de CO2 interno, esto afecta la tasa fotosintética en más de un 70%. También con los resultados mostrados por Corcobado et al. (2014), que demuestran que bajo condiciones de anegamiento la tasa fotosintética se puede reducir en más de un 50% en plantas de Quercus ilex, debido tanto a efectos de la limitación estomática como a efectos de la limitación no estomática, que genera acumulación de especies reactivas de oxígeno y, por ende, daño a nivel de membranas y fotosistemas (Benedetti, Ferreira y Fernandes, 2015; Sun et al., 2018).
La eficiencia máxima del PSII se vio realmente afectada por las condiciones de anegamiento, principalmente para D. coerulea (figura 4d). que disminuyó drásticamente evidenciando graves daños a nivel del PSII, posiblemente por per-oxidación de la proteína D1 y que seguramente no puede ser sintetizada a la misma o a mayor velocidad comparado con la degradación a la que está siendo sometida por el nivel de especies reactivas de oxígeno en esta especie (Ohnishi et al., 2005; Nishiyama, Allakhverdiev y Murata, 2006; Andrade, Dázio, Santos, Silva y Donizeti, 2018).
Los fotosistemas también se pueden ver afectados por la peroxidación lipídica de las membranas celulares afectando los procesos fotosintéticos y la respuesta de esta especie a condiciones de estrés. J. neotropica (figura 4b) y D. viscosa (figura 4e) redujeron en menor medida la eficiencia máxima del fotosistema II, con valores de 0.51 y 0.61 respectivamente, evidenciando que para 28 dda existen daños en el fotosistema que se pueden recuperar si la condición estresante se retira. Para las demás especies se observó una fotoinhibición dinámica, en la cual se evidenció una disminución de este parámetro por encima de 0.7, lo que indica que los fotosistemas rápidamente se están recuperando frente a las condiciones de estrés por una alta tasa de recambio en la proteína D1 del fotosistema II, como ha sido observado en otras investigaciones bajo condiciones de anegamiento (Pietrini, Chaudhuri, Thapliyal y Massacci, 2005; Guidi y Calatayud, 2014; Benedetti et al., 2015; Duan et al., 2018; Yan et al., 2018).
Por último, el aumento en el porcentaje de electrolitos sugiere un daño en las membranas cambiando su permeabilidad (González, Delgado, Zabaleta y Herrera, 2009). Este daño pudo ser causado por la pérdida de la capa de hidratación de la membrana o por la peroxidación de los lípidos causada por el aumento de ROS (Zhao et al., 2000; Simova-Stoilova, Demirevska, Petrova, Tsenov y Feller, 2009; Andrade et al., 2018), lo que permite mayor permeabilidad en sus membranas y, por consiguiente, mayor pérdida de electrolitos (González et al., 2009). En la figura 5 se puede observar que para la especie Q. humboldtii (figura 5a) no se presentó pérdida de electrolitos significativa para ningún momento de anegamiento, lo que significa que esta especie tolera muy bien la condición de estrés ya sea por una baja producción de especies reactivas de oxígeno (ROS) a nivel celular o una alta eficiencia en el control de estas ROS por medio de la síntesis y actividad de antioxidantes enzimáticos y no enzimáticos (Devkota y Kumar, 2010). Una tendencia similar se obtuvo en F. tequendamae (figura 5c), la cual no presentó un aumento significativo de pérdida de electrolitos sino hasta los 21 dda, los cuales permanecieron constantes a los 28 dda: una respuesta similar a Q. humboldtii.
Ahora bien, J. neotropica (figura 5b), D. viscosa (figura 5e) y S. viarum (figura 5f) presentaron un aumento gradual con diferencias significativas entre los diferentes periodos de anegamiento, alcanzando valores superiores al 70 y 90%. Esto señala que, aunque las plantas pueden tener algún mecanismo para impedir el daño a nivel de membranas celulares, este no es suficiente y si el factor estresante no es retirado posterior a los 28 dda posiblemente se genere un daño irreversible a nivel de las estructuras celulares.
CONCLUSIONES
De acuerdo a la respuesta fisiológica obtenida por medio de los diferentes parámetros evaluados se puede concluir que tanto Q. humboldtii como F. tequendamae, tienen una alta tolerancia a condiciones de anegamiento, debido a que no varía su contenido relativo de agua, no se afecta el estado del fotosistema II y no hay daño a nivel de membranas.
Especies como J. neotropica, D. viscosa y S. viarum, se pueden recomendar para zonas con altas precipitaciones, sin que el anegamiento sea una constante en la zona. Pese a que su recuperación tiende a ser rápida, tanto a nivel de fotosíntesis, conductancia estomática y estado del aparato fotosintético, las plantas de estas tres especies arbóreas presentaron el mayor daño a nivel de las membranas, seguramente por la mayor acumulación de especies reactivas de oxígeno y la menor actividad de enzimas antioxidantes.
No se recomienda el uso de la especie D. coerulea en zonas con altas precipitaciones y que tiendan a inundarse, debido a que, según el estudio, solo toleran 15 días de anegamiento y decrecen drásticamente parámetros como Fv/Fm. El anegamiento daña los fotosistemas y su recuperación es muy lenta. De acuerdo al estado actual del arbolado urbano de Bogotá, la especie D. coerulea es la que presenta menor número de individuos en la ciudad, con respecto a las otras especies evaluadas. Por este motivo, se sugiere que su establecimiento solo se realice en zonas que no sean inundables y, en lo posible, que no presenten un exceso en la precipitación.
Como se puede observar, las especies tolerantes a condiciones de anegamiento presentan un comportamiento similar con respecto a la protección de estructuras celulares como las membranas (pérdida de electrolitos) y los fotosistemas (Fv/Fm). Así pues, estos parámetros fisiológicos pueden ser usados como marcadores de tolerancia a condiciones de anegamiento en especies arbóreas.
REFERENCIAS
Licencia
Colombia Forestal conserva los derechos patrimoniales (copyright) de las obras publicadas, y favorece y permite la reutilización de las mismas bajo la licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional por lo cual se pueden copiar, usar, difundir, transmitir y exponer públicamente, siempre que:
Se reconozcan los créditos de la obra de la manera especificada por el autor o el licenciante (pero no de una manera que sugiera que tiene su apoyo o que apoyan el uso que hace de su obra).