DOI:
https://doi.org/10.14483/udistrital.jour.colomb.for.2013.2.a01Publicado:
01-07-2013Número:
Vol. 16 Núm. 2 (2013): Julio-DiciembreSección:
Artículos de investigación científica y tecnológicaImpacto de la fragmentación en la diversidad de plantas vasculares en bosques andinos del nororiente de Colombia
Impact of fragmentation on vascular plant diversity in an andean forest in northeastern Colombia
Palabras clave:
Andes, Colombia, fragmentación, heterogeneidad ambiental, plantas vasculares, predicción de la riqueza (es).Descargas
Referencias
Álvarez, E. (1997). Power Lines and Biodiversity in the Colombian Territory. In: Proceedings The Sixth International Symposium on Environmental Concerns in Rights-of-Way Management: 24-26 February 1997, New Orleans, Louisiana, USA. Oxford: Elsevier Science Ltd, (p. 343-352).
Álvarez, E. (2009). Oportunidades para la conservación de la biodiversidad en proyectos de desarrollo en Colombia. Revista Eólo, 14, 161-182.
Arroyo-Rodríguez, V., Pineda, E., Escobar, F. & Benítez-Malvido, J. (2009). Value of small patches in the conservation to plant-species diversity in highly fragmented rainforest. Conservation Biology 23,729–739.
Ås, S. (1999). Invasion of matrix species in small habitat patches. Conservation Ecology [online] 3(1), 1. Available from the Internet. URL: http://www.consecol.org/vol3/iss1/art
Barthlott, W., Mutke, J. & Kier, G. (2000). BIOMAPS - Biodiversity mapping for protection and sustainable use of the natural resources. Botanisches Institute uns Botanischer Garten. Rheinische Friederich – Wilhems – Universität Bonn. Absteilung Systematik und Biodiversität. Documento de Internet, sitio Web: http://www.botanik.uni-bonn.de/system/biomaps.html.
Bierregaard, R.O., Lovejoy, T.E., Kapos, V., Dos Santos, A.A. & Hutchings, R.W.. (1992). The biological dynamics of tropical rainforest fragments. A prospective comparison of fragments and continuous forest. BioScience, 42(11), 859-866.
Boone, R.B. & Krohn, W.B. (2000). Predicting broad-scale occurrences of vertebrates in patchy landscapes. Landscape Ecology 15, 63-74.
Brunig, E.F.(1973). Species richness and stand diversity in relation to site and succession of forest in Sarawak and Brunei (Borneo). Amazoniana, 3, 293-320.
Burnett, M.R., August, P.V., Brown, J.H., & Killingbeck, K.T. (1998). The Influence of Geomorphological Heterogeneity on Biodiversity. I. A Patch-Scale Perspective. Conservation Biology, 12(2), 363-370
Cagnolo, L., Cabido, M, & Valladares, G. (2006). Plant species richness in the Chaco Serrano Woodland from central Argentina: Ecological traits and habitat fragmentation effects. Biological Conservation, 132, 510–519.
Cavalier, J. (1997). Selvas y bosques montanos: En: Chaves, M.E. & Arango, N. Diversidad biológica de Colombia. Tomo 1. Isbn: 958-96529-1-3. p. 38.55.
Cherrill, A.J., McClean, C., Watson, P., Tuckers, K, Rushton, S.P. & Sanderson, R. (1995). Predicting the distribution of plant species at the regional scale: a hierarchical matrix model. Landscape Ecology, 10(4), 197-207.
Connell, J. (1978). Diversity in tropical rain forests and coral reefs. Science, 199, 1302–1310
Corlett, R.T. & Turner, I.M. (1997). Long-term survival in tropical forest remmnats in Singapore and Hong Kong. En: Laurance, W. F. & Bierregaard, R. O. Tropical Forest Remnants: Ecology, Management and Conservation of Fragmented communities. Chicago: University of Chicago. p. 333-346.
Cowling, R.M. & Samways, M.J. (1995). Predicting patterns of endemic plant species richness. Biodiversity Letter, 2, 127-131
Debinski, D.M. & Holt, R.D. (2000). A survey and Overview of habitat fragmentation experiments. Conservation biology, 14(2), 342-355.
De Toledo, J. J., Magnusson, W.E., Castilho, C.V., Nascimento, H. E. M. (2011). How much variation in tree mortality is predicted by soil and topography in Central Amazonia?. Forest Ecology and Management, 262, 331–338
Dinerstein, E., Olson, D.M., Graham, D.J., Webster, A. L., Primm, S.A., Bookbinder, M.P. & Ledec, G. (1995). A conservation assessment of the terrestrial ecoregions of Latin America and the Caribbean. The World Bank, Washington, 1995. 129 p.
Duivenvoorden, J.F. (1994). Vascular plant species counts in the rain forests of the midlle Caquetá, area, Colombian Amazonia. Biodiversity and Conservation, 3, 685-715.
Dzwonko, Z. & Loster, S. (1988). Specie richness of small woodlands on the western Carpathian foothills. Vegetation, 76, 15-27.
Dzwonko, Z. & Loster, S. (1989). Distribution of vascular plant species in small woodlands on the Western Carpathian foothills. Oikos, 56, 77-86.
Echeverría, C., A. C. Newton, A. Lara, J. M. Rey-Benayas, & D. Coomes. (2007). Impacts of Forest fragmentation on species composition and forest structure in the temperate landscape of southern Chile. Global Ecology and Biogeography, 16, 426–439.
Forman, R. T. T. (1995). Land mosaics. The ecology of landscapes and regions. Cambridge: Cambridge Univ. Press, 632 p. ISBN 052 1474620.
Fotogrametría Analítica Ltda (FAL). (1995). Mapa digital de coberturas y uso actual de los suelos en los municipios del altiplano del oriente antioqueño. Santa Fe de Bogotá: MASORA – CORNARE, p. 208
Fox, J. W. (2013). The intermediate disturbance hypothesis should be abandoned. Trends in Ecology & Evolution February, Vol. 28, No. 2
Franco-Roselli, P., Betancur, J. & Fernández-Alonso, J.L. (1997). Diversidad florística en dos bosques subandinos en el sur de Colombia. Caldasia, 19(1-2), 205-234
Frohn, R. C. (1998). Remote sensing for landscape ecology. New metrics indicators for monitoring, modeling, and assessment of ecosystems. Boston: Lewis, 99p. + Figure. ISBN 1-56670-275-5.
Gale, N. (1997). The relationsnship of canopy gaps and topography in a western Ecuadorian rainforest. En: Gale, N. Modes of tree death in four tropical forests, Ph.D. thesis, Faculty of Natural Sciences, University of Aarhus, Denmark.
Galeano, G., Suárez, S. & Balslev, H. (1998). Vascular plant species count in a wet forest in the Chocó area on the Pacifica coast of Colombia. Biodiversity and Conservation, 7,
-1575.
Gentry, A.H. (1986). Species richness and floristic composition of Chocó region plant communities. Caldasia, 15(71/75): 71-92.
Gentry, A. & Dodson, C. (1987). Contribution of nontrees to species richness of a tropical rain forest. Biotropica, 19(2), 149-156.
Gibson, L., Lynam, A. J., Bradshaw, C. J.A., He, F., Bickford, D. P., Woodruff, D. S., Bumrungsri, S. & Laurance, W.F. 2013. Near-Complete Extinction of Native Small Mammal Fauna 25 Years After Forest Fragmentation. Science, 341 (6153), 1508-1510. [DOI:10.1126/science.1240495]
Givnish, T. J. (1999). On the causes of gradients in tropical tree diversity. Journal of Ecology, 87, 193-210.
Gómez-Mora, A.M., Anaya, J.A., Álvarez-Dávila, E. 2005. Análisis de fragmentación de los ecosistemas boscosos en una región de la cordillera central de los andes colombianos. Revista Ingenierías Universidad de Medellín, 4(7), 413-27. Disponible en: http://www.redalyc.org/articulo.oa?id=75004702. Consultado el 17 de noviembre de 2013.
Gould, W. & Walker, M.D. (1999). Plant species and landscape diversity along an artic river. Journal of Vegetation Science, 10, 537-538
Grant, V. (1989). Especiación vegetal. México: Noriega, 587 p. ISBN 0 231 05112 3.
Ferraz, G., Russell, G.J., Stouffer, P.C., Bierregaard, R.O., Pimm, S.L., & Lovejoy, T.E. (2003). Rates of species loss from Amazonian forest fragments. Proc. Natl. Acad. Sci., 100, 14069–14073.
Hall, B. J. & Swaine, M. D. (1981). Distribution and ecology of vascular plants in a tropical rain forest: forest vegetation in Ghana. Junk, The Hague.
Halley, J.M., Sgardeli, V., & Monokrousos, N. (2013). Species-area relationships and extinction forecasts. Ann N Y Acad Sci.,1286, 50–61. Published online 2013 May 14. doi: 10.1111/nyas.12073.
Hanski, I., Zurita, G.A., Bellocq, M.I., Rybicki, J. (2013). Species–fragmented area relationship. Proc Natl Acad Sci., 110(31), 12715–12720. Published online 2013 July 15. doi: 10.1073/pnas.1311491110
Heywood, V.H., Mace, G.M., May, R.M., & Stuart, S.N. (1994). Uncertainties in extinction rates. Nature, 368,105.
Helliwell, D.R. (1976). The effects of size and isolation on the conservation value of wooded sites in Britain. Journal of Biogeography, 3, 407-416.
Honnay, O., Endels, P., Vereecken, H., & Hermy, M. (1999a). the role of patch area and habitat diversity in explaining native plant species richness in disturbed suburban forst patches in northern Belgium. Diversity and Distributions, 5, 129-141.
Honnay, O., Hermy, M., & Coppin, P. (1999b). Impact of habitat quality on forest plant species colonization. Forest Ecology and Management, 115(2-3), 157-170.
Hulshoff, R. (1995. Landscape indices describing a Dutch landscape. Landscape Ecology 10(2), 101-111
Instituto Geografico Agustin Codazzi. IGAC - COLOMBIA. (1979). Suelos del Departamento De Antioquia.
Iverson, L.R. & Prasad, A. (1998). Estimating regional plant biodiversity with GIS modelling. Diversity and Distributions, 4, 49-61.
Jacquemyn, H., Butaye, J. & Hermy, M. (2001). Forest plant species richness in small, fragmented mixed deciduous forest patches: the role of area, time and dispersal limitation. Journal of Biogeography, 28(6), 801-812.
Kellman, M. (1996). Redefining roles: plant community reorganization and species preservation in fragmented ecosystems. Global ecology and Biogeography Letters, 5, 111-116.
Kerr, J. T. (1999). Weal links: “Rapoport´s rule” and large-scale species richness paterns. Global Ecology and Biogeography, 8, 47-54.
Laurance, W. F. et al. (2011).The fate of Amazonian forest fragments: A 32-year investigation. Biological Conservation, 144, 56-67.
Laurance, W. F. & Bierregaard, R. O. Tropical Forest Remnants: Ecology, Management and Conservation of Fragmented communities. Chicago: University of Chicago, 1997. p. xi-1.
Lawton, J.H. (1999). Are there general laws in ecology? Oikos, 84, 177-192.
Loreau, M. & Mouquet, N. (1999). Immigration and the maintenance of local species diversity. The American Naturalist, 154(4), 427-440.
McGarigal, K. & Marks, B.J. (1995). Fragstats: Spatial pattern analysis program for quantifying landscape structure, Version 2.0, Oregon State University, Corvallis.
Newton, A.C., Cayuela, L., Echeverría, C., Armesto, J. J., Del Castillo, R. F., Golicher, D., Geneletti, D., Gonzalez-Espinosa, M., Huth, A., López-Barrera, F., Malizia, L., Manson, R., Premoli, A., Ramírez-Marcial, N., Rey Benayas, J.M., Rüger, N., Smith-Ramírez, C., & Williams-Linera, G. (2009). Toward integrated analysis of human impacts on forest biodiversity: lessons from Latin America. Ecology and Society, 14(2), 2. [online] URL: http://www.ecologyandsociety.org/vol14/iss2/art2/
Nichols, W.F., Killingbeck, K.T. & August, P.V. (1998). The Influence of Geomorphological Heterogeneity on Biodiversity. II. A landscape perspective. Conservation Biology, 12( 2), 371-379.
Parsons, R.F., & Cameron, D.G. (1974). Maximum plant species diversity in terrestrial communities. Biotropica, 6, 202–203.
Phillips, O.L., Hall, P., Gentry, A.H., Sawyer, S.A., & Vazquez, R. (1994). Dynamics and species richness of tropical rain forests. Proceedings of the National Academy of Sciences, 91, 2805-2809.
Priego-Santander, A., Moreno-Casasola, P., Palacio-Prieto, J.L., Lópes-Portillo, J-L. & Geissert-Kientz, D. (2003). Relación entre la heterogeneidad del paisaje y la riqueza de especies de flora en cuencas costeras del estado de Veracruz, México. Investigaciones Geográficas, Boletín del Instituto de Geografía, UNAM, 52, 31-52.
Rangel, T.F.L.V.B, Diniz-Filho, J.A.F & Bini, L.M. (2010) SAM: a comprehensive application for Spatial Analysis in Macroecology. Ecography, 33, 46-50.
Rodhe, K. (1992). Latitudinal gradients in species diversity: the search for the primary cause. Oikos, 65, 514-527.
Shafer, C.L. (1995). Values of shortcomings of small reserves. Bioscience, 45, 80-88.
Shmida, A. & Wilson, M.W. (1985). Biological determinants of species diversity. Journal
of Biogeography, 12, 1-20.
Siemman, E., Tilman, D., Haarstad, J. & Ritchie, M. (1998). Experimental test of the dependence of arthropod diversity on plant diversity. The American Naturalist, 152(5), 738-750.
Slik, J.W. F., Aiba, S-I, Brearley, F.Q., Cannon, C.H., Forshed, O., Kitayama, K., Nagamasu, H., Nilus, R., Payne, J., Paoli, G., Poulsen, A.D., Raes, N., Sheil, D., Sidiyasa, K., Suzuki, E., & Van Valkenburg, J. L. C. H. (2010). Environmental correlates of tree biomass, basal area, wood specific gravity, and stem density gradients in Borneo tropical forests. Glob Ecol Biogeogr, 19, 50–60.
Smith, A. P. (1988). Does correlation of Elevation with plant taxonomic richness vary with latitude?. Biotropica, 20(3): 259-261.
Tischendorf, L. & Fahrig, L. (2000). On the usage ande measurement of landscape connectivity. Oikos, 90, 7-19.
Turner, I. M. & Corlett, R. T. (1996). The conservation of small, isolated fragments of lowland tropical rain forest. TREE, 11(8), 330-333.
Weaver, M. & Kellman, M. (1981). The effects of forest fragmentation on woodland tree biotas in Southern Ontario. Journal of biogeography, 8, 199-210
Viana V.M., Tabanez A.J. & Batista, J.L. (1997). Dynamics and restoration of forest fragments in the Brazilian Atlantic forest. In: Laurence W.F. & Bierregaard R.O. Jr. (eds) Tropical Forest Remnants:Ecology, Management, and Conservation of Fragmented Communities. University of Chicago Press, Chicago, Illinois, pp. 351–365.
Webb, L. J., Tracey, J. G., Williams, W.T. & Lance. G. N. (1967). Studies in the numerical analysis of complex rain forest communities: I. A comparison of methods applicable to site/species data. Journal of Ecology, 55, 171-191.
Whitmore, T. C. (1997). Tropical forest disturbance, Disappearance, and species loss. En: Laurance, W. F. & Bierregaard, R. O. Tropical Forest Remnants: Ecology, Management and Conservation of Fragmented communities. Chicago: University of Chicago, p. 3-12.
Whitmore, T. C., Peralta, R. & Brown, K. (1985). Total species count in a Costa Rican rainforest. Journal of Tropical Ecology, 1, 375-378.
Wohlgemuth, T. (1998). Modelling floristic species richness on a regional scale: a case study in Switzerand. Biodiversity and Conservation, 7, 159-177.
Yepes-Quintero, A.P., Jaramillo-Restrepo, S.L., Del Valle-Arango, J.I., & Orrego-Suáza, S.A. (2007). Diversidad y composición florística en bosques sucesionales andinos de la región del río Porce, Colombia. Actual Biol., 29(86), 107-117.
Zacharias D., & Brandes, D. (1990). Species area-relationships and frequency – Floristical data analysis of 44 isolated woods in northwestern Germany. Vegetatio, 88, 21-29.
Zelený, D., Li, C.F. & Chytry, M. (2010). Pattern of local plant species richness along a gradient of landscape topographical heterogeneity: result of spatial mass effect or environmental shift?. Ecography, 33, 578 -589. doi: 10.1111/j.1600-0587.2009.05762.x
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
IMPACTO DE LA FRAGMENTACIÓN EN LA DIVERSIDAD DE PLANTAS VASCULARES EN BOSQUES ANDINOS DEL NORORIENTE DE COLOMBIA
Impact of fragmentation on vascular plant diversity in an andean forest in northeastern Colombia
Título corto: Fragmentación y diversidad de plantas vasculares
Alexandra Duque1, Esteban Álvarez2, Wilson Rodríguez3, Álvaro Lema4
1Departamento de Biología, Universidad de Antioquia. duque66@hotmail.com
2Laboratorio de Servicios Ecosistémicos y Cambio Climático, Jardín Botánico de Medellín. esalvarez3000@gmail.com, esalvarez@isa.com.co
3Departamento de Ciencias Forestales, Universidad Nacional de Colombia. djlema@perseus.unalmed.edu.co
4Herbario Joaquín Antonio Uribe de Medellín. Jardinbo@epm.net.co
Recepción: 20 de octubre de 2013 / Aprobación: 18 de noviembre de 2013
RESUMEN
Analizamos la relación entre variables a escala del paisaje (área del fragmento, forma, conectividad, altitud, contraste de borde, tipo de bosque, etc.) y la riqueza de plantas vasculares en un bosque andino del norte de Colombia. Con base en un mapa de vegetación escala 1:10.000, seleccionamos 39 fragmentos al azar (de un total de 700), y en cada uno de ellos establecimos al menos una parcela de 200 m2 donde se contó el número total de especies de plantas vasculares. La muestra estuvo constituida por fragmentos entre 1 ha y 840 ha, distribuidos en un gradiente altitudinal entre los 1800 m de altitud y 2800 m de altitud. En las 60 parcelas establecidas (1,2 ha en total) encontramos 108 familias, 259 géneros y 556 especies de plantas vasculares, lo que demuestra la alta biodiversidad que pueden albergar los bosques fragmentados de los Andes. La riqueza de especies estuvo entre 34 y 74 por parcela de 200 m2. El análisis mostró que las variables individuales más relacionadas con la riqueza de especies (de acuerdo con el coeficiente r de Pearson) son el área total del fragmento (r = 0,43, p<0,001, n = 60), el área central del fragmento (r = 0,49, p<0,001, n = 60) y el contraste de borde del fragmento (r = - 0,48, p<0,001, n = 60). Finalmente, construimos diferentes modelos de regresión múltiple que explican hasta el 32,6 % de la variación de la riqueza de especies de cada fragmento. Discutimos la utilidad del modelo para la identificación de prioridades de conservación a pequeña escala.
Palabras clave: Andes, Colombia, fragmentación, heterogeneidad ambiental, plantas vasculares, predicción de la riqueza.
ABSTRACT
We analyse the relationship between landscapescale variables (fragment area, shape, connectivity, altitude, edge contrast, forest type, etc.) and vascular plant richness in an Andean forest of northern Colombia. Using a vegetation map at a scale of 1:10000, we randomly selected 39 fragments (from a total of 700) in each of which we established a 200 m2 plot where we counted the total number of species of vascular plants. The sample consisted of fragments of between one ha and 840 ha at altitudes of between 1800 and 2800 m. In the 60 plots (1,2 ha in total) we found 108 families, 259 genera and 556 species of vascular plants. Species richness varied between 34 and 74 per 200 m2 plot. The analysis showed that the individual variables most closely related to species richness (according to the Pearson r coefficient) are the total area of the fragment (r = 0,43, p <0,001, n = 60), the central area of the fragment (r = 0,49, p <0,001, n = 60) and the fragment edge contrast (r = - 0,48, p <0,00, n = 60). Finally, we built multiple regression models to explain up to 32,6 % of the variation in species richness of each fragment. We discuss the usefulness of these models for the identification of small scale conservation priorities.
Keywords: Andes, Colombia, fragmentation, environmental heterogeneity, vascular plants, richness prediction.
INTRODUCCIÓN
La fragmentación y la deforestación representan una de las principales amenazas para la biodiversidad tropical (Ferraz et al., 2003; Laurance et al., 2011; Gibson et al., 2013). No obstante, un gran número de estudios relacionados con el efecto de la fragmentación en la estructura y función de los ecosistemas naturales confirman que los paisajes fragmentados pueden albergar una gran diversidad biológica (Kellman, 1996; Turner & Corlett, 1996; Debinski & Holt, 2000; Echeverría et al., 2007; Arroyo-Rodríguez et al., 2009; Newton et al., 2009).
Existen evidencias de que áreas remanentes relativamente pequeñas permiten la sobrevivencia de un gran número de especies, principalmente de invertebrados, plantas, hongos y pequeños vertebrados; adicionalmente, estos fragmentos pueden actuar como puentes para el movimiento y la dispersión de las especies entre áreas mejor conservadas (Dinerstein et al., 1995; Shafer, 1995; Turner & Corlett, 1996; Arroyo-Rodríguez et al., 2009). Por tanto, los remanentes de ecosistemas nativos que persisten en los paisajes fragmentados constituyen una herramienta valiosa para la preservación de especies y comunidades nativas, particularmente en regiones como la andina, que se caracteriza por altos niveles de diversidad. No obstante, existe muy poca información que permita establecer claramente el potencial que tienen los fragmentos para la conservación biológica en muchas áreas tropicales (Arroyo-Rodríguez et al., 2009).
Algunos estudios muestran que las variables de los fragmentos que se pueden medir con sensores remotos como el área, la conectividad y la heterogeneidad del hábitat pueden ser indicadores valiosos de la riqueza de especies (Nichols et al., 1998; Wohlgemuth, 1998; Burnett et al., 1998; Bastin &Tohmas, 1999; Honnay et al., 1999a, 1999b; Cagnolo et al., 2006; Arroyo-Rodríguez et al., 2009). En esta investigación se pone a prueba la hipótesis de que la riqueza de plantas vasculares en paisajes fragmentados de bosques andinos está relacionada con algunas características de fácil medición como el área, la forma y en general la configuración espacial de los fragmentos en bosques andinos.
El trabajo se llevó a cabo en el municipio de El Retiro (altiplano del oriente de Antioquia, Colombia), una región del norte de los Andes que ha sido sometida durante las últimas décadas a intensos procesos de deforestación, pero que alberga todavía una gran proporción de bosque nativo distribuido en fragmentos de diferente tamaño y grado de perturbación (Gómez-Mora et al., 2005). El estudio se enmarca dentro de los trabajos de un convenio de investigación realizado entre la Interconexión Eléctrica S.A. (ISA) y el Jardín Botánico de Medellín (JAUM), en la década pasada como parte del Programa de Biodiversidad de ISA (Álvarez 1997; 2009).
MATERIALES Y MÉTODOS
ÁREA DE ESTUDIO
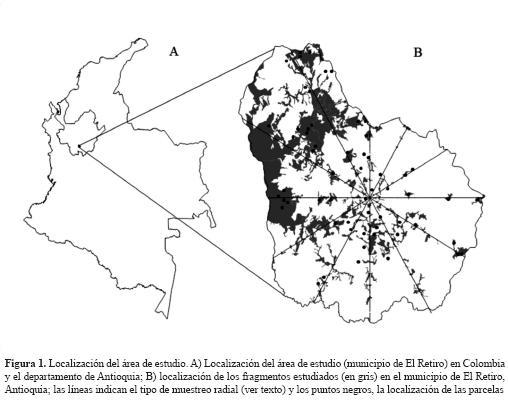
La investigación se llevó a cabo en una zona del altiplano del oriente antioqueño, entre 1800 m de altitud y 2800 m de altitud, en el municipio de El Retiro y parte de La Ceja (figura 1), a unos 40 km de la ciudad de Medellín (Antioquia, Colombia). En la región, la precipitación promedia anual está entre 2100 mm y 2300 mm, y la temperatura entre 17 oC y 19 oC (FAL, 1995). Las coordenadas del centro del área de estudio son 6° 3’ 10" N y 75° 30’ 21" O. La zona pertenece a la Cordillera Central e incluye el batolito antioqueño, constituido por granodioritas cuya edad parece estar ubicada entre el Cretáceo medio y superior (IGAC, 1979); está recubierta en su mayor parte por una capa espesa de cenizas volcánicas que constituyen el material de origen de sus suelos.
METODOLOGÍA
Selección de los fragmentos
Sobre un mapa digital de cobertura vegetal actualizado al 2003, que cubre un área aproximada de 270 km2, se seleccionó un punto central de referencia —punto de partida. A partir de este punto, se proyectaron 12 líneas en forma radial, con ángulos iguales de 30°. Posteriormente se seleccionaron 39 de los fragmentos (al azar restringido) que fueron cruzados por estas líneas como se muestra en la figura 1. De acuerdo con clasificaciones previas (FAL, 1995), los fragmentos seleccionados corresponden a bosques primarios con baja, media o alta intervención, debido a la extracción selectiva de madera y leña.
Variables a escala del paisaje de los fragmentos
En total se seleccionaron 39 fragmentos de los cuales 5 fueron considerados con baja intervención, 1 con media intervención y 33 con alta intervención; para la definición de estas categorías, se tuvieron en cuenta observaciones cualitativas de la cobertura del dosel y la presencia de senderos de ganado. Mediante aerofotografías con fechas entre los años 1960-1975, se verificó que todos los fragmentos son representativos de la cobertura boscosa original de la región. Para cada fragmento se midieron diferentes variables mediante el programa FRAGSTATS (McGarigal & Marks, 1995), el cual permite efectuar análisis de métrica del paisaje. Se consideran en total 11variables explicatorias agrupadas en tres clases (las fórmulas de cada variable se presentan en el anexo 1):
- Variables relacionadas con la geometría de los fragmentos y el paisaje: área total (Área en ha) y central (ÁreaC en ha) del fragmento, forma del fragmento (Fract), conectividad (Conec en m), vegetación que circunda el fragmento o contraste de borde (ConBor). Variables físicas como altitud de la parcela (Altitud en m de altitud), precipitación (Prec en mm/año), longitud de los drenajes dentro del fragmento (LonDre) y las pendientes longitudinal (PenLo) y transversal (PenTr) de cada parcela.
- Una variable indicadora del estado de conservación del fragmento (Pert).
Inventarios de la diversidad de plantas vasculares en cada fragmento
En los 39 fragmentos se establecieron 60 levantamientos de vegetación en parcelas de 4 X 50 m, donde se recolectaron muestras botánicas para identificar todas las especies de plantas vasculares presentes. 14 parcelas se establecieron en bosques de baja intervención; 3 parcelas, en bosques de media intervención, y 43, en bosques de alta intervención.
Las parcelas se ubicaron dentro de cada fragmento, dependiendo de la accesibilidad, pero con el fin de evitar el efecto de borde. El levantamiento de las parcelas y la identificación de las colecciones botánicas fueron realizados por el equipo de inventarios del Convenio ISA-JAUM, con la participación del primer autor. Para la identificación de las especies se trabajó con el concepto de especie taxonómica sensu (Grant, 1989). Los géneros y las familias sin identificar se trataron como diferentes y se incluyeron dentro de los cálculos de riqueza; se indicó el número de cada uno de estos. La identificación de las colecciones y la separación en morfoespecies se realizaron en el herbario JAUM del Jardín Botánico Joaquín Antonio Uribe de Medellín. Todas las colecciones se encuentran depositadas en el herbario JAUM bajo los códigos de colección de Alexandra Duque y Wilson Rodríguez.
PROCESAMIENTO DE LA INFORMACIÓN
Descripción de la riqueza y la composición de especies de plantas
La riqueza se presenta con base en las curvas de número de taxa (especies, géneros y familias) con respecto al área acumulada. Esas curvas se construyeron con el programa Estimate´s, versión 8.2 (viceroy.eeb.uconn.edu/estimates/). Para ilustrar la composición se elaboraron tablas y figuras que muestran las familias, los géneros y las especies con mayor importancia ecológica. Los resultados se comparan con otros estudios disponibles en la literatura.
Evaluación del efecto de variables del paisaje
Con la información obtenida en el campo se procedió a elaborar una base de datos que incluye el número de la parcela, variables de los fragmentos (área, contraste de borde, dimensión fractal, un índice de conectividad, etc.) y la riqueza de especies por parcela. La base de datos está disponible mediante solicitud por correo electrónico al autor de correspondencia o al primer autor. Cada una de estas variables tiene diferentes unidades de medida y para efectos del análisis de regresión múltiple, fueron transformadas en su logaritmo natural + 1, e inducida la normalidad en los datos, un requisito de la técnica de regresión lineal (Echeverría et al., 2007).
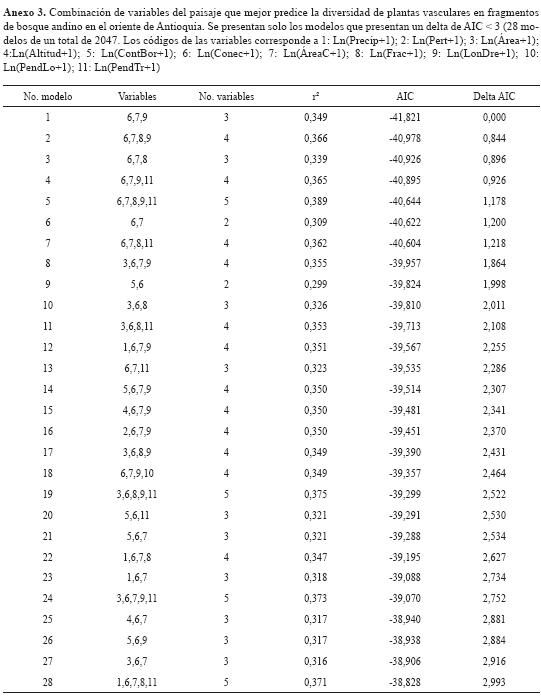
Se hicieron análisis de correlación (r de Pearson) para identificar la relación entre la riqueza de especies y las variables de los fragmentos. Con el objetivo de encontrar las combinaciones de variables del fragmento que mejor explican la riqueza de especies se efectuó un análisis de selección de modelos con base en el criterio de información de Akaike (AIC) con el programa SAM, versión 4.0 (Rangel et al., 2010). Este método permite calcular modelos de regresión múltiple para todas las posibles combinaciones de variables; en el presente caso, usando 11 variables predictoras para predecir la riqueza de especies, construimos 2047 modelos; estos se ordenan ascendentemente a partir del de menor AIC. De acuerdo con algunos autores, los modelos con diferencia en AIC < 3 son apropiados para determinar la importancia de las variables explicativas mediante su frecuencia de aparición en los modelos (Slik et al., 2010).
Para cada uno de los modelos seleccionados se determinaron las ecuaciones de regresión múltiple por medio de la técnica de mínimos cuadrados ordinarios con el fin de encontrar los de mejor calidad estadística, considerando que todas las variables aportarán significativamente al modelo (p < 0,05) y evitando incluir en el mismo modelo variables altamente correlacionadas (correlación de Pearson r > 0,7) (anexo 2).
RESULTADOS
Riqueza de especies y composición florística
En las 60 parcelas (1,2 ha) se encontraron 108 familias, 259 géneros y 556 especies. La curva especies-área sugiere que se puede esperar la inclusión de un mayor número de especies nuevas con el incremento en el área de muestreo (figura 2). Este resultado muestra la gran riqueza de especies que contienen los fragmentos de bosques altoandinos cuando se considera el total de las plantas vasculares.
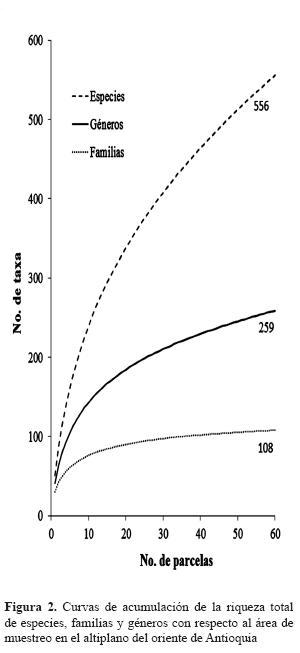
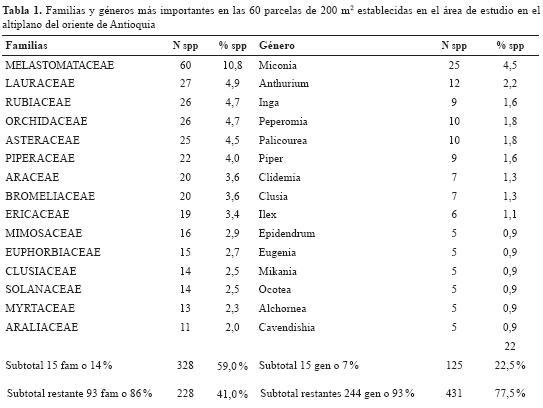
Las familias y los géneros más importantes se muestran en la tabla 1; la composición de especies es típica de los bosques andinos de Colombia, con dominancia de las familias Melastomataceae, Lauraceae, Rubiaceae, Orchidaceae, Asteraceae, Piperaceae, Araceae y Bromeliaceae y los géneros Miconia, Anthurium, Inga, Peperomia, Palicourea y Piper (tabla 1). Se identificaron hasta especie únicamente el 51% de las excicatas. El restante 45 % fue identificado hasta género y el 4 %, solo hasta familia.
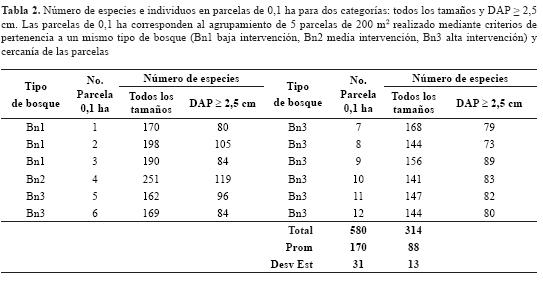
El número de especies por parcela de 200 m2 estuvo entre 34 y 74, con un promedio de 52 (± 10). Para efectos de la comparación con otros estudios, las parcelas de 200 m2 se agruparon en unidades de 0,1 ha de acuerdo con el tipo de bosque y la cercanía de las parcelas (ver tabla 2). Los resultados muestran que los bosques del altiplano pueden tener hasta 119 especies/0,1 ha para DAP ≥ 2,5 ha y 251 especies/0,1 ha de plantas vasculares de todos los tamaños.
RELACIÓN ENTRE LAS VARIABLES DEL PA ISAJE Y LA RIQUEZA DE ESPECIES
El análisis preliminar muestra que el área total, el área central, el contraste de borde del fragmento y la longitud del drenaje son las variables que presentan una mayor correlación con la riqueza de especies (figura 3). Este resultado está de acuerdo con diferentes estudios (Helliwell, 1976; Zacharias & Brandes, 1990; Dzwonko & Loster, 1989; Weaver & Kellman, 1981; Echeverría et al., 2007, Arroyo-Rodríguez et al., 2009). La riqueza de especies fue explicada por 28 modelos con un delta de AIC < 3, y estuvo relacionada más frecuentemente con la conectividad (Conec), el área central (ÁreaC) y la longitud de drenaje (LonDre) (tabla 3).
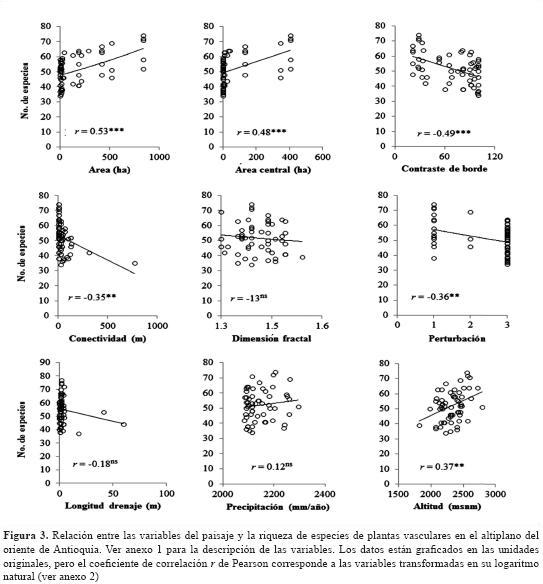
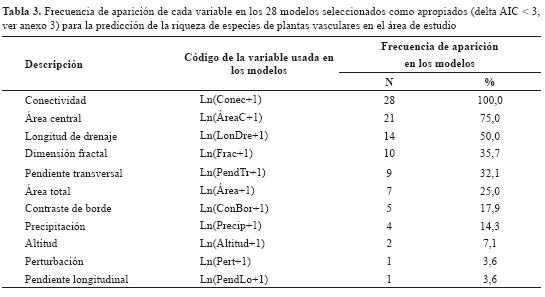
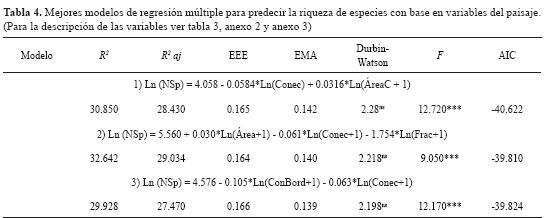
Para cada uno de los 28 modelos se realizó un análisis de regresión múltiple con el método de mínimos cuadrados, y se seleccionaron aquellos que cumplieron con todos los criterios estadísticos. Solo 3 modelos (de 28) cumplen con estos criterios y explican en general un 30% de la variación en la riqueza de especies (tabla 4). Se encontró que solo 3 combinaciones de variables (ÁreaC-Conec, Área-Conec-Frac y ConBor-Conec) generaron modelos predictivos que cumplen todos los criterios del análisis de regresión lineal múltiple y explican entre el 29,9% y el 32,6% de la variación en la riqueza de especies (tabla 4).
DISCUSIÓN
COMPOSICIÓN FLORÍSTICA Y RIQUEZA DE ESPECIES
El rango de la riqueza de especies de plantas leñosas DAP ≥ 2,5 cm en parcelas de 0,1 en el altiplano de Rionegro (105-73) está dentro del rango reportado para bosques montanos neotropicales entre 2000 m de altitud a 3000 m de altitud (120-124 especies), pero es superior al promedio ± (62 ± 27) para toda la región, y a los promedios reportados para Colombia (81 ± 26), México (36 ± 7), Costa Rica (45 ± 21) y Perú (65 ± 25) (Gentry, 1993). En la figura 4 se presenta una comparación de la riqueza total en parcelas de 0,1 ha en el altiplano de Rionegro en comparación con otros estudios de tierras bajas tropicales.
Los resultados que se resumen en esta figura indican que la riqueza del altiplano de Rionegro es superior a algunos reportes de Australia y Asia, similar a algunas de las parcelas del Chocó, pero inferior a los reportes para la Amazonia colombiana. Las familias y los géneros dominantes en este estudio coinciden con las familias reportadas con mayor número de especies para la región andina entre los 2000 m de altitud y los 2900 m de altitud (Gentry, 1993).
RELACIÓN ENTRE LAS VAR IABLES DEL PA ISAJE Y LA RIQUEZA DE ESPECIES
Efecto del área
La relación entre el área de los fragmentos y la riqueza de especies ha sido reportada frecuentemente en la literatura (Helliwel, 1976; Weaver & Kellman, 1981; Dzwonko & Loster, 1988, 1989; Nichols et al., 1998; Honnay et al., 1999a, 1999b; Zacharias & Brandes, 1990; Echeverría et al., 2007; Arroyo-Rodríguez et al., 2009). El efecto proporcional del área en la riqueza es explicado por el aumento en la heterogeneidad ambiental representada en la cantidad y la variedad de los hábitats que posibilitan la coexistencia de un mayor número de especies (Honnay et al., 1999).
El aumento del número de especies con el área ha sido estudiada por décadas y es considerada como una ley fundamental en ecología de comunidades (Ås, 1999). Sin embargo, algunos estudios no han encontrado esta relación e, incluso, han podido verificar un efecto contrario (ver revisión en Debinski & Holt, 2000). En el caso de los bosques del oriente de Antioquia, se encontró una relación significativa de la riqueza de especies con el área total (Área) y central delfragmento (ÁreaC) (figura 3 y anexo 2); esta última contribuyó mayormente en los modelos de regresión múltiple (tabla 4).Una variable que se relaciona también con la heterogeneidad ambiental es la longitud de los drenajes (LonDre) dentro del fragmento, ya que aumenta la variación en microclimas, disturbios naturales y condiciones del suelo (Zelený et al., 2010) y puede influir positivamente en la riqueza de especies, como en el caso del presente estudio.
Contraste de borde
Las comunidades naturales están sometidas a la influencia de áreas adyacentes y uno de los efectos más importantes es la dispersión; el flujo de individuos desde áreas donde las especies son favorecidas por las condiciones del medio hacia áreas menos favorables se denomina efecto de masa (EM) (Shmida & Wilson, 1985; Zelený et al., 2010).
El efecto del contraste de borde, observado en los bosques del oriente de Antioquia, indica que la riqueza de especies se reduce a medida que los fragmentos están rodeados por mayor proporción de potreros, y está de acuerdo con la hipótesis de Shmida & Wilson (1985). No obstante, es improbable una influencia aislada del EM como la muestra la relación positiva de esta variable con la intensidad de la perturbación (Pert) y negativa con el área central del fragmento (anexo 2).
Conectividad
En un sentido amplio, la conectividad se puede definir como el grado en el cual el paisaje facilita o impide el movimiento de los organismos y, por tanto, la dispersión de las especies entre fragmentos (Tischendorf & Fahrig, 2000). En el presente estudio se midió cómo la distancia promedia entre parches del mismo tipo (McGarigal & Marks, 1995) y los resultados indican qué tiene un efecto inverso en la riqueza de especies. Esto significa que el grado de aislamiento de un fragmento condiciona la tasa de inmigración de especies hacia su interior, lo que se reconoce como uno de los determinantes básicos para la persistencia de la riqueza local de especies (Loreau & Mouquet, 1999).
La tasa de inmigración depende de dos clases de variables; el primer grupo de variables se relaciona con la estructura del paisaje (por ejemplo, el área circundante que pueda contener emigrantes potenciales y el grado de perturbación de esta área). El segundo grupo de variables se relaciona con la capacidad de respuesta de los organismos (por ejemplo, el tamaño de la población y la capacidad de dispersión) (Tischendorf & Fahrig, 2000).
Efecto de la altitud
El efecto de la altitud en la riqueza de especies de plantas leñosas en los trópicos está bien documentado (ver Smith, 1988; Givnish, 1999). En el caso concreto de los Andes, Gentry (1988) muestra, con base en 11 sitios con altitudes entre 1500 m de altitud y 3100 m de altitud, una tendencia clara de decrecimiento en diversidad con el aumento de la altitud. Givnish (1999) plantea que este patrón está relacionado con la reducción en la disponibilidad de nutrientes en zonas altas y con otra gran variedad de factores, que incluyen la reducción del área total disponible y la reducción en el tamaño y la complejidad de la vegetación.
Por otra parte, existen otros estudios que muestran variaciones de este patrón. Por ejemplo, Cavalier (1997) muestra algunos casos donde se presentan curvas en forma de campana con un incremento en el número de especies leñosas a partir de los 1000 m de altitud, con lo que se alcanza un máximo de especies entre los 2000 m de altitud y los 2500 m de altitud, aunque este caso concreto (Cavalier, 1997) parece ser el producto de la presencia en un mismo transecto de bosques secos y húmedos, y no representa una excepción a la regla general de disminución de especies con el incremento de la altitud (Cavalier, 1997), sugiere que existen una gran variedad de factores que pueden afectar los patrones de riqueza de especies en gradientes altitudinales, incluyendo las actividades humanas.
Aunque no existen datos concretos publicados, se puede afirmar que la deforestación en la región de los Andes se produjo inicialmente en la franja entre los 1000 m de altitud a los 2000 m de altitud, donde se redujo el bosque original a pequeños fragmentos y se preservaron los de mayor área y mejor estado de conservación en la parte más alta de las montañas, como en Yepes-Quintero et al. (2007). Este parece ser el caso en el altiplano del oriente de Antioquia, donde se presenta una relación positiva entre el tamaño del fragmento y el incremento en la altitud (figura 3, anexo 2).
Otras variables
Algunos estudios sugieren que el efecto positivo de la pendiente en la riqueza de especies de los fragmentos de bosque puede estar relacionado con dos factores. En primer lugar, las altas pendientes incrementan la cantidad y la heterogeneidad de microhábitats, lo que permite la coexistencia de una mayor cantidad de especies (Burnett et al., 1998; Zelený et al., 2010). En segundo lugar, los resultados de otros trabajos sugieren un efecto positivo entre la riqueza de especies y las altas tasas de mortalidad de árboles (Phillips et al., 1994), lo que a su vez puede estar relacionado con mayores pendientes (Gale, 1997; De Toledo et al., 2011). Sin embargo, en el presente estudio no se observó ningún efecto de las pendientes en la riqueza de especies, debido posiblemente a que casi la totalidad de las parcelas estuvieron ubicadas en zonas de alta pendiente.
Nuestros resultados muestran que los bosques con baja intervención tienen un mayor número de especies que los bosques mediana y altamente intervenidos (figura 3, anexo 2). Este resultado está en contra de la hipótesis de perturbación intermedia, la cual establece que la riqueza de especies debe ser máxima en áreas con alteraciones ambientales o disturbios que se presentan con frecuencia intermedia (Conell, 1978). Sin embargo, recientemente se ha propuesta que esta hipótesis debe ser abandonada ya que pocas veces los estudios teóricos o empíricos la confirman (Fox, 2013).
Por último, la forma de los parches influye en la proporción entre especies propias del interior y las especies de borde y claros (Forman, 1995). Algunos estudios muestran que una forma irregular del parche produce un efecto positivo en el número total de especies en los fragmentos (Honnay et al., 1999a; 1999b). No obstante, los resultados encontrados en el altiplano del oriente contradicen los reportes anteriores; concretamente, para el caso de la riqueza de especies en el total de la muestra, el modelo de regresión indica que los fragmentos que tienen una mayor área central (ÁreaC) y una forma más regular (Frac) pueden contener un mayor número de especies.
COMPARACIÓN CON OTROS ESTUDIOS DE FRAGMENTACIÓN
Debinski & Holt (2000) agrupan las investigaciones sobre el efecto de la fragmentación del hábitat en tres grandes temas: a) estudios de observación de paisajes fragmentados, b) estudios teóricos del efecto de la fragmentación en comunidades naturales y c) manipulaciones experimentales de paisajes fragmentados. El presente estudio se ajusta al primer tema; en los tres casos existen reportes sobre la posibilidad de predecir la riqueza de especies con base en variables del paisaje, especialmente el área. Generalmente los estudios de "observación" coinciden con los estudios teóricos fundamentados en la teoría biogeográfica de islas, en la que variables como el área, la edad y algunas medidas simples de la heterogeneidad del hábitat son indicadoras de la riqueza de especies de plantas en fragmentos de bosque.
Aunque no son muchos los trabajos que cuantifican la relación entre la heterogeneidad del paisaje y la diversidad biológica en los Andes, los reportes existentes para diferentes regiones sugieren que en las escalas local e intermedia, las áreas con mayor número de especies dentro de una región están asociadas con grados altos de heterogeneidad ambiental (Cherrill et al., 1995; Wohlgemut, 1998; Burnett et al., 1998; Gould & Walker, 1999).
La mayor parte de los estudios que relacionan la riqueza de especies de plantas con variables ambientales se basan en la "observación de paisajes fragmentados". Los alcances de estos análisis varían en escalas que van desde lo local, cuando se considera el efecto de variables relacionadas con las características espaciales de los fragmentos (Helliwel, 1976; Weaver & Kellman, 1981; Dzwonko & Loster,1988, 1989; Nichols et al., 1998; Honnay et al., 1999a, 1999b; Zacharias & Brandes, 1990; Arroyo-Rodríguez et al., 2009; este estudio); pasando por escalas regionales, donde se analizan variables relacionadas con la heterogeneidad de los componentes del paisaje (Wolgemuth, 1998; Iverson & Prassad, 1998; Priego-Santander et al., 2003); hasta escala continental y mundial, donde se evalúan variables relacionadas con los gradientes espaciales y ambientales (Gentry, 1988; Cowling & Samways, 1995).
Concretamente, los estudios que relacionan la riqueza de especies con variables de los fragmentos son relativamente escasos y han sido realizados, en su mayoría, en las zonas templadas (tabla 5) (Helliwel, 1976; Weaver & Kellman, 1981; Dzwonko & Loster, 1988, 1989; Zacharias & Brandes, 1990; Nichols et al., 1998; Honnay et al., 1999a, 1999b).

Estos estudios se basan en muestras que incluyen la totalidad de las especies presentes en los fragmentos, esto solo es posible en las regiones templadas debido a la escasa diversidad que albergan sus ecosistemas en comparación con las regiones tropicales; por ejemplo, Dzwonko & Loster (1989); Honnay et al. (1999a) y Zacharias & Brades (1990) reportan un máximo de ha 50 especies de plantas vasculares nativas en fragmentos de 10 ha localizados en Bélgica, Rumania y Alemania, respectivamente; un valor muy bajo comparado con el promedio de 55 (+-11) especies en parcelas de 200 m2 y con las 556 especies encontradas en la muestra de 1,2 ha en el altiplano del oriente de Antioquia.
Por ejemplo, se encontraron pocos estudios similares (plantas vasculares contra variables del fragmento) para las regiones tropicales (Arroyo-Rodríguez et al., 2009). La variación en la riqueza de especies en fragmentos, explicada por los diferentes modelos en la tabla 5, comprende desde el 27% (Helliwell, 1976) al 85% (Dzwonko & Loster, 1989). El área es la variable significativa que se presenta con mayor frecuencia en los modelos con excepción de Helliwell (1976). En otros casos, el área no predice adecuadamente la riqueza total de especies, pero sí la de ciertos grupos funcionales (Echevarría et al., 2007), o pierde poder explicativo a medida que aumenta la intensidad de los disturbios (Arroyo-Rodríguez et al., 2013).
Paradójicamente, algunos de los resultados obtenidos de los estudios de observación para predecir el efecto de las variables del paisaje en la riqueza de especies, difieren de los obtenidos en los estudios experimentales (Debinski & Holt, 2000). Por ejemplo, en los estudios revisados por los anteriores autores, solo en el 47% de los casos (9 de 19) se presentó una respuesta positiva entre el área y la diversidad de aves, primates, mariposas, miriápodos, ranas, insectos y gasterópodos. Respuestas negativas se presentaron para plantas, escarabajos y pequeños. Adicionalmente, en los dos estudios donde se analizó si la conectividad incrementaba la riqueza de especies, se obtuvieron respuestas positivas con aves (para migrantes neotropicales) e insectos y una respuesta negativa para las especies "transeúntes".
En el altiplano del oriente, la contribución positiva de la heterogeneidad topográfica (representada por la longitud del drenaje LonDre) sugiere que la heterogeneidad ambiental es un factor que determina en alguna proporción la riqueza de especies en los fragmentos de bosque (ver tabla 3), lo cual ha sido reportado en otros estudios (Burnett et al., 1998; Honnay et al. 1999a, 1999b; Zelený et al., 2010). No obstante, el aporte de la conectividad indica que otras variables de orden biológico influyen en forma también significativa de acuerdo con la teoría del efecto de las tasas de inmigración en la persistencia de la diversidad local de especies (Loreau & Mouquet, 1999).
Cuando se consideran los modelos de regresión múltiple, se observa una reducción de la riqueza con la distancia a los fragmentos más cercanos (Conec) y el contraste de borde (ConBor), el cual es compensado con un efecto positivo del área de los fragmentos (Área y ÁreaC), de acuerdo con la mayoría de los estudios revisados.
La tendencia a una menor riqueza cuando se evalúa el efecto del hábitat (por ejemplo, nivel de perturbación; figura 3) sugiere que otras variables no medidas en este estudio, como el tiempo transcurrido desde la fragmentación, pueden contribuir a explicar la variación en la riqueza de especies. Existen reportes de algunos casos donde ni el área ni la edad de los fragmentos pueden explicar de manera independiente la variación en la riqueza de especies, y donde otros procesos como la dispersión pueden ser condicionantes importantes de la composición florística de las comunidades vegetales (Jacquemyn et al., 2001).
APLICACIÓN DE LOS RESULTADOS
La persistencia de las especies y su relación con las variables propias de los paisajes fragmentados es uno de los componentes más complejos de la diversidad biológica y, al mismo tiempo, uno de los menos explorados (Boone & Krohn, 2000). Actualmente se reconoce que el éxito de cualquier esfuerzo de conservación de la diversidad y de los procesos ecológicos con los que se relaciona, requiere de una aproximación a escala del paisaje.
En la literatura ecológica de las últimas décadas se encuentra una gran cantidad de estudios (Lawton, 1999) que pretenden evaluar el potencial que tiene la heterogeneidad ambiental para explicar los efectos de la fragmentación en los procesos espaciales y temporales de la biodiversidad. En general, los estudios realizados a escalas medias (o mesoescalas) sugieren que la mayoría de las áreas ricas en especies dentro de una región son aquellas con un alto grado de heterogeneidad ambiental (Gould & Walker, 1999; Zelený et al., 2010). Con base en la interpretación de estos patrones, se pueden desarrollar aproximaciones para el establecimiento de prioridades de conservación de la biodiversidad (Arroyo-Rodríguez et al., 2009).
Los modelos que predicen la riqueza de especies a partir de variables obtenidas con sensores remotos, como los desarrollados en el presente estudio, pueden ser empleados para la identificación de prioridades de conservación a escala local, especialmente mediante la identificación de áreas que puedan albergar el mayor número posible de especies con base en la configuración y la composición de los fragmentos en el paisaje. Los resultados permiten, además, hacer algunas inferencias sobre los procesos ecológicos que se presentan al interior del paisaje (por ejemplo, los generados por la conectividad del paisaje) y sobre la importancia de preservar grupos de fragmentos (Hulshoff, 1995).
Algunos estudios que relacionan heterogeneidad ambiental con riqueza de plantas vasculares sugieren que es probable extrapolar el resultado a ciertos grupos faunísticos (Burnett et al., 1998). Debido a la dependencia de muchas especies animales de recursos específicos ofrecidos por las plantas, se reporta generalmente una relación positiva entre la diversidad de plantas y la diversidad de animales (Burnett et al., 1998; Siemman et al., 1998).
A escala mundial, es bastante ilustrativa la relación positiva reportada entre la riqueza de plantas vasculares y la riqueza de tetrápodos (r = 0,86, n = 124) y la riqueza de insectos (r = 0,91, n = 14) (Barthlott et al., 2000); y a escala local, la relación positiva entre diversidad de plantas y diversidad de artrópodos (Siemmen et al., 1998). De tal manera, es posible esperar que fragmentos con alta riqueza de plantas vasculares tengan una alta riqueza de ciertos grupos faunísticos en el altiplano del oriente. No obstante, considerando el alto grado de intervención de los bosques en el área de estudio, se deben realizar inventarios que permitan conocer con certeza el estado de conservación de las poblaciones faunísticas en el área.
La fragmentación es normalmente un evento instantáneo y dramático que genera procesos que teóricamente deben culminar con la exclusión de muchas de las especies presentes previamente en el ecosistema (Bierregaard et al., 1992; Turner & Corlett, 1996). No obstante, se conoce poco acerca de los patrones de extinción producidos por la reducción en el área y el aislamiento de las poblaciones de flora y fauna, y gran parte de los estudios se sustentan en predicciones basadas en la curva especies-área (Heywood et al., 1994; Halley et al., 2013; Hanski et al., 2013); solo recientemente se tienen evidencias empíricas del efecto negativo de la fragmentación sobre la sobrevivencia de ciertos grupos de especies (Gibson et al., 2013).
Afortunadamente, evidencias recientes sugieren que en algunos casos se puede encontrar una sobrevivencia de especies mucho mayor que la esperada de acuerdo con las predicciones a partir de modelos (Whitmore, 1997). Por ejemplo, Viana et al. (1997) destacan que aunque los bosques húmedos tropicales de la Costa Atlántica de Brasil han sido reducidos hasta un 8 % de su área original, no existen evidencias que documenten la extinción de especies en grupos como plantas vasculares, mamíferos, pájaros y mariposas.
Por su parte, Corlett & Turner (1997) encontraron que los bosques actuales de Singapur, que representan el 1,2% de su área original, contienen el 71% de las plantas vasculares conocidas en su área continental. Esto sugiere que muchas de las especies de los bosques tropicales pueden ser relativamente resistentes a la fragmentación, y que las predicciones pesimistas sobre la extinción producida por la reducción del área, la pérdida de polinizadores y de vertebrados dispersores de semillas pueden ser una exageración en el caso de ciertos grupos (Corlett & Turner, 1997). Sin embargo, la situación es diferente cuando se consideran otros grupos como las aves (Ferraz et al., 2003) o los mamíferos (Gibson et al., 2013).
Por último, es necesario mirar estos resultados con precaución. La mayor parte de los estudios recientes (Laurance & Bierregaard, 1997; Arroyo-Rodríguez et al., 2007) muestran diferentes grados de sobrevivencia de especies en fragmentos de bosque bajo diferentes conjuntos de factores. Las evidencias indican que los factores principales que garantizan la persistencia de las especies en fragmentos son el tamaño del fragmento, el grado de aislamiento, la frecuencia e intensidad de la perturbación humana y el tipo de vegetación circundante (Corlett & Turner, 1997; Whitmore, 1997). Lo único cierto es que se requieren más estudios sobre los procesos de pérdida de diversidad en fragmentos de bosque con el fin de identificar aquellas variables que puedan tener mayores efectos, y utilizar la información en programas de conservación.
CONCLUSIONES
La riqueza de especies de plantas a escala del paisaje en el altiplano del oriente de Antioquia está relacionada con la heterogeneidad ambiental (área, longitud de drenaje y contraste de borde) y con las posibilidades de dispersión de los organismos (conectividad). Los modelos encontrados pueden ser empleados para predecir la riqueza de especies con base en combinaciones de variables relacionadas con la forma y la localización de los fragmentos en el paisaje.
A pesar de la relación entre el tamaño de los fragmentos y la riqueza de especies, debemos reconocer que se requiere más información, si se considera que es difícil separar los efectos del área de todos los demás factores. Si comparamos el efecto del área con el del contraste de borde y la altitud, estos contra la heterogeneidad del hábitat, y adicionalmente consideramos los impactos antrópicos, se tiene un conjunto de variables demasiado complejo.
La ecología del paisaje ha sido utilizada para la planificación y el manejo en algunos países desde hace décadas, y es necesario que países como Colombia adopten urgentemente esta línea, ya que la gestión para conservar la biodiversidad se fundamenta cada vez más en el manejo de un mosaico de "parches" remanentes de los ecosistemas nativos originales. De acuerdo con los resultados encontrados en este estudio y la revisión de la literatura, es claro que variables como la conectividad y la matriz que rodean a cada fragmento afectan significativamente la riqueza y la probabilidad de extinción de muchas especies de plantas vasculares. Esto significa que para que la conservación sea efectiva, debe considerar el paisaje en su conjunto para llegar finalmente a una planeación regional eficiente.
La información sobre los patrones del paisaje y la diversidad puede ser utilizada en la gestión de conservación de la biodiversidad. Estas relaciones pueden ser utilizadas para identificar fragmentos que tengan una combinación de variables (área, conectividad, etc.) que garanticen la persistencia de un gran número de especies. Adicionalmente, muchos autores recomiendan la incorporación en estos análisis de la dinámica del uso del suelo con el objetivo de diseñar un sistema local eficiente de áreas protegidas.
AGRADECIMIENTOS
Interconexión Eléctrica y el Jardín Botánico de Medellín aportaron la financiación requerida para el desarrollo de la presente investigación. Recursos adicionales para el desarrollo de los análisis y la escritura del artículo fueron posibles gracias al convenio entre Colciencias y el Jardín Botánico de Medellín (JBMED) No. 393 del 2012. Zorayda Restrepo y Sebastián Gonzáles ayudaron a corregir las versiones preliminares de este texto.
REFERENCIAS BIBLIOGRÁFICAS
Álvarez, E. (1997). Power Lines and Biodiversity in the Colombian Territory. In: Proceedings The Sixth International Symposiumon Environmental Concerns in Rights-of-Way Management: 24-26 February 1997, New Orleans, Louisiana, USA (pp. 343-352). Oxford: Elsevier Science Ltd.
Álvarez, E. (2009). Oportunidades para la conservación de la biodiversidad en proyectos de desarrollo en Colombia. Revista Eólo, 14, 161-182.
Arroyo-Rodríguez, V., Pineda, E., Escobar, F., & Benítez-Malvido, J. (2009). Value of small patches in the conservation to plant-species diversity in highly fragmentedra in forest. Conservation Biology, 23,729-739.
Ås, S. (1999). Invasion of matrix species in small habitat patches. Conservation Ecology [online], 3(1), 1. Recuperado de http://www.consecol.org/vol3/iss1/art.
Barthlott, W., Mutke, J., & Kier, G. (2000). BIOMAPS-Biodiversity mapping for protection and sustainable use of the natural resources. Botanisches Institute uns Botanischer Garten. Rheinische Friederich-Wilhems-Universität Bonn. Absteilung Systematik und Biodiversität. Recuperado de http://www.botanik.unibonn.de/system/biomaps.html.
Bierregaard, R. O., Lovejoy, T. E., Kapos, V., Dos Santos, A. A., & Hutchings, R. W. (1992). The biological dynamics of tropical rainforest fragments. A prospective comparison of fragments and continuous forest. Bio-Science, 42(11), 859-866.
Boone, R. B., & Krohn, W.B. (2000). Predicting broad-scale occurrences of vertebrates in patchy landscapes. Landscape Ecology, 15, 63-74.
Brunig, E. F. (1973). Species richness and stand diversity in relation to site and succession of forest in Sarawak and Brunei (Borneo). Amazoniana, 3, 293-320.
Burnett, M. R., August, P. V., Brown, J. H., & Killingbeck, K. T. (1998).The influence of geomorphological heterogeneity on biodiversity. I. A patch-scale perspective. Conservation Biology, 12(2), 363-370.
Cagnolo, L., Cabido, M., & Valladares, G.(2006). Plant species richness in the Chaco Serrano Woodland from central Argentina: Ecological traits and habitat fragmentation effects. Biological Conservation, 132, 510-519.
Cavalier, J. (1997). Selvas y bosques montanos: En: M. E. Chaves & N. Arango. Diversidad biológica de Colombia. Tomo 1. ISBN: 95896529-1-3. p. 38.55.
Cherrill, A. J., Mc Clean, C., Watson, P., Tuckers, K., Rushton, S. P., & Sanderson, R. (1995). Predicting the distribution of plant species at the regional scale: a hierarchical matrix model. Landscape Ecology, 10(4), 197-207.
Connell, J. (1978). Diversity in tropical rain forests and coral reefs. Science, 199, 1302-1310.
Corlett, R.T., & Turner, I. M. (1997). Long-term survival in tropical forest remmnats in Singapore and Hong Kong. En: W. F. Laurance & R. O. Bierregaard. Tropical forest remnants: ecology, management and conservation of fragmented communities (pp. 333-346). Chicago: University of Chicago.
Cowling, R. M., & Samways, M. J. (1995). Predicting patterns of endemic plant species richness. Biodiversity Letter, 2, 127-131.
Debinski, D. M. & Holt, R. D. (2000). A survey and overview of habitat fragmentation experiments. Conservation biology, 14(2), 342-355.
De Toledo, J. J., Magnusson, W. E., Castilho, C. V., & Nascimento, H. E. M. (2011). How much variation in tree mortality is predicted by soil and topography in Central Amazonia? Forest Ecology and Management, 262, 331-338.
Dinerstein, E., Olson, D. M., Graham, D. J., Webster, A. L., Primm, S. A., Bookbinder, M. P., & Ledec, G. (1995). A conservation assessment of the terrestrial ecoregions of Latin America and the Caribbean. Washington: The World Bank. 129 p.
Duivenvoorden, J. F. (1994). Vascular plant species counts in the rain forests of the midlle Caquetá, area, Colombian Amazonia. Biodiversity and Conservation, 3, 685-715.
Dzwonko, Z., & Loster, S. (1988). Specie richness of small woodlands on the western Carpathian foothills. Vegetation, 76, 15-27.
Dzwonko, Z., & Loster, S. (1989). Distribution of vascular plant species in small woodlands on the Western Carpathian foothills. Oikos, 56, 77-86.
Echeverría, C., Newton, A. C., Lara, A., Rey-Benayas, J. M., & Coomes, D. (2007). Impacts of Forest fragmentation on species composition and forest structure in the temperate landscape of southern Chile. Global Ecology and Biogeography, 16, 426-439.
Ferraz, G., Russell, G. J., Stouffer, P.C., Bierregaard, R.O., Pimm, S. L., & Lovejoy, T. E. (2003). Rates of species loss from Amazonian forest fragments. Proc. Natl. Acad. Sci., 100, 14069-14073.
Forman, R. T. T. (1995). Land mosaics. The ecology of landscapes and regions. Cambridge: Cambridge University Press. ISBN: 052 1474620. 632 p.
Fotogrametría Analítica Ltda. (FAL). (1995). Mapa digital de coberturas y uso actual de los suelos en los municipios del altiplano del oriente antioqueño. Santa Fe de Bogotá: Masora-Cornare, p. 208.
Fox, J. W. (2013). The intermediate disturbance hypothesis should be abandoned. Trends in Ecology & Evolution February, 28(2).
Franco-Roselli, P., Betancur, J., & Fernández-Alonso, J. L. (1997). Diversidad florística en dos bosques subandinos en el sur de Colombia. Caldasia, 19(1-2), 205-234.
Frohn, R. C. (1998). Remote sensing for landscape ecology. New metrics indicators for monitoring, modeling, and assessment of ecosystems. Boston: Lewis, 99 p. + Figure. ISBN: 1-56670-275-5.
Gale, N. (1997). The relationsnship of canopy gaps and topography in a western Ecuadorian rainforest. En: N. Gale. Modes of tree death in four tropical forests, Ph.D. thesis, Faculty of Natural Sciences, University of Aarhus, Denmark.
Galeano, G., Suárez, S., & Balslev, H. (1998). Vascular plant species count in a wet forest in the Chocó area on the Pacifica coast of Colombia. Biodiversity and Conservation, 7, 1563-1575.
Gentry, A. H. (1986). Species richness and floristic composition of Chocó region plant communities. Caldasia, 15(71-75), 71-92.
Gentry, A., & Dodson, C. (1987). Contribution of nontrees to species richness of a tropical rain forest. Biotropica, 19(2), 149-156.
Gibson, L., Lynam, A. J., Bradshaw, C. J. A., He, F., Bickford, D. P., Woodruff, D. S., Bumrungsri, S., & Laurance, W. F. (2013). Near-complete extinction of native small mammal fauna 25 years after forest fragmentation. Science, 341(6153), 1508-1510. doi:10.1126/ science.1240495.
Givnish, T. J. (1999). On the causes of gradients in tropical tree diversity. Journal of Ecology, 87, 193-210.
Gómez-Mora, A. M., Anaya, J. A., & Álvarez-Dávila, E. (2005). Análisis de fragmentación de los ecosistemas boscosos en una región de la Cordillera Central de los Andes colombianos. Revista Ingenierías Universidad de Medellín, 4(7), 413-27. Recuperado el 17 de noviembre de 2013 de http://www.redalyc.org/articulo.oa?id=75004702.
Gould, W., & Walker, M. D. (1999). Plant species and landscape diversity along an artic river. Journal of Vegetation Science, 10, 537-538.
Grant, V. (1989). Especiación vegetal. México: Noriega, 587 p. ISBN: 0231051123.
Hall, B. J., & Swaine, M. D. (1981). Distribution and ecology of vascular plants in a tropical rain forest: forest vegetation in Ghana. The Hague: Junk.
Halley, J. M., Sgardeli, V., & Monokrousos, N. (2013). Species-area relationships and extinction forecasts. Ann N Y Acad Sci., 1286, 50-61. Published online 2013 May 14. doi: 10.1111/nyas.12073.
Hanski, I., Zurita, G. A., Bellocq, M. I., & Rybicki, J. (2013). Species-fragmented area relationship. Proc Natl Acad Sci., 110(31), 12715-12720. Published online 2013 July 15. doi: 10.1073/pnas.1311491110.
Helliwell, D. R. (1976). The effects of size and isolation on the conservation value of wooded sites in Britain. Journal of Biogeography, 3, 407-416.
Heywood, V. H., Mace, G. M., May, R. M., & Stuart, S. N. (1994). Uncertainties in extinction rates. Nature, 368,105.
Honnay, O., Endels, P., Vereecken, H., & Hermy, M. (1999a). The role of patch area and habitat diversity in explaining native plant species richness in disturbed suburban forst patches in northern Belgium. Diversity and Distributions, 5, 129-141.
Honnay, O., Hermy, M., & Coppin, P. (1999b). Impact of habitat quality on forest plant species colonization. Forest Ecology and Management, 115(2-3), 157-170.
Hulshoff, R. (1995). Landscape indices describing a Dutch landscape. Landscape Ecology, 10(2), 101-111.
Instituto Geográfico Agustín Codazzi (IGAC) Colombia. (1979). Suelos del Departamento de Antioquia.
Iverson, L. R., & Prasad, A. (1998). Estimating regional plant biodiversity with GIS modelling. Diversity and Distributions, 4, 49-61.
Jacquemyn, H., Butaye, J., & Hermy, M. (2001). Forest plant species richness in small, fragmented mixed deciduous forest patches: the role of area, time and dispersal limitation. Journal of Biogeography, 28(6), 801-812.
Kellman, M. (1996). Redefining roles: plant community reorganization and species preservation in fragmented ecosystems. Global ecology and Biogeography Letters, 5, 111-116.
Kerr, J. T. (1999). Weal links: "Rapoport´s rule" and large-scale species richness paterns. Global Ecology and Biogeography, 8, 47-54.
Laurance, W. F., et al. (2011).The fate of Amazonian forest fragments: A 32-year investigation. Biological Conservation, 144, 56-67.
Laurance, W. F., & Bierregaard, R. (1997). Preface: a crisis in the making. En: W. F. Laurance & R. O. Bierregaard. Tropical forest remnants: ecology, management and conservation of fragmented communities (pp. xi-1). Chicago: University of Chicago.
Lawton, J. H. (1999). ¿Are there general laws in ecology? Oikos, 84, 177-192.
Loreau, M., & Mouquet, N. (1999). Immigration and the maintenance of local species diversity. The American Naturalist, 154(4), 427-440.
McGarigal, K., & Marks, B. J. (1995). Fragstats: Spatial pattern analysis program for quantifying landscape structure, Version 2.0, Oregon State University, Corvallis.
Newton, A. C., Cayuela, L., Echeverría, C., Armesto, J. J., Del Castillo, R. F., Golicher, D., Geneletti, D., González-Espinosa, M., Huth, A., López-Barrera, F., Malizia, L., Manson, R., Premoli, A., Ramírez-Marcial, N., Rey Benayas, J. M., Rüger, N., Smith-Ramírez, C., & Williams-Linera, G. (2009). Toward integrated analysis of human impacts on forest biodiversity: lessons from Latin America. Ecology and Society, 14(2), 2. Recuperado de http://www.ecologyandsociety.org/vol14/iss2/art2/.
Nichols, W. F., Killingbeck, K. T., & August, P. V. (1998). The influence of geomorphological heterogeneity on biodiversity. II. A landscape perspective. Conservation Biology, 12(2), 371-379.
Parsons, R. F., & Cameron, D. G. (1974). Maximum plant species diversity in terrestrial communities. Biotropica, 6, 202-203.
Phillips, O. L., Hall, P., Gentry, A. H., Sawyer, S. A., & Vázquez, R. (1994). Dynamics and species richness of tropical rain forests. Proceedings of the National Academy of Sciences, 91, 2805-2809.
Priego-Santander, A., Moreno-Casasola, P., Palacio-Prieto, J. L., Lópes-Portillo, J. L., & Geissert-Kientz, D. (2003). Relación entre la heterogeneidad del paisaje y la riqueza de especies de flora en cuencas costeras del estado de Veracruz, México. Investigaciones Geográficas, Boletín del Instituto de Geografía, UNAM, 52, 31-52.
Rangel, T. F. L. V. B, Diniz-Filho, J. A. F., & Bini, L. M. (2010). SAM: a comprehensive application for Spatial Analysis in Macroecology. Ecography, 33, 46-50.
Rodhe, K. (1992). Latitudinal gradients in species diversity: the search for the primary cause. Oikos, 65, 514-527.
Shafer, C. L. (1995). Values of shortcomings of small reserves. Bioscience, 45, 80-88.
Shmida, A., & Wilson, M. W. (1985). Biological determinants of species diversity. Journal of Biogeography, 12, 1-20.
Siemman, E., Tilman, D., Haarstad, J., & Ritchie, M. (1998). Experimental test of the dependence of arthropod diversity on plant diversity. The American Naturalist, 152(5), 738-750.
Slik, J. W. F., Aiba, S. I., Brearley, F. Q., Can-non, C. H., Forshed, O., Kitayama, K., Nagamasu, H., Nilus, R., Payne, J., Paoli, G., Poulsen, A. D., Raes, N., Sheil, D., Sidiyasa, K., Suzuki, E., & VanValkenburg, J. L. C. H. (2010). Environmental correlates of tree biomass, basal area, wood specific gravity, and stem density gradients in Borneo tropical forests. Glob Ecol Biogeogr, 19, 50-60.
Smith, A. P. (1988). Does correlation of elevation with plant taxonomic richness vary with latitude? Biotropica, 20(3), 259-261.
Tischendorf, L., & Fahrig, L. (2000). On the usage and measurement of landscape connectivity. Oikos, 90, 7-19.
Turner, I. M., & Corlett, R. T. (1996). The conservation of small, isolated fragments of lowland tropical rain forest. TREE, 11(8), 330-333.
Weaver, M., & Kellman, M. (1981). The effects of forest fragmentation on woodland tree biotas in Southern Ontario. Journal of Biogeography, 8, 199-210.
Viana V. M., Tabanez A. J., & Batista, J. L. (1997). Dynamics and restoration of forest fragments in the Brazilian Atlantic forest. In: W. F. Laurence & R. O. Bierregaard (eds.). Tropical forest remnants: ecology, management, and conservation of fragmented communities (pp. 351-365). Chicago, Illinois: University of Chicago Press.
Webb, L. J., Tracey, J. G., Williams, W. T., & Lance. G. N. (1967). Studies in the numerical analysis of complex rain forest communities: I. A comparison of methods applicable to site/ species data. Journal of Ecology, 55, 171-191.
Whitmore, T. C. (1997). Tropical forest disturbance, disappearance, and species loss. En: W. F. Laurance & R. O. Bierregaard. Tropical forest remnants: ecology, management and conservation of fragmented communities (pp. 3-12). Chicago: University of Chicago.
Whitmore, T. C., Peralta, R., & Brown, K. (1985). Total species count in a Costa Rican rainforest. Journal of Tropical Ecology, 1, 375-378.
Wohlgemuth, T. (1998). Modelling floristic species richness on a regional scale: a case study in Switzerand. Biodiversity and Conservation, 7, 159-177.
Yepes-Quintero, A. P., Jaramillo-Restrepo, S. L., Del Valle-Arango, J. I., & Orrego-Suáza, S. A. (2007). Diversidad y composición florística en bosques sucesionales andinos de la región del río Porce, Colombia. Actual Biol., 29(86), 107-117.
Zacharias, D., & Brandes, D. (1990). Species area-relationships and frequency-floristical data analysis of 44 isolated woods in northwestern Germany. Vegetatio, 88, 21-29.
Zelený, D., Li, C. F., & Chytry, M. (2010). Pattern of local plant species richness along a gradient of landscape topographical heterogeneity: result of spatial mass effect or environmental shift? Ecography, 33, 578-589. doi: 10.1111/j.1600-0587.2009.05762.x.
ANEXOS

Licencia
Colombia Forestal conserva los derechos patrimoniales (copyright) de las obras publicadas, y favorece y permite la reutilización de las mismas bajo la licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional por lo cual se pueden copiar, usar, difundir, transmitir y exponer públicamente, siempre que:
Se reconozcan los créditos de la obra de la manera especificada por el autor o el licenciante (pero no de una manera que sugiera que tiene su apoyo o que apoyan el uso que hace de su obra).















