DOI:
https://doi.org/10.14483/2256201X.11848Publicado:
01-01-2018Número:
Vol. 21 Núm. 1 (2018): Enero-JunioSección:
Artículos de investigación científica y tecnológicaRiqueza florística y recambio de especies en la vertiente orinoquense de los Andes, Colombia
Plant species richness and turnover in the Orinoco slope of the Andes in Colombia
Palabras clave:
riparian forest, terra firme forests, beta diversity, Orinoquia, floristic similarity (en).Palabras clave:
Bosque ribereño, bosque de tierra firme, similitud florística, diversidad beta, Orinoquía (es).Descargas
Referencias
Aldana, A.M. (2005). Patrones de regeneración y diversidad florística en fragmentos de bosque con intervención antrópica en el piedemonte llanero, Colombia (Trabajo de pregrado de Biología). Bogotá: Universidad de los Andes. 90 p.
Alvira, D. (1997). Estructura y composición florística de cuatro estadios sucesionales de bosque húmedo tropical en el piedemonte llanero (Trabajo de pregrado, Biología). Bogotá: Universidad de los Andes. 48 p.
Angiosperm Phylogeny Group APG IV. (2016). An update of the Angiosperm Phylogeny Group classification for the orders and families of flowering plants: APG IV. Botanical Journal of the Linnean Society, 181, 1-20.
Bell, G. (2001). Neutral macroecology. Science, 293, 2413-2418. DOI: https://doi.org/10.1126/science.293.5539.2413
Bernal, R., Gradstein, S.R., & Celis, M. (eds.). (2015). Catálogo de plantas y líquenes de Colombia. Bogotá: Instituto de Ciencias Naturales, Universidad Nacional de Colombia. 1504 p.
Bray, J.R., & Curtis, J.T. (1957). An ordination of upland forest communities of southern Wisconsin. Ecological Monographs, 27, 325-349. DOI: https://doi.org/10.2307/1942268
Calderón, J. M., Moreno, C.E., & Zuria, I. (2012). La diversidad beta: medio siglo de avances. Revista mexicana de biodiversidad, 83(3), 879-891. DOI: https://doi.org/10.7550/rmb.25510
Cano, A., & Stevenson, P. (2009). Diversidad y composición florística de tres tipos de bosque en la estación biológica Caparú, Vaupés. Colombia Forestal, 12, 63-80. DOI:
https://doi.org/10.14483/udistrital.jour.colomb.for.2009.1.a06
Castro, S., & Jaksic, F. (2008). Patterns of turnover and floristic similarity show a non-random distribution of naturalized flora in Chile, South America. Revista Chilena de Historia Natural, 81, 11-121. DOI: https://doi.org/10.4067/S0716-078X2008000100009
Chao, A. (1984). Nonparametric estimation of the number of classes in a population. Scandinavian Journal of statistics, 11, 265-270.
Colwel, R.K. (2013). EstimateS: Statistical stimation of species richness and shared species from samples. Versión 9. Recuperado de: purl.oclc.org/estimates
Condit, R., Pitman, N., Leigh, E.G., Chave, J., Terborgh, J., Foster R.B., Nuñez, V.P., Aguilar, S., Valencia, R., Villa, G., Muller-Landau, H.C., Losos, E., & Hubbell, S.P. (2002). Betadiversity in tropical forest trees. Science, 295, 666-669. DOI: https://doi.org/10.1126/science.1066854
Córdoba, M., Miranda, L., Avila, R., & Pérez, C. (2011). Flora de Casanare. En J.S. Usma & F. Trujillo (eds.) Biodiversidad del Casanare: ecosistemas estratégicos del departamento (pp. 82-101). Bogotá: Gobernación de Casanare-WWF Colombia.
Cornell, H.V., & Lawton, J.H. (1992). Species interactions, local and regional processes, and limits to the richness of ecological communities: a theoretical perspective. Journal of Animal Ecology, 61, 1-12. DOI: https://doi.org/10.2307/5503
Duivenvoorden, J.F., Svenning, J.C., & Wright, S.J. (2002). Beta diversity in tropical forests. Science, 295, 636-637.
Duque, A., Sánchez, M., Cavelier, J., & Duivenvoorden, J.F. (2002). Different floristic patterns of woody understorey and canopy plants in Colombian Amazonia. Journal of Tropical Ecology, 18, 499.525. DOI: https://doi.org/10.1017/S0266467402002341
Ferreira, C.S., Piedade, M.T., Franco, A.C., Gonc ̧alves, J.F., & Junk, W.J. (2009). Adaptive strategies to tolerate pro- longed flooding in seedlings of floodplain and upland populations of Himatanthus sucuuba, a Central Amazon tree. Aquatic Botany, 90, 246-252. DOI: https://doi.org/10.1016/j.aquabot.2008.10.006
Franco, P., Bentacur, J., & Alonso, J.L. (1997). Diversidad florística en dos bosques subandinos del sur de Colombia. Caldasia, 19(1-2), 205-234.
Galindo-T., R., Betancur, J., & Cadena-M., J.J. (2003). Estructura y composición florística de cuatro bosques andinos del santuario de flora y fauna Guanentá-alto río Fonce, cordillera Oriental colombiana. Caldasia, 25(2), 313-335.
Garavito, J., Suárez, C., Bravo, A., Vargas, R., Cuadros, L., Córdoba, M., Miranda, L., Martínez, J., & Usma, J. (2011). Descripción del medio natural del departamento del Casanare. En J.S. Usma & F. Trujillo (eds) Biodiversidad del Casanare: ecosistemas estratégicos del departamento (pp. 50-71). Bogotá: Gobernación de Casanare-WWF Colombia.
Garssen, A.G., Baattrup-Pedersen, A., Voesenek, L.A., Verhoeven, J.T., & Soons, M.B. (2015). Riparian plant community responses to increased flooding: A meta-analysis. Global Change Biology, 21, 2881-2890. DOI: https://doi.org/10.1111/gcb.12921
Gentry, A.H. (1982). Patterns of neotropical plant diversity. Evolutionary Biology, 15, 1-84.
Gentry, A.H. (1988). Tree species richness of upper Amazonian forests. Proceedings of the National Academy of Sciences of the United States of America, 85, 156-159. DOI: https://doi.org/10.1073/pnas.85.1.156
Gentry, A.H. (1995). Patterns of diversity and floristic composition in neotropical montane forest. En S.P. Churchill, H. Balslev, E. Forero & J.L. Luteyn (eds.) Biodiversity and conservation of neotropical montane forests (pp. 103-126). New York: The New York Botanical Garden.
Hammer, Ø., Harper, D.A.T., & Ryan, P.D. (2001). PAST: Paleontological statistics software package for education and data analysis. Palaeontologia Electronica, 4, 1-9.
Hubbell, S.P., Foster R.B., O’Brien, S.T., Harms, K.E., Condit, R., Wechsler, B., Wright, S.J., & Loo de Lao S. (1999). Light-gap disturbances, recruitment limitation, and tree diversity in a neotropical forest. Science, 283, 554-557.
Hutchinson, G.E. (1957) Concluding remarks. Cold Spring Harbor Symposia on Quantitative Biology, 22, 415-427. DOI: https://doi.org/10.1101/SQB.1957.022.01.039
Instituto Geográfico Agustín Codazzi (Igac). (1999). Casanare, características geográficas. Bogotá: Gobernacón de Casanare, Corporinoquía, Organización de los Estados Iberoamericanos, BP Exploration Company, Ecopetrol, Triton Colombia y Total Exploration Exprodukhe Maatchappisbu. 180 p.
Igac. (2014). Estudio general de suelos y zonificación de tierras departamento de Casanare, escala 1:100 000. Bogotá: Imprenta Nacional de Colombia.
Kessler, M., Grytnes, J.A., Halloy, S.R., Kluge, J., Krömer, T., León, B., & Young, K.R. (2011). Gradients of plant diversity: local patterns and processes. En S.K. Herzog, R. Martínez, P.M. Jørgensen & H. Tiessen (eds.) Climate change and biodiversity in the tropical Andes (pp. 204-219). São José dos Campos y París: Instituto Interamericano para la Investigación del Cambio Global y Comité Científico sobre Problemas del Medio Ambiente.
Legendre, P., Borcard, D., & Peres-Neto, P. (2005). Analyzing beta diversity: Partitioning the spatial variation of community composition data. Ecological Monographs, 75, 435-450. DOI: https://doi.org/10.1890/05-0549
Loiseau, N., Legras, G., Gaertner, J., Verley, P., Chabanet, P., & Mérigot, B. (2017). Performance of partitioning functional beta‐diversity indices: Influence of functional representation and partitioning methods. Global Ecology and Biogeography, 26, 753-762.
López, W., & Duque, A.J. (2010). Tasas de recambio florístico de géneros en bosques montanos del neotrópico. Caldasia, 32(1), 175-189.
Marcelo-Peña, J.L., & Reynel, C. (2014). Patrones de diversidad y composición florística de parcelas de evaluación permanente en la selva central de Perú. Rodriguesia, 65(1), 35-47. DOI: https://doi.org/10.1590/S2175-78602014000100003
Minorta, V., & Rangel, O. (2015). La riqueza y la diversidad de las plantas con flores de la Orinoquia colombiana. En O. Rangel (ed.) Colombia Diversidad Biótica XIV La región de la Orinoquia de Colombia (pp. 237-418). Bogotá: Instituto de Ciencias Naturales, Universidad Nacional de Colombia.
Naiman, R.J., & Decamps, H. (1997). The ecology of interfaces: riparian zones. Annual Review of Ecology and Systematics, 28(1), 621-658. DOI: https://doi.org/10.1146/annurev.ecolsys.28.1.621
Normand, S., Vormisto, J., Svenning, J.C., Grandez, C., & Balslev,
H. (2006). Geographical and environmental controls of palm beta diversity in paleo-riverine terrace forests in Amazonian Peru. Plant Ecology, 186, 161-176. DOI: https://doi.org/10.1007/s11258-006-9120-9
Pérez, C. (2005). Análisis comparativo de la composición y estructura de la vegetación riparia de tres rangos altitudinales, en un fragmento de bosque de piedemonte de la reserva forestal protectora cuenca alta del caño Vanguardia y quebrada Vanguardiuno (RFPVV), Villavicencio-Meta. (Trabajo de pregrado, Ecología). Bogotá: Pontificia Universidad Javeriana. 110 p.
Phillips O.L., Vargas, P., Monteagudo, A., Cruz, A., Zans, M.E., Sánchez, W., Yli-Halla, M., & Rose, S. (2003). Habitat association among Amazonian tree species: a landscape-scale approach. Journal of Ecology, 91, 757-775. DOI: https://doi.org/10.1046/j.1365-2745.2003.00815.x
Potts, M.D., Ashton, P.S., Kaufman, L.S., & Plotkin J.B. (2002). Habitat patterns in tropical rain forests: a comparison of 105 plots in northwest Borneo. Ecology, 83(10), 2782-2797. DOI: https://doi.org/10.1890/0012-9658(2002)083[2782:HPITRF]2.0.CO;2
Prada, C.M., & Stevenson, P.R. (2016). Plant composition associated with environmental gradients in tropical montane forests (Cueva de Los Guacharos National Park, Huila, Colombia). Biotropica, 48(5), 568-576. DOI: https://doi.org/10.1111/btp.12331
Purcell, A. (2016). Functional trait variation along a hydrological gradient and trait-based predictions of the composition of a wetland plant community (Trabajo de grado de Maestría, Ciencias Biológicas). Hamilton, New Zealand: The University of Waikato. 79 p.
R Core Team. (2016). R: A language and environment for statistical computing. Vienna: R Foundation for Statistical Computing. Recuperado de: https://www.R-project.org/.
Rangel-Ch., J.O., Aguilar, M., Sánchez, H., Lowy-C., P., Aguilar, M., & Castillo, A. (1995). Región de la Orinoquia. En J.O. Rangel-Ch. (ed.) Colombia diversidad biótica I (pp. 239-254). Bogotá: Instituto de Ciencias Naturales. Universidad Nacional de Colombia.
Reynel-R., C., & Antón, D. (2004). Diversidad y composición de la flora arbórea en un área ribereña de bosque montano: Pichita, Valle de Chanchamayo, 2000-2500 msnm. En D. Antón y C. Reynel (eds.) Relictos de Bosques de Excepcional Diversidad en los Andes Centrales del Perú (pp. 99-323). Lima: Herbario de la Facultad de Ciencias Forestales, Universidad Nacional Agraria La Molina.
Rodríguez, N., Armenteras, D., Morales, M., & Romero, M. (2004). Ecosistemas de los Andes colombianos. Bogotá: Instituto de Investigaciones Alexander von Humboldt. 155 p.
Socolar, J.B., Gilroy, J.J., Kunin, W.E., & Edwards, D.P. (2016). How should beta-diversity inform biodiversity conservation? Trends in Ecology and Evolution, 31(1), 67-80.
Terborgh, J., & Andresen, E. (1998). The composition of Amazonian forests: patterns at local and regional scales. Journal of Tropical Ecology, 14, 645-664. DOI: https://doi.org/10.1017/S0266467498000455
Ter Steege, H., Sabatier, D., Castellanos, H., van Andel, T., Duivenvoorden, J., De Oliveira, A.A., Ek, R., Lilwah, R., Maas, P., & Mori, S. (2000). An analysis of the floristic composition and diversity of Amazonian forests including those of the Guiana Shield. Journal of Tropical Ecology, 16, 801-828. DOI: https://doi.org/10.1017/S0266467400001735
Tuomisto, H., Ruokolainen, K., & Yli-Halla, M. (2003). Dispersal, environment, and floristic variation of western Amazonian forests. Science, 299, 241-244. DOI: https://doi.org/10.1126/science.1078037
Vélez, J.I., Poveda G., & Mesa, O.J. (2000). Balances hidrológicos de Colombia. Serie del Posgrado en Recursos Hidráulicos, 16.
Villarreal, H., Álvarez, M., Córdoba, S., Escobar, F., Fagua, G., Gast, F., Mendoza, H., Ospina M., & Umaña, A. (2006). Manual de métodos para el desarrollo de inventarios de biodiversidad. Bogotá: Instituto de Investigación de Recursos Biológicos Alexander von Humbold. 236 p.
Viña, A. (1995). Influencia de la fragmentación de bosques sobre la riqueza de especies de árboles en el piedemonte llanero (Trabajo de pregrado, Biología). Bogotá: Universidad de los Andes. 57 p.
Vormisto, J., Svenning, J.C., Hall, P., & Balslev, H. (2004). Diversity and dominance in palm (Arecaceae) communities in terra firme forests in the western Amazon basin. Journal of Ecology, 92, 577-588.
Whittaker, R.H. (1956) Vegetation of the great Smoky Mountains. Ecological Monographs, 26, 1-80. DOI: https://doi.org/10.2307/1943577
Wittmann, F., Householder, E., Piedade, M.T., Assis, R.L., Scho ̈ngart, J., & Parolin, P. (2013). Habitat specificity, endemism and the neotropical distribution of Amazonian white-water floodplain trees. Ecography, 36, 690-707. DOI: https://doi.org/10.1111/j.1600-0587.2012.07723.x
Zamborlini, F., Brown, J.L., Thomas, W.W., de Oliveira-Filho, A.T., & Carnaval, A.C. (2016). Environmental correlates of floristic regions and plant turnover in the Atlantic Forest hotspot. Journal of Biogeography, 43(12), 2322-2331. DOI: https://doi.org/10.1111/jbi.12774
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
 |
Trujillo-C.W., & Henao-Cárdenas, M.M. (2018). Riqueza florística y recambio de especies en la vertiente orinoquense de los andes, Colombia. Colombia Forestal, 21(1), 18-33. |
ARTÍCULOS/INVESTIGACIÓN CIENTÍFICA Y TECNOLÓGICA
RIQUEZA FLORÍSTICA Y RECAMBIO DE ESPECIES EN LA VERTIENTE ORINOQUENSE DE LOS ANDES, COLOMBIA
Plant species richness and turnover in the Orinoco slope of the Andes in Colombia
William Trujillo-C.1 , María Mónica Henao-Cárdenas2
1 Fundación Reserva Natural La Palmita. Bogotá, Colombia. williamtrujilloca@gmail.com Autor para correspondencia.
2 Fundación Reserva Natural La Palmita. Bogotá, Colombia. mmcardenas@unal.edu.co
Recibido: 02 de Marzo de 2017; Aprobado: 28 de Agosto de 2017
RESUMEN
El mecanismo de neutralidad propone que la diversidad beta es controlada por limitaciones de dispersión y que la similitud florística está correlacionada con la distancia geográfica. En este trabajo se evaluó dicha hipótesis y se comparó la riqueza de bosques subandinos de la Orinoquía con otras vertientes en Colombia, Ecuador y Perú. Se usó una prueba de Mantel para evaluar la correlación entre distancia y similitud florística en 19 parcelas de 0.1 ha y una prueba de Mann-Whitney para el análisis comparativo de riqueza. Se encontró que la distancia fue buen predictor de la similitud florística, sugiriendo que las limitaciones de dispersión son un mecanismo importante para explicar el recambio. La riqueza hallada (47-84 especies) fue significativamente más baja que en las vertientes Amazonía y Pacífico de los Andes, pero similar a la reportada en la vertiente Magdalena. La composición florística estuvo de acuerdo con el patrón reportado previamente para Orinoquía.
Palabras-clave: bosque ribereño; bosque de tierra firme; diversidad beta; Orinoquía; similitud florística.
ABSTRACT
The neutral theory proposes that the beta diversity is controlled by dispersal limitations and that the floristic similarity between communities is correlated with geographic distances. This work evaluated this hypothesis and compared the richness of Orinoco's subandine forests with forests in other slopes in Colombia, Ecuador and Peru. The Mantel test was used to evaluate the correlation between distance and floristic similarity in 19 plots of 0.1 ha and the Mann-Whitney test for a comparative richness analysis. We found that distance was a good predictor of floristic similarity, suggesting that dispersal limitations represent an important mechanism to explain species replacement. The richness found in the Orinoquia slope (47-84 species) was significantly lower than the Amazon and Pacific slopes of the Andes, but was similar to the one reported in the Magdalena slope. Finally, we found a similar plant species composition to that previously reported for Orinoquía.
Key words: riparian forest; terra firme forests; beta diversity; Orinoquia; floristic similarity.
INTRODUCCIÓN
Una buena parte de las investigaciones que se han enfocado en evaluar los determinantes ecológicos en el neotrópico han proporcionado evidencia de que el ensamblaje de nicho es un importante mecanismo para explicar la composición y el recambio de especies en comunidades de plantas (Potts et al., 2002; Phillips et al.,2003; Tuomisto et al., 2003; Prada & Stevenson, 2016; Zamborlini et al., 2016). El ensamblaje de nicho predice que los factores ambientales determinan la presencia o ausencia de especies y, por tanto, la variación de la composición entre los sitios (Whittaker, 1956; Hutchinson, 1957).
Otros estudios, por el contrario, demuestran que las variables espaciales son más importantes que las ambientales para explicar la similitud y el recambio florístico (Condit et al., 2002; Duivenvoorden et al., 2002; Duque et al., 2002; Vormisto et al., 2004). Por ejemplo, el trabajo de Terborgh & Andresen (1998) en la Amazonia encontró que los bosques inundables no fueron similares florísticamente a otros bosques del mismo tipo y que la similitud florística fue debida a la proximidad geográfica entre sitios. Este patrón ha sido explicado mediante procesos estocásticos (Cornell & Lawton, 1992; Hubbell et al., 1999; Bell, 2001), sugiriendo que no son las variables ambientales sino las limitaciones de dispersión las que determinan la similitud florística y el recambio de especies, el cual opera con mayor fuerza en escalas geográficas amplias que en pequeñas (Normand et al., 2006; López & Duque, 2010).
El piedemonte y los bosques subandinos representan subunidades de paisaje de alta importancia biogeográfica, pues se encuentran en la transición entre la sabana y la montaña de la Orinoquía y albergan la mayor proporción de la riqueza florística en la región (Minorta & Rangel, 2015). En el piedemonte, los bosques ribereños y de tierra firme son valiosas coberturas dado que en sus relictos se encuentra contenida la mayor parte de las especies con forma de vida arbórea en esta ecorregión (Rangel, 1995). Los bosques ribereños son ecosistemas asociados a cuerpos de agua que se inundan periódicamente y reciben su influencia regular (Neiman & Decamps, 1997). Es bien documentado que un aumento en la duración, la intensidad y la frecuencia de las inundaciones en bosques ribereños puede conducir a un cambio en la composición de especies (Ferreira et al., 2009, Wittmann et al., 2013). Ya que el exceso de inundación reduce la diversidad local al excluir especies arbóreas intolerantes a la anoxia del suelo (Garssen et al., 2015), seguido por la sustitución de especies adaptadas a las condiciones, debido a estrategias de historia de vida especializadas (Purcell, 2016).
Aunque un buen número de artículos se han enfocado en dilucidar los mecanismos que controlan la riqueza florística y la diversidad beta en el neotrópico, son escasos los trabajos en la vertiente orinoquense de los Andes, una región que se caracteriza por la acelerada transformación de los ecosistemas naturales y los vacíos de información florística (Córdoba et al., 2011). Los análisis de la riqueza son importantes para entender los patrones de la biodiversidad (Calderón et al., 2012), que serán determinantes para plantear acciones de conservación y predecir los efectos de posibles cambios generados por factores naturales o antrópicos (Kessler et al., 2011). Así mismo, se ha sugerido la necesidad de comprender mejor los procesos y patrones subyacentes al mantenimiento y la pérdida de la diversidad beta para conservar efectivamente la diversidad gamma (Socolar et al., 2016).
Basado en lo anterior, este artículo plantea aportar al conocimiento de la diversidad alfa y beta en el piedemonte y bosques subandinos de la Orinoquía, a partir de los siguientes objetivos: 1) medir la composición y riqueza florística y evaluar su variación respecto a otras vertientes andinas del neotrópico; 2) evaluar el recambio de especies entre bosques ribereño, bosques de tierra firme y bosques subandinos y analizar la importancia relativa de la distancia geográfica y el régimen de inundación como controladores de la diversidad beta en bosques de la vertiente orinoquense de los Andes.
MATERIALES Y MÉTODOS
Área de estudio
El estudio se llevó acabo en la región de la Orinoquía, sobre las cuencas hidrográficas de los ríos Pauto (departamento de Casanare) y Casanare (departamento de Arauca), grandes tributarios de la cuenca del río Orinoco; en bosques de piedemonte y subandinos. El piedemonte se ubica en un rango altitudinal de 300-1100 m de altitud (Garavito et al., 2011) y representa la transición entre la vegetación de cordillera y la vegetación de sabana (Rodríguez et al., 2004; Minorta & Rangel, 2015). Este hábitat natural se caracteriza por presentar un clima húmedo tropical, con temperatura promedio de 27°C que pueden disminuir 3°C en época de máxima precipitación entre mayo y julio, o aumentar casi 10°C en época de máxima sequía entre febrero y marzo (Rangel, 1995).
Los bosques subandinos se encuentran entre 950 y 2400 m de altitud; la temperatura media anual oscila entre 16° y 23°C, con un periodo seco de tres meses (IGAC, 1999); suelos de escaso desarrollo génico, desaturados, ácidos y de muy baja fertilidad; el relieve varía de moderadamente empinado hasta escarpado, con pendientes entre 12-75 % (IGAC, 2014).
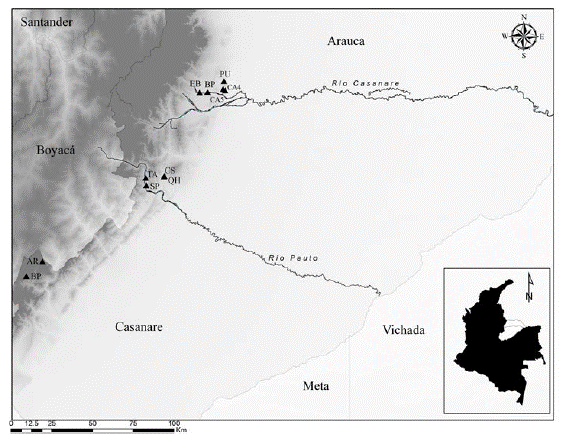
Los muestreos de vegetación se realizaron en ocho localidades (tabla 1, figura 1) en tres tipos de cobertura. Las coberturas de muestreo fueron: 1) bosques ribereños en el piedemonte de los departamentos Casanare y Arauca, ubicados entre los 390-550 m de altitud, caracterizados por ser zonas transicionales influenciadas regularmente por aguas continentales y que se extienden desde las márgenes de los cursos de agua hacia los límites o las zonas netamente terrestres (Naiman & Decamps, 1997); esta denominación incluye tanto los bosques ubicados en planos de inundación como en los diques de ribera. 2) bosques primarios de tierra firme del piedemonte de Casanare y Arauca ubicados entre los 305-546 m de altitud, que no se encuentran en la ribera de los ríos y no reciben su influencia regular, aunque pueden llegar a tener alto nivel freático o estar atravesados por cuerpos de agua menores; en el área de estudio, esta cobertura presenta niveles medios a bajos de disturbio, causado principalmente por extracción selectiva de especies maderables. 3) bosques subandinos del departamento de Casanare, ubicados en altitudes entre 1500-2000 m sobre pendientes medias a altas.
Trabajo de campo
Empleando el método propuesto por Gentry (1982), se censaron, en 19 parcelas de 0.1 ha, todos los individuos con diámetro del tallo a la altura del pecho (DAP medido a 1.3 m desde la superficie del suelo) mayor o igual a 2.5 cm. Cada parcela de 0.1 ha estaba dividida en 10 subunidades (transectos) de 50 x 2 m paralelas entre sí y separadas al menos por 20 m. En cada cobertura se realizó el levantamiento florístico en los sitios indicados en la tabla 1. Las colecciones botánicas fueron determinadas taxonómicamente en el Herbario Nacional Colombiano (COL) del Instituto de Ciencias Naturales de la Universidad Nacional de Colombia y depositadas en el Herbario Federico Medem del Instituto Humboldt (FMB), con duplicados en COL y en Herbario Amazónico Colombiano (COAH). Los especímenes fueron colectados en el marco del permiso de investigación 500-41-15.07209 de Corporinoquia y del acuerdo 15-14-172-010CE emitido por el Instituto de Investigación de Recursos Biológicos Alexander von Humboldt. La nomenclatura de las especies y familias sigue la empleada en la base de datos del Missouri Botanical Garden, la cual está de acuerdo con el sistema de clasificación APG IV (2016).
Tratamiento de datos
La diversidad alfa (a) se calculó como el número de especies por unidad de área; se computó la riqueza esperada según el estimador Chao1 (Chao, 1984) y se obtuvo la proporción de especies representada en la muestra usando el software StimateS (Colwel, 2013). Se realizó un análisis de similitud florística entre sitios empleando el índice cuantitativo de Bray-Curtis (Bray & Curtis, 1957) con el método UPGMA. Para este análisis se usó el software Past 3.13 (Hammer et al., 2001). Empleando una prueba de Mantel se evaluó la relación entre la similitud florística y la distancia geográfica entre sitios usando el lenguaje R (R Core Team, 2016). Usando la prueba no paramétrica de Mann-Whitney se evaluó si la riqueza obtenida en la vertiente orinoquense de los Andes era significativamente diferente a los resultados de estudios previos en las vertientes Amazónica, Pacífico y Magdalena que usaron la misma metodología de muestreo (gremio de árboles con DAP > 2.5 en parcelas de 0.1 ha), principalmente los estudios compilados por Gentry (1995; 1988). También se usó una prueba de Mann-Whitney para evaluar la diferencia en la riqueza de bosques de piedemonte y subandinos del área de estudio.
RESULTADOS
Composición
Se registraron un total de 4903 individuos pertenecientes a 477 especies, distribuidas en 178 géneros y 72 familias. El 44 % de los taxones fueron determinados hasta especie, 39 % hasta género, 13.8 % hasta familia y el 3.2 % indeterminados. En el piedemonte, Fabaceae fue la familia con mayor riqueza genérica y específica, mientras que en el bosque subandino fue Lauraceae por su riqueza específica y Rubiaceae por su riqueza genérica (tabla 2). Moraceae se encontró entre las cinco familias más diversas en piedemonte, pero no en bosque subandino, mientras que Meliaceae resultó ser diversa en bosque subandino pero no en piedemonte. Melastomataceae, Rubiaceae y Euphorbiaceae resultaron ser elementos florísticos de importancia en ambos hábitats naturales (tabla 2). En cuanto a la composición y riqueza a nivel de género se encontró que Inga(Fabaceae) y Miconia (Melastomataceae) fueron los taxones mejor representados en el piedemonte, con 12 especies cada uno (3.5 % del total), mientras que en el bosque subandino Miconia, con 10 especies (3.47 %), resultó ser el género mejor representado, seguido por Ocotea (Lauraceae) y Trichilia (Meliaceae) con ocho especies cada uno (4.82 %; tabla 3). Miconia e Inga registraron alta diversidad tanto en piedemonte como en bosque subandinos; sin embargo, Ficus (Moraceae), Sapium (Euphorbiaceae) y Annona (Annonaceae) lo fueron únicamente para piedemonte y Ocotea (Lauraceae), Trichilia (Lauraceae) y Nectandra (Lauraceae) para bosque subandino (tabla 3)
De las cuatro especies más abundantes registradas en todo el muestreo Rudgea crassiloba (Benth.) B.L. Rob. (Rubiaceae) y Siparuna guianensis Aubl. (Siparunaceae) se encontraron en las localidades de piedemonte (Támara y Tame), mientras que Socratea exorrhiza (Mart.) H. Wendl. (Arecaceae) y Oenocarpus minor Mart. (Arecaceae) se registraron únicamente en la localidad de Tame, pero ninguna de estas en las localidades de bosque subandino (Chámeza y Recetor). R. crassiloba y S. guianensis fueron especies generalistas que dominaron los estratos medios del bosque, con alturas no mayores a los 13 metros, tolerando diferentes tipos de ambiente pero que posiblemente encuentran sus condiciones óptimas de hábitat en bosques secundarios o con intervención antrópica media a alta como los bosques de las veredas Quebrada Honda (CS) y Caribabare (CA). De manera contrastante, Ardisia foetida Willd. ex Roem. & Schult. fue hallada casi exclusivamente en bosques ribereños de Quebrada Honda en Támara, alcanzando altas abundancias únicamente en esta cobertura.
Garcinia madroño (Kunth) Hammel, la quinta especie con mayor abundancia de todo el muestreo se registró en los bosques subandinos y de piedemonte estudiados, resultando ser la especie más generalista. Estas cinco especies constituyen taxones de importancia para la estructura de las comunidades estudiadas. Entre las especies generalistas se encuentra también Alchornea glandulosa Poepp., un taxón que alcanzó alturas de hasta 33 m y que fue registrada tanto en bosques subandinos como en bosques de piedemonte, pero con valores de abundancia mucho más altos en bosques subandinos. Esta especie resultó ser un elemento florístico importante, pues hace parte del grupo de especies que componen el dosel y el estrato emergente de la mayoría de bosques estudiados.
Riqueza
La representatividad del muestreo por parcela varió entre 55-90 %, según el estimador Chao1 (tabla 4), mientras que el cálculo de completitud para todo el muestreo (19 parcelas), mostró valores de 81.4 % y 82.2 %, según los estimadores Chao1 y ACE respectivamente. La riqueza de especies observada por unidad de muestreo arrojó valores entre 47-84 especies (tabla 4, figura 3). Los bosques subandinos registraron valores de riqueza mayores que los bosques de piedemonte, aunque la diferencia no fue significativa (p=0.340), con un promedio de 61 taxones (n=4) y un valor máximo de 84 especies (BT-11); mientras que en bosques de piedemonte la riqueza alcanzó un promedio de 58.9 especies (n=14) por unidad de área y un valor máximo de 80 especies en bosque ribereño (SP-2; tabla 4).
A nivel de géneros, la riqueza por unidad de muestreo en bosques de piedemonte fue mayor que en bosques subandinos, con un registro máximo de 50 taxones en bosque de tierra firme (EB-19) y un promedio de 41.1 géneros (n=14), mientras que en el bosque subandino se registró un valor máximo de 48 géneros (BT-11) y un promedio de 38.5 taxones (n=4) (tabla 4). A nivel de familias la riqueza por unidad de área fue mayor en bosques subandinos que en bosques de piedemonte (tabla 4). Los valores más bajos de riqueza a nivel de especies se registraron en bosques de tierra firme de piedemonte (PU-6) con 47 taxones, mientras que a nivel de género y familia el bosque subandino (AR-10) y el bosque ribereño de piedemonte (QH-13) con 32 y 25 taxones respectivamente, fueron los de menor riqueza.
Recambio de especies
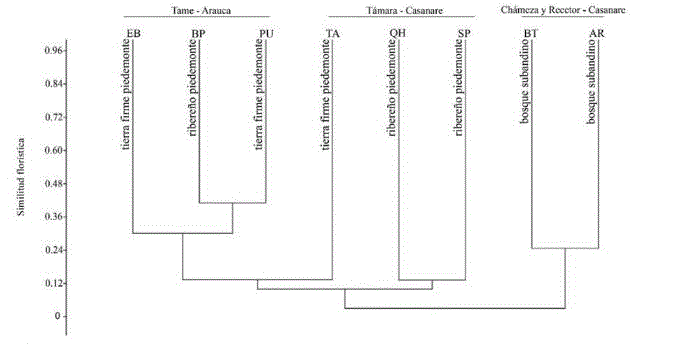
Los bosques estudiados conformaron dos grupos claramente diferenciados (figura 2): 1) bosques subandinos con una similitud florística del 25 % y; 2) bosques de piedemonte, con valores de 21-41 % de similitud entre las localidades de Tame. En los bosques subandinos se encontró una composición florística con predominio de elementos típicos de este hábitat natural, muchos de los cuales fueron exclusivos, estando ausentes en los bosques de piedemonte (Tamara y Tame). Ejemplos de estos elementos son Aniba panurensis (Meisn.) Mez, Billia rosea (Planch. & Linden) C. Ulloa & P. J0rg., Chrysochlamys weberbaueri EnglCybianthus poeppigii Mez, Helicostylis tovarensis (Klotzsch & H. Karst.) C.C., Meriania haemantha (Planch. & Lindl.) Humberto Mend. & Fern. Alonso, Nectandra cf. purpurea (Ruiz & Pav.) Mez, Nectandra cf. reticulata (Ruiz & Pav.) Mez, Siparuna thecaphora (Poepp. & Endl.) A. DC., Wettinia praemorsa (Willd.) Wess. Boer, Joosia umbellifera H. Karst., Arachnothryx glabrata (Standl.) Steyerm. y Miconia dolichorrhyncha Naudin, entre otras. Entre las especies compartidas con bosques de piedemonte se encuentran M. dolichorrhyncha, Miconia trinervia (Sw.) D. Don ex Loudon, Piper arboreum Aubl., Chrysophyllum argenteum Jacq., Henriettella tuberculosa (Donn. Sm.) L.O. Williams e Inga sapindoides Willd., entre otras las más abundantes.
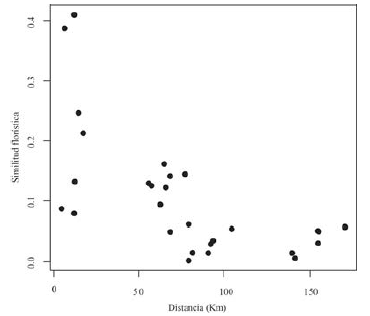
En el piedemonte, la similitud florística en los bosques estudiados de Tame se debe a la presencia compartida de las siguientes especies en los bosques de las veredas El Banco (EB y BP) y Puna-Puna (PU), que se destacan por su alta abundancia: S. exorrhiza, O. minor, S. guianensis, Tapirira guianensis Aubl., Garcinia madruno (Kunth) Hammel, R. crassiloba (Benth.) B.L.Rob., Annona edulis (Triana & Planch.) H. Rainer, Hieronyma alchorneoidesAllemao, Protium calanense Cuatrec. y Schefflera morototoni (Aubl.) Maguire, Steyerm. & Frodin. Por otro lado, en Támara la similitud florística entre bosques de las veredas El Tabloncito (TA) y San Pedro (SP), pese a que son tipos de bosques distintos, resultaron compartir un buen número de taxones destacados por su alta abundancia: S. guianensis, Myrcia fallax (Rich.) DC., Nectandra cuspidata Nees & Mart., Myrcia silvatica Barb. Rodr., Maprounea guianensis Aubl., Dimerocostus strobilaceus Kuntze, Miconia elata (Sw.) DC. y Guarea glabra Vahl. Así mismo, entre las especies más abundantes compartidas entre las localidades de Tame y Támara se encuentran: A. glandulosa, S. guianensis, T. guianensis, A. edulis, S. morototoni, Cecropia ficifolia Warb. ex Snethl., P calanense y Miconia prasina (Sw.) DC. Por otro lado, se encontró que la matriz de similitud florística entre bosques estuvo significativamente correlacionada con la matriz de distancias geográficas (prueba de Mantel: P < 0.0034, R =-0.65, figura 4).
DISCUSIÓN
Composición
La composición florística a nivel de familia se ajusta a lo reportado previamente para la Orinoquía colombiana y el neotrópico por franja altitudinal (Gentry, 1988; 1995), siendo la familia Fabaceae la más diversa en bosques de piedemonte por debajo de los 1000 m de altitud y Lauraceae en bosques subandinos entre 1500 y 2000 m de altitud (Córdoba et al., 2011; Bernal et al., 2015; Minorta & Rangel, 2015; tabla 2). Otros estudios coinciden con este resultado, en el que la familia Lauraceae reemplaza a Fabaceae como el taxón con mayor número de especies en elevaciones intermedias a altas (Galindo-T. et al., 2003; Reynel & Antón, 2004; Marcelo-Peña & Reynel, 2014); previamente Gentry (1988; 1995) había encontrado que la cota de 1500 m de altitud en bosques montanos representa el límite de presencia de muchos géneros y familias botánicas, lo que está de acuerdo con los resultados de este estudio. Tres de las cinco familias más representadas en el piedemonte son compartidas con los bosques subandinos (tabla 2), indicando una escasa variación en la composición a este nivel taxonómico, tal como fue sugerido por Gentry (1988), quien encontró que, al menos en tierras bajas del neotrópico, solo 11 familias contribuyen en cerca de la mitad de la riqueza de especies en muestras de 0.1 ha.
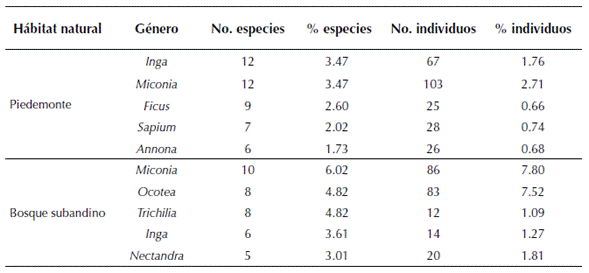
De los tres géneros más representados en los sitios de estudio, Miconia e Inga han sido reportados en trabajos previos como los taxones con mayor número de especies tanto en los departamentos de Casanare y Arauca como en otros bosques neotropicales (Gentry, 1995; Córdoba et al., 2011; Bernal et al., 2015), así mismo, Gentry (1995) encontró a Miconia como el género más diversificado en los bosques andinos del neotrópico. Respecto a la composición a nivel de especie, estudios previos en el piedemonte llanero de los departamentos de Meta y Casanare (Viña, 1995; Alvira, 1997; Pérez, 2005; Aldana, 2015), confirman la alta importancia ecológica de S. guianensis en el estrato subarbóreo y G. madroño y A. glandulosa en el estrato arbóreo. En relación a la importancia de palmas en los bosques de piedemonte en Tame (Arauca), es importante destacar que son elementos florísticos relevantes por su abundancia, más que por su diversidad; su presencia destacó en bosques primarios donde al menos tres especies (S. exorrhiza, O. minor y Attalea butyraceae (Mutis ex L. f.) Wess. Boer) presentaron altas abundancias por unidad de área, confirmando que las especies de palmas constituyen un componente estructural y funcional conspicuo en los bosques neotropicales (Terborgh & Andresen, 1998; Gentry, 1988).
Riqueza
De acuerdo con Villarreal et al. (2006), los muestreos que obtienen una representatividad mayor al 85 % pueden ser usados para hacer análisis de similitud y complementariedad; los valores obtenidos en este estudio (81.4 % y 82.2 %) se acercan al valor sugerido, sin embargo un mayor número de parcelas sería requerido para mejorar la completitud, principalmente en bosques subandinos donde el área de muestreo fue de 0.4 ha, mientras en bosques ribereños y de tierra firme de piedemonte fue de 0.8 y 0.7 respectivamente.
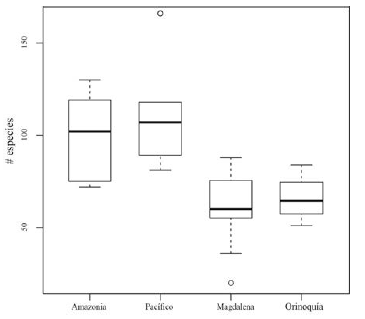
La riqueza florística encontrada en los bosques subandinos en parcelas de 0.1 ha (950-2400 m de altitud) de la vertiente orinoquense de los Andes (rango: 51-84, promedio: 66, figura 3) fue significativamente menor (P = 0.0317) a la registrada en estudios previos de la vertientes Pacífico (rango: 81-118, promedio: 100) y amazónica (rango: 72-130, promedio: 97; P= 0.066), sin embargo no mostró diferencias significativas con la vertiente Magdalena (rango: 20-88, promedio: 60.95; P=0.776; figura 3 y tabla 5).
Respecto a la riqueza florística encontrada en el piedemonte orinoquense (tabla 4), otros estudios en el piedemonte llanero han reportado valores de riqueza entre 82-91 especies (Viña, 1995; Alvira, 1997; Pérez, 2005), que aunque son levemente mayores, se encuentran muy cercanos al rango de riqueza reportado en este estudio (rango: 4780, promedio: 58, n=15; tabla 4). En otras regiones biogeográficas como, por ejemplo, el piedemonte amazónico de Ecuador y Perú (Gentry 1988; 1995) los valores de riqueza (rango: 97-184, promedio: 156 spp, n=6) resultaron significativamente mayores a los encontrados en este estudio (P=0.00103). Lo que apoya las afirmaciones de Minorta & Rangel (2015), quienes registran una baja riqueza de especies de plantas con flores en la región de la Orinoquía, respecto a otras regiones como Amazonia y Chocó. Los resultados sugieren que los factores abióticos e históricos que definen la riqueza de árboles en tierras bajas como, por ejemplo, la precipitación que explica la alta riqueza en el Chocó (Gentry, 1988), son determinantes en la riqueza de los Andes, pues sus respectivas vertientes registraron los valores de riqueza más altos comparados con las vertientes de Orinoquía y Magdalena, donde la riqueza de tierras bajas es menor (Minorta & Rangel, 2015). Para la cordillera de los Andes, se ha reportado que los patrones de precipitación están influenciados por el océano Atlántico, el océano Pacífico y la cuenca amazónica y que existen diferencias climáticas marcadas entre la vertiente oriental y occidental y entre diferentes flancos de los valles interandinos (Velez et al., 2000). Aunque se requieren estudios adicionales para evaluarlo, estas diferencias climáticas podrían ser determinantes en la riqueza florística de la región andina.
En relación con la riqueza a través del gradiente de elevación, la diferencia entre el piedemonte y los bosques subandinos no resultó significativa (p=0.340). Sin embargo, el bajo número de parcelas en elevaciones intermedias y altas señalan la necesidad de ampliar el esfuerzo de muestreo para hacer afirmaciones confiables, que permitan aportar al entendimiento de los modelos de variación en el número de especies a lo largo del gradiente altitudinal. Por otro lado, respecto a la riqueza comparativa entre tipos de bosque, otros estudios han sugerido que los bosques de tierra firme son más diversos que los bosques inundables (Ter Steege et al., 2000; Cano & Stevenson, 2009). Dichos resultados no son compartidos con este estudio ya que la diferencia de riqueza entre parcelas de piedemonte y montaña en diferentes tipos de bosque no fue representativa ni consistente entre sitios (tabla 4).
Recambio de especies
Los resultados obtenidos indican que las comunidades espacialmente cercanas tienden a presentar mayor similitud florística entre sí que con bosques del mismo tipo en zonas alejadas. La distancia entre parcelas explica el 65 % de la composición florística (prueba de Mantel: P < 0.01, R = -0.65), un porcentaje de correlación alto respecto al de otros estudios que encontraron correlación significativa, donde los valores de la correlación se encuentran entre 0.11-0.67. (Terborgh & Andresen, 1998; Condit et al., 2002; Duivenvoorden et al., 2002; Duque et al., 2002; Vormisto et al., 2004; Castro & Jaksic, 2008; López & Duque, 2010; Zamborlini et al., 2016). Lo anterior sugiere que la distancia geográfica es un buen predictor de la similitud florística y que las limitaciones de dispersión son un importante mecanismo para explicar el recambio florístico en bosques subandinos y de piedemonte en la Orinoquía colombiana.
El análisis de similitud florística mostró que los bosques ribereños de Tame y Támara en Casanare no son florísticamente similares (figura 2). Lo cual sugiere que, en la escala de análisis de este estudio, el régimen de inundación no es un factor ambiental que determine la composición de especies de árboles, favoreciendo evidencia a favor de los procesos estocásticos como controladores del recambio florístico en el área de estudio. Sin embargo, es probable que el esfuerzo de muestreo no sea suficiente para soportar el patrón observado; se requerirá un mayor número de parcelas para hacer afirmaciones confiables acerca de la importancia relativa del régimen de inundación en la diversidad beta de bosques de piedemonte. Estudios futuros deberían complementar el muestreo y emplear métodos numéricos adicionales como, por ejemplo, los propuestos por Legendre et al. (2005) para evaluar la partición de la varianza en componentes independientes: espacial, ambiental, combinado y residual. Así mismo, se deberían incluir variables funcionales, dado que un amplio número de publicaciones sugiere que la diversidad funcional, en lugar de la diversidad de especies, mejora el funcionamiento de los ecosistemas (Loiseau et al., 2017). Adicionalmente, para futuras investigaciones se sugiere que los bosques ribereños sean segregados en diques de ribera y planos de inundación como unidades distintas para evaluar su efecto en los resultados del análisis de diversidad beta, dadas sus diferencias en los regímenes de inundación, que podrían generar variaciones en la composición florística y afectar la interpretación del análisis de similitud florística.
CONCLUSIONES
Los resultados de este estudio mostraron que la riqueza florística en los bosques subandinos de la vertiente orinoquense fue significativamente más baja que la reportada por otros estudios en las vertientes de la Amazonia y el Pacífico. Sin embargo, fue similar a la registrada en la vertiente del Magdalena. Las diferencias climáticas y la influencia de la riqueza de tierras bajas adyacentes a cada vertiente son posibles explicaciones a estos resultados.
La distancia geográfica resultó ser un buen predictor de la similitud florística, lo que permite sugerir que las limitaciones de dispersión son un importante mecanismo para explicar el recambio florístico en bosques subandinos y de piedemonte en la Orinoquía colombiana. Mayor esfuerzo de muestreo y análisis numéricos más robustos serán necesarios para concluir acerca de la importancia relativa del régimen de inundación como variable explicativa del recambio florístico.
Finalmente, se encontró que la composición florística no presentó ningún patrón diferente al previamente reportado para la Orinoquía y el neotrópico; además, coincide con los reportes de estudios previos para el área de estudio.
AGRADECIMIENTOS
Esta investigación fue desarrollada en el marco de los proyectos "Conservación de especies amenazadas en el área de influencia del oleoducto Bicentenario", convenio de cooperación n.° 1514-172-010CE entre el Instituto de Investigación de Recursos Biológicos Alexander von Humboldt y la Fundación Reserva Natural La Palmita, Centro de Investigación; y "Caracterización de humedales, riqueza de ecosistemas de piedemonte y montaña, identificación de incentivos socioeconómicos para la conservación y servicios ecosistémicos asociados a adaptación de cambio climático en el departamento de Casanare", contrato de consultoría .n.° 1918 de 2014 entre la Gobernación del Casanare y el consorcio Casanare Biodiversa.
REFERENCIAS BIBLIOGRÁFICAS
Aldana, A.M. (2005). Patrones de regeneración y diversidad florística en fragmentos de bosque con intervención antrópica en el piedemonte llanero, Colombia (Trabajo de pregrado de Biología). Bogotá: Universidad de los Andes. 90 p.
Alvira, D. (1997). Estructura y composición florística de cuatro estadios sucesionales de bosque húmedo tropical en el piedemonte llanero (Trabajo de pregrado, Biología). Bogotá: Universidad de los Andes. 48 p.
Angiosperm Phylogeny Group APG IV. (2016). An update of the Angiosperm Phylogeny Group classification for the orders and families of flowering plants: APG IV. Botanical Journal of the Linnean Society , 181, 1-20.
Bell, G. (2001). Neutral macroecology. Science, 293, 2413-2418. DOI:https://doi.org/10.1126/science.293.5539.2413
Bernal, R., Gradstein, S.R., & Celis, M. (eds.). (2015). Catálogo de plantas y líquenes de Colombia. Bogotá : Instituto de Ciencias Naturales, Universidad Nacional de Colombia. 1504 p.
Bray, J.R., & Curtis, J.T. (1957). An ordination of upland forest communities of southern Wisconsin. Ecological Monographs , 27, 325-349. DOI:https://doi. org/10.2307/1942268
Calderón, J. M., Moreno, C.E., & Zuria, I. (2012). La diversidad beta: medio siglo de avances. Revista mexicana de biodiversidad , 83(3), 879-891. DOI: https://doi.org/10.7550/rmb.2551
Cano, A., & Stevenson, P. (2009). Diversidad y composición florística de tres tipos de bosque en la estación biológica Caparú, Vaupés. Colombia Forestal , 12, 63-80. DOI:https://doi.org/10.14483/udistrital. jour.colomb.for.2009.1.a06
Castro, S., & Jaksic, F. (2008). Patterns of turnover and floristic similarity show a non-random distribution of naturalized flora in Chile, South America. Revista Chilena de Historia Natural , 81, 11-121. DOI:https://doi.org/10.4067/S0716-078X2008000100009
Chao, A. (1984). Nonparametric estimation of the number of classes in a population. Scandinavian Journal of statistics , 1 1,265-270.
Colwel, R.K. (2013). EstimateS: Statistical stimation of species richness and shared species from samples. Versión 9. Recuperado de:purl.oclc.org/estimates
Condit, R., Pitman, N., Leigh, E.G., Chave, J., Terborgh, J., Foster, R.B., Nuñez, V.P., Aguilar, S., Valencia, R., Villa, G., Muller-Landau, H.C., Losos, E., & Hubbell, S.P. (2002). Betadiversity in tropical forest trees. Science ,295, 666-669. DOI:https://doi.org/10.1126/science.1066854
Córdoba, M., Miranda, L., Avila, R., & Pérez, C. (2011). Flora de Casanare. En J.S. Usma & F. Trujillo (eds.) Biodiversidad del Casanare: ecosistemas estratégicos del departamento (pp. 82-101). Bogotá: Gobernación de Casanare-WWF Colombia.
Cornell, H.V., & Lawton, J.H. (1992). Species interactions, local and regional processes, and limits to the richness of ecological communities: a theoretical perspective. Journal of Animal Ecology , 61, 1-12. DOI:https://doi.org/10.2307/5503
Duivenvoorden, J.F., Svenning, J.C., & Wright, S.J. (2002). Beta diversity in tropical forests. Science , 295, 636-637.
Duque, A., Sánchez, M., Cavelier, J., & Duivenvoorden, J.F. (2002). Different floristic patterns of woody understorey and canopy plants in Colombian Amazonia. Journal of Tropical Ecology , 18, 499.525. DOI: https://doi.org/10.1017/S0266467402002341
Ferreira, C.S., Piedade, M.T., Franco, A.C., Gongalves, J.F., & Junk, W.J. (2009). Adaptive strategies to tolerate prolonged flooding in seedlings of floodplain and upland populations of Himatanthus sucuuba, a Central Amazon tree. Aquatic Botany , 90, 246-252. DOI: https://doi.org/10.1016/).aquabot.2008.10.006
Franco, P., Bentacur, J., & Alonso, J.L. (1997). Diversidad florística en dos bosques subandinos del sur de Colombia. Caldasia , 19(1-2), 205-234.
Galindo-T., R., Betancur, J., & Cadena-M., J.J. (2003). Estructura y composición florística de cuatro bosques andinos del santuario de flora y fauna Guanentá-alto río Fonce, cordillera Oriental colombiana. Caldasia , 25(2), 313-335.
Garavito, J., Suárez, C., Bravo, A., Vargas, R., Cuadros, L., Córdoba, M., Miranda, L., Martínez, J., & Usma, J. (2011). Descripción del medio natural del departamento del Casanare. En J.S. Usma & F. Trujillo (eds)Biodiversidad del Casanare: ecosistemas estratégicos del departamento (pp. 50-71). Bogotá: Gobernación de Casanare-WWF Colombia .
Garssen, A.G., Baattrup-Pedersen, A., Voesenek, L.A., Verhoeven, J.T., & Soons, M.B. (2015). Riparian plant community responses to increased flooding: A meta-analysis. Global Change Biology , 21,2881-2890. DOI:https://doi.org/10.1111/gcb.12921
Gentry, A.H. (1982). Patterns of neotropical plant diversity. Evolutionary Biology , 15, 1-84.
Gentry, A.H. (1988). Tree species richness of upper Amazonian forests. Proceedings of the National Academy of Sciences of the United States of America , 85, 156-159. DOI:https://doi.org/10.1073/pnas.85.1.156
Gentry, A.H. (1995). Patterns of diversity and floristic composition in neotropical montane forest. En S.P. Churchill, H. Balslev, E. Forero & J.L. Luteyn (eds.) Biodiversity and conservation of neotropical montane forests(pp. 103-126). New York: The New York Botanical Garden.
Hammer, 0., Harper, D.A.T., & Ryan, P.D. (2001). PAST: Paleontological statistics software package for education and data analysis. Palaeontologia Electronica , 4, 1-9.
Hubbell, S.P., Foster R.B., O'Brien, S.T., Harms, K.E., Condit, R., Wechsler, B., Wright, S.J., & Loo de Lao S. (1999). Light-gap disturbances, recruitment limitation, and tree diversity in a neotropical forest. Science , 283, 554-557.
Hutchinson, G.E. (1957) Concluding remarks. Cold Spring Harbor Symposia on Quantitative Biology , 22, 415-427. DOI:https://doi.org/10.1101/ SQB.1957.022.01.039
Instituto Geográfico Agustín Codazzi (Igac). (1999). Casanare, características geográficas. Bogotá: Gobernarán de Casanare, Corporinoquía, Organización de los Estados Iberoamericanos, BP Exploration Company, Ecopetrol, Triton Colombia y Total Exploration Exprodukhe Maatchappisbu. 180 p.
Instituto Geográfico Agustín Codazzi (Igac). (2014). Estudio general de suelos y zonificación de tierras departamento de Casanare, escala 1:100 000. Bogotá: Imprenta Nacional de Colombia.
Kessler, M., Grytnes, J.A., Halloy, S.R., Kluge, J., Kromer, T., León, B., & Young, K.R. (2011). Gradients of plant diversity: local patterns and processes. En S.K. Herzog, R. Martínez, P.M. Jorgensen & H. Tiessen (eds.) Climate change and biodiversity in the tropical Andes (pp. 204-219). Sao José dos Campos y París: Instituto Interamericano para la Investigación del Cambio Global y Comité Científico sobre Problemas del Medio Ambiente.
Legendre, P., Borcard, D., & Peres-Neto, P. (2005). Analyzing beta diversity: Partitioning the spatial variation of community composition data. Ecological Monographs , 75, 435-450. DOI:https://doi.org/10.1890/05-0549
Loiseau, N., Legras, G., Gaertner, J., Verley, P., Chabanet, P., & Mérigot, B. (2017). Performance of partitioning functional beta-diversityindices: Influence of functional representation and partitioning methods. Global Ecology and Biogeography , 26, 753-762.
López, W., & Duque, A.J. (2010). Tasas de recambio florístico de géneros en bosques montanos del neotrópico. Caldasia , 32(1), 175-189.
Marcelo-Peña, J.L., & Reynel, C. (2014). Patrones de diversidad y composición florística de parcelas de evaluación permanente en la selva central de Perú. Rodriguesia , 65(1), 35-47. DOI:https://doi. org/10.1590/S2175-78602014000100003
Minorta, V., & Rangel, O. (2015). La riqueza y la diversidad de las plantas con flores de la Orinoquia colombiana. En O. Rangel (ed.) Colombia Diversidad Biótica XIV La región de la Orinoquia de Colombia (pp. 237-418). Bogotá: Instituto de Ciencias Naturales, Universidad Nacional de Colombia .
Naiman, R.J., & Decamps, H. (1997). The ecology of interfaces: riparian zones. Annual Review of Ecology and Systematics , 28(1), 621-658. DOI: https://doi.org/10.1146/annurev.ecolsys.28.1.621
Normand, S., Vormisto, J., Svenning, J.C., Grandez, C., & Balslev, H. (2006). Geographical and environmental controls of palm beta diversity in paleo-riverine terrace forests in Amazonian Peru. Plant Ecology , 186, 161-176. DOI:https://doi.org/10.1007/s11258-006-9120-9
Pérez, C. (2005). Análisis comparativo de la composición y estructura de la vegetación riparia de tres rangos altitudinales, en un fragmento de bosque de piedemonte de la reserva forestal protectora cuenca alta del caño Vanguardia y quebrada Vanguardiuno (RFPVV), Villavicencio-Meta. (Trabajo de pregrado, Ecología). Bogotá: Pontificia Universidad Javeriana. 110 p.
Phillips, O.L., Vargas, P., Monteagudo, A., Cruz, A., Zans, M.E., Sánchez, W., Yli-Halla, M., & Rose, S. (2003). Habitat association among Amazonian tree species: a landscape-scale approach. Journal of Ecology , 91, 757-775. DOI:https://doi. org/10.1046/j.1365-2745.2003.00815.x
Potts, M.D., Ashton, P.S., Kaufman, L.S., & Plotkin, J.B. (2002). Habitat patterns in tropical rain forests: a comparison of 105 plots in northwest Borneo. Ecology , 83(10), 2782-2797. DOI: https://doi.org/10.1890/0012-9658(2002)0832.0.CO;2
Prada, C.M., & Stevenson, P.R. (2016). Plant composition associated with environmental gradients in tropical montane forests (Cueva de Los Guacharos National Park, Huila, Colombia). Biotropica , 48(5), 568-576. DOI:https://doi.org/10.1111/btp.12331
Purcell, A. (2016). Functional trait variation along a hydrological gradient and trait-based predictions of the composition of a wetland plant community (Trabajo de grado de Maestría, Ciencias Biológicas). Hamilton, New Zealand: The University of Waikato. 79 p.
R Core Team. (2016). R: A language and environment for statistical computing. Vienna: R Foundation for Statistical Computing. Recuperado de: https://www.R-project.org/.
Rangel-Ch., J.O., Aguilar, M., Sánchez, H., Lowy-C., P., Aguilar, M., & Castillo, A. (1995). Región de la Orinoquia. En J.O. Rangel-Ch. (ed.) Colombia diversidad biótica I (pp. 239-254). Bogotá: Instituto de Ciencias Naturales. Universidad Nacional de Colombia.
Reynel-R., C., & Antón, D. (2004). Diversidad y composición de la flora arbórea en un área ribereña de bosque montano: Pichita, Valle de Chanchamayo, 2000-2500 msnm. En D. Antón y C. Reynel (eds.) Relictos de Bosques de Excepcional Diversidad en los Andes Centrales del Perú (pp. 99-323). Lima: Herbario de la Facultad de Ciencias Forestales, Universidad Nacional Agraria La Molina.
Rodríguez, N., Armenteras, D., Morales, M., & Romero, M. (2004). Ecosistemas de los Andes colombianos. Bogotá: Instituto de Investigaciones Alexander von Humboldt. 155 p.
Socolar, J.B., Gilroy, J.J., Kunin, W.E., & Edwards, D.P. (2016). How should beta-diversity inform biodiversity conservation? Trends in Ecology and Evolution , 31(1), 67-80.
Terborgh, J., & Andresen, E. (1998). The composition of Amazonian forests: patterns at local and regional scales. Journal of Tropical Ecology , 14, 645-664. DOI: https://doi.org/10.1017/S0266467498000455
Ter Steege, H., Sabatier, D., Castellanos, H., van Andel, T., Duivenvoorden, J., De Oliveira, A.A., Ek, R., Lilwah, R., Maas, P., & Mori, S. (2000). An analysis of the floristic composition and diversity of Amazonian forests including those of the Guiana Shield. Journal of Tropical Ecology , 16, 801-828. DOI: https://doi.org/10.1017/S0266467400001735
Tuomisto, H., Ruokolainen, K., & Yli-Halla, M. (2003). Dispersal, environment, and floristic variation of western Amazonian forests. Science , 299, 241-244. DOI: https://doi.org/10.1126/science.1078037
Vélez, J.I., Poveda, G., & Mesa, O.J. (2000). Balances hidrológicos de Colombia. Serie del Posgrado en Recursos Hidráulicos , 16.
Villarreal, H., Álvarez, M., Córdoba, S., Escobar, F., Fagua, G., Gast, F., Mendoza, H., Ospina, M., & Umaña, A. (2006). Manual de métodos para el desarrollo de inventarios de biodiversidad. Bogotá: Instituto de Investigación de Recursos Biológicos Alexander von Humbold. 236 p.
Viña, A. (1995). Influencia de la fragmentación de bosques sobre la riqueza de especies de árboles en el piedemonte llanero (Trabajo de pregrado, Biología). Bogotá: Universidad de los Andes. 57 p.
Vormisto, J., Svenning, J.C., Hall, P., & Balslev, H. (2004). Diversity and dominance in palm (Arecaceae) communities in terra firme forests in the western Amazon basin. Journal of Ecology , 92, 577-588.
Whittaker, R.H. (1956) Vegetation of the great Smoky Mountains. Ecological Monographs , 26, 1-80. DOI: https://doi.org/10.2307/1943577
Wittmann, F., Householder, E., Piedade, M.T., Assis, R.L., Schongart, J., & Parolin, P. (2013). Habitat specificity, endemism and the neotropical distribution of Amazonian white-water floodplain trees. Ecography , 36, 690-707. DOI: https://doi. org/10.1111/j.1600-0587.2012.07723.x
Zamborlini, F., Brown, J.L., Thomas, W.W., de OliveiraFilho, A.T., & Carnaval, A.C. (2016). Environmental correlates of floristic regions and plant turnover in the Atlantic Forest hotspot. Journal of Biogeography , 43(12), 2322-2331. DOI: https://doi.org/10.1111/jbi.12774
CONFLICTO DE INTERESES
Los autores declaran no tener conflicto de intereses.
CONTRIBUCIÓN POR AUTOR
El autor único es responsable de la obra en todos los aspectos que condujeron a la elaboración de su publicación.
Recibido: 2 de marzo de 2017; Aceptado: 28 de agosto de 2017
Resumen
El mecanismo de neutralidad propone que la diversidad beta es controlada por limitaciones de dispersión y que la similitud florística está correlacionada con la distancia geográfica. En este trabajo se evaluó dicha hipótesis y se comparó la riqueza de bosques subandinos de la Orinoquía con otras vertientes en Colombia, Ecuador y Perú. Se usó una prueba de Mantel para evaluar la correlación entre distancia y similitud florística en 19 parcelas de 0.1 ha y una prueba de Mann-Whitney para el análisis comparativo de riqueza. Se encontró que la distancia fue buen predictor de la similitud florística, sugiriendo que las limitaciones de dispersión son un mecanismo importante para explicar el recambio. La riqueza hallada (47-84 especies) fue significativamente más baja que en las vertientes Amazonía y Pacífico de los Andes, pero similar a la reportada en la vertiente Magdalena. La composición florística estuvo de acuerdo con el patrón reportado previamente para Orinoquía.
Palabras clave:
bosque ribereño, bosque de tierra firme, diversidad beta, Orinoquía, similitud florística..Abstract
The neutral theory proposes that the beta diversity is controlled by dispersal limitations and that the floristic similarity between communities is correlated with geographic distances. This work evaluated this hypothesis and compared the richness of Orinoco's subandine forests with forests in other slopes in Colombia, Ecuador and Peru. The Mantel test was used to evaluate the correlation between distance and floristic similarity in 19 plots of 0.1 ha and the Mann-Whitney test for a comparative richness analysis. We found that distance was a good predictor of floristic similarity, suggesting that dispersal limitations represent an important mechanism to explain species replacement. The richness found in the Orinoquia slope (47-84 species) was significantly lower than the Amazon and Pacific slopes of the Andes, but was similar to the one reported in the Magdalena slope. Finally, we found a similar plant species composition to that previously reported for Orinoquía.
Key words:
riparian forest, terra firme forests, beta diversity, Orinoquia, floristic similarity..INTRODUCCIÓN
Una buena parte de las investigaciones que se han enfocado en evaluar los determinantes ecológicos en el neotrópico han proporcionado evidencia de que el ensamblaje de nicho es un importante mecanismo para explicar la composición y el recambio de especies en comunidades de plantas (Potts et al., 2002; Phillips et al., 2003; Tuomisto et al., 2003; Prada & Stevenson, 2016; Zamborlini et al., 2016). El ensamblaje de nicho predice que los factores ambientales determinan la presencia o ausencia de especies y, por tanto, la variación de la composición entre los sitios (Whittaker, 1956; Hutchinson, 1957).
Otros estudios, por el contrario, demuestran que las variables espaciales son más importantes que las ambientales para explicar la similitud y el recambio florístico (Condit et al., 2002; Duivenvoorden et al., 2002; Duque et al., 2002; Vormisto et al., 2004). Por ejemplo, el trabajo de Terborgh & Andresen (1998) en la Amazonia encontró que los bosques inundables no fueron similares florísticamente a otros bosques del mismo tipo y que la similitud florística fue debida a la proximidad geográfica entre sitios. Este patrón ha sido explicado mediante procesos estocásticos (Cornell & Lawton, 1992; Hubbell et al., 1999; Bell, 2001), sugiriendo que no son las variables ambientales sino las limitaciones de dispersión las que determinan la similitud florística y el recambio de especies, el cual opera con mayor fuerza en escalas geográficas amplias que en pequeñas (Normand et al., 2006; López & Duque, 2010).
El piedemonte y los bosques subandinos representan subunidades de paisaje de alta importancia biogeográfica, pues se encuentran en la transición entre la sabana y la montaña de la Orinoquía y albergan la mayor proporción de la riqueza florística en la región (Minorta & Rangel, 2015). En el piedemonte, los bosques ribereños y de tierra firme son valiosas coberturas dado que en sus relictos se encuentra contenida la mayor parte de las especies con forma de vida arbórea en esta ecorregión (Rangel, 1995). Los bosques ribereños son ecosistemas asociados a cuerpos de agua que se inundan periódicamente y reciben su influencia regular (Neiman & Decamps, 1997). Es bien documentado que un aumento en la duración, la intensidad y la frecuencia de las inundaciones en bosques ribereños puede conducir a un cambio en la composición de especies (Ferreira et al., 2009, Wittmann et al., 2013). Ya que el exceso de inundación reduce la diversidad local al excluir especies arbóreas intolerantes a la anoxia del suelo (Garssen et al., 2015), seguido por la sustitución de especies adaptadas a las condiciones, debido a estrategias de historia de vida especializadas (Purcell, 2016).
Aunque un buen número de artículos se han enfocado en dilucidar los mecanismos que controlan la riqueza florística y la diversidad beta en el neotrópico, son escasos los trabajos en la vertiente orinoquense de los Andes, una región que se caracteriza por la acelerada transformación de los ecosistemas naturales y los vacíos de información florística (Córdoba et al., 2011). Los análisis de la riqueza son importantes para entender los patrones de la biodiversidad (Calderón et al., 2012), que serán determinantes para plantear acciones de conservación y predecir los efectos de posibles cambios generados por factores naturales o antrópicos (Kessler et al., 2011). Así mismo, se ha sugerido la necesidad de comprender mejor los procesos y patrones subyacentes al mantenimiento y la pérdida de la diversidad beta para conservar efectivamente la diversidad gamma (Socolar et al., 2016).
Basado en lo anterior, este artículo plantea aportar al conocimiento de la diversidad alfa y beta en el piedemonte y bosques subandinos de la Orinoquía, a partir de los siguientes objetivos: 1) medir la composición y riqueza florística y evaluar su variación respecto a otras vertientes andinas del neotrópico; 2) evaluar el recambio de especies entre bosques ribereño, bosques de tierra firme y bosques subandinos y analizar la importancia relativa de la distancia geográfica y el régimen de inundación como controladores de la diversidad beta en bosques de la vertiente orinoquense de los Andes.
MATERIALES Y MÉTODOS
Área de estudio
El estudio se llevó acabo en la región de la Orinoquía, sobre las cuencas hidrográficas de los ríos Pauto (departamento de Casanare) y Casanare (departamento de Arauca), grandes tributarios de la cuenca del río Orinoco; en bosques de piedemonte y subandinos. El piedemonte se ubica en un rango altitudinal de 300-1100 m de altitud (Garavito et al., 2011) y representa la transición entre la vegetación de cordillera y la vegetación de sabana (Rodríguez et al., 2004; Minorta & Rangel, 2015). Este hábitat natural se caracteriza por presentar un clima húmedo tropical, con temperatura promedio de 27°C que pueden disminuir 3°C en época de máxima precipitación entre mayo y julio, o aumentar casi 10°C en época de máxima sequía entre febrero y marzo (Rangel, 1995).
Los bosques subandinos se encuentran entre 950 y 2400 m de altitud; la temperatura media anual oscila entre 16° y 23°C, con un periodo seco de tres meses (IGAC, 1999); suelos de escaso desarrollo génico, desaturados, ácidos y de muy baja fertilidad; el relieve varía de moderadamente empinado hasta escarpado, con pendientes entre 12-75 % (IGAC, 2014).
Los muestreos de vegetación se realizaron en ocho localidades (tabla 1, figura 1) en tres tipos de cobertura. Las coberturas de muestreo fueron: 1) bosques ribereños en el piedemonte de los departamentos Casanare y Arauca, ubicados entre los 390-550 m de altitud, caracterizados por ser zonas transicionales influenciadas regularmente por aguas continentales y que se extienden desde las márgenes de los cursos de agua hacia los límites o las zonas netamente terrestres (Naiman & Decamps, 1997); esta denominación incluye tanto los bosques ubicados en planos de inundación como en los diques de ribera. 2) bosques primarios de tierra firme del piedemonte de Casanare y Arauca ubicados entre los 305-546 m de altitud, que no se encuentran en la ribera de los ríos y no reciben su influencia regular, aunque pueden llegar a tener alto nivel freático o estar atravesados por cuerpos de agua menores; en el área de estudio, esta cobertura presenta niveles medios a bajos de disturbio, causado principalmente por extracción selectiva de especies maderables. 3) bosques subandinos del departamento de Casanare, ubicados en altitudes entre 1500-2000 m sobre pendientes medias a altas.
Tabla 1: Información geográfica de los puntos de muestreo en bosques subandinos y de piedemonte de la vertiente
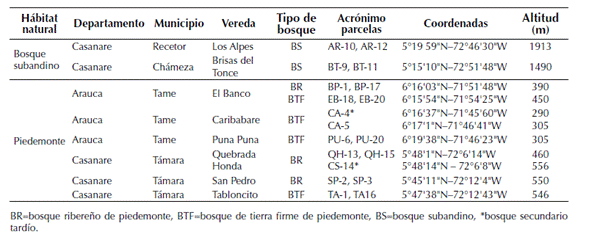
Figura 1: Área de estudio: bosques subandinos y de piedemonte de la vertiente orinoquense de la cordillera de los Andes, Colombia. BP= vereda Brisas del Tonce (Chámeza, Casanare); AR= vereda Los Alpes (Recetor, Casanare); SP=vereda San Pedro (Támara, Casanare); TA= vereda Tabloncito (Támara, Casanare); QH y CS= vereda Quebrada Honda (Támara, Casanare); CA4 y CA5= vereda Caribabare (Tame, Arauca); PU= vereda Puna Puna (Tame, Arauca); BP y EB = vereda El Banco Tame, Arauca).
Trabajo de campo
Empleando el método propuesto por Gentry (1982), se censaron, en 19 parcelas de 0.1 ha, todos los individuos con diámetro del tallo a la altura del pecho (DAP medido a 1.3 m desde la superficie del suelo) mayor o igual a 2.5 cm. Cada parcela de 0.1 ha estaba dividida en 10 subunidades (transectos) de 50 x 2 m paralelas entre sí y separadas al menos por 20 m. En cada cobertura se realizó el levantamiento florístico en los sitios indicados en la tabla 1. Las colecciones botánicas fueron determinadas taxonómicamente en el Herbario Nacional Colombiano (COL) del Instituto de Ciencias Naturales de la Universidad Nacional de Colombia y depositadas en el Herbario Federico Medem del Instituto Humboldt (FMB), con duplicados en COL y en Herbario Amazónico Colombiano (COAH). Los especímenes fueron colectados en el marco del permiso de investigación 500-41-15.07209 de Corporinoquia y del acuerdo 15-14-172-010CE emitido por el Instituto de Investigación de Recursos Biológicos Alexander von Humboldt. La nomenclatura de las especies y familias sigue la empleada en la base de datos del Missouri Botanical Garden, la cual está de acuerdo con el sistema de clasificación APG IV (2016).
Tratamiento de datos
La diversidad alfa (a) se calculó como el número de especies por unidad de área; se computó la riqueza esperada según el estimador Chao1 (Chao, 1984) y se obtuvo la proporción de especies representada en la muestra usando el software StimateS (Colwel, 2013). Se realizó un análisis de similitud florística entre sitios empleando el índice cuantitativo de Bray-Curtis (Bray & Curtis, 1957) con el método UPGMA. Para este análisis se usó el software Past 3.13 (Hammer et al., 2001). Empleando una prueba de Mantel se evaluó la relación entre la similitud florística y la distancia geográfica entre sitios usando el lenguaje R (R Core Team, 2016). Usando la prueba no paramétrica de Mann-Whitney se evaluó si la riqueza obtenida en la vertiente orinoquense de los Andes era significativamente diferente a los resultados de estudios previos en las vertientes Amazónica, Pacífico y Magdalena que usaron la misma metodología de muestreo (gremio de árboles con DAP > 2.5 en parcelas de 0.1 ha), principalmente los estudios compilados por Gentry (1995; 1988). También se usó una prueba de Mann-Whitney para evaluar la diferencia en la riqueza de bosques de piedemonte y subandinos del área de estudio.
RESULTADOS
Composición
Se registraron un total de 4903 individuos pertenecientes a 477 especies, distribuidas en 178 géneros y 72 familias. El 44 % de los taxones fueron determinados hasta especie, 39 % hasta género, 13.8 % hasta familia y el 3.2 % indeterminados. En el piedemonte, Fabaceae fue la familia con mayor riqueza genérica y específica, mientras que en el bosque subandino fue Lauraceae por su riqueza específica y Rubiaceae por su riqueza genérica (tabla 2). Moraceae se encontró entre las cinco familias más diversas en piedemonte, pero no en bosque subandino, mientras que Meliaceae resultó ser diversa en bosque subandino pero no en piedemonte. Melastomataceae, Rubiaceae y Euphorbiaceae resultaron ser elementos florísticos de importancia en ambos hábitats naturales (tabla 2). En cuanto a la composición y riqueza a nivel de género se encontró que Inga (Fabaceae) y Miconia (Melastomataceae) fueron los taxones mejor representados en el piedemonte, con 12 especies cada uno (3.5 % del total), mientras que en el bosque subandino Miconia, con 10 especies (3.47 %), resultó ser el género mejor representado, seguido por Ocotea (Lauraceae) y Trichilia (Meliaceae) con ocho especies cada uno (4.82 %; tabla 3). Miconia e Inga registraron alta diversidad tanto en piedemonte como en bosque subandinos; sin embargo, Ficus (Moraceae), Sapium (Euphorbiaceae) y Annona (Annonaceae) lo fueron únicamente para piedemonte y Ocotea (Lauraceae), Trichilia (Lauraceae) y Nectandra (Lauraceae) para bosque subandino (tabla 3)
Tabla 2: Familias más diversas en bosques subandinos y de piedemonte de la vertiente orinoquense de la Cordillera Oriental de los Andes en Colombia y Nectandra (Lauraceae) para bosque subandino (tabla 3).
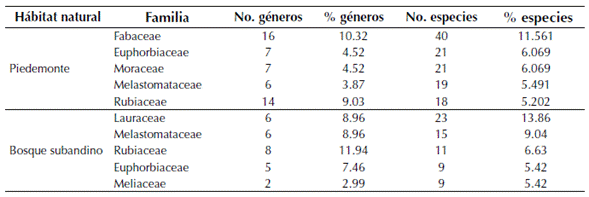
Tabla 3: Géneros más diversos en bosques subandinos y de piedemonte de la vertiente orinoquense de la Cordillera Oriental de los Andes de Colombia.
De las cuatro especies más abundantes registradas en todo el muestreo Rudgea crassiloba (Benth.) B.L. Rob. (Rubiaceae) y Siparuna guianensis Aubl. (Siparunaceae) se encontraron en las localidades de piedemonte (Támara y Tame), mientras que Socratea exorrhiza (Mart.) H. Wendl. (Arecaceae) y Oenocarpus minor Mart. (Arecaceae) se registraron únicamente en la localidad de Tame, pero ninguna de estas en las localidades de bosque subandino (Chámeza y Recetor). R. crassiloba y S. guianensis fueron especies generalistas que dominaron los estratos medios del bosque, con alturas no mayores a los 13 metros, tolerando diferentes tipos de ambiente pero que posiblemente encuentran sus condiciones óptimas de hábitat en bosques secundarios o con intervención antrópica media a alta como los bosques de las veredas Quebrada Honda (CS) y Caribabare (CA). De manera contrastante, Ardisia foetida Willd. ex Roem. & Schult. fue hallada casi exclusivamente en bosques ribereños de Quebrada Honda en Támara, alcanzando altas abundancias únicamente en esta cobertura.
Garcinia madroño (Kunth) Hammel, la quinta especie con mayor abundancia de todo el muestreo se registró en los bosques subandinos y de piedemonte estudiados, resultando ser la especie más generalista. Estas cinco especies constituyen taxones de importancia para la estructura de las comunidades estudiadas. Entre las especies generalistas se encuentra también Alchornea glandulosa Poepp., un taxón que alcanzó alturas de hasta 33 m y que fue registrada tanto en bosques subandinos como en bosques de piedemonte, pero con valores de abundancia mucho más altos en bosques subandinos. Esta especie resultó ser un elemento florístico importante, pues hace parte del grupo de especies que componen el dosel y el estrato emergente de la mayoría de bosques estudiados.
Riqueza
La representatividad del muestreo por parcela varió entre 55-90 %, según el estimador Chao1 (tabla 4), mientras que el cálculo de completitud para todo el muestreo (19 parcelas), mostró valores de 81.4 % y 82.2 %, según los estimadores Chao1 y ACE respectivamente. La riqueza de especies observada por unidad de muestreo arrojó valores entre 47-84 especies (tabla 4, figura 3). Los bosques subandinos registraron valores de riqueza mayores que los bosques de piedemonte, aunque la diferencia no fue significativa (p=0.340), con un promedio de 61 taxones (n=4) y un valor máximo de 84 especies (BT-11); mientras que en bosques de piedemonte la riqueza alcanzó un promedio de 58.9 especies (n=14) por unidad de área y un valor máximo de 80 especies en bosque ribereño (SP-2; tabla 4).
Tabla 4: Riqueza florística por parcelas de 0.1 ha y representatividad de muestreo en bosques subandinos y de piedemonte de la vertiente orinoquense de la Cordillera Oriental de los Andes de Colombia.
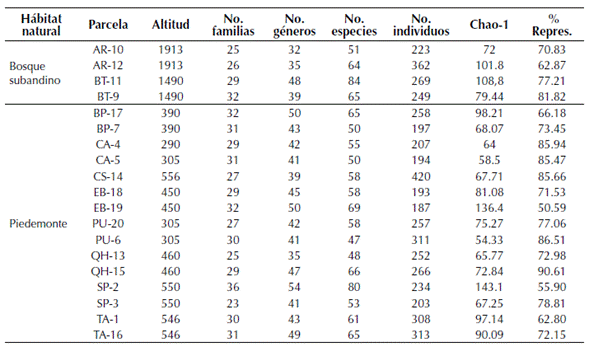
A nivel de géneros, la riqueza por unidad de muestreo en bosques de piedemonte fue mayor que en bosques subandinos, con un registro máximo de 50 taxones en bosque de tierra firme (EB-19) y un promedio de 41.1 géneros (n=14), mientras que en el bosque subandino se registró un valor máximo de 48 géneros (BT-11) y un promedio de 38.5 taxones (n=4) (tabla 4). A nivel de familias la riqueza por unidad de área fue mayor en bosques subandinos que en bosques de piedemonte (tabla 4). Los valores más bajos de riqueza a nivel de especies se registraron en bosques de tierra firme de piedemonte (PU-6) con 47 taxones, mientras que a nivel de género y familia el bosque subandino (AR-10) y el bosque ribereño de piedemonte (QH-13) con 32 y 25 taxones respectivamente, fueron los de menor riqueza.
Recambio de especies
Los bosques estudiados conformaron dos grupos claramente diferenciados (figura 2): 1) bosques subandinos con una similitud florística del 25 % y; 2) bosques de piedemonte, con valores de 21-41 % de similitud entre las localidades de Tame. En los bosques subandinos se encontró una composición florística con predominio de elementos típicos de este hábitat natural, muchos de los cuales fueron exclusivos, estando ausentes en los bosques de piedemonte (Tamara y Tame). Ejemplos de estos elementos son Aniba panurensis (Meisn.) Mez, Billia rosea (Planch. & Linden) C. Ulloa & P. J0rg., Chrysochlamys weberbaueri EnglCybianthus poeppigii Mez, Helicostylis tovarensis (Klotzsch & H. Karst.) C.C., Meriania haemantha (Planch. & Lindl.) Humberto Mend. & Fern. Alonso, Nectandra cf. purpurea (Ruiz & Pav.) Mez, Nectandra cf. reticulata (Ruiz & Pav.) Mez, Siparuna thecaphora (Poepp. & Endl.) A. DC., Wettinia praemorsa (Willd.) Wess. Boer, Joosia umbellifera H. Karst., Arachnothryx glabrata (Standl.) Steyerm. y Miconia dolichorrhyncha Naudin, entre otras. Entre las especies compartidas con bosques de piedemonte se encuentran M. dolichorrhyncha, Miconia trinervia (Sw.) D. Don ex Loudon, Piper arboreum Aubl., Chrysophyllum argenteum Jacq., Henriettella tuberculosa (Donn. Sm.) L.O. Williams e Inga sapindoides Willd., entre otras las más abundantes.
Figura 2: Dendrograma de similitud florística entre bosques subandinos y de piedemonte de la vertiente orinoquense de la Cordillera Oriental de los Andes en Colombia, considernado datos de abundancia (índice de Bray-Curtis).
En el piedemonte, la similitud florística en los bosques estudiados de Tame se debe a la presencia compartida de las siguientes especies en los bosques de las veredas El Banco (EB y BP) y Puna-Puna (PU), que se destacan por su alta abundancia: S. exorrhiza, O. minor, S. guianensis, Tapirira guianensis Aubl., Garcinia madruno (Kunth) Hammel, R. crassiloba (Benth.) B.L.Rob., Annona edulis (Triana & Planch.) H. Rainer, Hieronyma alchorneoides Allemao, Protium calanense Cuatrec. y Schefflera morototoni (Aubl.) Maguire, Steyerm. & Frodin. Por otro lado, en Támara la similitud florística entre bosques de las veredas El Tabloncito (TA) y San Pedro (SP), pese a que son tipos de bosques distintos, resultaron compartir un buen número de taxones destacados por su alta abundancia: S. guianensis, Myrcia fallax (Rich.) DC., Nectandra cuspidata Nees & Mart., Myrcia silvatica Barb. Rodr., Maprounea guianensis Aubl., Dimerocostus strobilaceus Kuntze, Miconia elata (Sw.) DC. y Guarea glabra Vahl. Así mismo, entre las especies más abundantes compartidas entre las localidades de Tame y Támara se encuentran: A. glandulosa, S. guianensis, T. guianensis, A. edulis, S. morototoni, Cecropia ficifolia Warb. ex Snethl., P calanense y Miconia prasina (Sw.) DC. Por otro lado, se encontró que la matriz de similitud florística entre bosques estuvo significativamente correlacionada con la matriz de distancias geográficas (prueba de Mantel: P < 0.0034, R =-0.65, figura 4).
Figura 3: Comparación de la riqueza florística por unidad de área (0.1 ha) de árboles con DAP ≥ 2.5 cm de bosques subandinos (1000 2400 m de altitud) de la vertiente Orinoquia (n=4), Magdalena (n=20) y Amazonia (n= 7) de la Cordillera Oriental con la vertiente Pacífico (n=5) de la Cordillera Occidental. Información de localidades, países y fuente de los datos se presentan en la Tabla 5.
Figura 4: Gráfico de dispersión mostrando la relación entre similitud florística y la distancia geográfica (km) entre muestras (0.2 ha) de bosques subandinos y de piedemonte de la vertiente orinoquense de la Cordillera Oriental de los Andes en Colombia.
DISCUSIÓN
Composición
La composición florística a nivel de familia se ajusta a lo reportado previamente para la Orinoquía colombiana y el neotrópico por franja altitudinal (Gentry, 1988; 1995), siendo la familia Fabaceae la más diversa en bosques de piedemonte por debajo de los 1000 m de altitud y Lauraceae en bosques subandinos entre 1500 y 2000 m de altitud (Córdoba et al., 2011; Bernal et al., 2015; Minorta & Rangel, 2015; tabla 2). Otros estudios coinciden con este resultado, en el que la familia Lauraceae reemplaza a Fabaceae como el taxón con mayor número de especies en elevaciones intermedias a altas (Galindo-T. et al., 2003; Reynel & Antón, 2004; Marcelo-Peña & Reynel, 2014); previamente Gentry (1988; 1995) había encontrado que la cota de 1500 m de altitud en bosques montanos representa el límite de presencia de muchos géneros y familias botánicas, lo que está de acuerdo con los resultados de este estudio. Tres de las cinco familias más representadas en el piedemonte son compartidas con los bosques subandinos (tabla 2), indicando una escasa variación en la composición a este nivel taxonómico, tal como fue sugerido por Gentry (1988), quien encontró que, al menos en tierras bajas del neotrópico, solo 11 familias contribuyen en cerca de la mitad de la riqueza de especies en muestras de 0.1 ha.
De los tres géneros más representados en los sitios de estudio, Miconia e Inga han sido reportados en trabajos previos como los taxones con mayor número de especies tanto en los departamentos de Casanare y Arauca como en otros bosques neotropicales (Gentry, 1995; Córdoba et al., 2011; Bernal et al., 2015), así mismo, Gentry (1995) encontró a Miconia como el género más diversificado en los bosques andinos del neotrópico. Respecto a la composición a nivel de especie, estudios previos en el piedemonte llanero de los departamentos de Meta y Casanare (Viña, 1995; Alvira, 1997; Pérez, 2005; Aldana, 2015), confirman la alta importancia ecológica de S. guianensis en el estrato subarbóreo y G. madroño y A. glandulosa en el estrato arbóreo. En relación a la importancia de palmas en los bosques de piedemonte en Tame (Arauca), es importante destacar que son elementos florísticos relevantes por su abundancia, más que por su diversidad; su presencia destacó en bosques primarios donde al menos tres especies (S. exorrhiza, O. minor y Attalea butyraceae (Mutis ex L. f.) Wess. Boer) presentaron altas abundancias por unidad de área, confirmando que las especies de palmas constituyen un componente estructural y funcional conspicuo en los bosques neotropicales (Terborgh & Andresen, 1998; Gentry, 1988).
Riqueza
De acuerdo con Villarreal et al. (2006), los muestreos que obtienen una representatividad mayor al 85 % pueden ser usados para hacer análisis de similitud y complementariedad; los valores obtenidos en este estudio (81.4 % y 82.2 %) se acercan al valor sugerido, sin embargo un mayor número de parcelas sería requerido para mejorar la completitud, principalmente en bosques subandinos donde el área de muestreo fue de 0.4 ha, mientras en bosques ribereños y de tierra firme de piedemonte fue de 0.8 y 0.7 respectivamente.
La riqueza florística encontrada en los bosques subandinos en parcelas de 0.1 ha (950-2400 m de altitud) de la vertiente orinoquense de los Andes (rango: 51-84, promedio: 66, figura 3) fue significativamente menor (P = 0.0317) a la registrada en estudios previos de la vertientes Pacífico (rango: 81-118, promedio: 100) y amazónica (rango: 72-130, promedio: 97; P= 0.066), sin embargo no mostró diferencias significativas con la vertiente Magdalena (rango: 20-88, promedio: 60.95; P=0.776; figura 3 y tabla 5).
Tabla 5: Riqueza de árboles con DAP ≥ 2.5 cm por parcelas de 0.1 ha en bosques subandinos neotropicales (950-2400 m de altitud) de las vertientes Amazonía, Pacífico y Magdalena.
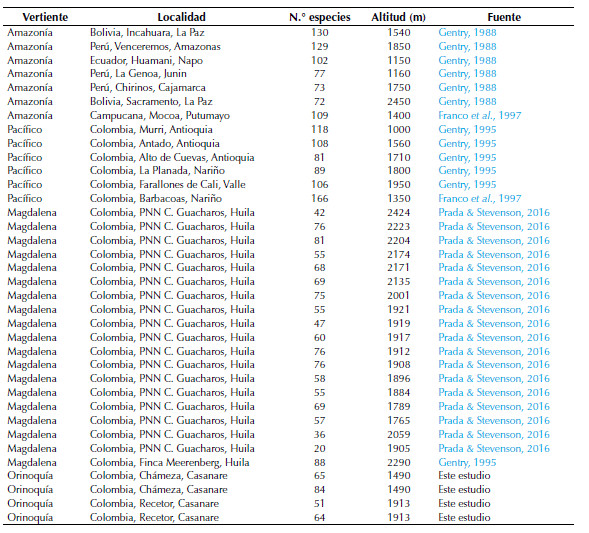
Respecto a la riqueza florística encontrada en el piedemonte orinoquense (tabla 4), otros estudios en el piedemonte llanero han reportado valores de riqueza entre 82-91 especies (Viña, 1995; Alvira, 1997; Pérez, 2005), que aunque son levemente mayores, se encuentran muy cercanos al rango de riqueza reportado en este estudio (rango: 4780, promedio: 58, n=15; tabla 4). En otras regiones biogeográficas como, por ejemplo, el piedemonte amazónico de Ecuador y Perú (Gentry 1988; 1995) los valores de riqueza (rango: 97-184, promedio: 156 spp, n=6) resultaron significativamente mayores a los encontrados en este estudio (P=0.00103). Lo que apoya las afirmaciones de Minorta & Rangel (2015), quienes registran una baja riqueza de especies de plantas con flores en la región de la Orinoquía, respecto a otras regiones como Amazonia y Chocó. Los resultados sugieren que los factores abióticos e históricos que definen la riqueza de árboles en tierras bajas como, por ejemplo, la precipitación que explica la alta riqueza en el Chocó (Gentry, 1988), son determinantes en la riqueza de los Andes, pues sus respectivas vertientes registraron los valores de riqueza más altos comparados con las vertientes de Orinoquía y Magdalena, donde la riqueza de tierras bajas es menor (Minorta & Rangel, 2015). Para la cordillera de los Andes, se ha reportado que los patrones de precipitación están influenciados por el océano Atlántico, el océano Pacífico y la cuenca amazónica y que existen diferencias climáticas marcadas entre la vertiente oriental y occidental y entre diferentes flancos de los valles interandinos (Velez et al., 2000). Aunque se requieren estudios adicionales para evaluarlo, estas diferencias climáticas podrían ser determinantes en la riqueza florística de la región andina.
En relación con la riqueza a través del gradiente de elevación, la diferencia entre el piedemonte y los bosques subandinos no resultó significativa (p=0.340). Sin embargo, el bajo número de parcelas en elevaciones intermedias y altas señalan la necesidad de ampliar el esfuerzo de muestreo para hacer afirmaciones confiables, que permitan aportar al entendimiento de los modelos de variación en el número de especies a lo largo del gradiente altitudinal. Por otro lado, respecto a la riqueza comparativa entre tipos de bosque, otros estudios han sugerido que los bosques de tierra firme son más diversos que los bosques inundables (Ter Steege et al., 2000; Cano & Stevenson, 2009). Dichos resultados no son compartidos con este estudio ya que la diferencia de riqueza entre parcelas de piedemonte y montaña en diferentes tipos de bosque no fue representativa ni consistente entre sitios (tabla 4).
Recambio de especies
Los resultados obtenidos indican que las comunidades espacialmente cercanas tienden a presentar mayor similitud florística entre sí que con bosques del mismo tipo en zonas alejadas. La distancia entre parcelas explica el 65 % de la composición florística (prueba de Mantel: P < 0.01, R = -0.65), un porcentaje de correlación alto respecto al de otros estudios que encontraron correlación significativa, donde los valores de la correlación se encuentran entre 0.11-0.67. (Terborgh & Andresen, 1998; Condit et al., 2002; Duivenvoorden et al., 2002; Duque et al., 2002; Vormisto et al., 2004; Castro & Jaksic, 2008; López & Duque, 2010; Zamborlini et al., 2016). Lo anterior sugiere que la distancia geográfica es un buen predictor de la similitud florística y que las limitaciones de dispersión son un importante mecanismo para explicar el recambio florístico en bosques subandinos y de piedemonte en la Orinoquía colombiana.
El análisis de similitud florística mostró que los bosques ribereños de Tame y Támara en Casanare no son florísticamente similares (figura 2). Lo cual sugiere que, en la escala de análisis de este estudio, el régimen de inundación no es un factor ambiental que determine la composición de especies de árboles, favoreciendo evidencia a favor de los procesos estocásticos como controladores del recambio florístico en el área de estudio. Sin embargo, es probable que el esfuerzo de muestreo no sea suficiente para soportar el patrón observado; se requerirá un mayor número de parcelas para hacer afirmaciones confiables acerca de la importancia relativa del régimen de inundación en la diversidad beta de bosques de piedemonte. Estudios futuros deberían complementar el muestreo y emplear métodos numéricos adicionales como, por ejemplo, los propuestos por Legendre et al. (2005) para evaluar la partición de la varianza en componentes independientes: espacial, ambiental, combinado y residual. Así mismo, se deberían incluir variables funcionales, dado que un amplio número de publicaciones sugiere que la diversidad funcional, en lugar de la diversidad de especies, mejora el funcionamiento de los ecosistemas (Loiseau et al., 2017). Adicionalmente, para futuras investigaciones se sugiere que los bosques ribereños sean segregados en diques de ribera y planos de inundación como unidades distintas para evaluar su efecto en los resultados del análisis de diversidad beta, dadas sus diferencias en los regímenes de inundación, que podrían generar variaciones en la composición florística y afectar la interpretación del análisis de similitud florística.
CONCLUSIONES
Los resultados de este estudio mostraron que la riqueza florística en los bosques subandinos de la vertiente orinoquense fue significativamente más baja que la reportada por otros estudios en las vertientes de la Amazonia y el Pacífico. Sin embargo, fue similar a la registrada en la vertiente del Magdalena. Las diferencias climáticas y la influencia de la riqueza de tierras bajas adyacentes a cada vertiente son posibles explicaciones a estos resultados.
La distancia geográfica resultó ser un buen predictor de la similitud florística, lo que permite sugerir que las limitaciones de dispersión son un importante mecanismo para explicar el recambio florístico en bosques subandinos y de piedemonte en la Orinoquía colombiana. Mayor esfuerzo de muestreo y análisis numéricos más robustos serán necesarios para concluir acerca de la importancia relativa del régimen de inundación como variable explicativa del recambio florístico.
Finalmente, se encontró que la composición florística no presentó ningún patrón diferente al previamente reportado para la Orinoquía y el neotrópico; además, coincide con los reportes de estudios previos para el área de estudio.
Acknowledgements
AGRADECIMIENTOS
Esta investigación fue desarrollada en el marco de los proyectos "Conservación de especies amenazadas en el área de influencia del oleoducto Bicentenario", convenio de cooperación n.° 1514-172-010CE entre el Instituto de Investigación de Recursos Biológicos Alexander von Humboldt y la Fundación Reserva Natural La Palmita, Centro de Investigación; y "Caracterización de humedales, riqueza de ecosistemas de piedemonte y montaña, identificación de incentivos socioeconómicos para la conservación y servicios ecosistémicos asociados a adaptación de cambio climático en el departamento de Casanare", contrato de consultoría .n.° 1918 de 2014 entre la Gobernación del Casanare y el consorcio Casanare Biodiversa.
REFERENCIAS BIBLIOGRÁFICAS
Licencia
Derechos de autor 2018 Colombia Forestal

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial-CompartirIgual 4.0.
Colombia Forestal conserva los derechos patrimoniales (copyright) de las obras publicadas, y favorece y permite la reutilización de las mismas bajo la licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional por lo cual se pueden copiar, usar, difundir, transmitir y exponer públicamente, siempre que:
Se reconozcan los créditos de la obra de la manera especificada por el autor o el licenciante (pero no de una manera que sugiera que tiene su apoyo o que apoyan el uso que hace de su obra).