DOI:
https://doi.org/10.14483/2256201X.19858Publicado:
01-07-2023Número:
Vol. 26 Núm. 2 (2023): Julio-diciembreSección:
Artículos de investigación científica y tecnológicaBiogeografía de islas de los relictos de bosque seco del valle geográfico del río Cauca (Colombia)
Island Biogeography of Dry Forest Relict of the Cauca River Geographical Valley (Colombia)
Palabras clave:
fragmentation, species-area relationship (SAR), phylogenetics, conservation, tropical dry forest (en).Palabras clave:
fragmentación, relación especies-área (SAR), filogenética, conservación, bosque seco tropical (es).Descargas
Referencias
Ackerly, D. D., & Reich, P. B. (1999). Convergence and correlations among leaf size and function in seed plants: a comparative test using independent contrasts. American Journal of Botany 86, 1272-1281. DOI: https://doi.org/10.2307/2656775
Arcadia, L. (2013). Lichen biogeography at the largest scales. The Lichenologist, 45(4), 565-578. https://doi.org/10.1017/S0024282913000170 DOI: https://doi.org/10.1017/S0024282913000170
Brown, J. H., & Kodric-Brown, A. (1977). Turnover rates in insular biogeography: effect of immigration on extinction. Ecology, 58(2), 445-449. DOI: https://doi.org/10.2307/1935620
Casanoves, F., Pla, L., Di Rienzo, J. A., & Díaz, S. (2010). FDiversity: A software package for the integrated analysis of functional diversity. Methods in Ecology and Evolution, 2, 233-237. https://doi.org/10.1111/j.2041-210X.2010.00082.x DOI: https://doi.org/10.1111/j.2041-210X.2010.00082.x
Cavender-Bares, J., Kozak, K. H., Fine, P. V. A. & Kembel, S. (2009). The merging of community ecology and phylogenetic biology. Ecology Letters, 12, 693-715. https://doi.org/10.1111/j.1461-0248.2009.01314.x DOI: https://doi.org/10.1111/j.1461-0248.2009.01314.x
Coleman, B. D., Mares, A. M., Willig, M. R., & Hsieh, Y. H. (1982). Randomness, area, and species richness. Ecology, 63(4), 1121-1133. https://doi.org/10.2307/1937249 DOI: https://doi.org/10.2307/1937249
Connor, E. F., & McCoy, E. D. (1979). Statistics and biology of the species-area relationship. American Naturalist, 113(6), 791-833. https://doi.org/10.1086/283438 DOI: https://doi.org/10.1086/283438
Conrad, O., Bechtel, B., Bock, M., Dietrich, H., Fischer, E., Gerlitz, L., Wehberg, J., Wichmann, V., & Böhner, J. (2015). System for automated geoscientific analyses (SAGA) v. 2.1.4. Geoscientific Model Development, 8(7), 1991-2007. https://doi.org/10.5194/gmd-8-1991-2015 DOI: https://doi.org/10.5194/gmd-8-1991-2015
Fick, S. E., & Hijmans, R. J. (2017). Worldclim 2: New 1-km spatial resolution climate surfaces for global land areas. International Journal of Climatology, 37(12), 4302-4315. https://doi.org/10.1002/joc.5086 DOI: https://doi.org/10.1002/joc.5086
Gaston, K., & Blackburn, T. (2000). Pattern and process in macroecology. Blackwell Science. DOI: https://doi.org/10.1002/9780470999592
Gotelli, N. J., & Entsminger, G. L. (1999). EcoSim: null models software for ecology. Version 4.0. Acquired Intelligence & Kesey-Bear. http://homepages.together.net/gentsmin/ecosim.htm
Guimarães, P. R., & Guimarães, P. (2006). Improving the analyses of nestedness for a large of metrics. Environmental Modelling & Software, 21, 1512-1513. https://doi.org/10.1016/j.envsoft.2006.04.002. DOI: https://doi.org/10.1016/j.envsoft.2006.04.002
Hammer, Ø., Harper, D.A.T. & Ryan, P.D. (2001). PAST-Palaeontological statistics. https://www.uv.es/pardomv/pe/2001_1/past/pastprog/past.pdf
Harvey, P.H. & Pagel, M.D. (1991). The comparative method in evolutionary biology. Oxford University Press.
Helmus, M. R., Bland, T. J., Williams, C. K. & Ives, A. R. (2007). Phylogenetic measures of biodiversity. American Naturalist, 169(3),68-83. https://doi.org/10.1086/511334 DOI: https://doi.org/10.1086/511334
Helmus, M. R., Keller, W., Paterson, M. J., Yan, N. D., Cannon, C. H. & Rusak, J. A. (2010). Communities contain closely related species during ecosystem disturbance. Ecology Letters, 13, 162-174. https://doi.org/10.1111/j.1461-0248.2009.01411.x DOI: https://doi.org/10.1111/j.1461-0248.2009.01411.x
Helmus, M. R., & Ives, A. R. (2012). Phylogenetic diversity-area curves. Ecology, 93, S31-S43. https://doi.org/10.1890/11-0435.1 DOI: https://doi.org/10.1890/11-0435.1
Karadimou, E. K., Kallimanis, A. S., Tsiripidis, I., & Dimopoulos, P. (2016). Functional diversity exhibits a diverse relationship with area, even a decreasing one. Scientific Reports, 6, 35420. https://doi.org/10.1038/srep35420 DOI: https://doi.org/10.1038/srep35420
Laurance, W. F. (2008). Theory meets reality: How habitat fragmentation research has transcended island biogeographic theory. Biological Conservation, 141, 1731-1744. DOI: https://doi.org/10.1016/j.biocon.2008.05.011
Laurance, W. F. (2010). Habitat destruction: Death by a thousand cuts. In N. Sodhi & P. Ehrlich (Eds.), Conservation Biology for All (pp. 73-87). Oxford University Press. DOI: https://doi.org/10.1093/acprof:oso/9780199554232.003.0005
Lomolino, M. V. (2000). Ecology's most general, yet protean pattern: the species±area relationship. Journal of Biogeography, 27, 17-26. DOI: https://doi.org/10.1046/j.1365-2699.2000.00377.x
Lomolino, M., Brown, J., & Davis, R. (1989). Island biogeography of montane forest mammals in the American Southwest. Ecology, 70(1), 18-194. https://doi.org/10.2307/1938425 DOI: https://doi.org/10.2307/1938425
MacArthur, R. H., & Wilson, E. O. (1967). The theory of island biogeography. Princeton University Press.
Mahecha, O., Garlacz, R. M., Andrade, G., Prieto, C., & Pyrcz, T. W. (2019). Island biogeography in continental areas: Inferring dispersal based on distributional patterns of Pronophilina butterflies (Nymphalidae: Satyrinae) in the north Andean massifs. Revista Mexicana de Biodiversidad, 90(1), 2796. https://doi.org/10.22201/ib.20078706e.2019.90.2796 DOI: https://doi.org/10.22201/ib.20078706e.2019.90.2796
Mayfield, M. M., & Levine, J. M. (2010). Opposing effects of competitive exclusion on the phylogenetic structure of communities. Ecology Letters, 13, 1085-1093. https://doi.org/10.1111/j.1461-0248.2010.01509.x DOI: https://doi.org/10.1111/j.1461-0248.2010.01509.x
McCune, B., Grace, J. B., & Urban, D. L. (2002). Analysis of ecological communities (vol. 28). Gleneden Beach, OR: MjM software design.
Méndez-Castro, F., Bader, M. Y., Mendieta-Leiva, G., & Rao, D. (2018). Islands in the trees: A biogeographic exploration of epiphyte‐dwelling spiders. Journal of Biogeography, 45, 2262-2271. https://doi.org/10.1111/jbi.13422 DOI: https://doi.org/10.1111/jbi.13422
Miles, L., Newton, A., DeFries, R., Ravilious, C., May, I., Blyth, S., Kapos, V., & Gordon, J. (2006). A global overview of the conservation status of tropical dry forests. Journal of Biogeography, 33(3), 491-505. https://doi.org/10.1111/j.1365-2699.2005.01424.x DOI: https://doi.org/10.1111/j.1365-2699.2005.01424.x
Patterson, B. D., & Atmar, W. (1986). Nested subsets and the structure of insular mammalian faunas and archipelagos. In L. R. Heaney & B. D. Patterson (Eds.), Island Biogeography of Mammals. Academic DOI: https://doi.org/10.1111/j.1095-8312.1986.tb01749.x
Press, London. 16 pp.
Patiño, J., Whittaker, R. J., Borges, P. A, Fernández‐Palacios, J. M., Ah‐Peng, C., Araújo, M. B., & de Nascimento L. (2017). A roadmap for island biology: 50 fundamental questions after 50 years of The Theory of Island Biogeography. Journal of Biogeography, 44(5), 963-983. https://doi.org/10.1111/jbi.12986 DOI: https://doi.org/10.1111/jbi.12986
Pizano, C., & García, H. (Editores) (2014). El bosque seco tropical en Colombia. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt.
Ramos, J. E., & Silverstone, P. A. (2018). Catálogo de la flora relictual del valle geográfico del río Cauca. Missouri Botanical Garden Press.
Rosenzweig, M. L. (1995). Species diversity in space and time. University of Cambridge Press, Cambridge. DOI: https://doi.org/10.1017/CBO9780511623387
Stan, K., & Sánchez-Azofeifa, A. (2019). Tropical dry forest diversity, climatic response, and resilience in a changing climate. Forests., 10(5), 443. https://doi.org/10.3390/f10050443 DOI: https://doi.org/10.3390/f10050443
Sklenár, P., Hedberg, I., & Cleef, A. M. (2014). Island biogeography of tropical alpine floras. Journal of Biogeography, 41, 287-297. https://doi.org/10.1111/jbi.12212 DOI: https://doi.org/10.1111/jbi.12212
Slik, J. W. F., Franklin, J., Arroyo-Rodríguez, V., Field, R., Aguilar, S., Aguirre, N., Ahumada, J., Aiba, S.-I., Alves, L. F., K., A., Avella, A., Mora, F., Aymard C., G. A., Báez, S., Balvanera, P., Bastian, M. L., Bastin, J.-F, Bellingham, P. J., van den Berg, & E. Zang, R. (2018). Phylogenetic classification of the world's tropical forests. PNAS, 115(8), 1837-1842. https://doi.org/10.1073/pnas.1714977115 DOI: https://doi.org/10.1073/pnas.1714977115
Scheiner, S. M., Chiarucci, A., Fox, G. A., Helmus, M. R., McGlinn, D. J., & Willig, M. R. (2011). The underpinnings of the relationship of species richness with space and time. Ecological Monographs, 81, 195-213. https://doi.org/10.1890/10-1426.1 DOI: https://doi.org/10.1890/10-1426.1
StatSoft (2005). STATISTICA (Data analysis software system), version 7.1. https://www.statsoft.com
Tabarelli, M., Mantovani, W., & Peres, C.A. (1999). Effects of habitat fragmentation on plant guild structure in the montane Atlantic forest of southern Brazil. Biological Conservation, 91, 119-127. https://doi.org/10.1016/S0006-3207(99)00085-3 DOI: https://doi.org/10.1016/S0006-3207(99)00085-3
Tjørve, E. (2003). Shapes and functions of species-area curves: A review of possible models. Journal of Biogeography, 30, 827-835. DOI: https://doi.org/10.1046/j.1365-2699.2003.00877.x
Torres, A. M., Bautista Adarve, J., Cárdenas, M., Vargas, J. A., Londoño, V., Rivera, K., Home, J., Duque, O. L., & González, A. M. (2012). Dinámica sucesional de un fragmento de bosque seco tropical del Valle del Cauca, Colombia. Biota Colombiana, 13(2), 66-85.
Triantis, K. A., Mylonas, M., Lika, K., & Vardinoyannis, K. (2003). A model for the species–area–habitat relationship. Journal of Biogeography, 30, 19-27. https://doi.org/10.1046/j.1365-2699.2003.00805.x DOI: https://doi.org/10.1046/j.1365-2699.2003.00805.x
Webb, C. O., Ackerly, D. D., McPeek, M. A., & Donoghue, M. J. (2002). Phylogenies and community ecology. Annual Review of Ecology, Evolution, and Systematics, 33, 475-505. ttps://doi.org/10.1146/annurev.ecolsys.33.010802.150448 DOI: https://doi.org/10.1146/annurev.ecolsys.33.010802.150448
Wiens, J. J., Ackerly, D. D., Allen, A. P., Anacker, B. L., Buckley, L. B., Cornell, H. V., Damschen, E. L., Davies, J., Grytnes, J.-A., Harrison, S. P., Hawkins, B. A., Holt, R. D., McCain, C. M., & Stephens, P. R. (2010). Niche conservatism as an emerging principle in ecology and conservation biology. Ecology Letters, 13, 1310-1324. https://doi.org/10.1111/j.1461-0248.2010.01515.x DOI: https://doi.org/10.1111/j.1461-0248.2010.01515.x
Williams, C. B. (1943). Area and the number of species. Nature, 152, 264-267. https://doi.org/10.1038/152264a0 DOI: https://doi.org/10.1038/152264a0
Williams, C. B. (1964). Patterns in the balance of nature and related problems in quantitative ecology. Academic Press.
Wright, S. J. (1985). How isolation affects rates of turnover of species on islands. Oikos, 44(2), 331-340. https://doi.org/10.2307/3544708 DOI: https://doi.org/10.2307/3544708
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Recibido: 10 de agosto de 2022; Aceptado: 18 de abril de 2023
Resumen
Este estudio analizó las relaciones entre la riqueza de especies-área y la diversidad filogenética-área en la flora relictual del bosque seco tropical en el valle del río Cauca en Colombia, utilizando un listado de especies de 38 relictos de bosque seco. Se encontró que la riqueza de plantas se ajusta al modelo relación especies-área (SAR), aunque con pendientes más pronunciadas que las islas de hábitat, y que la dispersión de las especies afectó el modelo SAR. Además, las comunidades de plantas presentaron un patrón de anidamiento. El clima no influyó en la riqueza de plantas, pero sí en la composición de especies. La diversidad filogenética no estuvo relacionada con el área, pero se incrementó el agrupamiento filogenético con la misma. En conclusión, la limitación en la dispersión es el factor que estructura la riqueza de plantas en los relictos del bosque seco tropical.
Palabras clave:
fragmentación, relación especies-área (SAR), filogenética, conservación, bosque seco tropical..Abstract
This study analyzed the relationships between species-area richness and phylogenetic diversity-area in the relict flora of the tropical dry forest in the Cauca River valley in Colombia, using a species list from 38 relict sites. The results showed that plant richness followed the species-area relationship (SAR) model, albeit with steeper slopes than expected for habitat islands, and that species dispersion affected the SAR model. Additionally, plant communities showed a nested pattern. Climate did not influence plant richness, but it did affect species composition. Phylogenetic diversity was not related to area, but phylogenetic clustering increased with it. As a conclusion, dispersion limitation is the factor that structures plant richness in tropical dry forest relicts.
Keywords:
fragmentation, species-area relation- ship (SAR), phylogenetics, conservation, tropical dry forest..INTRODUCCIÓN
El bosque seco tropical (bs-T) es uno de los ecosistemas más amenazados del Neotrópico y el mundo (Miles et al., 2006; Stan & Sánchez-Azofeifa, 2019). Se estima que, de las 104 870 000 ha a nivel mundial, en Suramérica se concentra alrededor del 54.2 % (Miles et al., 2006). Debido a la cantidad de asentamientos humanos y a la densidad poblacional presente en estas zonas de bs-T, la pérdida de la cobertura natural es uno de los grandes problemas que enfrenta este ecosistema. Actualmente, Colombia cuenta con apenas el 8 % de su cobertura original de bs-T, que en el pasado cubría más de nueve millones de hectáreas, principalmente en los valles interandinos, el Caribe y la Orinoquía (Pizano & García, 2014). En el Valle del Cauca, este ecosistema ha sido reemplazado por extensos cultivos de caña y pastos para ganadería, por lo cual solo quedan cerca de 500 ha (Pizano & García, 2014).
Actualmente, el bosque seco tropical del valle geográfico del Río Cauca está restringido a pequeños relictos inmersos en una matriz cañera, con poca conectividad. Esta fragmentación genera cambios en la estructura y microclima de los bosques, siendo estos efectos más fuertes en los relictos más pequeños (Laurance, 2008, 2010). Por ejemplo, los mayores niveles de radiación solar en hábitats abiertos fuera de los fragmentos aumentan la temperatura del aire, la velocidad del viento y la disponibilidad de luz, lo que resulta en una menor humedad del aire y del suelo cerca del borde del fragmento (Tabarelli et al., 1999). Sin embargo, los patrones de diversidad en estos fragmentos de bosque seco han sido poco estudiados desde el punto de vista botánico, y el trabajo más detallado es un catálogo de flora reciente (Ramos & Silverstone, 2018), que reúne información recopilada por más de 20 años.
La macroecología permite estudiar patrones empíricos a gran escala de la distribución de la abundancia, la riqueza y los rasgos, tratando de responder preguntas que serían imposibles de responder desde la ecología tradicional (Gaston & Blackburn, 2000). Ampliamente estudiada, la relación especies-área (SAR, por sus siglas en inglés) es uno de estos patrones, y establece que la riqueza de especies se relaciona con el área de una isla, y que es determinada por un equilibrio entre las tasas de colonización y de extinción de las especies. El modelo SAR que más ampliamente ocurre es el log-lineal (LogS=zlogA+C), cuyos parámetros varían según el grupo taxonómico, la capacidad de dispersión, el tipo de islas y la densidad de especies: el parámetro z es la pendiente del modelo y varía con respecto al grupo taxonómico y el nivel de aislamiento, y el parámetro C está relacionado con la densidad de especies y también varía con el taxón y la región biogeográfica (Triantis et al., 2003). La biogeografía de islas es una teoría con amplias aplicaciones, desde el estudio de bromelias como islas hasta el estudio de la fragmentación de ecosistemas (Rosenzweig, 1995; Lomolino, 2000; Tjørve, 2003; Scheiner et al., 2011). Se han planteado dos hipótesis para explicar la SAR, i.e., diversidad de hábitat (procesos basados en nicho) y muestreo pasivo (procesos de distribución al azar) (Williams, 1943, 1964; Connor & McCoy, 1979; Coleman et al., 1982), aunque los factores históricos también tienen un rol importante (Patiño et al., 2017). La SAR se ha estudiado para varios sistemas de islas, desde islas oceánicas, continentales e internas (lagos o montañas) hasta epífitas como islas (Méndez-Castro et al., 2018), pero aún existen innumerables preguntas por responder (Patiño et al., 2017). Entre estas cuestiones por estudiar está la relación diversidad filogenética-área (PDAR), con escasos estudios relacionados. La diversidad filogenética puede ayudar a entender los procesos ecológicos subyacentes al modelo SAR (Harvey & Pagel, 1991; Ackerly & Reich, 1999; Webb et al., 2002; Wiens et al., 2010). De esta manera, estudiar la PDAR puede ayudar a entender los mecanismos que determinan la biodiversidad en un sistema.
La ecología de la vegetación del bosque seco en el Valle del Cauca es poco conocida, con algunos estudios relacionados con la biomasa, la dinámica temporal y la fenología (Torres et al., 2012). De esta manera, las aproximaciones macroecológicas pueden ayudar a entender patrones de dispersión, plantear otras preguntas y mejorar los planes de manejo/conservación de este ecosistema. Así, el objetivo de este trabajo fue evaluar la relación entre riqueza de especies y diversidad filogenética con el área (SAR y DPAR) para la flora relictual del bs-T del valle geográfico del Río Cauca.
MATERIALES Y MÉTODOS
Área de estudio
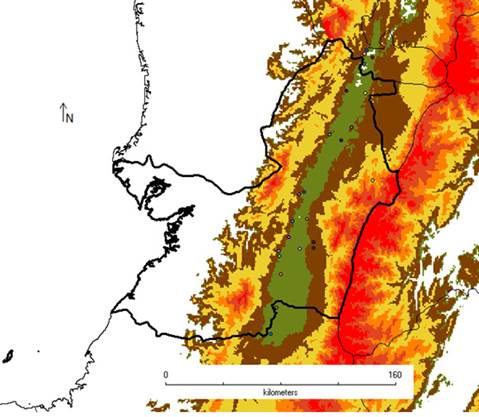
El valle geográfico del Río Cauca es una región que comprende los territorios interandinos de los departamentos de Cauca, Risaralda y Valle (Figura 1). Tiene una extensión de 240 km de largo y entre 24 y 40 km de ancho a lo largo del Río Cauca, con un área total de 4400 km2. Presenta una temperatura media anual de 23.5-26 °C, y la precipitación es bimodal, con épocas lluviosas en marzo-mayo y septiembre-noviembre. El rango de precipitación varía entre 924 y 1827 mm. Esta región está dominada por el monocultivo de caña de azúcar e intermitentemente por áreas de bs-T en diferentes estados de conservación y áreas de inundación por desbordamiento de ríos. Estos relictos de bosque seco son, en su mayoría, secundarios a muy perturbados, sumando casi 500 ha (Tabla 1). En este estudio, se tuvieron en cuenta solo 38 fragmentos que cuentan con inventarios de su flora (Ramos & Silverstone, 2018) (Tabla 1).
Tabla 1: Fragmentos de bosque seco tropical y sus áreas para el valle geográfico del Río Cauca
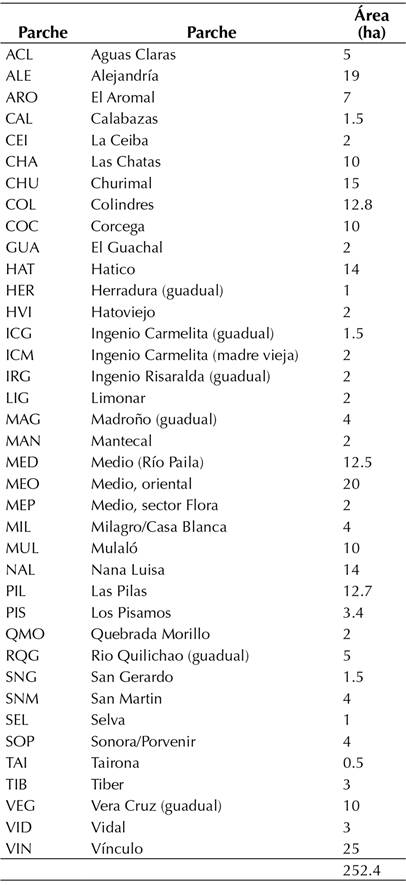
Figura 1: Mapa del valle geográfico del Río Cauca mostrando el área de bosque seco tropical (verde) y los fragmentos de bosque estudiados (puntos)
Recopilación de datos
Inicialmente, se construyó una lista de especies de plantas vasculares presentes en relictos de bosque seco del valle geográfico del Río Cauca. Este listado se extrajo del catálogo de la flora relictual del valle geográfico del río (Ramos & Silverstone, 2018), que incluye 875 especies. Se incluyó información como el nombre de la especie, su familia, su hábito y su tipo de dispersión. Se construyeron dos matrices según la capacidad de dispersión: especies de dispersión amplia (ornitocoria o anemocoria) y especies de dispersión limitada (autocoria o similares). Esto, en aras de evaluar el efecto de la dispersión sobre el modelo de biogeografía de islas. De esta manera, se obtuvieron 184 especies de dispersión limitada y 691 de dispersión amplia. También se extrajo información referente a los relictos de bosque, como localidad, coordenadas geográficas, área y elevación. Con base en las coordenadas de cada relicto, se estimó la distancia entre estos.
Por otro lado, se descargaron datos climáticos del WorldClim 2.0 (Fick & Hijmans, 2017). Se usaron las variables bioclimáticas Bio1 (temperatura promedio anual), Bio2 (variación de la temperatura), Bio12 (precipitación promedio) y Bio15 (variabilidad de la precipitación). Estas variables fueron las que mostraron mayor variación entre los relictos (según un análisis de componentes principales). Además, estas variables se eligieron para evitar la colinealidad, de acuerdo con las correlaciones de Pearson (r>0.7). Posteriormente, se estimaron los valores de todas las variables para cada relicto de bosque seco usando Saga-gis (Conrad et al., 2015).
Análisis de datos
Se realizaron análisis de regresión lineal entre la riqueza de especies y área de cada relicto de bosque seco y las variables transformadas a escala logarítmica, obteniendo así los parámetros de pendiente (z) e intercepto (c). Por otro lado, para evaluar el aislamiento, se tuvo en cuenta la distancia entre remanentes, la cual se calculó como la distancia geográfica con base en las coordenadas de cada remanente (centroide). Para evaluar el efecto del aislamiento, se hizo un análisis de bordes entre las distancias promedio de un remanente a todos los demás y la riqueza del mismo. Se usaron pruebas de bordes, debido a que los datos forman masas de puntos con patrones de agregación, por lo cual no fue posible usar correlaciones o regresiones (Gotelli & Entsminger, 1999). Las pruebas de bordes se efectuaron en el programa EcoSim (Gotelli & Entsminger, 1999), mientras que los análisis de regresión en el software Statistica, versión 7.1 (StatSoft, 2005).
Por otro lado, el recambio de especies se midió mediante el índice de Jaccard (0-1). Se usó este en lugar del índice de Simpson, debido a que es menos sensible a fuertes diferencias en los listados de especies por localidad (Arcadia, 2013). Posteriormente, se realizaron pruebas de bordes entre el recambio de especies y la distancia geográfica entre relictos (comparación entre parejas).
Para evaluar el efecto del tipo de dispersión (amplia vs. limitada) sobre los modelos de biogeografía de islas, se realizaron dos análisis de regresión: uno entre la riqueza de especies con dispersión amplia (ornitocoria o anemocoria) y el área, y otro entre la riqueza de especies con dispersión limitada (autocoria o similares) y el área. Asimismo, se estimó el efecto del aislamiento (distancia geográfica) sobre la riqueza y recambio de especies para los dos grupos de dispersión (análisis de bordes).
El anidamiento, o la formación de subgrupos de especies incluidas en grupos mayores (e.g., islas más grandes), se midió mediante la temperatura (Ta) de la matriz de especies x relictos. Posteriormente, se determinó la correlación de Spearman entre el orden de anidamiento de cada relicto y las variables climáticas y el área. Se estimaron dos modelos para medir el grado de anidamiento, o Ta (Er y Ce), (Guimarães & Guimarães, 2006). Los cálculos del grado de anidamiento se realizaron con el programa ANINHADO (Guimarães & Guimarães, 2006).
Para evaluar el efecto de las variables climáticas y el área sobre la composición de especies, se hizo un escalamiento no métrico multidimensional (NMS) con el índice de Simpson. Este análisis permite ordenar las unidades de muestreo (relictos) de acuerdo con su composición de especies, así como establecer la relación de patrones de agrupamiento con variables ambientales (McCune et al., 2002). El análisis se efectuó en el programa PAST 4.0 (Hammer et al., 2001).
Finalmente, se estimó la diversidad filogenética para cada relicto de bosque seco. Primero, se estimó una filogenia con la herramienta Phylomatic, que permite calcular un árbol particular a partir de un mega árbol para plantas vasculares (Slik et al., 2018). Después, se construyó una matriz de especies por relictos y, con base en el árbol filogenético estimado, se calcularon los índices PSV (variabilidad filogenética de especies) y PSC (agrupamiento filogenético de especies) (Helmus et al., 2007). Para determinar el efecto del área sobre la diversidad filogenética, se realizó un análisis de regresión lineal. Los índices de diversidad filogenética se efectuaron con el software FDiversity (Casanoves et al., 2010).
RESULTADOS
Relación riqueza de especies-área
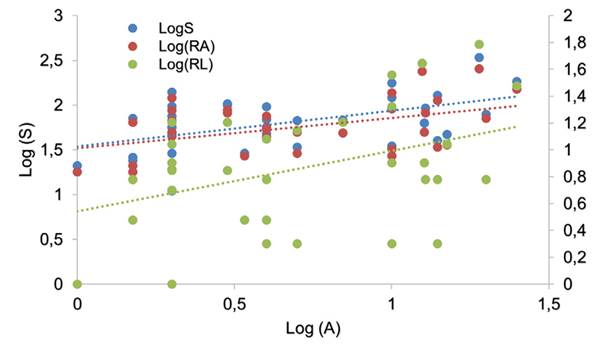
La riqueza de especies aumentó con el área del fragmento de bosque. Esta relación se ajustó al modelo LogS-LogA, con una pendiente z = 0.397 para todas las especies (R2=025, p<0.05). El intercepto fue c = 1.54 para todas las especies (Figura 2).
El modelo SAR para especies de dispersión amplia vs. dispersión limitada mostró que la pendiente fue más alta para este último (z=0.451, R2=0.17, p<0.05). Por otro lado, el intercepto fue mayor para el SAR que consideraba especies con dispersión amplia (Figura 2 y Tabla 2).
Tabla 2: Parámetros modelo de regresión Log A-Log S
Figura 2: Modelos de regresión Log A-Log S para la riqueza total (S), especies con dispersión limitada (RL) y dispersión amplia (RA) en parches de bosque seco tropical
Relación riqueza de especies-aislamiento
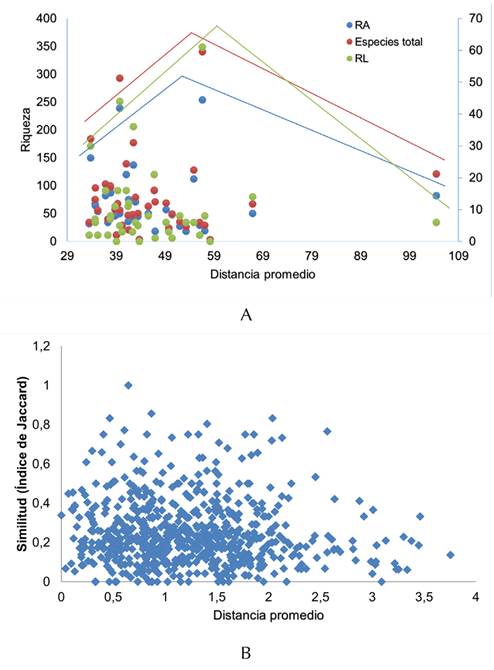
Inicialmente, la riqueza de especies mostró un patrón de incremento con el aislamiento, y luego una disminución (prueba de Bordes, p<0.05). De igual manera, cuando se hizo el análisis para las especies con dispersión limitada y amplia, se encontró el mismo patrón creciente al inicio y posteriormente decreciente (Figura 3a).
Figura 3: Relación riqueza de especies (A) y recambio de especies (B) vs. distancia geográfica entre parches de bosque seco tropical. Especies con dispersión limitada (RL) y dispersión amplia (RA)
Lo anterior sugiere que hay otros factores que afectan la riqueza de especies, pero se observa un patrón de disminución de dicha riqueza con la distancia entre parches.
Recambio de especie-aislamiento
Se encontró que la similitud entre parches de bosque aumentó inicialmente con la distancia, pero luego disminuyó, es decir, entre más distantes los relictos de bosque, mayor es el recambio de especies (Figura 3b). Sin embargo, se encontró un patrón de puntos agregados.
Riqueza de especies y clima
Al examinar la correlación de Spearman entre la riqueza de especies (la total, la de dispersión limitada y la amplia) y las variables climáticas, no se encontró ninguna correlación significativa (Tabla 3). Por otro lado, las variables bioclimáticas Bio2, Bio12 y Bio15 estuvieron correlacionadas significativamente con la latitud y longitud.
Tabla 3: Correlaciones de Spearman variables climáticas, geográficas y riqueza de especies de plantas (RA= riqueza de especies dispersión amplia, RL=riqueza de especies dispersión limitada)
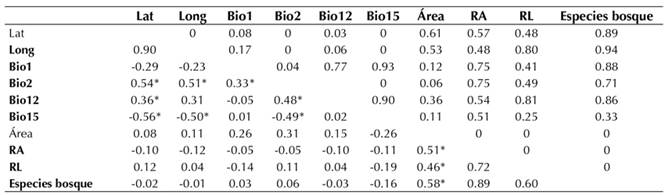
De esta manera, solo el área estuvo correlacionada con la riqueza de plantas, mientras que las variables bioclimáticas no afectaron la riqueza.
Composición de especies de bosque seco
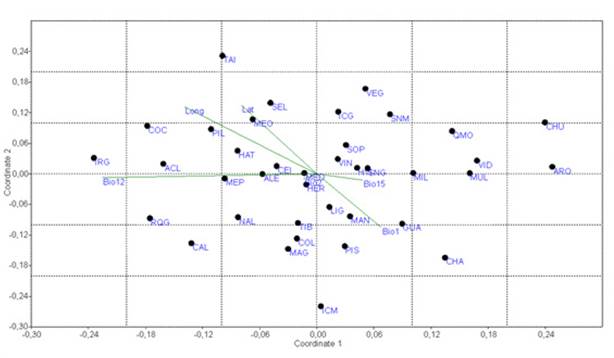
La composición de especies mostró varios patrones de agrupamiento de acuerdo con el resultado del NMS (Figure 4). Los parches de bosque más secos se agruparon al lado izquierdo del gráfico de ordenación, mientras que los más húmedos al lado derecho. De igual forma, este patrón estuvo relacionado con la latitud y la longitud. La variable que estuvo más relacionada con estos agrupamientos fue Bio12 (precipitación media). Así entonces, la precipitación fue determinante en la composición de especies de bosque seco.
Figura 4: NMS para relictos del bosque teco tropical en el valle geográfico del Río Cauca
Anidamiento
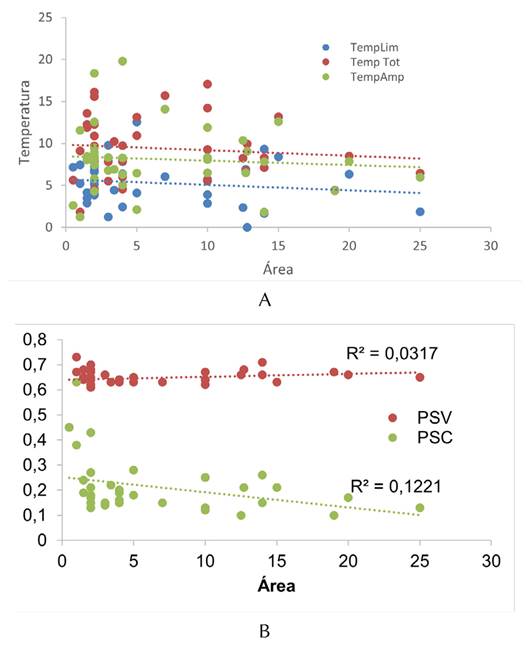
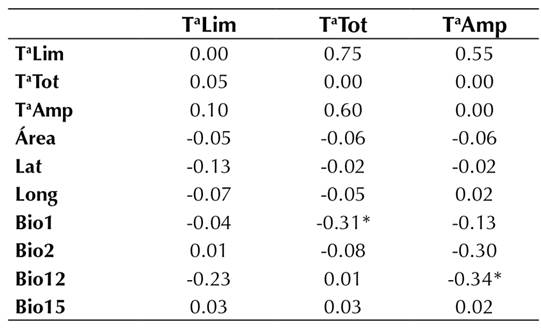
Se encontró que la temperatura fue baja en comparación con los modelos nulos Er y Ce (p<0.05), indicando un patrón de anidamiento. Con respecto a los tipos de dispersión (limitada vs. amplia), se encontró que Ta fue menor para las especies de dispersión limitada, lo cual implica un mayor anidamiento (Tabla 4). Para los tres grupos, se encontró un patrón decreciente del anidamiento con respecto al área (Figura 5A). Solamente la variable Bio12 estuvo correlacionada con Ta en el grupo de amplia dispersión, y Bio1 con la temperatura para el grupo de todas las especies (Tabla 5).
Tabla 4: Resultados análisis de anidamiento para relictos de bosque seco tropical en el valle geográfico del Río Cauca

Tabla 5: Correlaciones de Spearman entre Ta y variables climáticas
Relación diversidad filogénetica-área
La diversidad filogenética (PSV) no estuvo relacionada con el área (R2=0.032, p>0.05). En contraste, el agrupamiento filogenético (PSC) estuvo relacionado negativamente con el área (R2=0.12, p<0.05). Lo anterior indica que, mientras la variabilidad filogenética no se vio afectada por el tamaño del relicto, los parches más grandes tendieron a presentar un mayor agrupamiento filogenético en contraste con los parches pequeños (Figura 5B).
Figura 5: Relación anidamiento (temperatura) (A) y (B) diversidad filogenética vs. el área del fragmento de bosque seco tropical
DISCUSIÓN
La teoría de biogeografía de islas es uno de los modelos más estudiados y tiene una amplia variedad de aplicaciones, pero en Colombia son pocos los estudios que la incluyen (Sklenár et al., 2014; Mahecha et al., 2019). Este estudio es el primero que trata de aplicar la biogeografía de islas a fragmentos de bs-T en Colombia. Los resultados indican que la riqueza de plantas está relacionada con el área del relicto, lo cual sugiere que los fragmentos se ajustan a los modelos de biogeografía de islas. Se han propuesto dos hipótesis no excluyentes para explicar esta relación: el muestreo pasivo y la diversidad de hábitat (Williams, 1943, 1964; Connor & McCoy, 1979; Coleman et al., 1982). La primera indica que, a medida que se muestrea un área mayor, aumenta la probabilidad de encontrar más individuos de una especie, y subsecuentemente aumenta la probabilidad de muestrear una mayor riqueza de especies. Por otro lado, la hipótesis de la diversidad de hábitat establece que las especies tienen diferentes requerimientos de hábitat, y a mayor área muestreada, es más probable encontrar más hábitats distintos, y en consecuencia más especies adaptadas a estos (Williams, 1964).
Al analizar la SAR de las especies de dispersión limitada y amplia, se encontró que la pendiente fue mayor para el primer grupo. De acuerdo con Triantis et al. (2003), la pendiente del SAR tiene varias interpretaciones biológicas. En este estudio, la pendiente coincide con las encontradas para estudios en plantas y de islas oceánicas, que son más altas que para animales e islas continentales o internas. Estos altos valores de z pueden interpretarse como limitaciones a la dispersión y mayores tasas de especiación (Lomolino et al., 1989; Triantis et al., 2003). De esta manera, en los relictos de bosque seco, la matriz agrícola (principalmente monocultivo de caña) está ejerciendo una fuerte barrera para la dispersión de especies de plantas.
Con respecto al aislamiento, se observó que la riqueza de plantas disminuyó con la distancia promedio a los demás relictos, aunque esta, inicialmente, tendió a aumentar. Este patrón se ha asociado con eventos de dispersión frecuente (Lomolino et al., 1989), lo cual ocurre en este caso. Cuando comenzó el proceso de fragmentación del bosque seco del valle geográfico del río Cauca, es probable que los migrantes llegaran a los relictos en números suficientes para aumentar el número de individuos en los relictos más cercanos. Sin embargo, con el tiempo, la fragmentación se hizo más fuerte, y la tasa de migración se redujo a un punto donde las poblaciones se vieron afectadas por efectos estocásticos, con una consecuente reducción de la riqueza de los relictos (Lomolino et al., 1989). Lo anterior también se puede explicar por la presencia de migrantes desde la matriz externa, en algunos casos como consecuencia de bosques riparios cercanos que permiten un alto influjo de especies de dispersión amplia.
A diferencia del área, las variables climáticas no afectaron la riqueza de plantas. De esta manera, ni la precipitación ni la temperatura tuvieron un efecto sobre la riqueza de plantas, a pesar de ser factores determinantes de la riqueza (Gaston & Blackburn, 2000). Lo anterior se puede deber a que el número de especies de un relicto está definido por la ubicación al azar de las especies posterior a los procesos de fragmentación. Por lo tanto, el número de especies depende del tamaño del relicto, que implícitamente afecta el número de individuos (Williams, 1943).
El anidamiento de los relictos fue significativo, es decir, cada relicto es una comunidad contenida en todo el conjunto de especies, que se organizan de acuerdo con el área (Patterson & Atmar, 1986). Este patrón es típico de comunidades que estuvieron conectadas previamente. Otro proceso asociado con el anidamiento de las comunidades es la relajación, que es consecuencia de la extinción selectiva tras la fragmentación (Patterson & Atmar, 1986, 2000). Este proceso de extinción está relacionado con el área, ya que los relictos más pequeños pierden particularmente las especies con menor abundancia. Esto, debido a procesos estocásticos, que son más fuertes sobre especies especialistas y tienen mejor oportunidad de persistir en islas o fragmentos grandes (Patterson & Atmar, 1986).
Inicialmente, el recambio de especies aumentó, pero luego mostró un patrón decreciente con respecto al área. Brown y Kodric-Brown (1977) propusieron una modificación a la teoría del equilibrio de MacArthur y Wilson (1967), donde, inicialmente, los migrantes conespecíficos introducen variabilidad genética e incrementan las poblaciones de las islas. Si el número de migrantes es suficiente, ocurre un efecto de rescate que reduce las tasas de extinción y recambio de especies. Finalmente, el número de migrantes se reduce cuando aumenta el aislamiento, lo cual elimina el efecto de rescate (Wright, 1985).
La composición de especies de plantas de los relictos estuvo relacionada con las variables climáticas estudiadas (precipitación). Como se dijo anteriormente, el área es la variable que mejor explica la riqueza de plantas, pero no así las variables climáticas. Este patrón se puede explicar si se considera que, antes de la fragmentación del bosque seco, este no era un continuo, sino una compleja formación que iba desde humedales a arbustales muy secos. Estas formaciones son determinadas por el clima, la geografía y la historia biogeográfica. De esta manera, después de los procesos de fragmentación, la composición de especies depende de las condiciones climáticas, mientras que el número de especies está determinado por el tamaño del relicto.
Por otro lado, el análisis del efecto de la dispersión mostró una mayor pendiente y un mayor patrón de anidamiento (Ta) para el grupo de especies con dispersión limitada. Lo anterior sugiere que el patrón general de la riqueza de especies de plantas se ve afectado por limitaciones en la dispersión. Como ya se mencionó, la pendiente del SAR para el modelo general fue más alta de lo esperado para sistemas internos o islas de hábitats. De esta manera, están operando barreras que limitan la migración entre parches. Esto mismo también explica que ocurra un fuerte patrón de anidamiento de los relictos. De acuerdo con lo anterior, el SAR visto en los relictos de bosque seco del valle geográfico del río Cauca se podría explicar más por el efecto de muestreo pasivo (Williams, 1943, 1964) que por la diversidad de hábitat, ya que las comunidades se están organizando por factores estocásticos y limitación en la dispersión.
La PSV de los relictos no varió con el área. Esto indica que la variabilidad filogenética de las comunidades de plantas no varía con el tamaño de los relictos. Lo anterior, a su vez, indica que, a medida que aumenta el área, aumenta el número de especies funcional y filogenéticamente similares, con lo cual la variabilidad filogenética no cambia (Karadimou et al., 2016). En simulaciones de distribución de especies al azar y sin señal filogenética (limitación al azar o distribución al azar), también se ha encontrado que no se presenta una relación entre el área y la diversidad filogenética (o funcional), mientras que, bajo una fuerte señal filogenética en preferencias ambientales (hábitat preferencia o grupos de especies), se observa una fuerte relación área-diversidad filogenética (Helmus et al., 2012). La hipótesis de la preferencia de hábitat predice una relación PDAR, debido a que, a medida que aumenta el área, aumenta la probabilidad de encontrar más hábitats o nichos diferentes, lo cual, en consecuencia, incrementa la diversidad filogenética o funcional (Connor & McCoy, 1979; Coleman et al. 1982). Con base en esto, se puede inferir que, en los relictos de bosque seco del valle del río Cauca, están operando procesos de muestreo pasivo o limitación de dispersión. Sin embargo, si se consideran los resultados del SAR y el efecto de dispersión, se puede descartar la hipótesis del muestreo pasivo, ya que las pendientes del SAR fueron altas, y esta hipótesis predice mode- los con bajos z (Helmus et al., 2012).
Por otro lado, los relictos más grandes presentaron un mayor agrupamiento filogenético, sugiriendo que, a medida que se reduce el tamaño del bosque, se eliminan las especies similares filogenética o funcionalmente. Así, este proceso de filtrado solo deja las especies con mayor número de individuos (menor redundancia filogenética). Se han propuesto mecanismos de atracción y repulsión filogenética (Cavender-Bares et al., 2009; Mayfield & Levine, 2010). A medida que aumenta el área, dominan los mecanismos que atraen especies cercanamente relacionadas filogenéticamente (tales como dominancia competitiva conservada filogenéticamente o la filtración de hábitat) (Cavender-Bares et al., 2009; Mayfield & Levine, 2010). Por otro lado, en áreas pequeñas operan mecanismos de repulsión filogenética (similaridad limitante o exclusión competitiva), lo cual reduce el agrupamiento filogenético (Helmus et al., 2007).
CONCLUSIONES
Los resultados sugieren que los relictos de bosque seco del valle del Río Cauca se ajustan al modelo SAR, con pendientes más altas de lo esperado para islas de hábitat o internas. Estos altos valores de z son producto de limitaciones en la dispersión de las plantas, asociada con la matriz agrícola que rodea los relictos. Teniendo en cuenta los resultados del SAR, del anidamiento y del PDAR, se puede concluir que procesos dispersión limitada y de atracción y repulsión filogenética están estructurando las comunidades de plantas de los relictos de bosque seco. Por otro lado, el clima no estuvo relacionado con la riqueza, pero sí con la composición de especies de los relictos. De esta forma, al considerar la diversidad taxonómica y filogenética, se pueden inferir los procesos ya mencionados, que gobiernan los patrones de riqueza encontrados en los relictos de bosque seco del valle del Río Cauca. También es importante resaltar que las alteraciones a los mecanismos que generan repulsión filogenética en las comunidades vegetales locales, tales como la contaminación, las especies invasoras y la perturbación antropogénica, pueden reducir la diversidad filogenética (Helmus et al., 2010), produciendo un efecto cascada que podría afectar la diversidad filogenética de las otras áreas. Esto último resalta la importancia de mejorar la conectividad de estos relictos y así evitar las limitaciones a la dispersión descritas en este estudio.
Acknowledgements
AGRADECIMIENTOS
Los autores agradecen al Instituto para la Investigación y la Preservación del Patrimonio Cultural y Natural del Valle del Cauca (INCIVA) por el apoyo durante la elaboración del manuscrito.
REFERENCIAS
Licencia
Derechos de autor 2023 Colombia forestal

Esta obra está bajo una licencia internacional Creative Commons Atribución-CompartirIgual 4.0.
Colombia Forestal conserva los derechos patrimoniales (copyright) de las obras publicadas, y favorece y permite la reutilización de las mismas bajo la licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional por lo cual se pueden copiar, usar, difundir, transmitir y exponer públicamente, siempre que:
Se reconozcan los créditos de la obra de la manera especificada por el autor o el licenciante (pero no de una manera que sugiera que tiene su apoyo o que apoyan el uso que hace de su obra).