DOI:
https://doi.org/10.14483/udistrital.jour.colomb.for.2007.1.a09Publicado:
01-01-2007Número:
Vol. 10 Núm. 20 (2007): Enero-DiciembreSección:
Artículos de investigación científica y tecnológicaEfecto del Herbicida Atrazina sobre la Población de Bacterias en un Suelo del Municipio de Saldaña, Tolima
Effect of the Atrazine Herbicide on the Bacteria Population in a Soil of the Municipality of Saldaña, Tolima
Palabras clave:
Atrazina, bacterias, bagazo de maíz. Saldaña, Colombia (es).Palabras clave:
Atrazine, bacteria, corn stubble. Saldaña, Colombia. (en).Descargas
Referencias
Alexander, M. 1981. Introduction soil microbiology. John Wiley y Sons, Inc, Nueva York, E.U.A.
Anderson, R.C. & E.S.Menges, 1997. Effects of ire on Snadhill herbs: nutrients, mucorrhizae, and biomass allocation. Botanical Society of America Inc. July. 84 (7): 938-948.
Burges, A. & F. Raw 1971. Biología del suelo, aspecto microbiológico, botánico y zoológico. Editorial Omega S.A. Barcelona, España.
Crowley, D.E. S. Alvey & E.S. Gilbert 1997. Rhizosphere ecology of xenobiotic- degrading microorganisms. American Chemical Society. Pág. 20-36.
Fedi, S., E. Tola, Y. Moenne-Loccoz, D.N. Dowling, L.M. Smitj, & F. O'Gara 1997. Evidence for signaliny between the Phythium ultimum and Pseudomonas luorescens F113: P. ultimum represses the expression of genes in P. lourescens F113, resulting in altered ecological itness. American Society of Microbiology. Nov. 63 (11): 4261-4266.
Fernández-Quintanilla, C. & M. Saavedra 1991. Malas hierbas: conceptos generales. Páginas 16-48. Fundamentos sobre malas hierbas y herbicidas. Ediciones Mundi prensa, Madrid, España.
Guerrero, R. 1997. Curso de fertilización y fertilizante. Univ. Nac. De Colombia. Escuela de postgrado. Facultad de Agronomia. Santafé de Bogotá, D.C., Colombia.
Ingraham, J.L. & M. C.A Ingraham 1998. Introducción a la Microbiología. Editorial Reverte, S.A., Madrid, España.
Jordahl, J.L., L. Foster , J.L. Schnoor & P.J.J. Álvarez 1997. Effect of hybrid poplar trees on microbial populations important to hazardous waste bioremediation. SETAC press. June 1997. 16 (6): 1318-1321.
Mandelbaum, R.T., L.P. Wackett & D.L. Allan 1993. Mineralization of the S-triazine ring of atrazine by stable bacterial mixed cultures. American Society for Microbiology. 59 (6): 1695-1701.
Ordóñez, A. R. 1998. Efecto del herbicida atrazina sobre microorganismos diazotrofos asociados a un cultivo de maíz (zea mays) en un suelo de Saldaña Tolima. Tesis de grado para optar titulo de Biólogo. Facultad de Ciencias, Departamento de Biología, Universidad Nacional de Colombia, Santafé de Bogotá, Colombia.
Quevedo, C. 1992. Manual de Técnicas Agropecuarias. Canal Ramírez Antares LTDA., Santafé de Bogotá, Colombia.
Radosevich, M. S.J. Traina, Y.L. Hao & O.H. Touvinen 1995. Degradation and mineralization of atrazine by a soil bacterial isolate. American Society for Microbiology. 61 (1): 297-302.
Yanze-Kontchou, C. & N. Gshwind 1995. Mineralization of the herbicide atrazine in Soil inoculated with a Pseudomonas strain. American Chemical Society. 43 (8): 22912294.
Zablotowicz, R.M., R.E. Hoagland & M.A. Locke 1994. Glutathione S-transferase activity in rhizosphere bacteria and the potential for herbicide detoxiication. American Chemical Society. Pag. 184-198.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Colombia Forestal, Diciembre del 2007 vol:10 nro:20 pág:161-179
Efecto del herbicida Atrazina sobre la población de bacterias en un suelo del municipio de saldaña, Tolima
Jesús Alberto Lagos Caballero
Ingeniero Agrónomo, MSc. Profesor: Suelos y Geomorfología. Universidad Distrital Francisco José de Caldas. Facultad de Medio Ambiente y Recursos Naturales. Proyecto Curricular de Ingeniería Forestal. jalagosc@udistrital.edu.co
Ricardo Campos S.
Ing. Agrónomo, MSc. Profesor: Suelos y Química de Suelos. Universidad de La Salle. Facultad de Ingeniería Ambiental y Sanitaria. rcampos@gmail.com
Cilia L. Fuentes
Ing. Agrónomo, MSc.; PhD. Profesor Asociado, D.E. Manejo de malezas; Fisiología de herbicidas; Biología y ecología de malezas; manejo de plaguicidas. Universidad. Nacional de Colombia. Facultad de Agronomía. clfuentes@unal.edu.co
Resumen
Se evaluó el efecto de la atrazina en la dinámica de las poblaciones de microorganismos de un suelo de Saldaña, Tolima. Los grupos de microorganismos estudiados fueron bacterias en general, solubilizadoras de fósforo, desnitrificantes, amonificantes, nitrobacter y nitrosomonas. Se utilizó un diseño completamente al azar con cinco tratamientos y cuatro repeticiones. Los resultados se sometieron al análisis de varianza. Los tratamientos consistieron en: (1) Suelo original, (2) Suelo esterilizado, (3) Suelo con sustrato de bagazo de maíz, (4) Suelo tratado con atrazina en dosis de 1.5 kg i.a./ha, (5) Suelo con sustrato (bagazo de maíz) y atrazina. Se partió de la hipótesis nula según la cual, no existe diferencia entre las medias poblacionales. Como criterio de decisión, se utilizó la prueba F al 5% de significancia. Adicionalmente, se aplicó la prueba de Tukey al mismo nivel de significancia. Los resultados indicaron a lo largo del tiempo que el herbicida atrazina tiene un efecto detrimental sobre las poblaciones de bacterias amonificantes, nitrosomonas, desnitrificantes y nitrobacter. Sin embargo, el sustrato (bagazo de maíz) con adición de atrazina atenuó el efecto, aumentando el número de unidades formadoras de colonia por gramo de suelo (U.F.C./g de suelo).
Palabras clave: Atrazina, bacterias, bagazo de maíz. Saldaña, Colombia.
Abstract
The effect of atrazine in the population dynamics of soil microorganisms in Saldaña, Tolima was evaluated. The soil microorganisms studied were bacteria in general, phosphatesolubilizing bacteria, desnitrificant, amonificants, nitrobacter and nitrosomonas. We used a completely randomnized design with ive treatments and four repetitions. Results were analyzed using Analysis of variance Treatments consisted of (1) original soil, (2) sterilized soil, (3) soil with substrate of corn stubble, (4) soil treated with 1.5 kg i.a. atrazine /ha, (5) soil with substrate of corn stubble and atrazine. The null hypothesis has consisted that there are not significant differences between populations. Differences in variance were compared to F distribution of 5% significance level. The Tukey´s test was also used, with the same significance level. Results showed that, as time goes on, the atrazine herbicide has a detrimental effect on the amonificant bacteria populations, as well as on nitrosomonas, desnitrificant and nitrobacter populations. However, the corn stubble substrate with atrazine has reduced the effect by increasing the number of colony-forming units per gram of soil (U.F.C. /g of soil).
Key words: Atrazine, bacteria, corn stubble. Saldaña, Colombia.
INTRODUCCIÓN
Se conoce que las bajas concentraciones de plaguicidas en el suelo no afectan la mayoría de poblaciones de grupos microbianos, como en el caso de los herbicidas (Alexander 1981). Además, se sabe de efectos momentáneos de los herbicidas que generan escasez de nitrógeno (N) al inhibir la actividad microbial en su ciclo (Guerrero 1997).
En el caso especíico de atrazina se ha encontrado que la población bacteriana bajo condiciones aeróbicas lo emplean como fuente de carbono (C) y N (Radosevich et al. 2001). Sin embargo, se encontró que este herbicida en dosis de 3 kg de ingrediente activo (i.a) por ha en cultivo de maíz disminuyó la actividad de la enzima nitrogenasa en la cual es empleada por organismos procariotes para la ijación biológica de N. (Ordóñez 1998).
El presente estudio hace parte del proyecto "Impacto ambiental de la aplicación de herbicidas en suelos de Colombia", inanciado por la Agencia Internacional de Energía Atómica (Proyecto COL05/16) en asocio con la Facultad de Agronomía de la Universidad Nacional de Colombia, Sede Bogotá. D.C., y se enfocó en el análisis de posibles cambios que ocurren en la dinámica poblacional del suelo a través del tiempo (30, 45 y 60 días) después de aplicar 1.5 kg de i.a/ha del herbicida Atrazina y su efecto sobre disponibilidad nutricional en maíz (Zea mays). Además se tuvo en cuenta la población microbial en suelo lejano a la rizósfera y cerca de ésta. Los grupos estudiados fueron: Bacterias (analizadas en forma general), Nitrosomonas, Nitrosobácter, Solubilizadoras de Fósforo, Desnitrificantes, y Amonificantes.
MATERIALES Y MÉTODOS
El suelo para establecer el ensayo fue obtenido de una parcela que no había sido nunca tratada con atrazina anexa a la sede de Usuarios del Distrito de Riego del río Saldaña (USOSALDAÑA), ubicado en el municipio de Saldaña, Tolima, a una altura de 310 metros de altura, con temperatura promedio de 27 (ºC) y humedad relativa del 70 por ciento (%)4.
El suelo se tomó en distintos sitios ubicados equidistantemente dentro de la parcela 3200 m²; a una profundidad de 0-20 cm. Las muestras (40 en total con 200 kg de peso) se empacaron en costales de polietileno y llevadas al invernadero de vidrio anexo a la Facultad de Agronomía. Posteriormente se uniformizó el suelo, tamizándolo en una malla de 2 mm de diámetro. Taxonómicamente el suelo, donde se extrajo la muestra, fue clasificado como Ustropet Fluvaquent.
En cuanto a la planta se utilizó maíz, variedad Caribe V-108, siendo una de las más comunes para las zonas productoras del Tolima y la Costa Atlántica.
La semilla Caribe V-108, indica según características de las cifras numéricas: 1, para clima caliente, de 0 a 600 msnm; 08, color del grano amarillo (Quevedo 1992).
DISEÑO EXPERIMENTAL Y ANÁLISIS ESTADÍSTICO
Se estableció un experimento bajo un Diseño Completamente Aleatorizado (DCA) para evaluar el efecto de cinco tratamientos en cuatro repeticiones. Los resultados se sometieron al análisis de varianza.
Se partió de la hipótesis nula según la cual, la diferencia de promedios entre grupos en comparación, se puede explicar por variaciones muestrales, en dos poblaciones con una media común. La hipótesis alterna es que existe diferencia entre las medias poblacionales. Como criterio de decisión, se utilizó la prueba F al 5% de significancia. Adicionalmente, se aplicó la prueba de Tukey al mismo nivel de significancia para la separación de medias de tratamientos.
El estudio incluyó cinco (5) tratamientos:
T1: Suelo no esterilizado, sin atrazina y sustra to (Testigo uno).
T2: Suelo esterilizado, sin atrazina y sustrato (Testigo dos).
T3: Suelo con sustrato, sin atrazina y no esteri lizado.
T4: Suelo con atrazina, sin sustrato y no este rilizado.
T5: Suelo con atrazina y sustrato, sin esteri lizar.
La unidad experimental estuvo constituida por un matero, con su correspondiente planta de maíz sembrada en el centro del mismo. Los materos utilizados tenían una capacidad de 5040 cc con un peso de 237.9 g y una altura de 17 cm.
Para esterilizar el suelo, éste se introdujo en bolsas de plástico especíicas para soportar altas temperaturas y presiones. El autoclave que se utilizó fue el sistema a olla a presión la cual sometió al suelo a temperaturas de entre 212ºF ó 100 ºC, Hasta 259ºF ó 122.17ºC; con presiones desde 5 libras por pulgada cuadrada (LPC en idioma ingles PSI) equivalentes a 2.5 kg por 2.54 cm² hasta 20 PSI (10 kg/2.54 cm²). El anterior proceso tuvo una duración de 45 minutos con una replicación de igual tiempo, para obtener una completa esterilización.
El sustrato que se utilizó fue bagazo de maíz, en cantidades de 50 g por matero. La atrazina se aplicó sobre la supericie del suelo de los materos en cantidades equivalentes a 1.5 kg de ingrediente activo (ia) por ha, (correspondiente a 0.0067845 g disueltos en 100 cc de agua destilada y deionizada), la cual está en el rango de la dosis comercial utilizada corrientemente. El método de aplicación fue por aspersión.
ANÁLISIS QUÍMICO Y MICROBIOLÓGICO DEL SUELO
Se realizó un análisis químico preliminar del suelo en el cual se tuvieron en cuenta los siguientes parámetros: pH, textura, conductividad eléctrica, carbono orgánico, capacidad de intercambio catiónico, bases del suelo, saturación de bases, aluminio, manganeso, hierro, zinc, boro, cobre, fósforo, nitrato y amonio. Posteriormente, se hicieron para cada uno de los tratamientos, análisis microbiológicos cuantitativos empleando para medios sólidos la técnica de recuento y extensión en placa, y para medios líquidos la técnica de número más probable (nmp), con la utilización posterior de las tablas de Mc-Crady, a los 30, 40 y 60 días. Además se calculó el metabolismo del suelo a través de captura de CO2, a los 10, 22, 30, 45 y 60 días. Un último análisis químico de suelo, para cada tratamiento se efectuó terminada la investigación.
Se desarrollaron mediciones a nivel microbiológico, realizadas en el laboratorio de Malherbología y Microbiología, en los laboratorios de Física de Suelos y Fisiología Vegetal respectivamente. Todo lo anterior se ejecutó en la Facultad de Agronomía, de la Universidad Nacional de Colombia, sede Bogotá, D.C.
Los dos tipos de medios sólidos utilizados son los siguientes.
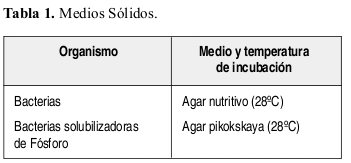
La forma de evaluación se efectuó mediante recuento y extensión en placa, donde las muestras diluidas de células microbianas se sembraron directamente en la supericie de la placa de medio, extendiéndola con ayuda de un asa de Digraslsky de cristal estéril. La cantidad de dilución aplicada a cada caja o placa de medio fue de 0.005 ml. Se hicieron diluciones transiriendo 1 g de suelo en 9 ml de agua destilada estéril, se agito durante cinco minutos con agitador magnético, dejando sedimentar durante un minuto (dilución 10 ¹). Luego se tomó 1 cc del sobrenadante y se adicionó en 9 cc de agua destilada estéril, obteniéndose la dilución 10 ². Las diluciones sucesivas (10 ³.....) se realizaron adicionando 1 cc de la solución inmediatamente anterior en 9 cc de agua destilada estéril, previa agitación del tubo de ensayo, aproximadamente durante 1 a 2 minutos. El número de dilución a la que se llegó fue 1:100000. Las bacterias fueron identificadas por medio de tinción de Gram y sus colonias descritas.

Se emplearon tres clases de medios líquidos como se muestra en la Tabla 2.
Para la presente investigación se utilizaron dos tubos por cada dilución, cada uno inoculado con 0.2 ml. De igual forma el número de dilución a la que se llegó fue 1:100000.
En los distintos muestreos de suelo que se efectuaron (Inicio, 30, 45 y 60 días), se tomaron muestras aproximadamente a 8 cm de distancia del tallo de la planta, en cantidades de 10 g de suelo por matero o unidad experimental. Además al cabo de 60 días, se procedió a retirar las raíces de cada matero, y se separó muy cuidadosamente el suelo que estaba cercano a estas. Se recolectó 10 g de cada raíz.
RESULTADOS
BACTERIAS
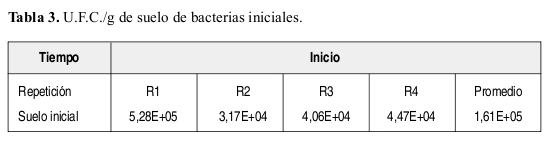
La Tabla 3 presenta el resultado inicial (antes de aplicación de atrazina) de conteo de U.F.C./ g de suelo de bacterias, el cual fue de 161250.
En la Figura 1 se observan los resultados inales de conteos de U.F.C./g. de suelo a los 30,45 y 60 días en muestras tomadas a 8 cm de distancia del tallo. En ellos se resalta el hecho de que la mayoría de los tratamientos aumentaron en número de U.F.C./g de suelo a través del tiempo. Se observa como el tratamiento T5 (suelo con atrazina y sustrato, sin esterilizar) obtuvo los mayores valores entre tratamientos, seguido por T3 (suelo con sustrato, sin atrazina y no esterilizado).
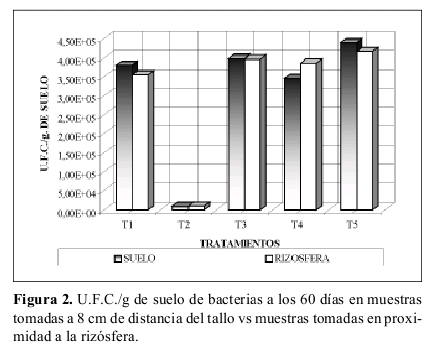
Bacterias en el suelo cercano a la rizósfera. Según lo indicado en la Figura 2, los valores de U.F.C./g de suelo obtenidos en muestras cercanas a la rizósfera y muestras tomadas a 8 cm de distancia del tallo, presentan valores muy similares en todos los tratamientos, pero caracterizándose en que la mayoría de tratamientos el número de U.F.C./g de suelo es superior en la muestra tomado a 8 cm de distancia del tallo que en el suelo cercano a la rizósfera, exceptuando el tratamiento T4.
GRUPOS ESPECÍFICOS
Bacterias Amonificantes. La Tabla 4 presenta el valor promedio del número de U.F.C./g de suelo iniciales de bacterias amonificantes. La Figura 3, reporta los valores del número de U.F.C./g de suelo a los 30, 40 y 60 días, en muestras de suelo tomadas a 8 cm de distancia del tallo.
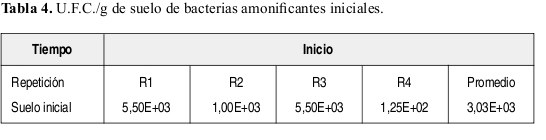
La Figura 3, se caracteriza porque todos los tratamientos aumentan sus U.F.C./g de suelo a los 30 días. Sin embargo comparando entre tratamientos se aprecia como el tratamiento T4 (suelo con atrazina sin sustrato y no esterilizado) sus U.F.C./g de suelo aumentaron muy poco respecto a lo reportado en el cuadro 4 o U.F.C./g. de suelo iniciales.
Al analizar el conteo de U.F.C./g de suelo a los 45 días se observa como el único tratamiento que siguió aumentando sus U.F.C./g de suelo fue T5 (suelo con atrazina y sustrato, sin esterilizar), en cambio los demás tratamientos disminuyeron sus valores. Lo anterior indica que todos los tratamientos tuvieron un crecimiento máximo a través del tiempo. Para los tratamientos T1 (suelo no esterilizado, sin atrazina y sustrato), T3 (suelo con sustrato, sin atrazina y no esterilizado) y T4 fue a los 30 días. Mientras para el tratamiento T5 este crecimiento máximo se presenta a los 45 días, siendo muy próximo a la vida media de la atrazina. Ya a los 60 días todos los tratamientos tienden a disminuir excepto T1 que aumenta ligeramente y T4 que su lectura se estabiliza con respecto a la tomada a los 45 días.
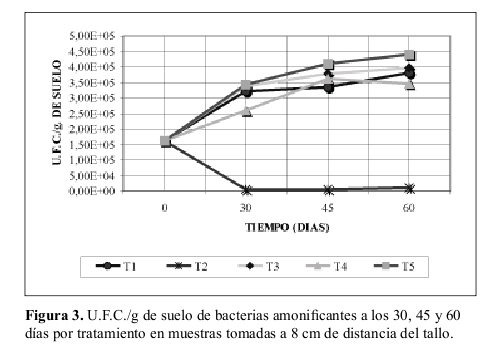
Bacterias amonificantes en suelo cercano a la rizósfera. La Figura 4 muestra los valores de U.F.C./g. de suelo que se obtuvieron en muestras tomadas a 8 cm de distancia del tallo comparado con el obtenido en muestras de suelo cercano a la rizósfera a los 60 días.
Bacterias Nitrosomonas. La Tabla 5 presenta el número de U.F.C./g de suelos iniciales de bacterias nitrosomonas. La Figura 5 indica el número de U.F.C./g de suelo tomados en muestras de suelo a 8 cm de distancia de suelo, a los 30, 45 y 60 días.
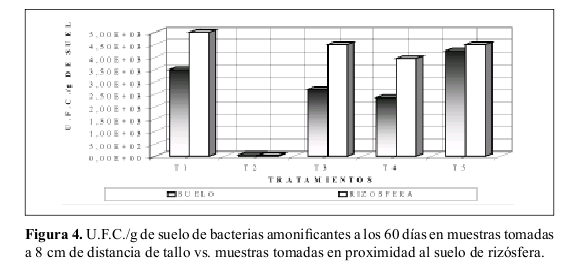

Al comparar la Figura 5 con la Tabla 5 se observa que el tratamiento T4 (suelo con atrazina, sin sustrato y no esterilizado) fue el único que no aumento su número de U.F.C./g de suelo con respecto al conteo inicial. Además los valores del tratamiento T4 a través del tiempo siempre fue muy inferior con respecto a los otros tratamientos.
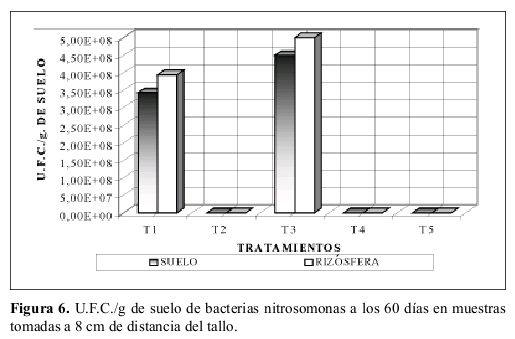

Bacterias nitrosomonas en suelo cercano a la rizósfera. La Figura 6 compara los valores de U.F.C./g de suelo entre la muestra de suelo tomada a 8 cm de distancia y la obtenida en suelo cercano a la rizósfera a los 60 días.
En ellos se observa claramente como el número de U.F.C./g de suelo en todos los tratamientos (excepto T2) fue superior en el suelo cercano a la rizósfera.
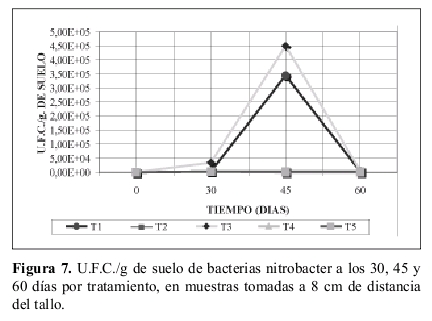
Bacterias nitrobacter. La Tabla 6 presenta el número de U.F.C./g de suelo iniciales de bacterias nitrobacter. La Figura 7 indica los valores de U.F.C./g de suelo a los 30, 45 y 60 días.
Todos los tratamientos a los 30 días aumentan su número de U.F.C./g de suelo, excepto T2 (suelo esterilizado sin atrazina y sustrato).
Bacterias nitrobacter en suelo cercano a la rizósfera. En la Figura 8 se observa claramente como el suelo cercano a la rizósfera posee el mayor número de U.F.C./g de suelo con respecto al tomado a 8 cm de distancia del tallo de la planta en todos los tratamientos.
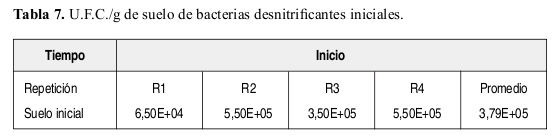
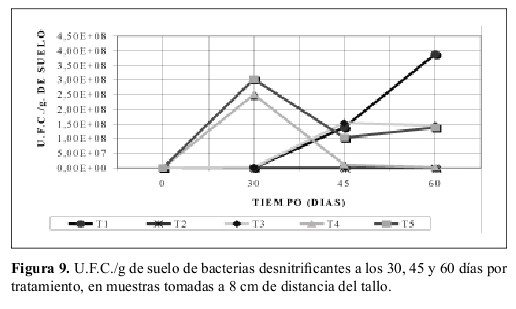
Bacterias desnitrificantes: La Tabla 7 presenta el resultado inicial de U.F.C./g de suelo. La Figura 9 reporta los resultados obtenidos a través de los intervalos de tiempo (30, 45 y 60 días) del número de U.F.C./g de suelo en muestras tomadas a 8 cm de distancia del tallo de la planta.
El tratamiento T4 (suelo con atrazina, sin sustrato y no esterilizado) presenta valores máximos de U.F.C./g de suelo a los 30 días, siguiendo con una disminución drástica a los 45 y 60 días próximos a la vida media de atrazina.
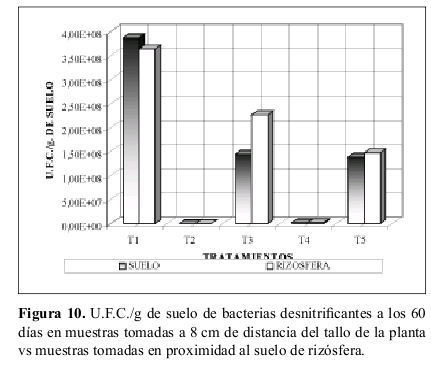
Bacterias desnitrificantes en suelo cercano a la rizósfera. La Figura 10 presenta valores donde el suelo cercano a la rizósfera posee mayor número de U.F.C./g de suelo con respecto al suelo tomado a 8 cm de distancia del tallo.
Todos los tratamientos (excepto T1) presentan un valor mayor de U.F.C./g de suelo en suelo cercano a la rizósfera.
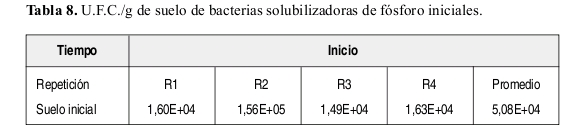
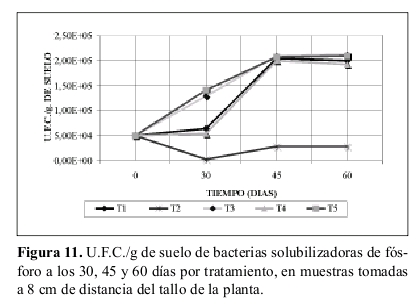
Bacterias solubilizadoras de fósforo. La Tabla 8 presenta los valores de U.F.C./g de suelo iniciales. La Figura 11 muestran los datos de U.F.C./g de suelo a los 30, 45 y 60 días de muestras tomadas a 8 cm de distancia del tallo de la planta.
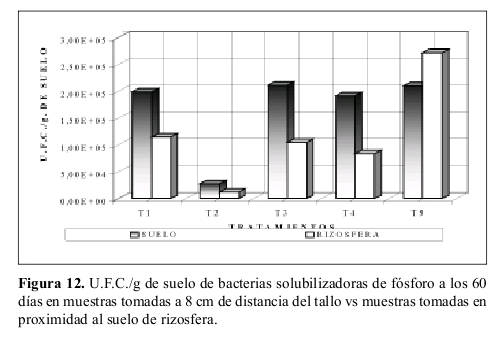
Bacterias solubilizadoras de fósforo en el suelo cercano a la rizósfera. La Figura 12 muestra los resultados obtenidos de U.F.C./g de suelo en suelo cercano a la rizósfera y suelo tomado a 8 cm de distancia del tallo. En ellos se aprecia claramente como hay mayor cantidad de organismos en el suelo tomado a 8 cm de distancia del tallo.
DISCUSIÓN
BACTERIAS
El resultado observado en la Figura 1 donde el tratamiento T5 y T3 obtuvieron los mayores valores entre tratamientos, ratifica lo expuesto por Ingraham (1998) cuando airma que el sustrato (bagazo de maíz) actúa como fuente orgánica para que los microorganismos lo utilicen para su crecimiento de la población. Por la anterior razón el tratamiento T5 y T3 presentó obtuvieron los valores más altos de conteo de U.F.C./g de suelo de bacterias.
De igual forma parece que la atrazina complementa esta acción como fuente orgánica, ya que el tratamiento T5, el cual es una mezcla de atrazina con sustrato obtuvo los rangos más altos de U.F.C./g de suelo. Lo expuesto conirma lo airmado por Yanze-Kontchov y Gschwind (1995) entre otros, quienes estudiaron gran variedad de microorganismos que degradan atrazina. El número de U.F.C./g de suelo en el tratamiento T4 sería mayor al T1 en el día 30. Pero tampoco se cumple a cabalidad el modelo no adaptativo ya que la población aumentó a través del tiempo (hasta los 45 días), y el mencionado modelo aclara que la atrazina no es fuente importante de alimento para los microorganismos. La pregunta que surge, es ¿por qué crece las U.F.C./g de suelo de bacterias en el tratamiento T1 y T4 ? La respuesta se debe a que los microorganismos utilizan las fuentes naturales de nutrientes existentes en el suelo para su desarrollo. Para el caso especíico del tratamiento T4 aumento sus U.F.C./g de suelo no solo por contener atrazina sino por poseer las mencionadas fuentes.
Además se obtiene un crecimiento máximo a los 45 días, para luego ir descendiendo a los 60 días donde a inalizado la vida media de la atrazina. El mencionado descenso se explica en agotamiento de sustrato y atrazina como también de interacciones producidas en la población microbial que afectan el número de U.F.C./g de suelo de las bacterias. Un ejemplo de lo anterior es el efecto que produce Pythium ultimun que reprime la expresión de genes de Pseudomonas loorescens, primer caso reportado por Fedi et al. (1997).
El comportamiento del tratamiento T2 (suelo esterilizado sin atrazina y sustrato) donde los valores de U.F.C./g de suelo son inferiores a las iniciales. Sin embargo la población de U.F.C./ g de suelo aumentan a través del tiempo. Se explica lo anterior en que quedaron microorganismos viables para crecer y desarrollarse una vez terminada la esterilización del suelo.
El análisis de varianza y prueba de Tukey el tratamiento que es significativamente diferente a todos los demás es T2 (suelo esterilizado, sin atrazina y sustrato). En términos generales todos los tratamientos no son significativamente diferentes siendo similares en cuanto al número de U.F.C./g de suelo excepto el T2.
Lo anterior demuestra la gran similitud en el crecimiento de U.F.C./g de suelo en la mayoría de tratamientos y la diferenciación con respecto al tratamiento T2.
Bacterias en el suelo cercano a la rizósfera. Lo observado en la Figura 2 anterior no corrobora lo expuesto por Burgues y Raw (1971), Anderson et al. (1994) entre otros, al airmar que la actividad microbiana aumenta en la rizósfera. Sin embargo es resaltante el hecho de que el tratamiento T4 (suelo con atrazina, sin sustrato y no esterilizado) fue el único cuyo numero de U.F.C./g de suelo en la muestra tomada cerca de la rizósfera fue superior a la muestra de suelo tomada a 8 cm del tallo, ratificando lo sustentado por Crowley et al. (1997) y otros, quienes airman que la degradación de atrazina es mayor en la rizósfera y el número de organismos en ella es superior que en el suelo circundante.
Una razón de que el número de U.F.C./g de suelo fuera superior en la muestra de suelo tomada a 8 cm de distancia del tallo que en el suelo próximo a la rizósfera (excepto en el tratamiento T4), es dada por Burges y Raw (1971) al explicar que la raíz al exudar sustancias de tipo orgánico o inorgánico, estas pueden actuar en contra de los organismos, como a la vez reforzar la actividad enzimática. Otra razón se fundamenta en que el análisis microbial de suelo para la presente investigación se baso en suelo cercano a la rizósfera y no propiamente en la rizósfera.
Estadísticamente, señala que no existen diferencias significativas entre tratamientos a excepción del tratamiento T2 (suelo estéril, sin atrazina y sustrato). Lo anterior se explica en que existen efectos altamente significativos (1%) entre el suelo estéril versus el resto de tratamientos al igual que los tratamientos que explicarían la similitud en los datos obtenidos exceptuando el tratamiento T2.
GRUPOS ESPECÍFICOS
Bacterias amonificantes. Lo observado en la Tabla 4 y Figura 3 ratifica nuevamente lo airmado por Ingraham (1998) ya que el sustrato (bagazo de maíz) sirvió como fuente e alimento para los microorganismos.
El tratamiento T4 no cumple con el modelo adaptativo explicado por García y Fernández-Quintanilla (1991) donde la población de microorganismos aumenta al degradar la molécula de atrazina. Si se cumpliera lo anterior el tratamiento T4 hubiese sido mayor su número de U.F.C./g de suelo al T1 a través del tiempo. Además se cumple lo estudiado por Knight et al. (1993) donde la atrazina disminuye el amonio (NH4+) del suelo, y lo sustentado por Guerrero (1997) al presentar un efecto momentaneo de inhibición de la actividad microbial con una correspondiente escases de N.
Se observa además un efecto atenuante al mezclar atrazina y sustrato, ya que a los 60 días el tratamiento T5, no disminuyo sus U.F.C./g de suelo tan notoriamente como los tratamientos T4 y T3.
En cuanto al tratamiento T2 (suelo esterilizado, sin atrazina y sustrato), se observa un efecto de la esterilización, ya que su número de U.F.C./g de suelo fue significativamente inferior a las iniciales y entre tratamientos a través del tiempo.
En cuanto a la estadística, indica la no existencia de diferencias significativas entre tratamientos, exceptuando el tratamiento T2 (suelo estéril, sin atrazina y sustrato). Además se presenta un efecto altamente significante (1%) solo en tratamientos lo que explica la uniformidad de comportamiento de los tratamientos (excepto T2) y la relación esterilidad versus resto de tratamientos, donde se explica estadísticamente la diferenciación de T2. No se encontraron efectos significativos al analizar la atrazina, sustrato, interacción atrazina por sustrato e interacción error por tratamiento.
Bacterias amonificantes en suelo cercano a la rizósfera. Lo observado en la Figura 4 se aprecia muy claramente que la actividad microbiana aumentó en el suelo cercano a la rizósfera concordando por lo expuesto por Anderson et al. (1994), Burges y Raw (1971), entre otros.
Además al observar el tratamiento T4 ( suelo con atrazina, sin sustrato y no esterilizado) se ratifica lo sustentado por Crowley et al. (1997) entre otros, quienes dicen que la degradación de atrazina es mayor en la rizósfera y el número de organismos es superior que en el suelo circundante.
El tratamiento T2 (suelo esterilizado, sin atrazina y sustrato) presenta un número de U.F.C./ g de suelo mayor en el suelo tomado a 8 cm del tallo, que en el suelo cercano a la rizósfera, lo cual puede ser debido a lo ya explicado por Burges y Raw (1971) donde la raíz exuda sustancias que pueden inhibir a la población microbial como también incentivarla.
Los tratamientos no son significativamente diferente exceptuando nuevamente el tratamiento T2 (suelo estéril, sin atrazina y sustrato) y donde se explica que hay efectos altamente significantes (1%) al analizar los tratamientos que explican su comportamiento al igual que la interacción esterilidad versus los demás tratamientos, explicando así el comportamiento de T2. No se encontraron efectos significativos al analizar la atrazina, el sustrato y la interacción atrazina por sustrato.
Bacterias Nitrosomonas. Lo observado en la Figura 5 y Tabla 5 ratifica lo expuesto por Guerrero (1997) al haber una inhibición momentánea de la actividad microbial con la correspondiente escasez de N por efecto de la atrazina. Dicha inhibición se aprecia también en el tratamiento T5 (suelo con atrazina y sustrato, sin esterilizar) aunque no tan marcada como el tratamiento T4. El anterior efecto de atenuación de la atrazina es debido a la presencia del sustrato bagazo de maíz.
Cabe resaltar el hecho de que no se produce el efecto de crecimiento adaptativo donde la atrazina sirve como sustrato de crecimiento para la población (García y Fernández-Quintanilla, 1991). Lo anterior obviamente es dado por el efecto de inhibición sobre la actividad microbial explicado por Guerrero (1997).
El tratamiento T2 suelo esterilizado, sin sustrato y atrazina al igual que lo explicado en los numerales anteriores su bajo número de U.F.C./g de suelo a través del tiempo se debió a la misma esterilización.
Según lo mostrado en la Tabla 8, existen diferencias significativas entre tratamientos, encontrándose efectos altamente significativos (1%) dados por los tratamientos, la atrazina, el sustrato, interacción esterilidad versus el resto de tratamientos, la evaluación y la evaluación por tratamiento.
La anterior significancia corrobora estadísticamente el efecto detrimental de la atrazina sobre población de nitrosomas, al igual que la atenuación del herbicida al mezclarlo con sustrato. No se encontraron efectos significativos al analizar la interacción atrazina por sustrato.
Bacterias nitrosomonas en suelo cercano a la rizósfera. La Figura 6 ratifica lo sustentado por Anderson et al. (1994), entre otros, donde la actividad microbiana aumenta en la rizósfera. Además nuevamente corrobora lo airmado por Crowlet et al. (1997), entre otros, donde el número de organismos es superior en la rizósfera que en el suelo circundante al igual que su degradación.
En el tratamiento T2 (suelo esterilizado sin atrazina y sustrato) presenta un número de U.F.C./g. de suelo mayor en el suelo tomado a 8 cm del tallo, que en el suelo cercano a la rizósfera. Al igual que en el caso de bacterias amonificantes dicha diferencia puede ser debida a sustancias exudadas por la raíz que inhibieron a la población microbial. Sin embargo se aclara que la mencionada diferencia no es muy significativa.
Además se observa que los tratamientos a los cuales se les aplicó atrazina T4 (suelo con atrazina, sin sustrato y no esterilizado) al igual que el T5 (suelo con atrazina y sustrato sin esterilizar) son significativamente muy similares. Lo anterior corrobora el efecto detrimental sobre la población de nitrosomas. De igual forma los tratamientos T3 (suelo con sustrato, sin atrazina y no esterilizado) y T1 (suelo sin sustrato y atrazina) presentan similaridad. El tratamiento T2 es significativamente diferente a todos los demás. Lo anterior se explica en efectos altamente significativos (1%) dados en los tratamientos, atrazina y la interacción esterilidad versus los demás tratamientos. No se encontró efectos significativos al analizar el sustrato la interacción atrazina por sustrato.
Bacterias nitrobacter. La razón de lo observado en la Tabla 6 y Figura 7 es la misma que se ha presentado en las anteriores discusiones. El efecto de la esterilización redujo su número incluso por debajo al inicial que se observa en la Tabla 6.
Los demás tratamientos aumentan sus U.F.C./g de suelo a los 30 días. No obstante el tratamiento T4 (suelo con atrazina, sin sustrato y no esterilizado) presenta el menor valor respecto a T1 (suelo no esterilizado, sin atrazina y sustrato), T3 (Suelo con sustrato, sin atrazina y no esterilizado) y el T5 (suelo con atrazina y sustrato, sin esterilizar).
Lo anterior igual que en el caso de bacterias nitrosomas no cumple con el crecimiento adaptativo (García y Fernández-Quintanilla, 1991). Donde la atrazina sirve para la población de microorganismos como agente para ser degradado y factor de crecimiento para la población.
Si fuese así los valores a los 30 días de T4 serían superiores al del tratamiento T1. Al observar los tratamientos T3, T5, T1 y compararlo con el T4 se ve un aumento a través del tiempo, obteniendo niveles máximos de valores de U.F.C./g de suelo hacia los 45 días. Luego disminuyen a los 60 días, pero no tan drásticamente como el tratamiento T4. Lo anterior vuelve a corroborar lo expuesto por Guerrero (1997) al haber una inhibición momentánea de la actividad microbial con la correspondiente escases de N por efecto de la atrazina. El tratamiento T5 se observa el anterior efecto pero no tan pronunciado gracias a la mezcla de sustrato con atrazina.
El análisis de varianza como los tratamientos T1 (suelo no tratado, sin atrazina y sustrato) es significativamente parecido a T3 (suelo con sustrato, sin atrazina y no esterilizado) y también similar a T5 (suelo con atrazina y sustrato, sin esterilizar) con lo cual está corroborando lo ya discutido en que la atrazina inhibe su daño detrimental si esta se mezcla con sustrato. En cambio el tratamiento T4 (suelo con atrazina sin sustrato y no esterilizado) es significativamente diferente a todos los tratamientos dada por su condición detrimental sobre las poblaciones de nitrobacter. De igual forma el tratamiento T2 (suelo estéril sin atrazina y sustrato) es significativamente diferente a los demás tratamientos por su condición de suelo estéril.
Bacterias nitrobacter en suelo cercano a la rizósfera. Según lo observado en la Figura 8, el suelo cercano a la rizósfera posee el mayor número de U.F.C./g de suelo con respecto al tomado a 8 cm de distancia del tallo de la planta. Esto ratifica lo descrito por Anderson et al. (1994), Zablotowicz et al. (1994) y otros, donde existe una mayor actividad de microorganismos en la rizósfera ya que la degradación tanto de la atrazina como sustrato es mayor en ella. La estadística, en el tratamiento T4 (suelo con atrazina, sin sustrato y no esterilizado) es significativamente muy similar a todos los tratamientos pero con características de T2 (suelo esterilizado, sin atrazina y sustrato). Lo anterior ratifica el efecto detrimental sobre población de nitrobacter. Este efecto de la atrazina se presenta como significante (5%) y resalta más en altamente significativo (1%) el efecto de tratamiento y la interacción esterilidad versus el resto de tratamientos.
Bacterias desnitrificantes. Lo encontrado en la Tabla 7 y Figura 9 indica que la atrazina sirvió hasta los 30 días aproximadamente como sustrato para que los microorganismos la degradaran y crecieran, ajustándose claramente al modelo adaptativo propuesto por García y Fernández-Quintanilla (1991). Sin embargo resalta el hecho el decrecimiento de T4 a los 45 y 60 días, el cual podría ser debido a un aumento máximo en la degradación de la atrazina a los 30 días y también debido a que su concentración se redujo a la mitad o vida media y no a un efecto de inhibición de las bacterias desnitrificantes por parte del herbicida, ya que el valor de U.F.C./g de suelo en T4 (a los 30 días) fue superior al tratamiento T1 (suelo no esterilizado sin atrazina y sustrato). Si se presento dicha inhibición, esta se desarrolló a los 45 y 60 días.
El tratamiento T5 (suelo con atrazina y sustrato, sin esterilizar) también obtuvo su máximo valor de U.F.C./g de suelo a los 30 días. Presentó además una disminución de U.F.C./g de suelo a los 45 días próximo al valor de vida media de atrazina (55 días), lo cual al igual que lo discutido con las bacterias nitrosomonas, nitrosobacter y amonificantes hay una disminución de población en T5 pero no de la misma manera como en T4.
El tratamiento T3 (suelo con sustrato, sin atrazina y no esterilizado), presenta un crecimiento de U.F.C./g de suelo similar al tratamiento T1, pero con la diferencia que T3 alcanza su valor máximo de U.F.C./g de suelo a los 45 días, mientras que T1 hacia los 60 días. Se resalta además el hecho de que el tratamiento T1 obtuvo el menor valor entre tratamientos de U.F.C./g de suelo a los 30 días (no incluido el tratamiento T2), incluso por debajo del conteo inicial, como también el valor más alto de U.F.C./g de suelo a los 60 días.
El tratamiento T2 (suelo esterilizado, sin atrazina y sustrato), presentó los niveles más bajos de U.F.C./g de suelo a través del tiempo. Lo anterior debido a lo ya comentado en discusiones pasadas donde las pocas U.F.C./g de suelo obtenidos crecieron por estructuras que quedaron con viabilidad después de la esterilización. El análisis de varianza presenta que no hay diferencias significativas al comparar el tratamiento T4 (suelo con atrazina, sin sustrato y no esterilizado) con los demás tratamientos exceptuando al T2 (suelo estéril, sin sustrato y atrazina) el cual si presenta diferencias significativas con todos los tratamientos, dada por su condición de esterilidad.
Bacterias desnitrificantes en suelo cercano a la rizósfera. Lo encontrado en la Figura 10, igual que en casos ya discutidos corrobora lo airmado por Anderson et al. (1994) y otros, donde hay una mayor actividad de microorganismos en la rizósfera, al igual que una más alta degradación del herbicida atrazina (Jordahl et al.1997).
En el análisis de varianza, los tratamientos T4 (suelo con atrazina, sin sustrato y no esterilizado) al igual que T5 (suelo con sustrato y atrazina, sin esterilizar) se asemejan a los demás tratamientos indicando que no son significativamente diferentes. Sin embargo en el cuadro 39 se ve una disminución de T4 respecto a los demás tratamientos (incluido T5) lo cual indicaría que el efecto detrimental se da y es corroborable por un efecto significativo (5%) dado por la atrazina. De igual forma existe efecto altamente significativos (1%) que explican porque T2 (suelo estéril, sin atrazina y sustrato) es significativamente diferente a todos los otros tratamientos y es el efecto esterilidad versus demás tratamientos. No se encontraron efectos significativos al analizar el sustrato, y la interacción atrazina por sustrato.
Bacterias solubilizadoras de fósforo. Al analizar lo observado en la Tabla 8 y Figura 11 y comparar el tratamiento T4 (suelo con atrazina, sin sustrato y no esterilizado) con el tratamiento T1 (suelo no esterilizado, sin atrazina y sustrato) los valores de ambos tratamientos a través de los intervalos de tiempo (30, 45 y 60 días) son muy parecidos. Inclusive el valor a los 30 días de T4 es inferior a T1. Lo anterior aclara que no existe el modelo adaptativo dado por García y Fernández-Quintanilla (1991), para bacterias solubilizadoras de fósforo si no el no adaptativo donde la atrazina no es fuente de alimento para este tipo de microorganismos. En general la atrazina es fuente de C y N según lo investigado por Radosevich et al. (1995), Gan et al. (1996) y Mandelbaum et al. (1993). Se destaca además que la población de microorganismos es inferior en el tratamiento T4 comparado con el tratamiento T1, lo cual indicaría que la atrazina afecta a la población, pero no tan drásticamente como lo observado en bacterias nitrobacter y nitrosomonas. Sin embargo hay que resaltar que el número de U.F.C./g de suelo en el tratamiento T3 (suelo con sustrato, sin atrazina y no esterilizado) obtuvo los mayores valores de U.F.C./g de suelo a los 45 y 60 días, y que el tratamiento T5 (suelo con atrazina y sustrato sin esterilizar) obtuvo un valor de U.F.C./g de suelo superior al T3 a los 30 días. Lo cual explica que hay una acción del sustrato con la atrazina, que permite que la población microbial no disminuya por el efecto del herbicida, sino antes por el contrario aumente la población. En general el aumento del número de U.F.C./g de suelo es debido al sustrato (bagazo de maíz) y atenúa el efecto del herbicida sobre la población.
El tratamiento T2 (suelo esterilizado, sin atrazina y sustrato) mantuvo un número de U.F.C./ g de suelo inferiores a las iniciales, lo anterior debido en si a la esterilización realizada. Las poblaciones que crecieron provienen de aquellas que resistieron dicha esterilización. En el análisis de varianza, no existen diferencias significativas entre los tratamientos. Únicamente el tratamiento T2 (suelo esterilizado, sin atrazina y sustrato) presenta diferencias significativas respecto a los demás. No existió efecto significativo al analizar los tratamientos, la atrazina, el sustrato y la interacción atrazina por sustrato.
Bacterias solubilizadoras de fósforo en el suelo cercano a la rizósfera. Lo dado en la Figura 12 no se relaciona con lo airmado por Anderson et al. (1994) donde la actividad microbiana aumenta en la rizósfera. Sin embargo el tratamiento T5 (suelo con atrazina y sustrato, sin esterilizar) presenta un número de U.F.C./g de suelo mayor en el suelo cercano a la rizósfera, conirmando lo sustentado por Zablotowicz et al. (1994) donde la actividad microbiana aumenta en la rizósfera. Lo anterior se debe a una acción mixta entre el sustrato (Bagazo de maíz) y atrazina que permite un mayor número de organismos en el suelo cercano a la rizósfera.
El análisis de varianza, los tratamientos T1 (suelo no esterilizado, sin atrazina y sustrato) T3 (suelo con sustrato, sin atrazina y no esterilizado) y T4 (suelo con atrazina, sin sustrato y no esterilizado) presentan un comportamiento muy similar a T2 (suelo esterilizado, sin sustrato y atrazina) y a la vez a T5 (suelo con atrazina y sustrato, sin esterilizar), lo cual explicaría en cierto sentido como el tratamiento T5 presento un mayor número de U.F.C./g de suelo mayores a los demás tratamientos debido a la acción mixta de sustrato con atrazina.
CONCLUSIONES
La atrazina no causa efecto detrimental a través del tiempo sobre las poblaciones de bacterias (analizadas en forma general) solubilizadoras de fósforo.
El sustrato al ser aplicado con la atrazina aumentó las unidades formadoras de colonia por gramo de suelo (U.F.C./g) a través del tiempo más que al adicionar solo el herbicida. Lo anterior también sucedido en el suelo cercano a la rizósfera.
Al aplicar solo sustrato las poblaciones presentaron aumento de U.F.C./g de suelo a través del tiempo en forma parecida pero menor al observado cuando se adicionó este último con atrazina. Así como el suelo cercano a la rizósfera presentó similar comportamiento.
No se puede catalogar a la atrazina en un modelo adaptativo con respecto a las poblaciones ya que éstas no demostraron un crecimiento significativo en los tratamientos donde se adiciono el herbicida, a su vez no se puede clasificar en un modelo no adaptativo ya que las poblaciones presentaron un crecimiento a través del tiempo muy similar al suelo no tratado.
La planta de maíz generó un ambiente idóneo para el desarrollo y crecimiento de bacterias gram negativas más que las gram positivas en suelo cercano a la rizósfera como el tomado a 8 cm de distancia del tallo.
La atrazina causó un efecto detrimental a través del tiempo sobre poblaciones de Bacterias amonificantes, Bacterias nitrosomonas, Bacterias desnitrificantes. De los anteriores grupos de microorganismos se derivan las siguientes conclusiones. Aunque la atrazina causó efecto detrimental sobre las poblaciones mencionadas, esta al ser aplicada sola logró hacia los 30 días valores de U.F.C./g de suelo superiores al inicial. Sin embargo al grupo de bacterias nitrosomonas obtuvo su máximo valor a los 45 días antes de cumplirse la vida media del herbicida.
La atrazina presentó un comportamiento de tipo adaptativo con el grupo de bacterias desnitrificantes ya que estas aumentaron hacia los 30 días superando al suelo no tratado. Sin embargo existe un efecto detrimental sobre esta población cerca al periodo de vida media del herbicida.
En los demás grupos aunque sus poblaciones crecieron superando a las iniciales, no se considera comportamiento de tipo adaptativo por parte de la atrazina debido a que sus valores de U.F.C./g de suelo no superaron a las del suelo no tratado.
El sustrato al ser adicionado con atrazina atenuó el efecto detrimental causado por el herbicida aumentando el número de U.F.C./g de suelo de las poblaciones. Sin embargo el mencionado incremento fue menor al suelo no tratado exceptuando la población de bacterias amonificantes y desnitrificantes, las cuales superaron a este último.
El sustrato al ser aplicado solo aumento en mayor número las U.F.C./g de suelo que al adicionarlo con la atrazina. Sin embargo la población de Bacterias amonificantes y desnitrificantes, reportaron valores de U.F.C./g de suelo inferiores a las obtenidas al aplicar sustrato con atrazina.
REFERENCIAS BIBLIOGRAFÍCAS
Alexander, M. 1981. Introduction soil micro biology. John Wiley y Sons, Inc, Nueva York, E.U.A.
Anderson, R.C. & E.S.Menges, 1997. Effects of ire on Snadhill herbs: nutrients, mucorr hizae, and biomass allocation. Botanical So ciety of America Inc. July. 84 (7): 938-948.
Burges, A. & F. Raw 1971. Biología del sue lo, aspecto microbiológico, botánico y zoo lógico. Editorial Omega S.A. Barcelona, España.
Crowley, D.E. S. Alvey & E.S. Gilbert 1997. Rhizosphere ecology of xenobioticdegra ding microorganisms. American Chemical Society. Pág. 20-36.
Fedi, S., E. Tola, Y. Moenne-Loccoz, D.N. Dowling, L.M. Smitj, & F. O'Gara 1997. Evidence for signaliny between the Phythium ultimum and Pseudomonas luo rescens F113: P. ultimum represses the ex pression of genes in P. lourescens F113, resulting in altered ecological itness. American Society of Microbiology. Nov. 63 (11): 4261-4266.
Fernández-Quintanilla, C. & M. Saavedra 1991. Malas hierbas: conceptos generales. Páginas 16-48. Fundamentos sobre malas hierbas y herbicidas. Ediciones Mundi prensa, Madrid, España.
Guerrero, R. 1997. Curso de fertilización y fertilizante. Univ. Nac. De Colombia. Es cuela de postgrado. Facultad de Agrono mia. Santafé de Bogotá, D.C., Colombia.
Ingraham, J.L. & M. C.A Ingraham 1998.Introducción a la Microbiología. EditorialReverte, S.A., Madrid, España.
Jordahl, J.L., L. Foster , J.L. Schnoor &P.J.J. Álvarez 1997. Effect of hybrid poplartrees on microbial populations important tohazardous waste bioremediation. SETACpress. June 1997. 16 (6): 1318-1321.
Mandelbaum, R.T., L.P. Wackett & D.L.Allan 1993. Mineralization of the S-triazine ring of atrazine by stable bacterial mixedcultures. American Society for Microbiology. 59 (6): 1695-1701.
Ordóñez, A. R. 1998. Efecto del herbicidaatrazina sobre microorganismos diazotrofos asociados a un cultivo de maíz (zeamays) en un suelo de Saldaña Tolima. Tesisde grado para optar titulo de Biólogo. Facultad de Ciencias, Departamento de Biología, Universidad Nacional de Colombia,Santafé de Bogotá, Colombia.
Quevedo, C. 1992. Manual de Técnicas Agropecuarias. Canal Ramírez Antares LTDA.,Santafé de Bogotá, Colombia.
Radosevich, M. S.J. Traina, Y.L. Hao &O.H. Touvinen 1995. Degradation and mineralization of atrazine by a soil bacterialisolate. American Society for Microbiology. 61 (1): 297-302.
Yanze-Kontchou, C. & N. Gshwind 1995.Mineralization of the herbicide atrazine inSoil inoculated with a Pseudomonas strain.American Chemical Society. 43 (8): 22912294.
Zablotowicz, R.M., R.E. Hoagland & M.A.Locke 1994. Glutathione S-transferase activity in rhizosphere bacteria and the potential for herbicide detoxification. AmericanChemical Society. Pag. 184-198.
NOTAS
4 Datos climatológicos tomados de promedios acumulados de 10 años, IDEAM.
Creation date:
Licencia
Colombia Forestal conserva los derechos patrimoniales (copyright) de las obras publicadas, y favorece y permite la reutilización de las mismas bajo la licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional por lo cual se pueden copiar, usar, difundir, transmitir y exponer públicamente, siempre que:
Se reconozcan los créditos de la obra de la manera especificada por el autor o el licenciante (pero no de una manera que sugiera que tiene su apoyo o que apoyan el uso que hace de su obra).














