DOI:
https://doi.org/10.14483/udistrital.jour.colomb.for.2009.1.a02Publicado:
01-01-2009Número:
Vol. 12 Núm. 1 (2009): Enero-DiciembreSección:
Artículos de investigación científica y tecnológicaDEPENDENCIA MICORRIZAL DE LAUREL (Ocotea sp.)
Laurel (Ocotea sp.) mycorrhizal dependence
Palabras clave:
micorriza, fijación de fósforo, Ocotea (es).Palabras clave:
mycorrhiza, phosphorus fixation, Ocotea. (en).Descargas
Referencias
Allen, M. 1996. The ecology of arbuscular mycorrhizas: a look back into the 20th century and a peek into the 21th. Mycological Research 100: 769-782.
Aziz, T. & M. Habte. 1987. Determining vesicular-arbuscular micorrhizal effectiveness by monitoring P status of leaf disk. Canadian Journal Microbiology 33: 1097-1101.
Barea, J. M., R. Azcón & C. Azcón-Aguilar. 2002. Mycorrhizosphere interactions to improve plant fitness and soil quality. Antonie Van Leewenhoek 81: 343-351.
Díez, M. 2006. Dependencia micorrizal de pino romeron, Retrophyllum rospigliosii (Pilg.) C. N. Page (Podocarpaceae), bajo diferentes niveles de intensidad lumínica. Informe de tesis presentado a la Universidad Nacional de Colombia, Sede Medellín, Facultad de Ciencias Agropecuarias. Medellín.
Elsen, A., H. Baimey, R. Swennen & D. De Waele. 2003. Relative mycorrhizal dependency and mycorrhiza-nematode interaction in banana cultivars (Musa sp.) differing in nematode susceptibility. Plant and Soil 256: 303-313.
Fox, R. & E. Kamprath. 1970. Phosphate sorption isotherms for evaluating the phosphate requirements of soils. Soil Science Society of America Proceedings 34: 902-907.
Gerdemann, J. W. 1968. Vesicular-arbuscular mycorrhiza and plant growth. Phytopatol 6: 397-418.
Giovannetti, M. & B. Mosse. 1980. An evaluation of techniques for measuring vesicular-arbuscular mycorrhizal infection in roots. New Phytology 84: 489-500.
González, O. & N. W. Osorio. 2008. Determinación de la dependencia micorrizal del lulo. Acta Biológica Colombiana 13 (2): 163-174.
Habte, M., R. Fox & R. Huang. 1987. Determining vesicular-arbuscular micorrhizal effectiveness by monitoring P status of subleaflets of indicator plants. Communications in Soil Science and Plant Analysis 18: 1403-1420.
Habte, M. & A. Manjunath. 1987. Soil solution phosphorus status and mycorrhizal dependency in Leucaena leucocephala. Applied and Environmental Microbiology 53: 797-801.
Habte, M. & A. Manjunath. 1991. Categories of vesicular-arbuscular mycorrhizal dependency of host species. Mycorrhiza 1: 3-12.
Habte, M. & N. W. Osorio. 2001. Arbuscular mycorrhizas: Producing and applying arbuscular mycorrhizal inoculum. University of Hawaii. Honolulu, Hawai. Pp. 1-47.
Haselwandter, K. & G. D. Bowen. 1996. Mycorrhizal relations in trees for agroforestry and land rehabilitation. Forest Ecology and Management 81: 1-17.
Holdridge, L. R. 1967. Life zone ecology. Tropical Science Center.
Janos, D. 1980a. Mycorrhizae influence tropical succession. Biotropica 12: 54-64.
Janos, D. 1980b. Vesicular-arbuscular mycorrhizae affect lowland tropical rain forest plant growth. Ecology 61: 151-162.
Jaramillo, S. P., M. Silva & N. W. Osorio. 2004. Potencial simbiótico y efectividad de hongos micorrízico arbusculares de tres suelos sometidos a diferentes usos. Medellín. Revista Facultad Nacional de Agronomía 57: 2203-2214.
Johansson, J. F., L. R. Paul & R. D. Finlay. 2004. Microbial interactions in the mycorrhizosphere and their significance for sustainable agriculture. Fems Microbiology Ecology 48: 1-13.
Johansson, F., R. Leslie, & R. Finlay. 2004. Microbial interactions in the mycorrhizosphere and their significance for sustainable agriculture. Plant and Soil 0: 1-21.
Kormanik, P. P., A. C. Mcgraw & R. C. Schultz. 1980. Procedure and equipment for staining a large number of plant samples for endomycorrhizal assay. Canadian Journal of Microbiology 26: 536-538.
Manjunath, A. & M. Habte. 1990. Establishment of soil solution P levels for studies involving vesicular-arbuscular micorrizal fungi. Communications in Soil Science and Plant Analysis 21: 557-566.
Mansfeld-Giese, K., J. Karsen & L. Bødker. 2002. Bacterial populations associated with mycelium of the arbuscular mycorrhizal fungus Glomus intrarradices. Fems Microbiology Ecology 41: 133-140.
Murphy, J. & J. P. Riley. 1962. A modified single solution method for the determination of phosphate in natural waters. Analytica Chimica Acta 27: 31-35.
Osorio, W., M. C. Díez, J. Sierra & L. Paternina. 2008. Consideraciones ecológicas sobre la asociación micorrizal en suelos de la region altoandina. En: J. D. León (ed.). Ecología de bosques andinos. Experiencias de investigación. La Carreta Editores. Medellín. Pp. 181-200.
Phillips, J. M. & D. S. Hayman. 1970. Improved procedures for clearing and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection. Transactions of the British Mycological Society 55: 158-161.
Plenchette, C., A. Fortin & V. Furlan. 1983. Growth responses of several plant species to mycorrhizae in a soil of moderate P fertility. I. mycorrhizal dependency under field conditions. Plant and Soil 70: 191-209.
Porter, W. 1979. The "most probable number" method for enumerating infective propagules of vesicular arbuscular micorrizal fungi in soil. Australian Journal of Soil Research 17: 515-519.
Rilling, M. 2004. Arbuscular mycorrhizae and terrestrial ecosystem processes. Ecology Letters 7: 740-754.
Sánchez, M. 1999. Endomicorrizas en agroecosistemas colombianos. Departamento de Ciencias Básicas, Universidad Nacional de Colombia, Sede Palmira. Palmira.
Sieverding, E. 1991. Vesicular-arbuscular mycorrhiza management in tropical agrosystems. Technical cooperation, Eschbor. República Federal de Alemania.
Smith, S. & D. Read. 1997. Mycorrhizal Symbiosis. Academic Press. Londres.
Uchida, R. & N. V. Hue. 2000. Plant nutrient management in Hawaii's soils, approaches for tropical and subtropical agriculture. En: Silva, J. A. & R. Uchida (eds.). College of Tropical
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
 | Sierra-Escobar, J., Castro-Restrepo, D., & Osorio-Vega, W. (2009). Dependencia micorrizal de laurel (Ocotea sp.). Colombia Forestal, 12, 19-24. |
DEPENDENCIA MICORRIZAL DE LAUREL (Ocotea sp.)
Laurel (Ocotea sp.) mycorrhizal dependence
Dependência micorrizal do Louro (Ocotea sp.)
Jorge A. Sierra-Escobar1, Dagoberto Castro Restrepo2 & Walter Osorio Vega3
1Universidad Católica de Oriente, A.A. 050956, Rionegro, Antioquia. Correspondencia:
jsierra@uco.edu.co
2Unidad de Biotecnología Vegetal, Universidad Católica de Oriente, A.A. 050956, Rionegro, Antioquia.
dcastro@uco.edu.co
3Laboratorio de Microbiología del Suelo, Universidad Nacional de Colombia, A.A. 3840, Medellín, Antioquia.
nwosorio@unal.edu.co
Recepción: Marzo 7 de 2009/Aprobación: Abril 16 de 2009
RESUMEN
Se realizó un experimento en invernadero para determinar la dependencia micorrizal (DM) de laurel (Ocotea sp.). Para tal fin se utilizó un diseño experimental completamente al azar. Los tratamientos tuvieron un arreglo factorial 3x2 con cinco repeticiones, los cuales consistieron en la combinación de tres niveles de fósforo (P) en la solución del suelo (0.002, 0.02 y 0.2 mg L-1) y dos niveles de inoculación micorrizal (inoculado y no inoculado) con Glomus aggregatum Schenck & Smith. Se emplearon como variables respuesta el contenido de P foliar en función del tiempo. Al momento de la cosecha, se determinaron la masa seca aérea, el P total absorbido en la parte aérea, la colonización micorrizal y la DM. Los resultados indican que en algunos días de muestreo el contenido de P foliar aumentó significativamente con la inoculación micorrizal en laurel al nivel de P en solución de 0.2 mg L-1 pero no en los otros niveles de P. El contenido de P total absorbido no incrementó significativamente. La DM fue del 28%, lo que permite clasificar esta especie como moderadamente dependiente.Palabras clave: micorriza, fijación de fósforo, Ocotea.
ABSTRACT
A greenhouse experiment was carried out to determine the mycorrhizal dependency of laurel (>Ocotea sp.). In order to do this, a completely randomized experimental design was used, with six treatments in a factorial array of 3x2 and five repetitions. The treatments involved a combination of three Phosphorus (P) levels in soil solution (0.002, 0.02 and 0.2 mg L-1) and two levels of mycorrhizal inoculation, either inoculated or non-inoculated with Glomus aggregatum Schenck & Smith. The leaf P content as a function of time was used as an output variable. Shoot dry matter, shoot P content, mycorrhizal colonization of roots, and mycorrhizal dependence were measured at harvest. The results indicated that the leaf P content increased significantly when using the mycorrhizal inoculation in laurel at P level 0.2 mg L -1, but not in the other P levels, on some of the sampling days. Shoot dry weight and total plant P content did not increase at all levels of soil available P. Mycorrhizal dependency of laurel reached 28%, which allows this species to be classified as moderately dependent on mycorrhiza.
Keywords: mycorrhiza, phosphorus fixation, Ocotea.
RESUMO
Realizou-se uma experiência num invernadeiro para determinar a dependencia micorrizal (dm) do louro (Ocotea sp.). Para tal fim se utilizou um desenho experimental completamente aleatório. Os tratamentos tiveram um arranjo fatorial de 3x2 com cinco repetições, os quais consistiram na combinação de três níveis de fósforo (P) na solución do solo (0.002, 0.02 e 0.2 mg L-1) e dois níveis de inoculação micorrizal (inoculado e não inoculado) com Glomus aggregatum Schenck & Smith. Empregaram-se como variáveis em resposta ao conteúdo de P foliar em função do tempo. No momento da colheita, se determinou a massa seca aérea, com P total absorvido na parte aérea, na colonização micorrizal e a dm. Os resultados indicam que em alguns dias de amostra o conteúdo do P foliar aumentou significativamente com a inoculação micorrizal no louro ao nível de P na solução de 0.2 mg L-1 mas não em outros níveis de P. O conteúdo de P total absorvido não incrementou significativamente. A DM foi de 28%, o que permitiu classificar esta espécie como moderadamente dependente.
Palavras chave: Micorriza, fixação do fósforo, Ocotea.
INTRODUCCIÓN
Una de las estrategias más exitosas desarrolladas por las plantas para superar el estrés que se presenta durante la colonización de ecosistemas terrestres es la capacidad de las raíces para establecer simbiosis benéficas con microorganismos del suelo (Allen 1996, Rilling 2004). Ejemplo de ello son las asociaciones simbióticas mutualistas entre las raíces del 95% de las especies vegetales y ciertos grupos de hongos micorrizales (Sánchez 1999). Aunque el 95% de las especies vegetales establecen este tipo de asociaciones, sólo se han examinado en un 3% de ellas (Smith & Read 1997) y es mucho más incipiente la información acerca de su dependencia por la condición micorrizal. Otros autores opinan que sólo el 80% de los ecosistemas terrestres del mundo poseen algún tipo de asociación micorrizal y que la clase de asociación depende de la zona de vida (Cuenca 2001). Son varias las ventajas que ofrece la asociación micorrizal a las plantas: aumenta la toma de nutrientes del suelo, especialmente de P, contribuye significativamente a mejorar la estructura del suelo, incrementa la resistencia de la planta al estrés biótico y abióti co, y favorece el establecimiento de interacciones con otros microorganismos benéficos (Sieverding 1991, Haselwandter & Bowen 1996, Barea et al. 2002, Mansfeld et al. 2002, Elsen et al. 2003, Johansson et al. 2004). En tal sentido, para poder utilizar con éxito los hongos micorrizo arbusculares (HMA) y mejorar la eficiencia en el uso de P por parte de las plantas, y a su vez aprovechar las otras ventajas anteriormente mencionadas, es necesario conocer el grado de relación entre el hongo y el hospedero (planta). En algunas especies de plantas la asociación con HMA es indispensable para su crecimiento, sin embargo, el grado de DM varía con la especie vegetal. La DM es definida como el grado en el cual una especie de planta depende de la condición micorrizal para alcanzar su máximo crecimiento o producción (Gerdemann 1968). Ésta se determina como el porcentaje de la diferencia entre la producción de masa seca total de plantas inoculadas y no inoculadas sobre la producción total de masa seca de plantas inoculadas (Plenchette et al. 1983). Nuestra hipótesis es que las especies que crecen naturalmente en los suelos de los bosques altoandinos, característicamente bajos en P disponible, establecen algún tipo de asociación micorrizal y dependen de ella para su establecimiento y desarrollo inicial. Por tal motivo, el objetivo de la presente investigación fue determinar la dependencia micorrizal del laurel (Ocotea sp.) especie típica de interior de bosque perteneciente a la zona de vida bosque húmedo montano bajo (Holdridge 1967).
METODOLOGÍA
El experimento se realizó en el invernadero de la Universidad Católica de Oriente (6° 9´ 15.2” N, 75° 22´ 10.4” O, a una altitud de 2112 msnm en Rionegro, Colombia). El sitio presenta una temperatura promedio de 17° C y una precipitación anual de 1700 mm y se ubica en la zona de vida bosque húmedo montano bajo (Holdridge 1967).
El suelo en el que crecieron las plantas correspondió a una muestra del horizonte Bw de un Andisol de la estación experimental Piedras Blancas (6° 15´ 38” N, 75° 30´ 23” O; altitud: 2484 msnm). Se utilizó esta muestra de suelo subsuperficial para reducir la influencia del P orgánico sobre el P disponible. El suelo se secó al aire y se tamizó a 4 mm y luego se analizó en el Laboratorio de Suelos de la Universidad Nacional de Colombia, Sede Medellín. Los resultados fueron: arena 92%, limo 4%, arcilla 4%, textura A (Bouyucos), pH 5.7 (agua, 1:1, V: V), materia orgánica 11% (Walkley y Black), calcio, magnesio y potasio, 1.7, 0.1 y 0.05 cmolc kg-1 (acetato de amonio 1M, pH 7), respectivamente; fósforo 1 mg kg-1 (Bray II); hierro, manganeso, cobre y zinc 64, 1, 1 y 1 mg kg -1 (Olsen-edta); boro no detectable mg kg-1(agua caliente); nitrato 3 mg kg -1(sulfato de aluminio 0.025M) y amonio 18 mg kg-1 (KCL 1M).
El pH del suelo se ajustó a 5.9 con 2 g de CaCO3 por kg de suelo para evitar niveles altos de aluminio y optimizar la solubilidad de P. Para determinar el requerimiento de cal se realizó una curva de incubación con CaCO 3 (Uchida & Hue 2000). El suelo se esterilizó con vapor a 80° C y durante una hora.
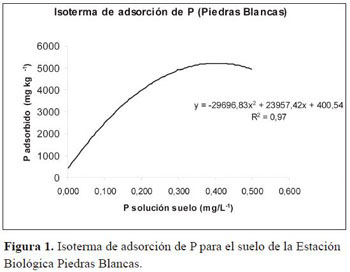
La fertilización del sustrato consistió en la adición S 204, Zn 10, Cu 5, B 0.8 y Mo 0.5. El sustrato se de urea 0.17 mg kg-1, CaSO4 2H2O 0.73 mg kg -1, MgSO4, 7H2O 0.93 mg kg-1, y K2 SO 4 0.21 mg kg-1. Así mismo, se aplicó P en forma de KH 2PO4 para obtener tres concentraciones de P en la solución del suelo 0.002, 0.02 y 0.2 mg L-1, según lo propuesto por Habte & Manjunath (1991) para estudios de DM. Para este fin se realizó una isoterma de adsorción de P de acuerdo al método de Fox & Kamprath (1970) cuyos resultados se muestran en la (Figura 1). Las cantidades de KH2 PO4 fueron 2, 3.8 y 17.6 g kg-1. Luego, el sustrato estéril y fertilizado se trasfirió a bolsas plásticas con 18 cm de diámetro por 29.5 cm de altura.
Cada unidad experimental recibió quincenalmente la solución nutritiva Hogland libre de P a las siguientes dosis (mg L-1): N 50, K 132, Mg 106, mantuvo entre un 50-60% de la máxima capacidad de retención de agua (39 y 47% respectivamente), para lo cual se aplicó agua corriente o la solución nutritiva mencionada.
Las semillas de laurel se obtuvieron de poblaciones naturales de árboles ubicados en el Santuario de Flora y Fauna Otún Quimbaya (Risaralda, Colombia). Todas las semillas se lavaron con agua destilada, se desinfectaron con hipoclorito de sodio al 1%, se trasfirieron a bandejas de germinación (temperatura ambiente) que contenían arena esterilizada hasta su germinación. Una vez germinadas, cada plántula se trasplantó a potes plásticos que contenían arena estéril donde permanecieron hasta alcanzar 10 o 15 cm de altura, para posteriormente pasarlas a una bolsa plástica en su respectiva unidad experimental.
Se utilizó un inóculo crudo de Glomus aggregatum de efectividad comprobada, el cual contenía esporas, fragmentos de raíces infectadas e hifas del hongo suspendidas en una matriz sólida compuesta por suelo y cuarzo (1:1). El inóculo tuvo 8500 propágulos micorrizales infectivos por kg de suelo de terminado por el método del número más probable (NMP) (Porter 1979). Este hongo fue originalmente suministrado por M. Habte de la Universidad de Hawai (Honolulu, EEUU) y multiplicado en raíces de sorgo y kudzú (Habte & Osorio 2001) en el La boratorio de Microbiología del Suelo de la Universidad Nacional de Colombia. La efectividad de este HMA para incrementar la absorción de P y el crecimiento vegetal en suelos con bajo contenido de P soluble ha sido comprobada por Jaramillo et al. (2004), Osorio et al. (2008) y González & Osorio (2008). Al momento de la siembra, 20 g de inóculo crudo de G. aggregatum por kg de suelo se mezclaron uniformemente en cada unidad experimental. El suelo no inoculado recibió 20 g de suelo estéril por kg, además de filtrados de una suspensión del inóculo crudo (10%) luego de remover las estruc turas de los hongos con papel filtro Schleicher & Schuell (tamaño de poro: 2 µm).
Se utilizó un diseño experimental completamente al azar. Los tratamientos tuvieron un arreglo factorial 3x2 con cinco repeticiones y consistieron en la combinación de los tres niveles de P (0.002, 0.02 y 0.2 mg L-1) y los dos niveles de inoculación micorrizal de G. aggregatum (inoculado y no inoculado).
Se realizaron mediciones periódicas del contenido de P en las hojas jóvenes completamente maduras (Habte & Osorio 2001). Para tal fin, una porción circular del tejido foliar se removió con un perforador (6 mm de diámetro). El contenido de P se expresó en términos de µg por disco de hoja. El P fue determinado por el método del azul de molibdato (Murphy & Riley 1962) luego de reducir los discos de hoja a cenizas en mufla a 500° C por 3 horas. Este método de muestreo no destructivo fue originalmente propuesto por Aziz & Habte (1987).
Al final del periodo de crecimiento de las plantas se cosechó la parte aérea. Las muestras se llevaron a estufa y se secaron a 60° C durante 72 horas. Luego se determinó la masa seca aérea (MSA). El P total absorbido en la parte aérea fue determinado al final de la cosecha como se describió anteriormente. Para esto se utilizó la concentración de P en el disco de hoja al momento de la cosecha (Habte et al. 1987). Para medir la colonización micorrizal las raíces finas de las plantas se sometieron a koh para aclaración (Phillips & Hayman 1970), luego se tiñeron con fucsina ácida (Kormanik et al. 1980) y posteriormente se determinó la colonización micorrizal siguiendo el método del intercepto de cuadrícula propuesto por Giovannetti & Mosse (1980). Con los datos de masa seca total se determinó la DM usando para ello la fórmula propuesta por Plenchette et al. (1983):
DM= (Masa seca plantas inoculadas – Masa seca plantas no inoculadas) x 100 / (Masa seca plantas inoculadas)
Luego, la DM de las especies vegetales se clasificó de acuerdo a lo propuesto por Manjunath & Habte (1990) y Habte & Manjunath (1991).
Los datos obtenidos fueron sometidos al análisis de varianza (prueba F) para determinar si existían diferencias significativas en función de los tratamientos. La prueba de la Diferencia Mínima Significativa (LSD) se usó para separar promedios con respecto al control no inoculado en cada uno de los niveles de P. Para los análisis estadísticos se empleó un nivel de significancia (P) ≤ 0.05 y se utilizó el paquete estadístico StatGraphics versión 4.0.
RESULTADOS Y DISCUSIÓN
La inoculación micorrizal no tuvo efectos significativos sobre el contenido de P foliar del laurel en los diferentes niveles de P en la solución de suelo y para todas las fechas de muestreo (Figura 2).
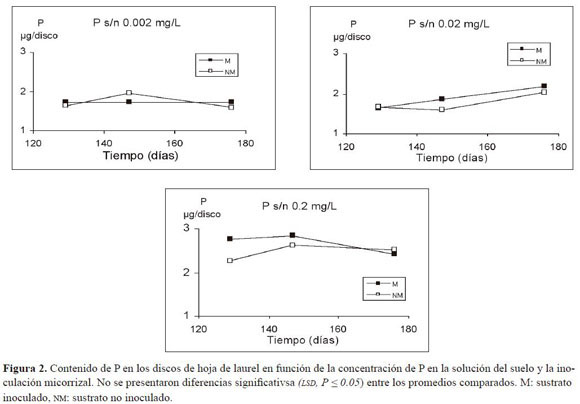
Por otro lado, la concentración de P en la solución del suelo de 0.2 mg L-1 incrementó significativamente el contenido de P foliar en todos los días de muestreo con respecto al nivel más bajo de P disponible.
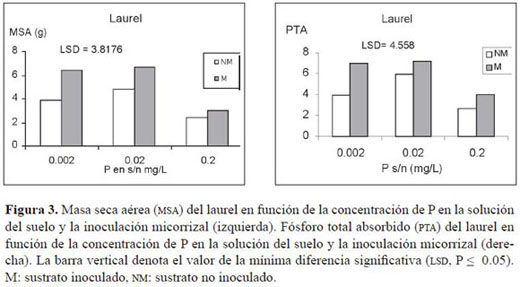
Aunque la MSA del laurel fue mayor con la inoculación micorrizal (M), estas diferencias no alcanzaron a ser significativas (P ≤ 0.05). Además, se encontró que en la medida en que el P en solución se incrementó, la MSA fue significativamente menor (Figura 3).
El fósforo total absorbido (PTA) del laurel fue ligeramente mayor con la inoculación micorrizal (M), pero estas diferencias no alcanzaron a ser significativas (P ≤ 0.05) (Figura 3).
Para la colonización micorrizal del laurel no se detectaron estructuras en ninguno de los tratamientos inoculados y no inoculados, posiblemente a causa de la gran cantidad de taninos encontrados en las raíces de esta especie, los cuales no permitieron una lectura de la colonización satisfactoria.
La dependencia micorrizal para el laurel fue moderada acorde con lo propuesto por Habte & Manjunath (1991) con valor 27.8 %, cuando se aplicó la formula de Plenchete et al. (1983).
El laurel es una especie que se puede clasificar ecológicamente como no pionera (árbol de interior del bosque); en tal sentido, los resultados son similares a los de estudios realizados en bosques húmedos tropicales por Janos (1980a, 1980b) y Díez (2006), en los cuales las especies pioneras poseen simbiosis micorrizal facultativa y las especies no pioneras obligada.
Los niveles bajo e intermedio de P disponible (0.002 y 0.02 mg L-1) sólo tuvieron ligeras variaciones sobre la MSA, lo que indica la gran adapta ción del laurel a suelos con bajo contenido de P. Incluso, el sistema radical varió con respecto al contenido de P: en el nivel alto las raíces tuvieron menor tamaño.
Para futuros estudios de DM en especies de bosque húmedo montano bajo se deben reevaluar los niveles de P en solución sugeridos por Manjunath & Habte (1990) y Habte & Manjunath (1991), en especial el nivel alto (P en solución de 0.2 mg L-1). A este nivel, las plántulas presentaron síntomas de necrosis foliar y en algunos casos radical, asociadas posiblemente a problemas fisiológicos de los individuos (Figura 4); al parecer las concentraciones bajas y altas de P limitan el crecimiento vegetal y la actividad micorrizal (Osorio et al. 2008). Para el efecto se deben hacer estudios de calibración y correlación de la planta a estudiar versus el P aplicado para definir unos niveles acordes con los requerimientos de la especie vegetal.

Por último, los resultados poseen aplicación práctica, ya que los métodos aquí utilizados permiten establecer la relación de plantas (dependencia micorrizal) con los HMA, lo que puede servir de herramienta de decisión a la hora de utilizar hongos micorrizales con fines forestales. Para el caso del laurel (Ocotea sp.) se sugiere utilizar HMA para me jorar y promover el crecimiento de esta especie en plantaciones forestales.
CONCLUSIONES
La DM del laurel fue moderada. Los valores de DM decrecieron al incrementar la concentración de P disponible en el suelo así: 40.3, 27.8, 22.2 % a los niveles de 0.002, 0.02, y 0.2 mg L -1, respectivamente. No se observaron estructuras ni propágulos infectivos en las raíces del laurel. El contenido de P foliar aumentó significativamente con la inoculación micorrizal a 0.2 mg L -1 en algunos días de muestreo.
AGRADECIMIENTOS
Este trabajo fue realizado gracias a la financiación y apoyo de la Dirección de Investigación y Desarrollo de la Universidad Católica de Oriente, en coordinación con la Unidad de Biotecnología Vegetal de la misma universidad. Además, se agradece muy especialmente a todos los integrantes del Grupo de Microbiología de Suelos de la Universidad Nacional Sede Medellín, quienes con su apoyo permitieron llevar a feliz término la presente investigación.
REFERENCIAS BIBLIOGRÁFICAS
Allen, M. 1996. The ecology of arbuscular mycorrhizas: a look back into the 20th century and a peek into the 21th. Mycological Research 100: 769-782.
Aziz, T. & M. Habte. 1987. Determining vesicular-arbuscular micorrhizal effectiveness by monitoring P status of leaf disk. Canadian Journal Microbiology 33: 1097-1101.
Barea, J. M., R. Azcón & C. Azcón-Aguilar. 2002. Mycorrhizosphere interactions to im prove plant fitness and soil quality. Antonie Van Leewenhoek 81: 343-351.
Díez, M. 2006. Dependencia micorrizal de pino romeron, Retrophyllum rospigliosii ( Pilg.) C. N. Page (Podocarpaceae), bajo diferentes niveles de intensidad lumínica. Informe de tesis presentado a la Universidad Nacional de Colombia, Sede Medellín, Facultad de Ciencias Agropecuarias. Medellín.
Elsen, A., H. Baimey, R. Swennen & D. De Waele. 2003. Relative mycorrhizal dependency and mycorrhiza-nematode interaction in banana cultivars (Musa sp.) differing in nematode susceptibility. Plant and Soil 256: 303-313.
Fox, R. & E. Kamprath. 1970. Phosphate sorption isotherms for evaluating the phosphate requirements of soils. Soil Science Society of America Proceedings 34: 902-907.
Gerdemann, J. W. 1968. Vesicular-arbuscular mycorrhiza and plant growth. Phytopatol 6: 397-418.
Giovannetti, M. & B. Mosse. 1980. An evaluation of techniques for measuring vesicular-arbuscular mycorrhizal infection in roots. New PhytoLogy 84: 489-500.
González, O. & N. W. Osorio. 2008. Determinación de la dependencia micorrizal del lulo. Acta Biológica Colombiana 13 (2): 163-174.
Habte, M., R. Fox & R. Huang. 1987. Determining vesicular-arbuscular micorrhizal effec tiveness by monitoring P status of subleaflets of indicator plants. Communications in Soil Science and Plant Analysis 18: 1403-1420.
Habte, M. & A. Manjunath. 1987. Soil solution phosphorus status and mycorrhizal dependency in Leucaena leucocephala. Applied and Environmental Microbiology 53: 797-801.
Habte, M. & A. Manjunath. 1991. Categories of vesicular-arbuscular mycorrhizal dependency of host species. Mycorrhiza 1: 3-12.
Habte, M. & N. W. Osorio. 2001. Arbuscular mycorrhizas: Producing and applying arbuscular mycorrhizal inoculum. University of Hawaii. Honolulu, Hawai. Pp. 1-47.
Haselwandter, K. & G. D. Bowen. 1996. Mycorrhizal relations in trees for agroforestry and land rehabilitation. Forest Ecology and Management 81: 1-17.
Holdridge, L. R. 1967. Life zone ecology. Tropical Science Center.
Janos, D. 1980a. Mycorrhizae influence tropical succession. Biotropica 12: 54-64.
Janos, D. 1980b. Vesicular-arbuscular mycorrhizae affect lowland tropical rain forest plant growth. Ecology 61: 151-162.
Jaramillo, S. P., M. Silva & N. W. Osorio. 2004. Potencial simbiótico y efectividad de hongos micorrízico arbusculares de tres suelos sometidos a diferentes usos. Medellín. Revista Facultad Nacional de Agronomía 57: 2203-2214.
Johansson, J. F., L. R. Paul & R. D. Finlay. 2004. Microbial interactions in the mycorrhizosphere and their significance for sustainable agriculture. Fems Microbiology Ecology 48: 1-13.
Johansson, F., R. Leslie, & R. Finlay. 2004. Microbial interactions in the mycorrhizosphere and their significance for sustainable agriculture. Plant and Soil 0: 1-21.
Kormanik, P.P., A.C. Mcgraw & R.C. Schultz. 1980. Procedure and equipment for staining a large number of plant samples for endomycorrhizal assay. Canadian Journal of Microbiology 26: 536-538.
Manjunath, A. & M. Habte. 1990. Establishment of soil solution P levels for studies involving vesicular-arbuscular micorrizal fungi. Communications in Soil Science and Plant Analysis 21: 557-566.
Mansfeld-Giese, K., J. Karsen & L. Bødker. 2002. Bacterial populations associated with mycelium of the arbuscular mycorrhizal fungus Glomus intrarradices. Fems Microbiology Ecology 41: 133-140.
Murphy, J. & J. P. Riley. 1962. A modified single solution method for the determination of phosphate in natural waters. Analytica Chimica Acta 27: 31-35.
Osorio, W., M. C. Díez, J. Sierra & L. Paternina. 2008. Consideraciones ecológicas sobre la asociación micorrizal en suelos de la region altoandina. En: J. D. León (ed.). Ecología de bosques andinos. Experiencias de investigación. La Carreta Editores. Medellín. Pp. 181-200.
Phillips, J. M. & D. S. Hayman. 1970. Improved procedures for clearing and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection. Transactions of the British Mycological Society 55: 158-161.
Plenchette, C., A. Fortin & V. Furlan. 1983. Growth responses of several plant species to mycorrhizae in a soil of moderate P fertility. I. mycorrhizal dependency under field conditions. Plant and Soil 70: 191-209.
Porter, W. 1979. The "most probable number" method for enumerating infective propagules of vesicular arbuscular micorrizal fungi in soil. Australian Journal of Soil Research 17: 515-519.
Rilling, M. 2004. Arbuscular mycorrhizae and terrestrial ecosystem processes. Ecology Letters 7: 740-754.
Sánchez, M. 1999. Endomicorrizas en agroecosistemas colombianos. Departamento de Ciencias Básicas, Universidad Nacional de Colombia, Sede Palmira. Palmira.
Sieverding, E. 1991. Vesicular-arbuscular mycorrhiza management in tropical agrosystems. Technical cooperation, Eschbor. República Federal de Alemania.
Smith, S. & D. Read. 1997. Mycorrhizal Symbiosis. Academic Press. Londres.
Uchida, R. & N. V. Hue. 2000. Plant nutrient management in Hawaii´s soils, approaches for tropical and subtropical agriculture. En: Silva, J. A. & R. Uchida (eds.). College of Tropical.
Licencia
Colombia Forestal conserva los derechos patrimoniales (copyright) de las obras publicadas, y favorece y permite la reutilización de las mismas bajo la licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional por lo cual se pueden copiar, usar, difundir, transmitir y exponer públicamente, siempre que:
Se reconozcan los créditos de la obra de la manera especificada por el autor o el licenciante (pero no de una manera que sugiera que tiene su apoyo o que apoyan el uso que hace de su obra).