DOI:
https://doi.org/10.14483/2256201X.19375Publicado:
01-01-2023Número:
Vol. 26 Núm. 1 (2023): Enero-junioSección:
Artículos de investigación científica y tecnológicaDiversidad y distribución espacial de epífitas vasculares en fragmentos de bosque seco tropical del Caribe colombiano
Diversity and Vertical Distribution of Vascular Epiphytes in Tropical Dry Forest Fragments of the Colombian Caribbean
Palabras clave:
Abundancia, estructura, forófitos, recambio, riqueza (es).Palabras clave:
Abundance, structure, phorophytes, turnover, richness (en).Descargas
Referencias
Acebey, A., & Krömer, T. (2001). Diversidad y distribucíon vertical de epífitas en los alrededores del campamento Rio Eslabón y de la laguna Chalalán, Parque Nacional Madidi, Dpto. la Paz, Bolivia. Revista de la Sociedad Boliviana de Botánica, 3, 104-123.
Álvarez-Arnesi, E., Barberis, I., & Vesprini, J. L. (2018). Distribución de epífitas vasculares sobre cuatro especies arbóreas en un bosque xerofítico del Chaco Húmedo, Argentina. Ecología Austral, 28, 480-495. https://doi.org/10.25260/EA.18.28.3.0.694 DOI: https://doi.org/10.25260/EA.18.28.3.0.694
Andrade, J. L., & Nobel, P. S. (1997). Microhabitats and water relations of epiphytic cacti and ferns in a lowland neotropical forest. Biotropica, 29 (3), 261-270. https://doi.org/10.1111/j.1744-7429.1997.tb00427.x DOI: https://doi.org/10.1111/j.1744-7429.1997.tb00427.x
Arévalo, R. & Betancur, J. (2006). Vertical distribution of vascular epiphytes in four forest types of the Serranía de Chiribiquete, Colombian Guayana. Selbyana, 27(2), 175-185. https://botanica.uniandes.edu.co/investigacion/pdfs/Arevalo-Chiribiquete%20Epiphytes.pdf
Banda, K., Delgado-Salinas, A., Dexter, K. G., Linares-Palomino, R., Oliveira-Filho, A., Prado, D. Pullan, M., Quintana, C., Riina, R., Rodríguez, G. M., Weintritt, J., Acevedo-Rodríguez, P., Adarve, J., Álvarez, E., Aranguren, A., Arteaga, J. C., Aymard, G., Castaño, A., Ceballos-Mago, N. … Pennington, R. T. (2016). Plant diversity patterns in neotropical dry forests and their conservation implications. Science, 353 (6306), 1383-1387. https://doi.org/10.1126/science.aaf5080 DOI: https://doi.org/10.1126/science.aaf5080
Barker, M. G., & Sutton, S. L. (1997). Low-tech methods for forest canopy access. Biotropica, 29 (2), 243-247. https://doi.org/10.1111/j.1744-7429.1997.tb00032.x DOI: https://doi.org/10.1111/j.1744-7429.1997.tb00032.x
Baselga, A. (2017). Partitioning abundance-based multiple-site dissimilarity into components: balanced variation in abundance and abundance gradients. Methods in Ecology and Evolution, 8(7), 799-808. https://doi.org/10.1111/2041-210X.12693 DOI: https://doi.org/10.1111/2041-210X.12693
Baselga, A., & Orme, C. D. L. (2012). betapart: An R package for the study of beta diversity. Methods in Ecology and Evolution, 3(5), 808-812. https://doi.org/10.1111/j.2041-210X.2012.00224.x DOI: https://doi.org/10.1111/j.2041-210X.2012.00224.x
Benzing, D. (1990). Vascular epiphytes. General biology and related biota Cambridge University Press. DOI: https://doi.org/10.1017/CBO9780511525438
Carbonó-Delahoz, E., Barros-Barraza, A., & Jiménez-Vergara, J. (2013). Cactaceae de Santa Marta, Magdalena, Colombia. Revista Academia Colombiana de Ciencias Exactas, 37(143), 177-187. DOI: https://doi.org/10.18257/raccefyn.2
Chao, A., Gotelli, N. J., Hsieh, T. C., Sander, E. L., Ma, K. H., Colwell, R. K., & Ellison, A. M. (2014a). Rarefaction and extrapolation with Hill numbers: a framework for sampling and estimation in species diversity studies. Ecological Monographs, 84(1), 45-57. https://doi.org/10.1890/13-0133.1
Chao, A., Gotelli, N. J., Hsieh, T. C., Sander, E. L., Ma, K. H., Colwell, R. K., & Ellison, A.M. (2014b). Rarefaction and extrapolation with Hill numbers: a framework for sampling and estimation in species diversity studies. Ecological Monographs, 84(1), 1557-7015. https://doi.org/10.1890/13-0133.1 DOI: https://doi.org/10.1890/13-0133.1
Colwell, R., Chao, A. Gotelli, N. Lin, S.-Y., Mao, C.-X., Chazdon, R. L., & Jhon T. L. (2012). Models and estimators linking individual-based and sample-based rarefaction, extrapolation and comparison of assemblages. Journal of Plant Ecology, 5(1), 3-21. https://doi.org/10.1093/jpe/rtr044 DOI: https://doi.org/10.1093/jpe/rtr044
Cornwell, W., & Ackerly, D. (2009). Community assembly and shifts in plant trait distributions across an environmental gradient in coastal California. Ecological Monographs, 79, 109-126. https://doi.org/10.1890/07-1134.1 DOI: https://doi.org/10.1890/07-1134.1
de la Rosa-Manzano, E. Guerra-Pérez, A. Mendieta-Leiva, G. Mora-Olivo, A. Martínez-Ávalos, J. G., & Arellano-Méndez, L. U. (2017). Vascular epiphyte diversity in two forest types of the “El Cielo” Biosphere Reserve, Mexico. Botany, 95(6), 599-610. https://doi.org/10.1139/cjb-2016-0184 DOI: https://doi.org/10.1139/cjb-2016-0184
Díaz-Pérez, C. Morales-Puentes, M. Gil-Leguizamón, P. Gil-Novoa, J., & Mercado-Gómez, J. (2019). Vegetación asociada al hábitat de anfibios y reptiles en el bosque seco tropical del Cesar y Magdalena. En F. Vargas-Salinas, J. Muñoz-Avila & M. Morales-Puentes (Eds.), Biología de Anfibios y Reptiles en el Bosque Seco Tropical del Norte de Colombia (pp. 6-55). Buhos Tunja. DOI: https://doi.org/10.19053/978-958-660-341-6.1
Dislich, R., & Mantovani, W. (2015). Vascular epiphyte assemblages in a Brazilian Atlantic Forest fragment: investigating the effect of host tree features. Plant Ecology, 217, 1-12. https://doi.org/10.1007/s11258-015-0553-x DOI: https://doi.org/10.1007/s11258-015-0553-x
Emerson, B. C., & Gillespie, R. G. (2008). Phylogenetic analysis of community assembly and structure over space and time. Trends in Ecology & Evolution, 23(11), 619-630. https://doi.org/10.1016/j.tree.2008.07.005 DOI: https://doi.org/10.1016/j.tree.2008.07.005
Flores-Palacios, A. García-Franco, J. G., & Capistrán-Barradas, A. (2015). Biomass, phorophyte specificity and distribution of Tillandsia recurvata in a tropical semi-desert environment (Chihuahuan Desert, Mexico). Plant Ecology and Evolution, 148(1), 68-75. https://doi.org/10.5091/plecevo.2015.874 DOI: https://doi.org/10.5091/plecevo.2015.874
Francisco, T. M., Couto, D. R., Garbin, M. L., Muylaert, R. L., & Ruiz-Miranda, C. R. (2019). Low modularity and specialization in a commensalistic epiphyte-phorophyte network in a tropical cloud forest. Biotropica, 51(4), 509-518. https://doi.org/10.1111/btp.12670 DOI: https://doi.org/10.1111/btp.12670
García, H., Corzo, G. Isaac, P., & Etter, A. (2014). Distribución y estado actual de los remanentes del bioma de bosque seco tropical en Colombia: insumos para su conservación. En C. Pizano & H. García (Eds.), El bosque seco tropical en Colombia (pp. 228-251). Instituto de Investigacion de Recursos Biológicos Alexander von Humboldt.
García-Martínez, S., Basilio, B., Herazo-Vitola, F., Mercado-Gómez, J., & Morales-Puentes, M. (2016). Diversidad de briófitos en los Montes de María, Colosó (Sucre, Colombia). Colombia Forestal, 19(1), 41-52. https://doi.org/10.14483/udistrital.jour.colomb.for.2016.1.a03 DOI: https://doi.org/10.14483/udistrital.jour.colomb.for.2016.1.a03
García-Martínez, S., & Mercado-Gómez, J. (2017). Diversidad de briófitos en fragmentos de bosque seco tropical, Montes de María, Sucre, Colombia. Revista Mexicana de Biodiversidad, 88, 824-831. https://doi.org/10.1016/j.rmb.2017.10.035 DOI: https://doi.org/10.1016/j.rmb.2017.10.035
García-Martínez, S., & Mercado-Gómez, J. (2020). Contribución a la micobiota liquénica del bosque seco tropical colombiano (Montes de María, Sucre). Ciencia en Desarrollo, 11(2), 43-52. https://doi.org/10.19053/01217488.v11.n2.2020.11000 DOI: https://doi.org/10.19053/01217488.v11.n2.2020.11000
García-Q., H., Carbonó de la Hoz, E., & Barranco-Pérez, W. (2021). Diversidad beta del bosque seco tropical en el norte del Caribe colombiano. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales, 45(174), 95-108. https://doi.org/10.18257/raccefyn.1267 DOI: https://doi.org/10.18257/raccefyn.1267
Gentry, A. (1993). A field guide to the families and genera of woody plants of northwest South America : (Colombia, Ecuador, Peru): With supplementary notes on herbaceus taxa. Conservations International.
Gentry, A. (1995). Diversity and floristic composition of neotropical dry forests. En S. H. Bullock, H. A. Mooney & E. Medina (Eds.), Seasonally Dry Tropical Forests (pp. 146-194). Cambridge University Press. DOI: https://doi.org/10.1017/CBO9780511753398.007
Gentry, A., & Dodson, C. (1987). Contribution of non trees to species richness of a tropical rainforest. Biotropica, 19(2), 149-156 https://doi.org/10.25260/EA.18.28.3.0.694 DOI: https://doi.org/10.2307/2388737
González, R., García, H., Isaacs, P., Cuadros, H., López-Camacho, R., Rodríguez, N., Pérez, K., Mijares, F., Castaño-Naranjo, A., Jurado, R., Idárraga-Piedrahíta, Á., Rojas, A., Vergara, H., & Pizano, C. (2018). Disentangling the environmental heterogeneity, floristic distinctiveness and current threats of tropical dry forests in Colombia. Environmental Research Letters, 13(4), 045007. https://doi.org/10.1088/1748-9326/aaad74 DOI: https://doi.org/10.1088/1748-9326/aaad74
Gradstein, S. R., Nadkarni, N. M., Kromer, T., Holz, I., & Noske, N. (2003). A protocol for rapid and representative sampling of vascular and non-vascular epiphyte diversity of tropical rain forests. Selbyana, 24 (1), 105-111. https://journals.flvc.org/selbyana/article/view/121584
Graham, E. A., & Andrade, J. L. (2004). Drought tolerance associated with vertical stratification of two co-occurring epiphytic bromeliads in a tropical dry forest. American Journal of Botany, 91(5), 699-706. https://doi.org/10.3732/ajb.91.5.699 DOI: https://doi.org/10.3732/ajb.91.5.699
Halffter, G., & Ros, M. (2013). A strategy for measuring biodiversity. Acta Zoologica Mexicana, 29, 400-411. https://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S0065-17372013000200011 DOI: https://doi.org/10.21829/azm.2013.2921117
Herazo-Vitola, F., Mendoza-Cifuentes, H., & Mercado-Gómez, J. (2017). Estructura y composición florística del bosque seco tropical en los Montes de María (Sucre – Colombia). Ciencia en Desarrollo, 8(1), 79-90. https://doi.org/10.19053/01217488.v8.n1.2017.5912 DOI: https://doi.org/10.19053/01217488.v8.n1.2017.5912
Holmgren, P., Holmgren, N., & Barnett, L. (1990). Index Herbariorum. Part I: The Herbaria of the World. (8va ed.). International Association for Plant Taxonomy, The New York Botanical Garden.
Hsieh, T., Ma, K., & Chao, A. (2016). iNEXT: An R package for rarefaction and extrapolation of species diversity (Hill numbers). Methods in Ecology and Evolution, 7(12), 1451-1456. https://doi.org/10.1111/2041-210X.12613 DOI: https://doi.org/10.1111/2041-210X.12613
Iriarte-Cárdenas, S., García-Martínez, S., & Mercado-Gómez, J. D. (2022). Beta diversity analyses reveal distinct bryophyte community assemblages on different substrates in Neotropical seasonally dry forest fragments of the Colombian Caribbean. Journal of Bryology, 43(4), 355-367. https://doi.org/10.1080/03736687.2021.2009268 DOI: https://doi.org/10.1080/03736687.2021.2009268
Jiménez-López, D. A., Roblero-Velasco, R. d. .J., Martínez-Meléndez, N., Ocampo, G., & Gallardo-Cruz, J. A. (2017). Relación entre variables del forófito y la riqueza de epífitas vasculares en los Pantanos de Centla, Tabasco, México. Acta botánica mexicana, 125-137. https://doi.org/10.21829/abm121.2017.1179 DOI: https://doi.org/10.21829/abm121.2017.1179
Johansson, D. (1974). Ecology of vascular epiphytes in west African rain forest. Acta Phytogeograpica Suecica, 59, 1-136. https://www.diva-portal.org/smash/get/diva2:565496/FULLTEXT01.pdf.;
Jost, L. (2006). Entropy and diversity. Oikos, 113, 363-374. https://doi.org/10.1111/j.2006.0030-1299.14714.x DOI: https://doi.org/10.1111/j.2006.0030-1299.14714.x
Koch, M. A., Kleinpeter, D., Auer, E., Siegmund, A., del Rio, C., Osses, P., García, J.-L., Marzol, M. V., Zizka, G., & Kiefer, C. (2019). Living at the dry limits: ecological genetics of Tillandsia landbeckii lomas in the Chilean Atacama Desert. Plant Systematics and Evolution, 305(10), 1041-1053. https://doi.org/10.1007/s00606-019-01623-0 DOI: https://doi.org/10.1007/s00606-019-01623-0
Kress, W. J. (1986). The systematic distribution of vascular epiphytes: an update. Selbyana, 9(1), 2-22. https://doi.org/10.1111/boj.12010
Krömer, T., Kessler, M., & Gradstein, S.R. (2007). Vertical stratification of vascular epiphytes in submontane and montane forest of the Bolivian Andes: The importance of the understory. Plant Ecology, 189(2), 261-278. https://doi.org/10.1007/s11258-006-9182-8 DOI: https://doi.org/10.1007/s11258-006-9182-8
Lebrija-Trejos, E., Pérez-García, E. A., Meave, J. A., Bongers, F., & Poorter, L. (2010). Functional traits and environmental filtering drive community assembly in a species-rich tropical system. Ecology, 91(2), 386-398. https://doi.org/10.2307/25661065 DOI: https://doi.org/10.1890/08-1449.1
Leopardi, C., Reina-Rodríguez, G., Carnevali, G., & Romero-González, G. (2014). Two new greenish em Encyclia: em E. parkeri and em E. silverarum (Laeliinae, Orchidaceae). Phytotaxa, 183, 159-170. https://doi.org/10.11646/phytotaxa.183.3.3 DOI: https://doi.org/10.11646/phytotaxa.183.3.3
Linares-Palomino, R., Cardona, V., Hennig, E., Hensen, I., Hoffmann, D., Lendzion, J., Soto, D., Herzog, S., & Kessler, M. (2009). Non-woody life-form contribution to vascular plant species richness in a tropical American forest. Plant Ecology, 201(1), 87-99. https://doi.org/10.1007/s11258-008-9505-z DOI: https://doi.org/10.1007/s11258-008-9505-z
López-Martínez, J. O., Hernández-Stefanoni, J. L., Dupuy, J. M., & Meave, J. A. (2013). Partitioning the variation of woody plant β-diversity in a landscape of secondary tropical dry forests across spatial scales. Journal of Vegetation Science, 24(1), 33-45. https://doi.org/10.1111/j.1654-1103.2012.01446.x DOI: https://doi.org/10.1111/j.1654-1103.2012.01446.x
Magurran, A. (1989). Diversidad ecológica y su medición. Ediciones Vedra.
Marcon, E., & Hérault, B. (2015). entropart: An R Package to measure and partition diversity. Journal of Statistical Software, 67(8), 1-26. https://doi.org/10.18637/jss.v067.i08 DOI: https://doi.org/10.18637/jss.v067.i08
Marcon, E., Hérault, B., Baraloto, C., & Lang, G. (2012). The decomposition of Shannon's entropy and a confidence interval for beta diversity. Oikos, 121(4), 516-522. https://doi.org/10.1111/j.1600-0706.2011.19267.x DOI: https://doi.org/10.1111/j.1600-0706.2011.19267.x
Martínez-Meléndez, N., Pérez-Farrera, M. A., & Flores-Palacios, A. (2008). Estratificación vertical y preferencia de hospedero de las epífitas vasculares de un bosque nublado de Chiapas, México. Revista de Biología Tropical, 56, 2069-2086. https://www.scielo.sa.cr/scielo.php?script=sci_arttext&pid=S0034-77442008000400037 DOI: https://doi.org/10.15517/rbt.v56i4.5780
Mercado-Gómez, J., Giraldo-Sánchez, C., & Escalante, T. (2021). Geographic distance and environmental variation drive community structure of woody plants in Neotropical seasonally dry forest fragments in the Colombian Caribbean. Plant Ecology & Diversity, 14(3-4), 169-182. https://doi.org/10.1080/17550874.2021.2002455 DOI: https://doi.org/10.1080/17550874.2021.2002455
Mercado-Gómez, J., Herazo-Vitola, F. Y., & Morales-Puentes, M. E. (2019). Phytogeography and floristic affinities of woody plants in “Los Montes de María”, a tropical dry forest fragment in the Colombian Caribbean. The Botanical Review, 85, 273-291. https://doi.org/10.1007/s12229-019-09212-z DOI: https://doi.org/10.1007/s12229-019-09212-z
Mercado-Gómez, Y., Mercado-Gómez, J., & Giraldo-Sánchez, C. (2018). Mariposas en un fragmento de bosque seco tropical en Montes de María (Colombia). Ciencia en Desarrollo, 9(2), 35-45. https://doi.org/10.19053/01217488.v9.n2.2018.7595 DOI: https://doi.org/10.19053/01217488.v9.n2.2018.7595
Motzkin, G., Wilson, P. ,Foster, D. R., & Allen, A. (1999). Vegetation patterns in heterogeneous landscapes: The importance of history and environment. Journal of Vegetation Science, 10(6), 903-920. https://doi.org/10.2307/3237315 DOI: https://doi.org/10.2307/3237315
Núñez-Avellaneda, L., Castro, M., Mestre, G., & Lozano, L. (2019). Los bosques de galería conectores de vida. Ámbito Investigativo, 4(4), 15-19. https://ciencia.lasalle.edu.co/cgi/viewcontent.cgi?article=1030&context=ai#:~:text=Los%20bosques%20de%20galer%C3%ADa%20se,matas%20de%20monte%20y%20agroecosistemas.
Oksanen, J., Blanchet, F. G., Friendly, M., Kindt, R., Legendre, P., McGlinn, D., Minchin, P. R., O'Hara, R. B., Simpson, G. L., Solymos, P., Stevens, M. H. H., Szoecs, E., & Wagner, H. (2018). vegan: Community ecology package. R package version 2.5-2. https://cran.r-project.org/package=vegan
Olascuaga, D., Sánchez-Montaño, R., & Mercado-Gómez, J. (2016). Análisis de la vegetación sucesional en un fragmento de bosque seco tropical en Toluviejo-Sucre (Colombia). Colombia forestal 19(1), 23-40. https://doi.org/10.14483/udistrital.jour.colomb.for.2016.1.a02 DOI: https://doi.org/10.14483/udistrital.jour.colomb.for.2016.1.a02
Pizano, C., & García, H. (2014). El bosque seco tropical en Colombia. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt.
Qian, H., Ricklefs, R. E., & White, P. S. (2005). Beta diversity of angiosperms in temperate floras of eastern Asia and eastern North America. Ecology Letters, 8(1), 15-22. https://doi.org/10.1111/j.1461-0248.2004.00682.x DOI: https://doi.org/10.1111/j.1461-0248.2004.00682.x
Raux, P. S., Gravelle, S., & Dumais, J. (2020). Design of a unidirectional water valve in Tillandsia. Nature Communications, 11(1), 396. https://doi.org/10.1038/s41467-019-14236-5 DOI: https://doi.org/10.1038/s41467-019-14236-5
Reina-Rodríguez, G. A., Rubiano-Mejía, J. E., Castro-Llanos, F. A., & Soriano, I. (2017). Orchid distribution and bioclimatic niches as a strategy to climate change in areas of tropical dry forest in Colombia. Lankesteriana, 17, 17-47. https://doi.org/10.15517/LANK.V17I1.27999 DOI: https://doi.org/10.15517/lank.v17i1.27999
Reina-Rodríguez, G. O., & Otero, J. T. (2011). Guía ilustrada de las orquídeas del valle geográfico del Río Cauca y Piedemonte Andino Bajo. Sociedad Vallecauacana de Orquideología, Universidad Nacional de Colombia, Sede Palmira.
Rivera-Díaz, O., & Rangel, J. O. (2012). Diversidad de espermatofitos de la región Caribe. En J. O. Rangel-Ch. (Eds.). Colombia Diversidad Biótica: XII La región Caribe de Colombia (pp. 199-317). Instituto de Ciencias Naturales.
Rosa-Manzano, E. d. l., Andrade, J. L., Zotz, G., & Reyes-García, C. (2014). Respuestas fisiológicas a la sequía, de cinco especies de orquídeas epífitas, en dos selvas secas de la península de Yucatán. Botanical Sciences, 92, 607-616. https://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S2007-42982014000400012&lng=es&nrm=iso&tlng=es DOI: https://doi.org/10.17129/botsci.139
Ruiz, A., Cavelier, J., Santos, M., & Soriano, P. (2002). Cacti in the dry Formations of Colombia. En T. Fleming & A. Valiente-Banuet (Eds.), Columnar Cacti and Their Mutualists. Evolution, Ecology and Conservation (pp. 324-341). The University of Arizona Press. DOI: https://doi.org/10.2307/j.ctv23khmrw.21
Sánchez-Azofeifa, A., Kalácska, M., Espírito-Santo, M. M. d., Fernandes, G. W., & Schnitzer, S. (2009). Tropical dry forest succession and the contribution of lianas to wood area index (WAI). Forest Ecology and Management, 258(6), 941-948. https://doi.org/10.1016/j.foreco.2008.10.007 DOI: https://doi.org/10.1016/j.foreco.2008.10.007
Taylor, A., Zotz, G., Weigelt, P., Cai, L., Karger, D. N., König, C., & Kreft, H. (2022). Vascular epiphytes contribute disproportionately to global centres of plant diversity. Global Ecology and Biogeography, 31(1), 62-74. https://doi.org/10.1111/geb.13411 DOI: https://doi.org/10.1111/geb.13411
Ter Steege, H., Sabatier, D., Castellanos, H., Andel, T. V., Duivenvoorden, J., Oliveira, A. A. d., Ek, R., Lilwah, R., Maas, P., & Mori, S. (2000). An analysis of the floristic composition and diversity of Amazonia forests including those of the Guiana Shield. Journal of Tropical Ecology, 16, 801-828. http://hdl.handle.net/11449/31255 DOI: https://doi.org/10.1017/S0266467400001735
Thiers, B. (2018). Index Herbariorum: A global directory of public herbaria and associated staff. New York Botanical Garden’s virtual herbarium. http://sweetgum.nybg.org/science/ih/
Toledo-Aceves, T., García-Franco, J., & Flores-Palacios, A. (2017). Do cloud forest tree species differ in their suitability as a substrate for epiphytic bromeliads? Plant Ecology, 218(5), 541-546. https://doi.org/10.1007/s11258-017-0709-y DOI: https://doi.org/10.1007/s11258-017-0709-y
Vargas, W. (2012). Los bosques secos del Valle del Cauca, Colombia: una aproximación a su flora actual. Biota Colombiana, 13(2), 102-164. http://revistas.humboldt.org.co/index.php/biota/article/view/265
Wagner, K., Bogusch, W., & Zotz, G. (2013). The role of the regeneration niche for the vertical stratification of vascular epiphytes. Journal of Tropical Ecology, 29(4), 277-290. https://doi.org/10.1017/S0266467413000291 DOI: https://doi.org/10.1017/S0266467413000291
Wang, Q., Guan, W.-B., Gi Wong, M. H., Ranjitkar, S., Sun, W.-N., Pan, Y., El-Kassaby, Y. A., & Shen, L.-X. (2017). Tree size predicts vascular epiphytic richness of traditional cultivated tea plantations in Southwestern China. Global Ecology and Conservation, 10, 147-153. https://doi.org/10.1016/j.gecco.2017.03.002 DOI: https://doi.org/10.1016/j.gecco.2017.03.002
Zotz, G. (2013). The systematic distribution of vascular epiphytes – A critical update. Botanical Journal of the Linnean Society, 171(3), 453-481. https://doi.org/10.1111/boj.12010 DOI: https://doi.org/10.1111/boj.12010
Zotz, G., Schmidt, G., & Mikona, C. (2011). What is the proximate cause for size-dependent ecophysiological differences in vascular epiphytes? Plant Biology, 13(6), 902-908. https://doi.org/10.1111/j.1438-8677.2011.00460.x DOI: https://doi.org/10.1111/j.1438-8677.2011.00460.x
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Recibido: 9 de mayo de 2022; Aceptado: 5 de octubre de 2022
Resumen
Este estudio analizó la estructura de comunidades de epífitas vasculares en dos localidades de los Montes de María (Chalán y Morroa). Se calcularon las curvas de rango-abundancia, rarefacción e interpolación-extrapolación y la diversidad alfa de las dos localidades. Además, la diversidad alfa y beta fueron estimadas en cinco estratos verticales de los forófitos. La diversidad beta se calculó con el número efectivo de comunidades y el índice de disimilitud de Bray-Curtis. Se identificó un total de 3 familias, 10 géneros y 13 especies. Orchidaceae fue la familia más rica, y Encyclia sp. y Tillandsia fueron los géneros más abundantes. Chalán es la localidad más diversa, y Anacardium excelsum es el forófito más habitado. Se hallaron por lo menos dos ensamblajes de especies relacionados con el dosel medio y alto, los cuales son el resultado del recambio de especies. Estos resultados contribuyen al conocimiento de las epífitas en el bosque seco tropical colombiano.
Palabras clave:
abundancia, estructura, forófitos, recambio, riqueza..Abstract
This study analyzed the community structure of vascular epiphytes in two localities of Montes de María (Chalán and Morroa). Rank-abundance, rarefaction, and interpolation-extrapolation curves were calculated, as well as the alpha diversity of the two localities. Alpha and beta diversity were estimated in five vertical phorophyte strata. The beta diversity was calculated using the effective number of communities and the Bray-Curtis dissimilarity index. A total of three families, 10 genera, and 13 species was identified. Orchidaceae was the family with the most species, and Encyclia sp. and Tillandsia were the most abundant genera. Chalán is the most diverse locality, and Anacardium excelsum is the most inhabited phorophyte. At least two species assemblages related to the middle and upper canopy were found, which are the result of species turnover. These results contribute to the knowledge of epiphytes in the Colombian tropical dry forest.
Keywords:
abundance, structure, phorophytes, turnover, richness..INTRODUCCIÓN
El bosque seco tropical (BS-T), producto de su larga historia de impacto antrópico (foco de desarrollo y objeto agrícola y ganadera), es catalogado como uno de los ecosistemas más amenazados en el Neotrópico (Banda et al., 2016). Aunque estos bosques han sido históricamente menos atendidos científicamente que otros ecosistemas, en años recientes se ha incrementado el número de publicaciones, principalmente en plantas leñosas (Banda et al., 2016). En Colombia, por ejemplo, el conocimiento de la vegetación presente en los BS-T ha mejorado en aspectos de composición, estructura, distribución, biogeografía y ecología (Herazo-Vitola et al., 2017; Mercado-Gómez et al., 2018; Díaz-Pérez et al., 2019; Núñez-Avellaneda et al., 2019; García-Martínez & Mercado-Gómez, 2020; García et al., 2021). De hecho, la comunidad científica se ha interesado principalmente en realizar estudios relacionados con problemas de conservación en estos ecosistemas (González et al., 2018), ya que su cobertura ha disminuido drásticamente en los últimos años -en la actualidad se cuenta con el 3 % de la cobertura boscosa original, dentro de la cual el Caribe presenta alrededor del 55 % y el departamento de Sucre posee 1.2 % de polígonos naturales y 2.5 % de polígonos fragmentados (García et al., 2014).
Montes de María, localizado en el departamento de Sucre, es considerado uno de los fragmentos de BS-T en mejor estado de conservación biológica del Caribe (Pizano & García, 2014); es posible encontrar parches de vegetación continuos y poco perturbados que aún reflejan el estado prístino de los bosques secos. Esta área es significativa para analizar cómo se conformaron la estructura de las comunidades de plantas, su posible origen y relación diversidad-geografía (Mercado-Gómez et al., 2019, 2021; Iriarte-Cárdenas et al., 2022). En este sentido, aunque en esta zona se han realizado diferentes estudios que analizan la estructura de las comunidades (diversidad alfa y beta), estos se han enfocado principalmente en plantas leñosas (Olascuaga et al., 2016; Herazo-Vitola et al., 2017; Mercado-Gómez et al., 2021) y algunos en epifitas no vasculares (García-Martínez et al., 2016; García-Martínez & Mercado-Gómez, 2017, 2020). En este contexto, en estos fragmentos de bosque seco se desconoce la riqueza de epífitas vasculares y, por lo tanto, su aporte a la diversidad del BS-T.
En términos de diversidad, se estima que las epífitas pueden sumar un 10 % de la flora vascular del mundo, calculándose aproximadamente 29 000 especies, representadas entre 65 y 84 familias que incluyen entre 850 y 896 géneros (Kress, 1986; Taylor et al., 2022). Para Gentry y Dodson (1987) las epífitas vasculares pueden aportar el 35 % del total de especies en un bosque tropical. Para algunos autores, las formas de vida no leñosas como las epifitas han mostrado ser un grupo taxonómico relevante para la diversidad de los BS-T (Linares-Palomino et al., 2009; Sánchez-Azofeifa et al., 2009). No obstante, en los Montes de María se desconoce la composición, diversidad y estructura de estos grupos. Las epífitas son sitios de alimentación, refugio y reproducción para una gran variedad de organismos como insectos, aves y anfibios (Benzing, 1990; Zotz, 2013), las cuales pueden ser utilizadas como bioindicadores de cambio climático, polución y daño ecológico (Reina-Rodríguez et al., 2017). Conocer la riqueza de las epífitas vasculares presentes en los BS-T permite no solo incrementar el conocimiento sobre la diversidad de especies, sino también mejora los estimativos generales de su ecología e importancia en estos ecosistemas altamente degradados.
Otro de los aspectos poco explorados de las epífitas vasculares en los BS-T es su conformación o estructura espacial en los forófitos. Es claro que en ecosistemas húmedos hay ensamblajes de especies, de acuerdo con la posición y altura con respecto al forófito (Arévalo & Betancur, 2006; Krömer et al., 2007). De hecho, algunos estudios han demostrado que la composición de las epífitas a menudo varía verticalmente a lo largo del tronco y dosel del forófito (Francisco et al., 2019). En este sentido, la distribución vertical de las epífitas puede variar a lo largo del tronco en un forófito, y se pueden configurar diferentes ensamblajes de especies. Sin embargo, se desconoce cuáles especies ocurren en los BS-T de los Montes de María, los forófitos ocupados por este grupo y si estas presentan algún tipo de configuración espacial. Por lo tanto, se desconoce también si existen ensamblajes de especies asociados a las zonas o los estratos de vida en un forófito. Según lo anterior, el objetivo de este estudio es realizar una aproximación sobre la estructura ecológica de las epífitas vasculares en dos fragmentos bosque seco tropical en los Montes de María. Se realizaron estimaciones de la diversidad alfa y beta entre dos localidades y se analizó la estructura ecológica a través del gradiente vertical con el fin de establecer la presencia de posibles ensamblajes de especies asociados a la distribución vertical en los forófitos.
MATERIALES Y MÉTODOS
Área de estudio
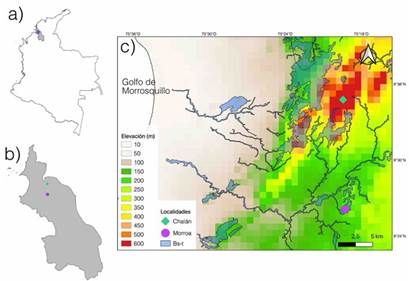
Este estudio se llevó a cabo en los Montes de María, localizados al nororiente del departamento de Sucre, sobre la llanura del Caribe colombiano (Figura 1a-c). Los Montes de María presentan temperaturas entre los 25-28 °C y precipitaciones de 896-1233 mm por año, con un periodo estacional seco (noviembre-febrero) donde la precipitación disminuye a menos de 200 mm; mientras que la humedad relativa promedio anual es de 83.5 % (Herazo-Vitola et al., 2017; Mercado-Gómez et al., 2021). La vegetación corresponde es la de un bosque seco tropical, dentro del cual Fabaceae, Malvaceae, Meliaceae, Sapindaceae, Capparaceae, Rubiaceae y Cactaceae son las familias de plantas más importantes en términos de riqueza y abundancia de especies. Ampelocera edentula Kuhlm, Aspidosperma polyneuron Müll. Arg, Brosimum alicastrum Swartz, Myrcia fallax (Rich.) DC. y Simira cordifolia (Hook.F) Steyerm fueron reportadas como las más abundantes (Herazo-Vitola et al., 2017; Mercado-Gómez et al., 2021). No obstante, como gran parte del bosque seco tropical colombiano, estos fragmentos se encuentran en un mosaico de vegetación conformado por bosques, cultivos y zonas de pastoreo-ganadería (Olascuaga et al., 2016).
Figura 1: Localización geográfica de las áreas de muestreo (a) Colombia, (b) departamento de Sucre y (c) dentro de los fragmentos de bosque seco tropical (BS-T) en los Montes de María y sus variaciones altitudinales
Levantamiento de flora y diseño del muestreo
Los Montes de María están conformados por varias comunidades de plantas leñosas, con una clara relación entre la flora y el clima; hay una comunidad asociada a un ambiente más húmedo y otra a uno más seco (Mercado-Gómez et al., 2021). Con el fin de abordar la mayor representatividad de epífitas posible, se seleccionaron dos localidades: una en áreas húmedas (Chalán) y otra en zonas más secos (Morroa). En cada zona de estudio se estableció una parcela de 500 m2 lineales, dentro de la cual se demarcaron 5 subparcelas de 10 x 10 m, de acuerdo con las recomendaciones de Gradstein et al. (2003). Los siguientes elementos fueron tomados en cuenta para la selección de los forófitos: (i) una distancia mínima de 25 m entre cada individuo, (ii) un diámetro a la altura de pecho (DPA) > 5 cm y (iii) una altura > 20 m y un notable crecimiento de flora epífita (Dislich & Mantovani, 2015). Para la recolecta de las epífitas en los forófitos, se utilizaron técnicas de ascenso de una sola cuerda, desjarretadera y recolectas manuales con podadoras (Barker & Sutton, 1997). Luego, en cada forófito se contabilizaron todos los individuos desde la base del tronco hasta la parte exterior de la copa en los cinco estratos propuestos de acuerdo con Johansson (1974). De cada epífita se recolectaron tres ejemplares y se tomaron datos que se pudieran perder con el secado (colores y olores, entre otros). Posteriormente, y con el fin de obtener especímenes con flores y frutos, se hicieron revisiones periódicas durante los seis meses tiempo de trabajo en campo del proyecto.
Composición florística
Una vez finalizada la recolecta del material, este fue sometido al proceso estándar de herborización en el herbario de la Universidad de Sucre (HEUS). Con el material debidamente secado, se llevó a cabo la identificación, empleando claves especializadas a nivel de familias (Gentry, 1993). El material recolectado fue determinado con la ayuda de bibliografía especializada (Gentry, 1993, 1999; Carbonó-Delahoz et al., 2013) y por comparación con ejemplares del herbario HEUS y de las colecciones en línea del herbario COL (http://www.biovirtual.unal.edu.co/es/colecciones/search/plants/). En segundo lugar, se emplearon claves especializadas para Orchidaceae y Bromeliaceae. Todas las muestras fueron depositadas en el herbario HEUS según la enumeración de Álvarez PJ. Todos los acrónimos de herbario siguen a Holmgren et al. (1990) y las actualizaciones de Thiers (2018).
Análisis de estructura ecológica de comunidades
Para establecer qué tan dominadas se encontraban las comunidades en las localidades (en términos de especies), se construyeron curvas de rango-abundancia con transformación log(10), las cuales permiten comparar la composición, abundancia y uniformidad de las especies en cada localidad (Magurran, 1989). Con el fin de establecer si los muestreos eran representativos, se calculó el número esperado de especies en cada localidad a través de las curvas de rarefacción y extrapolación-interpolación. Este método usa la muestra y una curva de completitud elaborada con el doble del tamaño de la muestra de referencia más pequeña a comparar, con un intervalo de confianza de 95 % obtenido mediante un remuestreo de 100 pseudoréplicas por bootstrap (Chao et al., 2014a). Dichos análisis fueron implementados en el entorno RStudio con el paquete iNEXT (Hsieh et al., 2016), siguiendo los parámetros establecidos por Chao et al. (2014a) y Colwell et al. (2012).
Con el fin de estimar la diversidad alfa, los índices de diversidad verdadera (números de “Hill”) expresados en el número efectivo de especies (0D, 1D, 2D) (Jost, 2006) fueron calculados a través del paquete Entropart (Marcon & Hérault, 2015) en el entorno RStudio. Jost (2006) propone analizar la diversidad en varios niveles, que incluyen la diversidad del orden cero (0D) o riqueza de especies; la diversidad del orden uno (1D) o exponencial del índice de Shannon, que pondera la diversidad por la abundancia relativa de las especies; y la diversidad del orden dos (2D), o inverso del índice de Simpson (Chao et al., 2014b), que considera las especies más abundantes. Los números efectivos de especies también fueron calculados para cada uno de los estratos en las dos localidades.
Para determinar si existen ensamblajes de especies asociados a los estratos verticales de los forófitos, se calcularon el número efectivo de comunidades (βT) a través de la partición multiplicativa gamma Dβ = Dϒ/Dα (Jost, 2006). En este sentido, se descompuso la diversidad mediante simulaciones de Monte Carlo, asumiendo la distribución vertical de las especies en los estratos, y se calculó el intervalo de confianza remuestrándolas (Marcon et al., 2012) en el paquete R Entropart (Marcon & Hérault, 2015). βT tiene un valor mínimo de 1 cuando no existen diferencias entre las unidades de muestreo y un valor máximo equivalente al número de unidades de muestreo, asumiendo que estas no comparten ninguna especie. Por lo tanto, cada una de ellas es una comunidad o ensamblaje de especies (Halffter & Ros, 2013). En este estudio, se asume que cada estrato es un ensamblaje o comunidad, i.e., un total de cinco comunidades virtuales (Halffter & Ros, 2013) que corresponden a cada uno de los estratos (Figura 2).
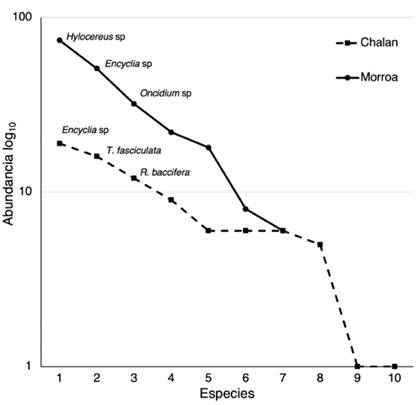
Figura 2: Curva de rango-abundancia de las comunidades de epífitas vasculares en Chalán y Morroa
Con el fin de visualizar la disimilitud total entre cada ensamblaje de especies, se utilizaron las matrices pareadas de cada localidad, medidas como la disimilitud del índice de Bray-Curtis (βBC), con el cual se realizó un análisis cluster en el paquete R Vegan (Oksanen et al., 2018). Para establecer si la disimilitud entre las comunidades en el área de estudio está determinada por el recambio o el anidamiento, se empleó la función “beta.multi.abund” en el paquete R Betapart (Baselga & Orme, 2012). Esta función separa el índice de disimilitud de Bray-Curtis (βBC) en sus componentes de variación equilibrada (βBC.BAL), i.e., recambio y el componente de gradiente de abundancia (βBC.GRA) o anidamiento (Baselga, 2017).
RESULTADOS
Composición florística
Se registraron 1234 individuos de epífitas en las dos zonas estudiadas, los cuales pertenecen a 3 familias, 10 géneros y 13 especies (Tabla 1). La familia Orchidaceae fue la mejor representada, con 7 especies. Bromeliaceae estuvo compuesta por 4 especies, todas del género Tillandsia. La familia Cactaceae solo presentó dos especies (Hylocereus sp. y Rhipsalis baccifera (Sol.) Stearn), de las cuales Hylocereus sp. se encuentra distribuida en las dos áreas, mientras que R. baccifera solo presentó registro en Chalán. En Chalán se hallaron especies en todos los estratos. Sin embargo, en Morroa no se encontraron especies en el estrato 1. Con respecto a los forófitos, un total de 26 individuos pertenecientes a 5 familias, 9 géneros y 9 especies fueron hallados en las áreas de estudio. Fabaceae fue la familia más rica, con 4 especies, seguida por Anacardiaceae (2 especies). Anacardium excelsum (Bertero & Balb. Ex Kunth) Skeels fue el forófito con el mayor número de individuos con especies de epífitas (Tabla 2).
Tabla 1: Lista de epífitas vasculares encontradas en las áreas evaluadas: Chalán (CH) y Morroa (MR)

Tabla 2: Listado de los forófitos en las dos áreas evaluadas: Chalán (CH) y Morroa (MR)

Análisis de estructura ecológica de comunidades
El análisis de rango-abundancia (Figura 2) muestra dos comportamientos en la estructura de las comunidades las epífitas vasculares en cada localidad. En el primer caso, Chalán presenta una pendiente menos inclinada, lo cual sugiere que sus comunidades están representadas por especies igualmente comunes y pocas especies dominantes. No obstante, el caso es diferente para Morroa, donde se observa una pendiente elevada -es decir, una baja equitatividad- y, por lo tanto, muchas especies dominantes y poca riqueza. En Chalán son dominantes Encyclia sp, Tillandsia fasciculada y R. baccifera, mientras que en Morroa lo son Hylocereus sp, Encyclia sp y Oncidium (Figura 2).
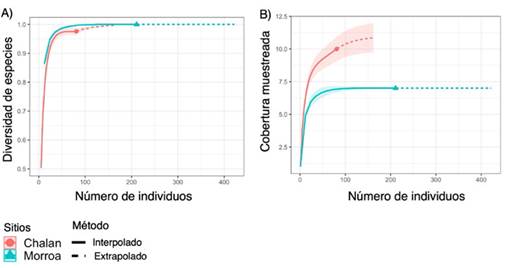
La completitud de especies del área de estudio fue de 98.5 %, lo cual significa que el muestreo fue representativo, alcanzando el 97.5 % para Chalán y el 100 % para Morroa (Figura 3a). Para cada tipo de cobertura se observa que, al aumentar el tamaño de la muestra de referencia en términos de individuos (81-Chalán y 211-Morroa) al doble (162-Chalán y 422-Morroa), las estimaciones de la completitud del muestreo difieren poco. Esto significa que, aunque se recolecten más individuos en el área de estudio, el muestreo seguirá siendo representativo para las dos áreas de estudio (Figura 3a). Al comparar la riqueza de especies en relación con el número de individuos entre los sitios de muestreo, se pudo establecer, con un intervalo de confianza del 95 %, que la riqueza de epífitas esperada seguiría siendo superior en Morroa que en Chalán aun cuando todas las especies existentes fuesen registradas (Figura 3b).
Figura 3: Curvas de rarefacción e interpolación-extrapolación basadas en (A) la riqueza de especies y (B) la cobertura muestreada de epífitas vasculares en Chalán y Morroa
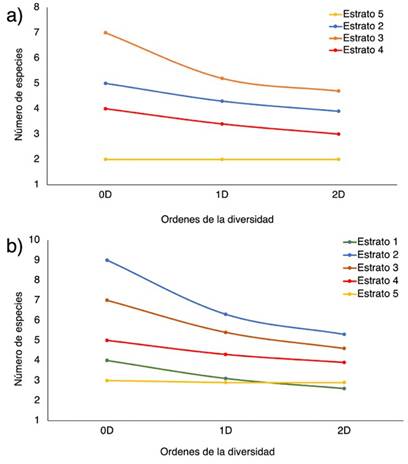
De acuerdo con el análisis de la diversidad alfa según el número efectivo de especies, Chalán presentó la mayor riqueza, con 10 especies (0D); mientras que Morroa presentó 7 especies. Asimismo, Chalán tiene 7 especies efectivas y Morroa 5.3 (1D); el primero tiene dos especies efectivas más que el segundo. Con respecto al número de especies efectivas dominantes, Chalán tiene 7 y Morroa 4 (2D). En otras palabras, Chalán es más rico, diverso y dominante que Morroa. Con respecto a los estratos, en Chalán, el estrato 2 presenta mayor riqueza (0D), número de especies efectivas (1D) y número de especies dominantes efectivas (2D), seguido por los estratos 3 y 4 (Figura 4a). Los estratos 1 y 5 son los menos ricos, con menor número de especies efectivas y especies dominantes efectivas (Figura 4a). En Morroa, el patrón es similar, pero el estrato 3 es el más rico (0D), con mayor número de especies efectivas (1D) y especies dominantes efectivas (2D), seguido por los estratos 2 y 4, mientras que el estrato 5 es el menos diverso (Figura 4b).
Figura 4: Perfiles de diversidad alfa en función de los órdenes de los números efectivos (0D, 1D y 2D) de los estratos verticales de las especies de epífitas vasculares en (a) Chalán y (b) Morroa
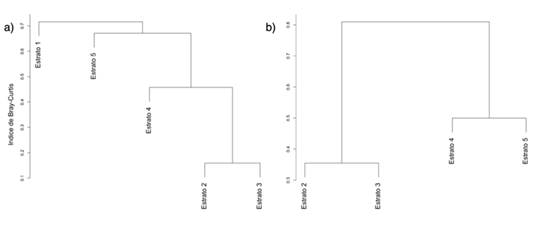
Para el análisis de la diversidad beta en términos del número efectivo de comunidades, los resultados son: Chalán βT = 1.54 y Morroa βT = 1.8. Estos resultados, según los índices propuestos por Baselga (2017), muestran los siguientes valores para Chalán: βBC = 0.65, βBC.BAL = 0.18 y βBC.GRA = 0.46. Entretanto, Morroa muestra βBC = 0.67, βBC.BAL = 0.30 y βBC.GRA = 0.36. En términos generales, las agrupaciones observadas a través del análisis cluster incluyen lo siguiente. En Chalán, el primer grupo (CZ1) está conformado por los estratos 2, 3 y 4, pero los estratos 2 y 3 tienen menor disimilitud en comparación con el estrato 4. El segundo grupo (CZ2) está conformado por las especies del estrato 5 (CZ3), las cuales conforman un ensamble diferente a CZ1. Asimismo, las especies del estrato 1 (CZ4) son un ensamble diferente a CZ1 y CZ2. En Morroa solo se observan dos ensamblajes, dentro de los cuales los estratos 2 y 3 conforman el primer grupo (MZ1), mientras que el segundo contiene los estratos 4 y 5 (MZ2).
DISCUSIÓN
La familia Orchidaceae fue la mejor representada en términos de diversidad en el área de estudio, con un total de 7 especies, de las cuales 6 han sido reportadas para otros fragmentos de bosque seco en Colombia (Vargas, 2012). Esta familia presenta gran diversidad de especies (alrededor de 30 000) y una gama de formas, tamaños y colores, lo cual la lleva a ser uno de los grupos taxonómicos más ricos de epifitas en el bosque seco (Reina-Rodríguez et al., 2017). Encyclia presentó la mayor abundancia de especies, lo cual puede ser explicado por el hecho de que algunas de sus especies presentan adaptaciones a la sequía, como la disminución de la fotosíntesis y la humedad. Además, tienen una reducción foliar y estomas pequeños, lo que les confiere gran plasticidad morfológica y fisiológica para tolerar la alta radiación y las sequías (Rosa-Manzano et al., 2014). La familia Bromeliaceae está representada por 4 especies, todas del género Tillandsia, las cuales también han sido reportadas por Vargas (2012) para otros fragmentos de bosque seco en Colombia. La especie más abundante de Tillandsia es T. fasciculata Sw., con 263 individuos, y se presenta solo en el área de Chalán (Tabla 1). Tillandsia es un género que cuenta con diferentes adaptaciones como tricomas peltados que pueden reducir la intensidad de los rayos del sol, pero también con estrategias reproductivas sexuales y asexuales que le permiten crecer en áreas con recursos limitados como los bosques secos, lo cual explica su gran abundancia (Flores-Palacios et al., 2015; Koch et al., 2019; Raux et al., 2020).
Figura 5: Ensambles de epífitas vasculares basados en matrices de disimilitud de Bray-Curtis para (a) Chalán y (b) Morroa)
La familia Cactaceae Hylocereus presentó una alta riqueza, y es claro que las especies de este género crecen preferiblemente en ecosistemas estacionalmente secos, desde la Florida (EEUU) hasta Argentina (Leopardi et al., 2014), lo cual puede implicar algún tipo de adaptación al bosque seco y, a su vez, una gran dispersión y mayor abundancia. No obstante, esta hipótesis debe ser estudiada con mayor detalle. R. baccifera presenta una alta capacitancia relativa (0.50 M/Pa) y un metabolismo ácido, los cuales le permiten ocurrir y resistir los ambientes secos (Andrade & Nobel, 1997). Lo anterior explica sus reportes para Colombia en los valles secos interandinos, en la región Caribe y en la zona seca de baja altitud de Santa Marta (Ruiz et al., 2002; Rivera-Díaz & Rangel, 2012).
El análisis de diversidad alfa muestra claramente que la parcela en Chalán presenta mayor riqueza, diversidad y dominancia que la de Morroa. Esta zona está ubicada en un paisaje de montaña con una alta concentración de suelos tipo II (arcillosos, poco drenados, con calizas del Eoceno-Mioceno y pH ligeramente ácido a neutro) (Herazo-Vitola et al., 2017). Estos suelos pueden proveer los nutrientes necesarios para mejorar las tasas de crecimiento y desarrollo de los forófitos y, con esto, un incremento de la humedad dada por la ampliación de la cobertura vegetal. Mercado-Gómez et al. (2021) identificaron que Chalán es más húmeda que Morroa, soportando los resultados aquí obtenidos. La disponibilidad de agua puede disminuir el estrés y modificar la disponibilidad de recursos durante el periodo de sequía y, por lo tanto, impulsar una mayor riqueza de la comunidad (Motzkin et al., 1999) y el surgimiento de nuevos ensambles de especies (Cornwell & Ackerly, 2009; López-Martínez et al., 2013). De hecho, Mercado-Gómez et al. (2021) sugieren que existen diferentes comunidades de plantas leñosas dentro de los Montes de María, e indican que aquellos ensambles localizados en Morroa presentan una riqueza de especies más similar a aquellas halladas en otras localidades de bosque seco en el Caribe colombiano, en comparación con localidades halladas en Chalán y Colosó.
La influencia del agua en Chalán también puede explicar por qué en esta zona se encuentran los cinco estratos, mientras que en Morroa solo hay cuatro (no se hallaron especies en el estrato 1). Asimismo, Gentry (1995) y Herazo-Vitola et al. (2017) encontraron que, en áreas cercanas a los sitios de muestreo en Chalán los forófitos tienen mayor DAP y altura, generando así más espacio para el establecimiento de comunidades de epifitas hacia el estrato 1. El mayor número de estratos en Chalán también puede estar relacionado con las diferencias en la tolerancia a ciertas condiciones de luz y humedad, así como con sus adaptaciones ecofisiológicas (Johansson, 1974; Ter Steege et al., 2000). En el primer caso, el gradiente de luz es el principal impulsor detrás de la segregación vertical, ya que la magnitud de las ondas de luz desde el exterior del dosel al suelo del bosque disminuye considerablemente (Wagner et al., 2013), por lo que en los estratos más altos pueden ocurrir especies menos tolerantes a la desecación durante los periodos de sequía. Lo anterior podría explicar la formación de los ensamblajes de especies de acuerdo con la estratificación vertical.
Los resultados de la βT muestran la formación de por lo menos dos ensamblajes, lo cual se ve reflejado en las zonas obtenidas por el cluster para ambas localidades. La formación de estas comunidades puede ser una respuesta a las variables microclimáticas halladas en las áreas de estudio. Por ejemplo, explica por qué, en las zonas CZ2 y CZ3, la especie más abundante es R. baccifera, una Cactaceae que, por su tipo de fotosíntesis, soporta de forma adecuada los periodos secos (Andrade & Nobel, 1997). Asimismo, las especies del género Tillandsia son abundantes en los estratos superiores para ambas localidades. Este género es característico de ambientes xéricos, pues posee adaptaciones que le permiten tolerar condiciones rigurosas como las que predominan en las zonas secas (Flores-Palacios et al., 2015; Koch et al., 2019; Raux et al., 2020). De hecho, Graham y Andrade (2004) señalan que la humedad es sumamente importante en la conformación de la estructura de comunidades de epífitas, ya que, al ser esta más constante en los estratos intermedios que en los altos, se generan condiciones climáticas diferentes en comparación con las zonas más altas, que permiten el crecimiento de especies menos tolerantes a la desecación. Esto explica por qué la diversidad es mayor en los ensamblajes CZ1 y MZ1. De la Rosa-Manzano et al. (2017) sugieren que las especies prefieren estos lugares porque se ven favorecidas por una mayor acumulación de material orgánico en las bifurcaciones de las ramas principales (Acebey & Krömer, 2001; Krömer et al., 2007). La zona que presentó los valores más bajos fue la zona 1, quizás porque las condiciones del bosque seco no la favorecen, pues la hacen poco productiva para las especies epífitas. Lo contrario ocurre en bosques húmedos, donde la mayor riqueza y abundancia se concentran en esta zona (Martínez-Meléndez et al., 2008).
Otro aspecto relevante es que estas comunidades fueron conformadas por el recambio, más que por el anidamiento. El recambio espacial implica la sustitución de unas especies por otras, como consecuencia de la ordenación ambiental o espacial y limitaciones históricas (Qian et al., 2005). En este sentido, y de acuerdo con los resultados de este estudio, posiblemente existe un filtro ambiental que evita que las especies de los sustratos superiores ocurran en el dosel medio. El filtro ambiental ha jugado un papel importante en la conformación de muchas comunidades (Emerson & Gillespie, 2008), incluidas las plantas del bosque seco (Lebrija-Trejos et al., 2010), ya que este puede limitar el movimiento de especies, aun entre sitios cercanos que difieren significativamente en sus características abióticas (Qian et al., 2005). No obstante, se requieren estudios adicionales que midan la diversidad funcional y filogenética, así como las variables microclimáticas, en cada ensamblaje para poder corroborar estas hipótesis.
Con respecto a la abundancia de las epífitas en los forófitos, se esperaría que se observaran valores altos en árboles más grandes, pues estos ofrecen mayor superficie para su colonización. Por el contrario, los individuos más pequeños proporcionan menor superficie y tendrían una menor diversidad de especies (Toledo-Aceves et al., 2017; Wang et al., 2017). Así, en el área de estudio se evidenció que las epífitas ocurren principalmente en A. excelsum, una especie con amplia ramificación y cobertura vegetal, pero también con una alta capacidad de retención de agua en la corteza (Andrade & Nobel, 1997). Además, la cobertura vegetal, producto de su amplia ramificación, genera espacios más húmedos y sombreados, lo cual puede producir variaciones en la humedad, la temperatura, la cantidad de luz y la velocidad del viento a lo largo del tronco. Esto, a su vez, forma nichos con diferentes características aprovechables por las epífitas (Zotz et al., 2011; Jiménez-López et al., 2017; Álvarez-Arnesi et al., 2018). Además, A. excelsum presenta cortezas resquebrajadas o arrugadas, cubiertas de líquenes y musgos, que parecen ofrecer lugares para sostenerse y, por lo tanto, para el establecimiento de las epífitas (Andrade & Nobel, 1997; Zotz et al., 2011).
Los resultados aquí obtenidos indican que, aunque las áreas de muestreo se encuentran dentro de una misma región, los sitios analizados son heterogéneos en sus aspectos ambientales y ecológicos, los cuales parecen generar ciertas condiciones ambientales que permiten albergar diferentes especies de epífitas vasculares sobre los estratos verticales en los cuales coocurren. En otras palabras, ciertas condiciones al interior de cada localidad, forófito u hospedero pueden favorecer o no a ciertas especies, dando lugar a diferentes ensambles de especies. En este orden se hallaron tres grupos de especies de epifitas vasculares en los Montes de María, un ensamblaje asociado a los estratos inferiores (CZ3), uno intermedio (CZ1 y MZ1) y uno alto (CZ2 y MZ2).
La ecología de las epífitas, sus procesos fenológicos y de distribución vertical y sus afinidades microclimáticas con los árboles hospederos son componentes de la estructura de comunidades de este grupo de plantas poco conocidos para el BS-T, los cuales deben ser explorados con el fin de mejorar su biología y ecología. Deben obtenerse datos microclimáticos que permitan determinar si estos están relacionados con la formación de ensambles de especies. Asimismo, deben realizarse análisis de estructura de comunidades basados en diversidad filogenética y rasgos funcionales que ayuden a entender cuáles procesos permitieron la conformación de estas comunidades en los Montes de María. Es necesario ampliar el área de estudio hacia más localidades, de tal forma que se pueda entender si (como proponen Mercado-Gómez et al. (2021) para plantas leñosas) las epífitas conforman una sola comunidad o más de una en los Montes de María.
Acknowledgements
AGRADECIMIENTOS
Al Laboratorio de Conservación Biológica de la Universidad de Sucre por facilitar las instalaciones para la identificación y almacenamiento de los ejemplares; y a Sandy Escorcia y Naguib Peñates por su ayuda en campo.
REFERENCIAS
Licencia
Derechos de autor 2023 Colombia forestal

Esta obra está bajo una licencia internacional Creative Commons Atribución-CompartirIgual 4.0.
Colombia Forestal conserva los derechos patrimoniales (copyright) de las obras publicadas, y favorece y permite la reutilización de las mismas bajo la licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional por lo cual se pueden copiar, usar, difundir, transmitir y exponer públicamente, siempre que:
Se reconozcan los créditos de la obra de la manera especificada por el autor o el licenciante (pero no de una manera que sugiera que tiene su apoyo o que apoyan el uso que hace de su obra).