DOI:
https://doi.org/10.14483/udistrital.jour.colomb.for.2006.1.a05Published:
2006-01-01Issue:
Vol. 9 No. 19 (2006)Section:
Scientific articleRevigorización y establecimiento in-vitro de Gmelina arborea Roxb. V. mediante cultivo de tejidos vegetales
In vitro revitalization and establishment of Gmelina arborea Roxb. V. by plant tissue culture
Keywords:
Gmelina arborea, Melina, revigoración, propagación vegetativa in-vitro, Monterrubio, Pivijay, Magdalena, Colombia (es).Downloads
References
Answar, K. A. 1975. Primary: Preventive and Perrnisive Roles of Hormones in Plant Systems. The Botanical Review. Vol. 41 (4). Pp. 391-419.
Álvarez, M. 1995. Procesamiento de frutos y de semillas de Bombacopsis quinatum, Gmelina arborea y Eucalyptus spp. En: Curso regional sobre recolección y procesamiento de semillas forestales. 13-21 de marzo de 1995. CATIE&PROFESOR. Turrialba, Costa Rica.
Ávila, T. Izquierdo, J. 2004. Management of appropriate agricultural biotechnology for small producers: case study-Bolivia. REDBIO/FAO. Disponible en http://www.redbio.orgiestud_casos.htm
Ballester, A. 1990. Development of Rejuvenation for in vitro establishment, multiplication and rooting of mature trees. In: Plant aging: Basic and Aplied Approaches .Plenum Press, New York. 49p.
Bonga, J. M., 1Durzan, D.J. 1987. Vegetative propagation in relation to juvenility, maturity and rejuvenation. En: Tissue culture in forestry. Nijhoft /Junk (eds.). The Hage: 387-412.
Boulay, M. 1987. In vitro propagation of tree species. En: Plant tissue culture and cell culture. De C. E. Green et al. Alan R. Liss, Inc. 367-382.
Briscoe, B. C. 1995. Silvicultura y manejo de teca, melina y pochote. CATIE. Serie Técnica. Informe Técnico No. 270, Turrialba costa rica, 44 p.
CamBioTec. 2003. La biotecnología en América Latina: Panorama al ario 2002. Verástegui, J. Ed. CamBioTec -- IDRC. Ottawa.
Curtis, II. 2000. Biología. Editorial Médica Panamericana. Buenos Aires.
De Peña, M. 2005. Informe de gestión. Febrero 2000 a enero 2005. Secretaría Técnica. Programa Nacional de Biotecnología. Colciencias.
FAO. 1979. Mejoramiento genético de árboles forestales. Investigaciones y desarrollo industrial forestal. Bogotá, Colombia. 179 p.
FAO. 1993. Ex situ storage of seeds, pollen and in vitro cultures of perinnial woody plants species. Rome, FAO Forestry Pader 113. 83 p.
Gupta P. K. 1980. Tissue culture offorest trees: Clonal Multiplication of Tectona grandis (Teak) by tissue culture. Plant Science Le Hers. 259-268p.
Hartmann, T. H. Kesler, D. 1992. Propagación de plantas: principios y prácticas. Compañía Editorial Continental, 5. A. de C. V. México. 760 p.
Hodson de Jaramillo, E., Forero, C. y Carrizosa, MS. 2003. "Políticas públicas en biotecnología agroalimentaria y bioseguridad en Colombia". Biotecnología: Políticas públicas y aceptación social en Argentina, Brasil, Chile, Colombia, Cuba, Ecuador, España y México. Subprograma III: Biotecnología.
Kannan, V.R. et al. 1995. Clonal propagation and comparative analysis of free radical scavenging enzymes in vitro and in vivo tissues of Gmelina arborea R.V. En : In-vitro; N. 31 (3)2, 80A.
Kannan, V.R. et al. 1996. Micropropagation of Gmelina arborea. En: Plant cell tissue organ culture, 46 (3)269-71.
Lamprecht, H. 1990. Silvicultura en los trópicos. Deutsche Gesellschaft für technische Zusammenarbeit. Eschbom. 335 p.
Lindsey, K. 1992. Biotecnología vegetal agrícola. Zaragoza. Editorial Acribia S.A. 277 p.
Molish, H. 1938. The longevity of plants. Fulling, NY.
Murillo, O. 1991. Colección de guías silviculturales- Melina (Gmelina arborea).CATIE, Turrialba, Costa Rica, 55 p.
Margara, J. 1988. Multiplicación vegetativa y cultivo in-vitro. Mundi-Prensa. Madrid, España. 232 p.
Parent, G. 1989. Guía de reforestación. Bucaramanga, Colombia. 125 p.
Patirio, J. 1985. Los principales árboles de cada una de las formaciones vegetales de Colombia. Ministerio de Agricultura. Bogotá, Colombia.
Pierik, R. L. 1990. Cultivo in vitro de plantas superiores. Mundi-Prensa. Madrid, España. 326 p.
Pontificia Universidad Javeriana. 1992. Sistemas modelo para la micropropagación y conservación de especies forestales. Primera Etapa. En: Programa de Investigación en Biotecnología Forestal en Colombia. P. U. J & INDERENA. Bogotá, Colombia. 155 p.
Roy, S. K. 1992. Shoot multiplication and plant regeneration from shoot tip of Gmelina arborea by in vitro culture. En: In vitro, 28(3)2, 116A.
Tamas, I. A. 1987. Hormonal regulation of apical dominance. In: Plant Hormones and Their Role in Plant Growth and Development. P.J. Davies, Martinus Nijhoff Publishers. Alemania. Pp. 395-410.
Trippi, V. 1982. Ontogenia y senilidad en plantas. Universidad Nacional de Córdoba, Córdoba. Argentina.
Trippi, V. 1986. Aging of Meristems and Morfogenetic Potentialities. Laboratorio de fisiología vegetal. Universidad Nacional de Córdoba. Argentina. En: Plant aging. Plenum Press-New York and tondon. 1992.
U. C. O. Universidad Católica de Oriente: 1997. Memorias Curso Nacional de Protección y Biotecnología Forestal. Fundación Buen Pastor. Rionegro, Antioquia. 216 p.
Urueria, L. H. 1997. Gmelina arborea R. Nota de Investigación 24. Monterrey Forestal. Zambrano, Bolívar. 3 p.
Vandame, C. 1988. Propagación de Tectona grandis Linneo f (Verbenaceae) por medio de cultivo de tejidos in-vitro. Trabajo de tesis. Pontificia Universidad Javeriana. Bogotá, Colombia. 208 p.
Villalobos, V. 1983. Aplicaciones del cultivo de tejidos en especies forestales. En: Ciencia y Desarrollo. Julio-Agosto. Num. 51. Ario IV. México. 58 p.
Zobel, B. 1992. Técnicas de mejoramiento genético de árboles forestales. Editorial Limusa S.A. Mexico D.F. 545 p.
How to Cite
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Download Citation
Artículos de investigación científica y tecnológica
Colombia Forestal, 2006-12-00 vol:9 nro:19 pág:70-87
Revigorización y establecimiento in-vitro de Gmelina arborea Roxb.V. mediante cultivo de tejidos vegetales
Adriana Yepes
adyepes@yahoo.com
Universidad Distrital Francisco José de Caldas
Resumen
Gmelina arborea es una especie procedente del sudeste asiático que, debido a su amplia adaptación y a su rápido crecimiento, ha sido introducida en gran número de países tropicales (Murillo, 1991).
Este trabajo se desarrolló en la plantación de la Reforestadora de la Costa, ubicada en el corregimiento de Monterrubio, municipio de Pivijay, Magdalena. Se realizaron prácticas de rejuvenecimiento fisiológico en material adulto de 7 y 14 arios en rebrotes de tocón (brotes epicórmicos) y en estacas de Gmelina arborea.
Posteriormente se evaluó el establecimiento in-vitro de yemas de esta procedencia. Los mayores porcentajes de enraizamiento de brotes de tocón en invernadero se obtuvieron empleando K-AIB en concentraciones de a 2000 y 4000 mg/1 con 16 raíces de 4.5 cm de longitud promedio.
En estacas se obtuvo sólo un 2.1% de enraizamiento. Se indujo el enraizamiento de los esquejes de 5 cm que se regeneraron de ellas. El enraizamiento de los esquejes etiolados por 15 días fue estadísticamente mayor (42.7%) que el de los no etiolados (17.7%), al igual que la longitud de las raíces emitidas por ellos. El enraizamiento con AIB-K en concentración de 4000 mg/1 fue del 45.8%.
Con respecto al establecimiento in vitro, el mayor porcentaje de supervivencia a desinfección de yemas con Na0C1 al 0.25% para el establecimiento in-vitro, correspondió a las yemas procedentes de brotes de tocón.
Palabras claves:
Gmelina arborea, Melina, revigorización, propagación vegetativa in-vitro, Monterrubio, Pivijay, Magdalena, Colombia
Abstract
Gmelina arborea is a Southeast Asian species that have been introduced to many tropical countries due to its easy adaptation and fast growing (Murillo, 1991).
This Project was carried out in the Reforestadora de la Costa plantation, located at Monterrubio, Pivijay, Magdalena state. Physiological rejuvenation practices were performed on 7 and 14 years old individuals iii stump sprouts (epicormic shoots) and stakes. Later, their invitro establishment was evaluated.
The highest rooting sprouts percentages were obtained using K-AIB in 2000 and 4000 mg/1 concentrations with 16 roots of 4.5 cm average length.
Stakes rooting were obtained on only 2.1 % of the samples. Regenerated sprouts with 5 cm long were rooted. Rooting of the covered stakes during 15 days were statistically higher (42.7%) compared to the non-covered (17.7), as well as the length of their roots. Rooting with AIB-K of 4000 mg/1 concentration was 45.8%.
Regarding the in-vitro establishment, the highest survival percentage on bud desinfection using Na0C1 at 0.25%, was for those coming from stump sprouts.
Key words:
Gmelina arborea, Melina, physiologic rejuvenation, asexual reproduction, establishment in-vitro, Monterrubio, Pivijay, Magdalena, Colombia.
INTRODUCCIÓN
La Reforestadora de la Costa cuenta con un proyecto silvopastoril ubicado en el corregimiento de Monterrubio, municipio de Pivijay, departamento del Magdalena. El Proyecto La Gloria, lugar donde se realizó este trabajo, tiene un total de 7.128 hectáreas, de las cuales 4.674,4 están plantadas con especies maderables, entre las cuales se hallan Roble (Tabebuia rosea), Teca (Tectona grandis), Eucalipto (Eucalyptus tereticornis) y Melina (Gmelina arborea).
El empleo de las técnicas de cultivo de tejidos vegetales para la propagación de especies de interés forestal es una importante herramienta de apoyo a los programas de reforestación y establecimiento de huertos semilleros clonales (Ávila, 2004; Cam Biotech, 2003; De Peña, 2005).
Gmelina arborea es originaria del sur de Asia, donde se distribuye desde Pakistán hasta la península de Indochina y en algunas islas circundantes del continente (FA0,1979). Melina (Figura 1) es un árbol de bosque productor, de corta rotación, crecimiento rápido, resistente a plagas y enfermedades, que rebrota bien al cortar (Parent, 1989). Esta especie crece en ambientes de bosque seco tropical (bsT), bosque húmedo tropical (bhT) y bosque muy húmedo tropical (bmhT), según la clasificación de Holdridge a temperaturas superiores a 24°C, con precipitación anual entre 250-4500 mm y a una altitud hasta de 1000 msnm (Álvarez, 1995; Briscoe, 1995; Patiño, 1985; Untefía, 1997).

PROPAGACIÓN VEGETATIVA
La regeneración de un individuo por vía asexuada a partir de una célula o de un pequeño grupo de células es la expresión de la totipotencia celular. Esta característica se ha aprovechado en la propagación vegetativa (reproducción asexual), lográndose a partir de partes bien diferenciadas (Margara, 1988, Roy, 1992). Esta técnica de propagación asexual se emplea como metodología para llevar a cabo rejuvenecimiento fisiológico de material adulto de un fenotipo sobresaliente (Lamprecht, 1990; Pierik, 1990). En términos generales, el uso de la propagación vegetativa permite captar y transferir al nuevo árbol todo el potencial genético del árbol donado (Zobel, 1992).
El uso de estacas enraizadas como método de propagación vegetativa es uno de los que se ha desarrollado con mayor rapidez; sin embargo, está limitado por la variabilidad clonal que existe en la capacidad de enraizamiento, más notoria en individuos viejos. Sin embargo, la variación clonal en el enraizamiento ocurre sin importar qué método se utilice (Zobel, 1992; UCO, 1997; Hodson, 2003).
La micropropagación vegetal consiste en el empleo de técnicas de cultivo in vitro de tejidos vegetales, que permiten la propagación clonal de plantas por proliferación e inducción de un grupo de células meristemáticas. Estas células se expresan luego como yemas axilares, apicales o como raíz, en condiciones asépticas (Curtis, 2000; Kannan, 1996). Así, se pueden obtener plántulas genéticamente idénticas en un periodo relativamente corto y en un espacio pequeño. Alternando la proporción de hormonas, se puede inducir a las plántulas a que desarrollen raíces sin que proliferen y se multipliquen en nuevas plantas completas. (FAO, 1993; UCO, 1997). Las técnicas de cultivo de tejidos se conciben en relación con el mantenimiento de la estabilidad genética. Esta estabilidad se puede lograr mediante el cultivo de meristemos, vástagos, órganos o explantes apropiados que retengan in-vitro la organización meristemática.
Las plantas producidas por micropropagación pueden ser liberadas de infecciones bacterianas y fúngicas, ya que se parte de una masa mínima de tejido y se trabaja en condiciones asépticas durante todo el proceso de clonación. (Lindsey, 1992; Curtis, 2000).
La propagación in-vitro de especies forestales puede incluir diversos procesos como el desarrollo de brotes adventicios, brotes axilares y la embriogénesis somática; existen varias publi caciones de las listas de especies que han podido ser propagadas mediante esta técnica. En general, las Angiospermas responden mucho más fácil a las técnicas de micropropagación, pero también se han observado buenos resultados en las Gimnospermas (Boulay, 1987; Villalobos, 1983; Kannan, 1995).
Con cualquiera de los procesos utilizados para la micropropagación, se ha observado que es más difícil obtener resultados cuando se usa material adulto que cuando se trabaja con material juvenil (material revigorizado, semillas, embriones o explantes de árboles jóvenes), y son pocas las plantas que se han podido regenerar a partir de árboles madre adultos. Aquellos que se han producido no presentan anormalidades genéticas significativas (Trippi, 1982; Boulay, 1987; Gupta, 1980; Kannan, 1996; UCO, 1997; CambioTech, 2003).
Se han planteado diferentes estrategias como solución a problemas de manejo in-vitro de material adulto, como:
- Selección de explantes juveniles:
· Zonas fisiológicamente juveniles: cambium, ápices meristemáticos.
· Cultivo de explantes provenientes de provenientes de células sexuales.
- Preacondicionamiento de la planta donadora del explante, promoviendo el rejuvenecimiento (Pontificia Universidad Javeriana, PUJ, 1992; Ávila, 2004).
El rejuvenecimiento ocurre en todas las partes del árbol, hasta el final de su vida, pero generalmente en zonas específicas, por ejemplo en la base del tronco y cerca a estructuras sexuales y meristemáticas (Bonga, 1987; Kannan, 19%).
Las plantas muestran diferentes cualidades morfogénicas a lo largo de su estructura, por lo que se sugiere un gradiente ascendente del envejecimiento. Molish (1938) denominó topófisis la diferencia de potencial morfogénico de meristemos ubicados en diferentes lugares. Estas diferencias se pueden observar en el hábito de crecimiento de las plantas, la forma de las hojas, la capacidad de enraizar y el contenido de carbohidratos. En algunas plantas el plagiotropismo es un carácter juvenil, mientras que para algunas otras especies leñosas el crecimiento ortotrópico es una característica juvenil.
La intensidad de la luz, el fotoperiodo, la temperatura ambiental y la adición de sustancias como reguladores de crecimiento (GA, ANA, ATA 2, 4-D que atrasan el desarrollo de formas adultas) pueden influir en el hábito de crecimiento de algunas plantas, principalmente en aquellas sensibles a condiciones ambientales (Trippi, 1986; Ávila, 2004; Cambio Tech, 2003).
La utilidad de la micropropagación de árboles forestales está limitada por la eficiencia con la cual árboles seleccionados pueden ser reproducidos vegetativamente. La transición de juvenil a adulto puede ocurrir gradualmente, y algunas partes de un árbol adulto pueden retener características juveniles o transitorias por muchos años; material de este tipo incluye brotes epiCórmicos, brotes enraizados y brotes de tocón de árboles adultos. Este tipo de material presenta mayor facilidad de establecimiento in-vitro que el material proveniente de ramas de la copa del mismo árbol (Ávila, 2004; Ballester, 1990; Kannan, 1996).
Los árboles adultos no siempre presentan propiedades juveniles y en algunos casos el tejido adulto tiene que ser revigorizado para permitir su establecimiento in-vitro. Métodos de rejuvenecimiento reportados recientemente incluyen podas severas, aspersión Con citocininas o giberelinas, inducción y enraizamiento de brotes epicórmicos, injertos en patrones juveniles y etiolación parcial de material inicial. Subcultivos consecutivos de explantes de árboles maduros y cultivo de meristemos producen un incremento gradual de juventud (Ballester, 1990; PUJ, 1992, Kannan 1995; CambioTech, 2003). Ballester (1990) también demostró que la etiolación parcial puede facilitar el establecimiento in-vitro y la subsecuente multiplicación de material adulto, presumiblemente por la reducción del envejecimiento fisiológico.
El objetivo de este trabajo fue el establecimiento in-vitro de Gmelina arborea para su propagación, empleando material vegetal adulto revigorizado y así obtener el protocolo de establecimiento in-vitro. La investigación se desarrolló en el laboratorio de cultivo de tejidos in vitro de la Reforestadora de la Costa, entre 1997 - 1998 y 2004.
MATERIALES Y MÉTODOS
ELECCIÓN DEL MATERIAL VEGETAL
Debido a que los ensayos exploratorios de establecimiento in-vitro presentaron contaminación y poca respuesta de los tejidos, se desarrollaron métodos para obtener yemas juveniles de material vegetal enraizado que, además, poseyera mayor facilidad de manipulación en invernadero.
El material vegetal de Gmelina arborea empleado para este trabajo consistió en:
- Brotes en tocones de árboles de 7 y de 14 años.
- Estacas provenientes de las tres zonas de la copa (alta, media y baja), de árboles de 7 y de 14 años.
- Esquejes (brotes axilares que elongaron en las estacas) de estacas de 7 y de 14 años.
El material llevado a invernadero se mantuvo con saram 70% (28°C - 35°C de temperatura promedio; h.r. 85% aprox.), riego foliar continuo y aplicaciones semanales de fungicida sistémico con ingrediente activo Propamocarb-HC1 en concentración de 1 m1/1.
Ensayos para la inducción de juvenilidad
Los ensayos para la inducción de juvenilidad siguieron esta metodología:
a. Inducción de brotes epicórmicos (brotes de tocón).
b. Enraizamiento de brotes epicórmicos. Los brotes epicórmicos se enraizaron en sustrato arena: suelo (3:1). En este ensayo se evaluó el efecto de la edad de los toco nes generadores de brotes (7 y 14 arios) y de la concentración del ácido indolbutírico, AIB, (control; 1000 mg/1; 2000 mg/1; 4000 mg/1; 5000 mg/1).
c. Enraizamiento de estacas. Para analizar el enraizamiento en estacas se correlacionó la evaluación del efecto de la edad de los árboles de donde procedían (árboles de 7 y de 14 arios), sustratos (arena y mezcla arena:suelo (3:1)), concentración de AIB y localización en la copa (alta, me dia, baja).
d. Enraizamiento de esquejes de estacas.
Establecimiento in-vitro de material revigorizado y adulto
El día anterior a la cosecha se le aplicó aspersión de fungicida sistémico, Benlatee. Antes de la siembra los nudos se lavaron con champú con complejo yodo-polaxamer 45g, equivalente a 0.75g de yodo disponible Prepodine ®, se desinfectaron con Etanol al 50%, durante 30 s. En los tratamientos de evaluados se emplearon soluciones de Na0C1 al 1%, 0.5% y 0.25% sulfatadas con una gota de Tween 20®, durante 5, 10 y 15 min. Por último, se les dieron tres enjuagues con agua estéril suplementada con L-cisteína.
Las yemas se sembraron en el medio de cultivo de Schenk y Hildebrandt, enriquecido con los microelementos de Bourgin y Nitsch, carbón activado y solidificado con agar.
RESULTADOS Y DISCUSIÓN
INDUCCIÓN DE BROTES EPICÓRMICOS
A la quinta semana de haber sido derribados los árboles, se realizó la evaluación de los brotes axilares que se indujeron en tocones de árboles de 7 y de 14 años (Figura 2). El número promedio de brotes producidos está relacionado en la Tabla 1.
De acuerdo con el análisis de varianza, se encontró diferencia significativa entre el número promedio de brotes de tocón y la edad de los mismos. Así, tocones de árboles de 7 años producían en promedio 17.5 brotes comparado con 21.7 brotes en tocones de 14 años, lo que estadísticamente es significativo (Tabla 1).
Al observar estos resultados, se tomó en cuenta la covariante diámetro de los tocones. Gracias a un diámetro mayor en tocones se tiene un mayor perímetro que, como en el caso de los tocones de 14 arios, puede albergar un número mayor de yemas dormantes que elonguen y den lugar a brotes epicórmicos. Además, se presume que exista una mayor cantidad de carbohidratos que contribuya con el crecimiento y desarrollo de estas yemas.
Otro factor que ejerce una importante influencia en el desarrollo de las yemas axilares es el contenido endógeno de auxinas. Aunque, al igual que en los carbohidratos, no está determinada cuantitativamente la cantidad de estas sustancias en los tocones, se presume su existencia ya que son factores determinantes en ese proceso.
En el proceso de rompimiento de la dormancia de las yemas, existen diferentes sustancias que intervienen promoviendo o inhibiendo su desarrollo. Parece que el estímulo primario lo cumplen las auxinas, interviniendo además otras sustancias como las citocininas que causan la liberación de la dormancia y de inhibidores como el ácido absícico (ABA), que mantiene la dormancia de las yemas (Answar, 1975).


Diferentes inhibidores y otras sustancias mantienen la dormancia de las yemas; se ha observado que estas plantas, o parte de ellas, cuando están sujetas a estrés muestran incremento en este tipo de sustancias y reducciones en los niveles de citocininas. Uno de los causantes de estrés puede ser la baja precipitación anual de la zona geográfica donde se realizó la investigación (1200 mm/ ario). El crecimiento en plantación también puede ser un factor estresante para los árboles, ya que cuando crecen aislados no hay competencia por la luz, siendo baja su copa y su ramificación.
Las citocininas, factor clave en el desarrollo de las yemas laterales, intervienen en su desarrollo y ejercen una acción sinérgica junto con las giberelinas, oponiéndose a la acción de los inhibidores (Tamas, 1987).
ENRAIZAMIENTO DE BROTES EPICÓRMICOS
En este ensayo (Figura 3) se evaluó el efecto de la edad de los tocones generadores de brotes y de la concentración del ácido indolbutírico AIB, sobre los indicadores señalados en la Tabla 2.

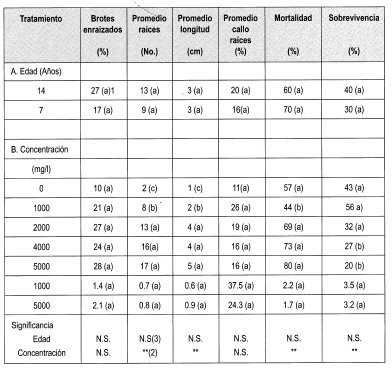
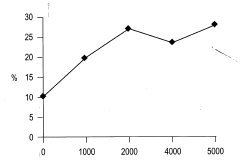
El análisis de varianza en este ensayo muestra que la edad no ejerce una influencia estadística en el porcentaje de enraizamiento de los brotes. Esto se puede explicar ya que los brotes de tocón evaluados proceden de árboles adultos, que ya superaron la juvenilidad y se encuentran en un estado fisiológico muy similar, por lo que no se encuentra diferencia significativa. La prueba de Duncan indica que el porcentaje de brotes enraizados tampoco está determinado por la concentración de AIB. Sin embargo, se puede observar una tendencia lineal a producirse un mayor porcentaje de enraizamiento al aumentar la concentración de AIB (Figura 5).
Es importante destacar que los brotes epicórmicos de Gmelina arborea poseen una tendencia intrínseca a enraizar, ya que enrizó el 9.8% de brotes control, es decir, sin pulso hormonal con. AIB. Esto podría explicar una presumible presencia de un alto contenido endógeno de auxinas en los brotes (Hartmann & Kesler, 1992).
Con respecto a la influencia que tuvieron las diferentes concentraciones de AIB en el número y la longitud de las raíces adventicias se ven diferencias estadísticas significativas, observándose un mayor número de raíces en las concentraciones de 2000, 4000 y 5000 mg/1 de AIB, al igual que una mayor longitud promedio en estas concentraciones (Figura 4).
La prueba de Duncan muestra que la concentración de AIB pudo influir en la mortalidad de los brotes epicórmicos enraizados, encontrándose menor sobrevivencia en las concentraciones de 4000 y 5000 mg/l. Sin embargo, este fenómeno también se puede explicar al tener en cuenta la calidad del agua de riego. Esta agua procedía de represas de agua lluvia, sin ningún tipo de tratamiento previo.
ENRAIZAMIENTO DE ESTACAS
Se evaluó el enraizamiento de las estacas de Gmelina arborea con respecto a los parámetros que se consignan en la Tabla 3.
La prueba de Duncan muestra que existe diferencia estadísticamente significativa entre la edad y el porcentaje de enraizamiento: 2.1% para estacas de 14 años y 0.3% de enraizamiento para estacas de árboles de siete años. Una de las razones que explica este comportamiento podría ser un bajo contenido endógeno de auxinas en las estacas. Otra explicación podría ser que la corteza actúe como un impedimento mecánico para el desarrollo de las raíces. Esta gruesa capa hace que la elongación de las raíces se realice a partir del cambium por la parte inferior de la estaca y no lateralmente, como se observa en los brotes de tocón.
Las estacas tomadas proceden de la copa de los árboles, por tanto son material vegetal ontogénicamente maduro. Este material presenta una baja capacidad para la regeneración de raíces. Este efecto varía con la especie, el genotipo y sobre todo con la edad de la planta de donde proceden los clones, así como de la posición en la copa del ortet de donde procede el explante.
En el enraizamiento de estacas de Gmelina arborea se presentó una diferencia significativa entre el porcentaje de enraizamiento en arena (2.1%) y en mezcla (0.3%) a la semana cinco cuando se realizó la evaluación. La arena presenta baja compactación, lo que permite mayor drenaje y oxigenación, factores necesarios para la emisión de raíces en Gmelina arborea.
Con respecto al número y a la longitud de las raíces en estacas no existió diferencia estadística en ninguno de los indicadores evaluados, presumiblemente por el mínimo porcentaje de enraizamiento presente en estacas de Melina.
Con referencia a la presencia de callo en las estacas enraizadas, se observó que no existía diferencia estadística en ninguno de los indicadores evaluados. El callo es un tejido desdiferenciado que se forma a partir del cambium (tejido meristemático). Este tejido puede ser un indicador previo a la formación de raíces adventicias (Hartmann & Kester, 1992). Esto podría indicar que tiempo después de la formación del callo, ocurriría la diferenciación de estas células iniciada presumiblemente por un estímulo interno, por ejemplo la producción de auxinas en los brotes desarrollados. Sin embargo, este evento no se presentó.
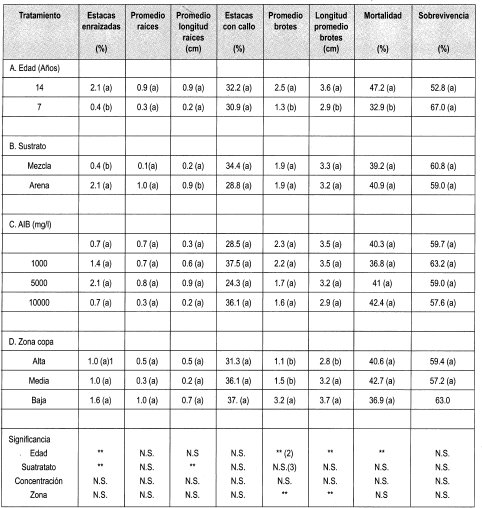
En este ensayo también se evaluó el número y la longitud promedio de esquejes que se desarrollaron en las estacas enraizadas de Gmelina arborea. Se encontró que existe diferencia es= tadística entre el número y la longitud de los brotes elongados y la edad y zona de la copa. Se halló que estacas de siete arios producían en promedio 1.3 brotes de 2.9 cm de longitud promedio, mientras que se desarrollaron 2.5 brotes de 3.6 cm en estacas de 14 años. Esto pudo deberse a que en las estacas existía una variación del diámetro con la edad, lo que implica una diferencia en el contenido de carbohidratos y de yemas dormantes que dieron origen a los brotes que elongaron.
ENRAIZAMIENTO DE ESQUEJES DE ESTACAS
Se llevó a cabo la evaluación del efecto de la edad, la etiolación y la concentración de AIB en el enraizamiento y desarrollo de esquejes de Gmelina arborea (Figura 6) a través de los parámetros indicados en la Tabla 4.
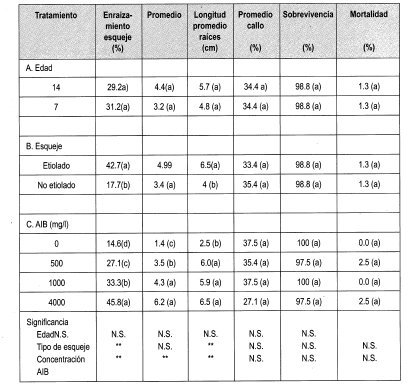
Los esquejes se formaron a partir de yemas dormantes en estacas que elongaron y se desarrollaron. Estos esquejes son material-vegetal que aunque más joven que las estacas, conserva características de árbol adulto. Entre ellas está la forma de las hojas, la capacidad de enraizamiento, el hábito de crecimiento.
La prueba de Duncan indica que el porcentaje de enraizamiento fue mayor empleando AIB a 4000 mg/L y en esquejes etiolados (42.7%).
Los efectos fisiológicos de la etiolación son muy poco comprendidos, pero es sabido que la etiolación reduce la lignificación, altera la anatomía e incrementa la concentración de inhibidores de AIA-oxidasas. Se han reportado cambios en los fenoles: los estudios han reportado que se aislaron dos compuestos fenólicos inhibidores de enraizamiento de brotes de tocón de Castaño sin etiolar, que no estuvieron presentes en brotes etiolados. Ballester (1990) recomienda el método de etiolación parcial no sólo como pretratamiento de tejidos recalcitrantes maduros, sino también para facilitar las investigaciones básicas del efecto de la etiolación en la fisiología de plantas leñosas.
Se ha encontrado que algunas plantas enraízan con facilidad después de la aplicación de AIB (Ballester, 1990). El análisis de varianza nos muestra que existen diferencias significativas entre el porcentaje de esquejes enraizados y la concentración del regulador empleado (AIB), enraizando el 45.8% de esquejes con AIB a 4000 mg/L (Figura 5). Se puede observar un aumento lineal del porcentaje de enraizamiento con un incremento en la concentración del regulador empleado.
En el caso del enraizamiento de esquejes de Gmelina arborea, la prueba de Duncan nos indica que un incremento en la concentración del regulador empleado (en este caso AIB) provoca un aumento en la longitud promedio (cm) de las raíces adventicias emitidas en la base del esqueje.

Es importante observar que existe diferencia significativa al comparar el porcentaje de enraizamiento de los brotes epicórmicos y esquejes teniendo en cuenta la edad y las concentraciones empleadas. A pesar de los altos porcentajes de mortalidad en los brotes epicórmicos se presenta un promedio mayor en el número de raíces (9.4 y 12.8 de 7 y 14 años, respectivamente) comparado con el promedio de raíces adventicias que se desarrollaron en los esquejes de Melina. Esto mismo ocurrió en las diferentes concentraciones de AIB empleadas. Esta característica puede indicar un rejuvenecimiento mayor en los brotes epicórmicos, ya que se puede observar que se facilitó el desarrollo del número de raíces sin necesidad de emplear la técnica de etiolación.
Es necesario tener en cuenta que el estado fisiológico de los esquejes para sobrevivir en las condiciones de humedad y temperatura presentes en los ensayos establecidos probablemente es mejor que el estado de los brotes epicórmicos, quizá por la lignificación del esqueje y el contenido interno de carbohidratos.
ESTABLECIMIENTO In-vitro
Se realizaron tres ensayos para la desinfección de yemas provenientes de los diferentes'tipos de material de Gmelina arborea establecidos en invernadero. El tratamiento de desinfección con un mayor porcentaje de yemas establecidas se aplicó a los todos los tipos de yemas, tanto a las obtenidas de campo como de invernadero.
Evaluación del Na0C1 AL 1%
Se estableció el ensayo empleando el protocolo citado en la metodología, para evaluar Na0C1 al 1% durante diferentes tiempos. Los parámetros se citan en la Tabla 5, cuya lectura de resultados se hizo a los 7 días de haber establecido el ensayo.
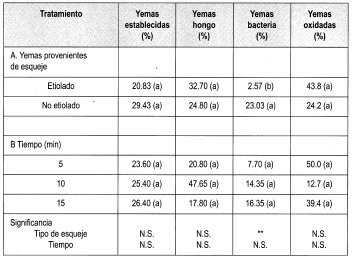
La prueba de Duncan señala que no existe diferencia significativa en ninguno de los tratamientos aplicados para la desinfección de yemas de brotes de tocón, empleando Na0C1 al 1%. Sin embargo, se observa diferencia significativa entre el porcentaje de yemas con presencia de bacteria en yemas procedentes de brotes epicórmicos etiolados. Esto se puede explicar, ya que el saram empleado para etiolar los brotes ejerce una función de aislamiento de los brotes con el medio ambiente. Esta condición puede permitir que las yemas se establezcan con una diferencia significativa en el porcentaje de bacteria presente en los ensayos realizados.
Evaluación del Na0C1 AL 0.5%
Se estableció el ensayo empleando el protocolo citado en la metodología, para evaluar Na0C1 al 0.5% durante diferentes tiempos. Los parámetros evaluados se citan en la Tabla 6, cuya lectura de resultados se hizo a los 7 días de haber establecido el ensayo.
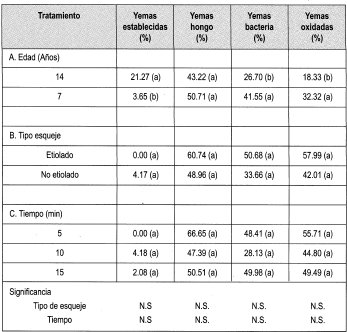
Al igual que en el ensayo anterior, días después de hacer la lectura de desinfección, el porcentaje de contaminación pasó en hongo y bacterias a un 100 %, aunque la oxidación permaneció estable.
Evaluación del Na0C1 AL 0.25%
Se estableció el ensayo empleando el protocolo citado en la metodología para evaluar Na0Cl al 0.25% durante diferentes tiempos.
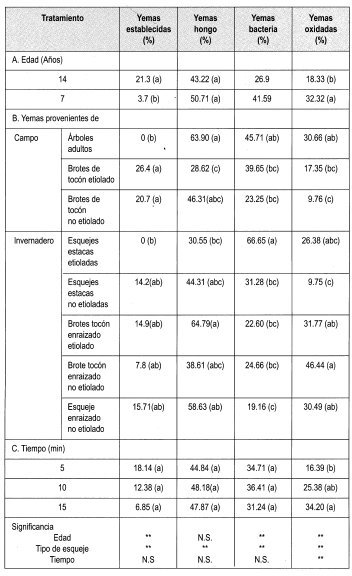
En la Tabla 8 se observa la matriz de evaluación con los promedios obtenidos en la evaluación de la desinfección de yemas de brotes de tocón de Gmelina arborea con Na0C1 al 0.25%, empleando todos los tipos de material vegetal disponibles.
En general, los factores más importantes que impidieron el establecimiento de las yemas in-vitro fueron la contaminación por hongo, bacteria y la oxidación; sin embargo, no se presentaron problemas de vitrificación en el material vegetal.
Teniendo en cuenta que el porcentaje de yemas sanas empleando Na0C1 al 0.25% arrojó el mayor número de yemas establecidas, se tomó este protocolo para aplicarlo en todos los tipos de material vegetal adulto y revigorizado obtenido durante el trabajo.
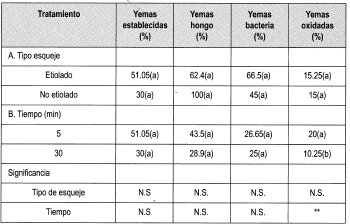
La prueba de Duncan muestra que existe diferencia significativa entre el porcentaje de yemas establecidas y la edad de los tocones de donde se tomaron las yemas. De esta forma se puede presumir que la zona geográfica donde se encuentren los tocones marca una pauta para el establecimiento de las yemas. Los ensayos anteriores revelaron que existe uniformidad entre la edad ontogénica de los dos tipos de yemas evaluados (7 y 14 arios). Sin embargo, la ubicación de los tocones de ambas edades difieren geográficamente, siendo el sitio de los tocones de 7 arios más húmedo, con 871.4 mm en promedio de 1997, comparados con los 831.6 mm promedio de la zona donde están los tocones de 14 arios. Otra característica de esta región es la distancia de siembra de los árboles. En el lote de árboles de 7 arios es de 3x3, con una mayor densidad de árboles plantados.
La prueba de Duncan también muestra que existe diferencia significativa entre el tipo de yema con el porcentaje de establecimiento, presentándose un mayor porcentaje de establecimiento en yemas de brotes epicórmicos (etiolados y no etiolados) y de las yemas de los esquejes de las estacas. Este último tipo de material responde en un mayor porcentaje al tratamiento de desinfección y de etiolación. Las plántulas de esquejes enraizados no permiten su etiolación, ya que aproximadamente a los cinco días de establecido el ensayo las hojas de estas plántulas pierden adherencia, lo que lleva a la muerte del material. Los esquejes de las estacas permiten su etiolación, lográndose el palidecimiento del material en pocos días (a partir del día décimo). Sin embargo, su establecimiento in vitro presenta muchos problemas, como altos porcentajes de oxidación y de contaminación por bacteria. Además, se presenta una baja respuesta de las yemas frente a su desarrollo in vitro.
CONCLUSIONES
Se promovió la revigorización de Ginelina arborea con prácticas como la poda severa, enraizamiento y la brotación consecuente, y mediante etiolación parcial o total del material vegetal. Se observó mejor respuesta en el establecimiento de las yemas provenientes de tocón y de esquejes enraizados no etiolados.
Se logró la brotación de tocones obteniendo un promedio de 21.7 brotes por lote, promedio que se puede duplicar realizando decapitamiento de la yema apical para promover la elongación de las yemas axilares.
Se indujo el enraizamiento de estacas de las tres zonas de la copa de árboles adultos de Gmelina arborea, observando que este material posee una mínima capacidad de producir raíces adventicias, ya que el enraizamiento fue 2.075%. Se presentó mayor brotación en estacas de árboles de 14 arios (2.53 brotes) de la zona baja de la copa (3.18 brotes) en condiciones de humedad relativa del 80% y de temperatura no superior a 35°C.
Se logró enraizar esquejes de estacas promoviendo etiolación basal durante quince días y se aplicó pulso hormonal con AIB-K a 4000 mg/l.
Se evaluaron varios protocolos para la desinfección de las yemas de Gmelina arborea a establecer in-vitro. Se observó que el uso de Na0C1 al 0.25% durante diez minutos de inmersión fue el mejor tratamiento con brotes de tocón enraizados etiolados y no etiolados y esquejes enraizados no etiolados.
Se observó que la etiolación total de los tocones de Gmelina arborea es positiva para el establecimiento de yemas in-vitro por ser un mecanismo de aislamiento en el medio en que se desarrollan. Al igual que en la primera etapa del establecimiento, la etiolación total de las yemas in-vitro impide su oxidación.
RECOMENDACIONES
Para la obtención de mayor cantidad de yemas de Gmelina arborea procedentes de brotes epicórmicos en tocones o en campo y de esquejes de estacas, se recomienda aplicar la técnica de decapitamiento con la cual se promueve la elongación de las yemas axilares. Además, sería conveniente la aspersión de reguladores de crecimiento como BAP en diferentes concentraciones para evaluar su efecto en el desarrollo de yemas.
REFERENCIAS BIBLIOGRÁFICAS
- Answar, K. A. 1975. Primary: Preventive and Perrnisive Roles of Hormones in Plant Systems. The Botanical Review. Vol. 41 (4).Pp. 391-419.
- Álvarez, M. 1995. Procesamiento de frutos y de semillas de Bombacopsis quinatum, Gmelina arborea y Eucalyptus spp. En: Curso regional sobre recolección y procesamiento de semillas forestales. 13-21 de marzo de 1995. CATIE&PROFESOR. Turrialba, Costa Rica.
- Ávila, T. Izquierdo, J. 2004. Management of appropriate agricultural biotechnology for small producers: case study-Bolivia. REDBIO/FAO. Disponible en http://www.redbio.orgiestud_casos.htm
- Ballester, A. 1990. Development of Rejuvenation for in vitro establishment, multiplication and rooting of mature trees. In: Plant aging: Basic and Aplied Approaches .Plenum Press, New York. 49p.
- Bonga, J. M., 1Durzan, D.J. 1987. Vegetative propagation in relation to juvenility, ma turity and rejuvenation. En: Tissue culture in forestry. Nijhoft /Junk (eds.). The Hage: 387-412.
- Boulay, M. 1987. In vitro propagation of tree species. En: Plant tissue culture and cell culture. De C. E. Green et al. Alan R. Liss, Inc. 367-382.
- Briscoe, B. C. 1995. Silvicultura y manejo de teca, melina y pochote. CATIE. Serie Técnica. Informe Técnico No. 270, Turrialba costa rica, 44 p.
- CamBioTec. 2003. La biotecnología en América Latina: Panorama al ario 2002. Verástegui, J. Ed. CamBioTec -- IDRC. Ottawa.
- Curtis, II. 2000. Biología. Editorial Médica Panamericana. Buenos Aires.
- De Peña, M. 2005. Informe de gestión. Febrero 2000 a enero 2005. Secretaría Técnica. Programa Nacional de Biotecnología. Colciencias.
- FAO. 1979. Mejoramiento genético de árboles forestales. Investigaciones y desarrollo industrial forestal. Bogotá, Colombia. 179 p.
- Gupta P. K. 1980. Tissue culture offorest trees: Clonal Multiplication of Tectona grandis (Teak) by tissue culture. Plant Science LeHers. 259-268p.
- Hartmann, T. H. Kesler, D. 1992. Propagación de plantas: principios y prácticas. Compañía Editorial Continental, 5. A. de C. V. México. 760 p.
- Hodson de Jaramillo, E., Forero, C. y Carrizosa, MS. 2003. "Políticas públicas en biotecnología agroalimentaria y bioseguridad en Colombia". Biotecnología: Políticas públicas y aceptación social en Argentina, Brasil, Chile, Colombia, Cuba, Ecuador, España y México. Subprograma III: Biotecnología.
- Kannan, V.R. et al. 1995. Clonal propagation and comparative analysis of free radical scavenging enzymes in vitro and in vivo tissues of Gmelina arborea R.V. En : In-vitro; N. 31 (3)2, 80A.
- Kannan, V.R. et al. 1996. Micropropagation of Gmelina arborea. En: Plant cell tissue organ culture, 46 (3)269-71.
- Lamprecht, H. 1990. Silvicultura en los trópicos. Deutsche Gesellschaft für technische Zusammenarbeit. Eschbom. 335 p.
- Lindsey, K. 1992. Biotecnología vegetal agrícola. Zaragoza. Editorial Acribia S.A. 277 p.
- Molish, H. 1938. The longevity of plants. Fulling, NY.
- Murillo, O. 1991. Colección de guías silviculturales- Melina (Gmelina arborea).CATIE, Turrialba, Costa Rica, 55 p.
- Margara, J. 1988. Multiplicación vegetativa y cultivo in-vitro. Mundi-Prensa. Madrid, España. 232 p.
- Parent, G. 1989. Guía de reforestación. Bucaramanga, Colombia. 125 p.
- Patiño,J. 1985. Los principales árboles de cada una de las formaciones vegetales de Colombia. Ministerio de Agricultura. Bogotá, Colombia.
- Pierik, R. L. 1990. Cultivo in vitro de plantas superiores. Mundi-Prensa. Madrid, España. 326 p.
- Pontificia Universidad Javeriana. 1992. Sistemas modelo para la micropropagación y conservación de especies forestales. Primera Etapa. En: Programa de Investigación en Biotecnología Forestal en Colombia. P. U. J & INDERENA. Bogotá, Colombia. 155 p.
- Roy, S. K. 1992. Shoot multiplication and plant regeneration from shoot tip of Gmelina arborea by in vitro culture. En: In vitro, 28(3)2, 116A.
- Tamas, I. A. 1987. Hormonal regulation of apical dominance. In: Plant Hormones and Their Role in Plant Growth and Development. P.J. Davies, Martinus Nijhoff Publishers. Alemania. Pp. 395-410.
- Trippi, V. 1982. Ontogenia y senilidad en plantas. Universidad Nacional de Córdoba,Córdoba. Argentina.
- Trippi, V. 1986. Aging of Meristems and Morfogenetic Potentialities. Laboratorio de fi siología vegetal. Universidad Nacional de Córdoba. Argentina. En: Plant aging. Plenum Press-New York and tondon. 1992.
- U. C. O. Universidad Católica de Oriente: 1997. Memorias Curso Nacional de Protección y Biotecnología Forestal. Fundación Buen Pastor. Rionegro, Antioquia. 216 p.
- Urueria, L. H. 1997. Gmelina arborea R. Nota de Investigación 24. Monterrey Forestal. Zambrano, Bolívar. 3 p.
- Vandame, C. 1988. Propagación de Tectona grandis Linneo f (Verbenaceae) por medio de cultivo de tejidos in-vitro. Trabajo de tesis. Pontificia Universidad Javeriana. Bogotá, Colombia. 208 p.
- Villalobos, V. 1983. Aplicaciones del cultivo de tejidos en especies forestales. En: Ciencia y Desarrollo. Julio-Agosto. Num. 51. Añ IV. México. 58 p.
- Zobel, B. 1992. Técnicas de mejoramiento genético de árboles forestales. Editorial Limusa S.A. Mexico D.F. 545 p.
Creation date:
License
Colombia Forestal retains the patrimonial rights (copyright) of the published works, and favors and allows the reuse of the same under the Creative Commons Attribution-ShareAlike 4.0 International license, so they can be copied, used, disseminated, transmitted and exhibited publicly, provided that:
You acknowledge the credits of the work in the manner specified by the author or licensor (but not in a way that suggests that you have their support or that they endorse your use of their work).














