DOI:
https://doi.org/10.14483/22484728.3746Publicado:
2012-06-13Número:
Vol. 6 Núm. 1 (2012)Sección:
Visión InvestigadoraAnálisis de la transposición didáctica del modelo científico para la electroquímica en textos de enseñanza
Analysis of the transposition didactic of the model for scientific electrochemistry on the teaching texts
Palabras clave:
Transposición didáctica, historia y epistemología, didáctica de la ciencia (es).Palabras clave:
Transposition of didactic history and epistemology, didactic of science (en).Descargas
Referencias
Y. Chevallard. La transposición didáctica. Del saber sabio al saber enseñado. Buenos Aires: Aique, 2005.
J. Cornejo. “El libro de texto de Ciencias Naturales como documento histórico”. Congreso de Promoción de la Lectura y el Libro. Buenos Aires: Fundación El Libro, OEI y Ministerio de Educación, Ciencia y Tecnología, 2005, pp. 219-223.
S. Gvirtz; A. Aisenstein; J. Cornejo y A. Valerani. “The natural sciences in the schools: Tension in the modernization process of Argentine society (1870- 1950)”. Science and Education, 10(6) (2001): 545-558.
G. M. Gándara; Q. M. Gil y P. Sanmarti. Del modelo científico de adaptación biológica” en los libros de texto de enseñanza secundaria obligatoria. Enseñanza de las ciencias, 20(2) (2002): 303-314.
J. Jiménez y J. Perales. “Aplicación del análisis secuencial al estudio del texto escrito e ilustraciones de los libros de física y química de la ESO”. Enseñanza de las Ciencias, 19 (1) (2001): 3-19.
F. Perales y J. D. Jiménez. “Las ilustraciones en la enseñanza-aprendizaje de las ciencias, análisis de libros de texto”. Enseñanza de las Ciencias, 20 (3) (2002): 369-386.
F. Cajas. Alfabetización Científica y Tecnológica: La Transposición didáctica del conocimiento tecnológico. Enseñanza de las Ciencias, 19 (2) (2001): 243-254.
C. González; S. García y C. Martínez. “¿A qué contenidos relacionados con la fotosíntesis dan más importancia los textos escolares de secundaria?” Enseñanza de las Ciencias, Número Extra (2001), VI Congreso.
L. Cuéllar F.; R. Gallego B. y R. Pérez M. “El modelo atómico de E. Rutherford. Del saber científico al conocimiento escolar”. Enseñanza de las Ciencias, 26(1) (2008): 45-32.
J. Camacho G.; R. Gallego B. y R. Pérez M. “La ley periódica. Un análisis histórico epistemológico y didáctico de algunos textos de enseñanza”. Educación Química, 18(4) (2007): 278-285.
R. Gallego Badillo. “Un concepto epistemológico de modelo para la didáctica de las ciencias experimentales”. Revista Electrónica de Enseñanza de las Ciencias, 3(3) (2004), art. 4. [En línea]. Disponible en: http://www.saum.uvigo.es/rec
M. del C. Herrera y C. Varela C. “Aplicación de una técnica de análisis textual a textos escolares sobre el sistema solar”. Revista Electrónica de Enseñanza de las Ciencias, 7(1) (2008), art.13. [En línea]. Disponible en: http://www.saum.uvigo.es/rec
M. Faraday. On electrical decomposition.Philosophical of the Royal Society. 1834. [En línea]. Disponible en: http//chem.ch.huji.ac.il/history/faraday.htm
J. Costa. La electroquímica: Cuando el pasado era presente. Departamento deQuímica Física, Facultad de Química, Universidad de Barcelona, 2005.
R. Muñoz y J. Bertomeau. “La historia de la ciencia en los libros de textos: La (s) hipótesis de Avogadro”. Enseñanza de las Ciencias, 21(3) (2003): 369-386.
Svante Arrhenius. “On the dissociation of substances dissolved in water”. Zeitschrift fur physikalische Chemie, I(631) (1887). [En línea]. Disponible en: http://dbhs.wvusd.k12.ca.us/webdocs/Chem-History/Arrhenius
N. Bjerrum. “A New Form for the Electrolytic Dissociation Theory”. Proceedings of the Seventh Internacional Congreso of Applied Chemistry Londres, 27 de mayo al 3 de junio de 1909, pp. 55-50. [En línea]. Disponible en: http://dbhs. wvusd.k12.ca.us/webdocs/Chem-History/Bjerrum-Strong-Electrolyte.html
P. Debye y E. Huckel. “On the theory of electrolytes. I. Freezing point depression and related phenomena”. Physikalische Zeitschrift, 24(9): 185-206. En línea:
O. Lombardi. “La noción de modelo en ciencias”. Educación en Ciencias, II(4-5) (2000).
L. Bardin. El análisis de contenido. Madrid: Akal, 1987.
L. Cuéllar F. “El modelo atómico de E. Rutherford. Del saber sabio al saber escolar”. Tesis de Maestría Universidad Pedagógica Nacional, Bogotá, 2004.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
VISIÓN INVESTIGADORA
Visión Electrónica, 2012-06-01 Volumen:6, Año:1 pág: 53–65
ANÁLISIS DE LA TRANSPOSICIÓN DIDÁCTICA DEL MODELO CIENTÍFICO PARA LA ELECTROQUÍMICA EN TEXTOS DE ENSEÑANZA
ANALYSIS OF THE TRANSPOSITION DIDACTIC OF THE MODEL FOR SCIENTIFIC ELECTROCHEMISTRY ON THE TEACHING TEXTS
Rosendo López G.
Ing. Químico, Universidad del Atlántico, Colombia. MSc. En enseñanza de la Química, Universidad Pedagógica Nacional, Colombia. Investigador Grupo SciBas Universidad Distrital Francisco José de Caldas. Docente Universidad Distrital Francisco José de Caldas. Correo: rlopezg@udistrital.edu.co
RESUMEN
El conocimiento científico clásico, llamado por Y. Chevallard [1] en el 2005 saber sabio, necesita de su recontextualización para ser llevado por los docentes al aula. En esta investigación se analizan –creando una metodología, como en la reconstrucción del modelo para los fenómenos de la electroquímica– los textos recomendados por los profesores de la Universidad Distrital Francisco José de Caldas y Pedagógica Nacional, pues no tienen en cuenta satisfactoriamente algunos aspectos relacionados con los artículos originales, donde se formuló el modelo científico para la electroquímica. La investigación adelantada fue base para la obtención del título de Magíster en Docencia de la Química por parte del investigador principal.
Palabras claveTransposición didáctica, historia y epistemología, didáctica de la ciencia.
.Abstract
The classic scientific knowledge, called by Y. Chevallard (2005), wisdom knowledge needs to be adapted within the real context before to bring it to the classroom by the teachers. This investigation pretends to analyzed and creates a methodology for rebuilding the model of the phenomenon of the electrochemical due to the suggest texts by the teacher of the Distrital University and National Pedagogical do not take into consideration some aspects related with the original articles where they were formulated some basic things of the scientific model for the electrochemical. The advanced research was the basis for obtaining the title of master in teaching chemistry, by the main investigator
Key WordsTransposition of didactic history and epistemology, didactic of science.
Introducción
El estudio de la confiabilidad de los textos de enseñanza se ha constituido en campo de investigación de la didáctica de la ciencia. Es así, por cuanto estos textos constituyen la herramienta más usualmente utilizada por los profesores en su ejercicio habitual. Algunos trabajos realizados ponen de presente que en la transposición didáctica [1] que realizan los autores de los textos, para convertir la ciencia de los científicos en ciencia escolarizada, acuden a analogías que eventualmente introducen errores conceptuales. Además presentan una ciencia desde la perspectiva positivista de la acumulación lineal de descubrimientos, versión esta que genera una imagen distorsionada de la historia.
De conformidad con lo anterior, el responsable de la presente investigación decidió seleccionar para este caso el desarrollo histórico epistemológico del modelo científico para los fenómenos de la electroquímica, desde los trabajos de Faraday (1791-1867) hasta lo elaborado por Debye-Huckel-Onsonger, con el propósito de precisar la estructura conceptual y metodológica del modelo que concluyó en la primera mitad del siglo XX y que la comunidad científica aceptó como explicación de los fenómenos de la electroquímica.
El propósito de este trabajo fue resolver los siguientes interrogantes: ¿Contemplan los textos seleccionados y recomendados el desarrollo histórico y epistemológico del modelo científico para los fenómenos electroquímicos? En relación con los textos originales en los que se propuso y se desarrolló el modelo, ¿hasta qué punto la transposición didáctica que se halla en la base de tales textos introduce errores conceptuales y metodológicos?
Los textos de enseñanza de las ciencias
Según J. Cornejo [2], además de la historia de la ciencia propiamente dicha, existe una disciplina relacionada que ha dado en llamarse la “historia de la enseñanza de la ciencia”, la cual estudia las modalidades, formas y características que la enseñanza de las disciplinas científicas han adoptado a lo largo de las épocas. A su vez, dentro de la historia de la enseñanza de la ciencia, el estudio comparado de manuales escolares y libros de texto desempeña un papel significativo.
Los libros de texto, además de cumplir con su función específica, son documentos históricos donde se reflejan la ciencia y la didáctica de cada época, junto con las vivencias experimentadas por cada autor en su particular contexto sociohistórico [2]. Esto ha resultado evidente en textos correspondientes a disciplinas de ciencias sociales, pero después de los trabajos de S. Gvirtz., A. Aisenstein., J. Cornejo y A. Valeri [3] se aplica también a los textos de ciencias naturales.
Con la introducción del problema de la transposición didáctica, el análisis de los textos en el campo de las ciencias de la naturaleza dio lugar a reconceptualizaciones [4-10]. Dichas reconceptualizaciones han planteado los siguientes interrogantes: ¿Qué imagen de cada ciencia transmiten los textos? ¿De qué manera la organización de los capítulos obedece o no a una reconstrucción histórica? ¿Qué concepción didáctica y de la enseñanza se impone a estudiantes y profesores? [11] Desde otra perspectiva, los maestros Herrera y Varela [12] centran su trabajo en el análisis textual, con el fin de establecer las relaciones entre los vocablos utilizados en textos para la enseñanza de las ciencias, y llaman a mejorar los textos escolares, pues, aunque en apariencia estén bien estructurados, las interrelaciones existentes entre los términos que los componen pueden inducir a errores conceptuales o a planteamientos inadecuados.
De conformidad con lo anterior, y hecha una revisión bibliográfica, hasta donde se puede afirmar, se encontró que para el modelo científico de los fenómenos de la electroquímica no se han realizado trabajos sobre el problema de la conversión de este saber sabio en saber enseñado, por lo que se puede considerar que esta investigación hace aportes, hasta cierto punto, a la base de datos acerca la transposición didáctica en ciencias.
Construcción histórica epistemológica del modelo científico
La institucionalización de la electroquímica está ligada a los trabajos iniciales de Michael Faraday (1791-1867), en los que formuló las leyes de la electrólisis [13]. Hay que mencionar también los estudios de Jhon Daniell (1790-1845), Johann Hittorf (1824-191499, Svante Arrhenius (1859-1972), Walter Nerst (1864-1941), Jacobus van ‘t Hoff (1852-1911), quienes supieron interpretar observaciones y sistematizar conceptos conducentes al desarrollo de los modelos sobre los cuales descansa la electroquímica [14].
Destáquese que en el Programa de Investigación (PID) de H. Davy (1778-1829) gravitaban dos grandes intereses: la electricidad y la química. Una de las predicciones del PID sostenía que materiales como la caliza, la magnesia, la potasa y la sosa contenían sustancias metálicas en sus estructuras, algo que hasta el momento no había podido demostrarse. El desarrollo del PID permitió a Davy diseñar y construir una batería con más de 250 placas metálicas con el fin de contrastar la hipótesis de la presencia de los elementos en compuestos anteriormente enlistados. En efecto, en 1807, la corriente que atravesó la potasa liberó un metal que Davy llamó potasio. Este experimento desencadenó otros en los que se pudieron aislar Sodio, Calcio, Estroncio y Bario.
Anótese que en 1813 Davy se hizo acompañar de Faraday en su gira por Europa, en París hicieron contacto con varios científicos, destacándose entre ellos A. Ampére (1775- 1836), cuyo programa de investigación estaba centrado en la estructura de las sustancias bajo el influjo de la filosofía empiromecanicista de R. Boyle (1627-1691), cuya explicación de la materialidad del mundo acudía en la existencia de partículas o corpúsculos microscópicos [15].
M. Faraday [13] plantea tres principios: 1. en la introducción del artículo, se establece una nueva taxonomía en el estudio de la electroquímica, y al formular los conceptos alude a ánodo, cátodo y electrolito; 2. lo que la mayoría de los textos de química llaman las leyes de Faraday, que plantean una relación directa entre la cantidad de electricidad y la electrodeposición hecha en los electrodos; 3. una descripción exhaustiva de lo que fue el experimento, presentando un dibujo de los montajes que utilizó en el laboratorio. De otra parte, explica cómo construyó los instrumentos y la forma cuidadosa como fue efectuado el experimento.
J. H. van 't Hoff (1852-1911) relacionó la termodinámica clásica con las reacciones químicas. Sus estudios sobre las propiedades de las disoluciones sirvieron de base a Svante Arrhenius (1859-1927) para escribir su artículo sobre la disociación de las sustancias disueltas en agua. En dicho artículo Arrhenius demuestra que la disociación de ciertas sustancias disueltas en agua depende de las propiedades eléctricas de ellas [16]. La hipótesis que surge de ahí es que, cuando se disuelve en agua un ácido, una base o una sal, una porción considerable de la misma se disocia espontáneamente en iones positivos y negativos. Estos iones se pueden mover independientemente y son guiados a los electrodos de signos opuestos por los efectos del campo eléctrico que se forma. Arrhenius parte del criterio de que la proporción de moléculas que se disocia en iones varía con la concentración, por lo que es factible calcular la fracción de moléculas disociadas. En el caso de las soluciones muy diluidas al límite, todas las moléculas de un electrolito están ionizadas. Esta concepción sirvió de base para calcular el denominado coeficiente de actividad de los electrolitos o grado de disociación.
Arrhenius, en su tesis doctoral, formuló la teoría de la disociación electrolítica. Esta teoría enuncia que en las disoluciones electrolíticas los compuestos químicos disueltos se disocian en iones. También sostuvo que el grado de disociación aumenta con el grado de dilución de la disolución, una hipótesis que posteriormente resultó ser válida solo para los electrolitos débiles. Más tarde, su modelo fue aceptado y finalmente se convirtió en una de las piedras angulares de la química física y la electroquímica moderna, convalidado por la comunidad científica. Así mismo, en 1889, Arrhenius demostró que la velocidad de las reacciones químicas aumenta con la temperatura, en una relación proporcional a la concentración.
De otra parte, N. Bjerrum [17] estableció una relación entre la disociación de un electrolito y el cambio de color de la solución, en función de la conductividad eléctrica. Sustentó lo anterior aludiendo a los experimentos que realizó con cloruro, nitrato y Sulfato de cromo, en los que encontró que estas sales en solución tienen exactamente la misma longitud de onda, sin importar la concentración. Puntualizó que esto sucede en el caso de electrólitos fuertes. Cuando se trata de los electrólitos débiles, este cambio de color depende de la concentración, concluyó, de modo que los electrólitos fuertes siempre están completamente separados en iones, razón por la cual tienen el mismo color en todas las concentraciones.
Por otro lado, Walther Nernst (1864-1941) realizó aportes al estudio de los equilibrios químicos y a la teoría de las disoluciones, en relación con la reflexión acerca de las propiedades atribuidas a los electrólitos. Desde la perspectiva termodinámica, formuló la ecuación que lleva su nombre.
Aspectos cuantitativos en el desarrollo del modelo científico en electroquímica
En una reconstrucción histórica del modelo científico para los fenómenos de la electroquímica, los planteamientos cuantitativos se hicieron en varias etapas. En la primera fase, acudiendo a la ley de Ohm. Si tenemos en cuenta que los estudios George Simon Ohm (1787-1854) ya eran conocidos, sobre todo, sus experimentos, publicados en 1825, sobre mediciones de corriente y tensiones, en donde subrayaba la disminución de la fuerza electromagnética que pasa por un conductor a medida que este se hacía más largo, Ohm (1827) expone toda su teoría sobre la electricidad, cuyo resultado más destacable fue el planteamiento de una relación fundamental entre la intensidad de la corriente, la diferencia de potencial y la resistencia.
Luego se relacionó la cantidad de electricidad y la velocidad de transporte, que permitió establecer el puente con la termodinámica, definiendo el trabajo eléctrico efectuado por una corriente de una intensidad determinada. Estas precisiones condujeron a la formulación de los conceptos de conductores eléctricos y conductores electrolíticos (soluciones electrolíticas fuertes y débiles, sales fundidas y algunas sales sólidas) con el fin de puntualizar que la transferencia electrónica tiene lugar por migración iónica positiva y negativa hacía los electrodos.
Se precisó, entonces, que las disoluciones, al igual que los conductores metálicos, obedecen la ley de Ohm, y que la conductividad es inversamente proporcional a la resistencia. Para los metales, la medida de la resistencia varía en relación directa con su longitud (cm) y es inversamente proporcional a su superficie A (cm2), de donde se desprende el concepto de resistencia específica y se sabe que existe conductividad específica para cada uno de los materiales, como una medida de la facilidad con que la corriente fluye.
En este punto del desarrollo histórico mediante representaciones gráficas se empezaron a formular y discutir los mecanismos sobre el trasporte de electrones e iones en las soluciones electrolíticas. De allí se concretó un primer modelo, expresado así: los electrones entran y salen de la soluciones como consecuencia de los cambios químicos que se realizan en los electrodos, y los electrones pasan por las soluciones debido a la migración iónica, de tal manera que el mismo número que entra es el que sale.
Este modelo fue reelaborado ante la conclusión de que, si bien la corriente se transporta a través de la solución por migración de iones positivos y negativos, la fracción total de corriente transportada por cada uno de estos iones no es necesariamente igual. Los iones que se mueven con mayor velocidad transportan la mayor fracción de corriente. Solo si todos los iones lo hicieran con la misma velocidad trasportarían la misma cantidad.
Se pasó entonces a formular matemáticamente la relación cuantitativa entre la fracción de corriente transportada por un ión y su velocidad de migración y los números de transporte o transferencia de cationes y aniones. El método que permite calcular los números de trasporte se conoce como la regla de Hittorff, que consiste en un balance de masas y cargas en los compartimientos anódicos y catiónicos, después de realizarse un proceso de electrólisis en el sistema; por tanto, la determinación experimental de los números de transferencia o números de transporte puede definirse como la fracción de corriente transportada por cada ión.
El problema siguiente fue medir la conductividad de las soluciones. Se concluyó que la conductividad específica no es una medida adecuada para el estudio del fenómeno de la conductividad de las soluciones electrolíticas. El perfeccionamiento del modelo requirió de la construcción del concepto de conductancia, con el objetivo de elaborar para las soluciones electrolíticas el de “conductancia equivalente”, muy relacionada con la concentración de las soluciones. La tarea que continúo fue la de determinación experimental de la conductancia, e intervino para este efecto C. Wheatstone (1802-1875) inventando el puente que lleva su nombre, que empleaba corriente directa.
Los experimentos llevados a cabo permitieron concluir que tanto la conductancia específica como la equivalente de una solución varían con la concentración. Así, para electrolitos fuertes la conductancia específica aumenta con la concentración, mientras que para los débiles se incrementa mucho más gradualmente. En cuanto a la conductancia equivalente de electrolitos fuertes y débiles, esta aumenta con la dilución.
F. Kohlrausch (1840-1910) fue el primero en señalar que, cuando la conductividad equivalente para electrolitos fuertes se gráfica contra la raíz cuadrada de las concentraciones, la curva obtenida se aproxima a la línea recta en soluciones diluidas. En una dilución infinita en la que la disociación de todos los electrolitos es completa, cada ión emigra independientemente de su coión.
Se requirió, entonces, de una modificación del modelo, que fue llevada acabo por Petrus J. W. Debye (1884-1966) y Erich. A. Hückel (1896-1980) en 1923, que explica la reacción química de los electrolitos en disolución. Debye-Huckel (1923) postularon que para explicar la atracción interiónica, cada ión se halla rodeado por una atmósfera de otros iones, cuya carga neta es opuesta a la del ion central. Cuando sobre los iones no hay una fuerza externa aplicada, esta atmósfera es esférica y simétricamente distribuida. Cuando dicha fuerza se aplica, se ponen en movimiento los electrones, cambian las distribuciones de las atmósferas electrónicas y se produce una disminución de las velocidades de los mismos. Los autores señalaron que estos efectos se deben a la relajación de la atmósfera iónica y al efecto electroforético. Primero, debido a que cada ion central y su atmósfera se hallan rodeados de cargas opuestas, por lo que la aplicación de un potencial produciría la migración del ion central en una dirección y de la atmósfera en otra.
L. Osanger (1926; 1927) hizo un tratamiento matemático en el que incluyó no solo la relajación y los efectos electroforéticos sino también el movimiento browniano de los iones, con lo cual derivó una ecuación de la dependencia de la conductancia equivalente de un electrólito binario con la concentración; ecuación que hoy es aplicable tanto a las soluciones acuosas como a los electrólitos fuertes en otros solventes.
Se sostiene en este artículo que la elaboración del modelo para explicar el comportamiento de las soluciones electrolíticas fue un proceso de obtención de conceptos hasta llegar al último modelo conocido como Debye-Huckel- Onsonger [18]. El autor de esta investigación resolvió realizar este artículo en el límite temporal de 1927, especificando para ese tiempo el modelo acerca de la electroquímica y los conceptos que este comprende para dar cuenta de los fenómenos que involucra.
La conclusión que se desprende de esta reconstrucción histórica es la de que a finales de la segunda década del siglo XX el modelo científico para la electroquímica que se elaboró era de carácter simbólico, basado en la axiomática de las matemáticas [19], que acude a representaciones gráficas o icónicas y también analógicas.
En un análisis crítico del modelo científico admitido para la electroquímica, sus predicciones solo se cumplen para soluciones en las que el solvente está “ligeramente contaminado” por el soluto, esto es, para soluciones extremadamente diluidas, por lo que es un modelo límite o ideal, como todos aquellos con los que construyen y trabajan las comunidades de especialistas.
Metodología. Análisis de contenido (AC)
La técnica empleada en el estudio de los textos es la del análisis de contenido (AC), cuya finalidad analítica, según L. Bardin [20], es la identificación y explicación de las representaciones cognitivas, que otorgan sentido a todo relato comunicativo. El AC es heredero de la antigua hermenéutica, que buscaba en los textos sagrados oscuros mensajes que acudían a una interpretación, pero la actitud interpretativa se mantiene en el AC.
Del conjunto de técnicas de AC, se empleó en este trabajo el análisis por categorías, que funciona por descomposición del texto en unidades de análisis (UA) o criterios. Teniendo en cuenta que las UA constituyen segmentos contenidos en los artículos originales, se trata entonces de cruzarlas con las categorías establecidas, con el fin de caracterizarlas.
Determinación de las categorías y las unidades de análisis
Desde la perspectiva de los textos, son concebidas algunas categorías (C) de análisis:
C1. De referencia a los trabajos realizados. Indaga por el desarrollo de antecedentes en la formulación del modelo para la electroquímica, tanto de índole teórica como experimental.
C2. De construcción colectiva del conocimiento. Intenta demostrar que la llegada al modelo científico para la electroquímica fue un proceso donde intervinieron varios científicos y no fue el producto de la genialidad de un individuo aislado.
C3. De afianzamiento del modelo de la electroquímica de acuerdo con los resultados experimentales y teóricos. Investiga los resultados empíricos que le dieron soporte al modelo.
C4. De flexibilidad interpretativa. Se tiene en cuenta esta categoría debido a que en la revisión histórico-epistemológica de los documentos originales, que deberían ser el sustento de los textos, hay diferentes interpretaciones en el sentido de que la ciencia no se ha construido por una única vía.
Las unidades de análisis (UA) se caracterizaron en las cuatro categorías escogidas producto del estudio de los documentos originales. Se seleccionaron diez UA o criterios, que fueron la base para el estudio de las transposiciones didácticas del modelo propuesto por los científicos en los libros de textos. Así:
UA1. Trabajos de Luigi Galvani (1737-1738) y Volta (1745-1827) como antecedentes de los trabajos de M. Faraday.
UA2. Se reconoce la electrólisis practicada por Humphrey Devy (1778-1829).
UA3. Un nuevo conjunto de conceptos para el modelo de la electroquímica propuesto por M. Faraday.
UA4. Formulación cuantitativa del modelo para la electroquímica acudiendo a la ley de Ohm.
UA5.Transferencia electrónica por migración iónica positiva y negativa hacia los electrodos.
UA6. Se registra que la fracción de corriente transportada no es igual para los iones y depende de la velocidad de estos.
UA7. Dependencia de la conductancia respecto de la concentración de la solución.
UA8. Movilidad iónica como responsable de la conducción de la electricidad por parte de los electrolitos (atracción interiónica).
UA9. Desarrollo histórico y colectivo para el modelo científico de la electroquímica.
UA10. Reformulaciones constantes del modelo de acuerdo con las investigaciones y las formulaciones teóricas.
Relación entre unidades de análisis y categorías
Categoría 1. Referencias a los trabajos realizados. En esta categoría pueden ser incluidas las unidades de análisis UA1 a UA4, teniendo en cuenta que fueron los pasos iniciales de la conformación del modelo científico de la electroquímica.
Categoría 2. Construcción colectiva del conocimiento. En esta categoría se incluyó la unida de análisis UA9. Se tiene en cuenta que la construcción del modelo científico para los fenómenos de la electroquímica fue producto de un cúmulo de investigaciones e investigadores, ya que la investigación científica no es actividad individual.
Categoría 3. De afianzamiento del modelo de la electroquímica de acuerdo con los resultados teóricos y experimentales. En esta categoría se encajaron las unidades de análisis UA5 a UA8, partiendo de la idea de que los diversos experimentos y formulaciones teóricas dieron como resultado práctico conceptos que se han mantenido, con el fin de darle sustento científico al modelo.
Categoría 4. Flexibilidad interpretativa. Esta categoría se relacionó con la unidad de análisis UA10. Se observa que no existe una visión absolutista del modelo para electroquímica, sino que hay diferentes interpretaciones y constantes reformulaciones.
Para seleccionar los textos se diseñó la entrevista, cuyos resultados se muestran en la Figura 1, a profesores de las universidades Pedagógica y Distrital. Hay que resaltar que tanto las categorías, las y unidades de análisis como las entrevistas fueron sometidas a la revisión de tres pares académicos, investigadores en didáctica de las ciencias. Las sugerencias fueron acogidas críticamente para la elaboración final y aplicación de estos instrumentos.
Figura 1. Porcentajes del comportamiento de los textos con relación a las evaluaciones.
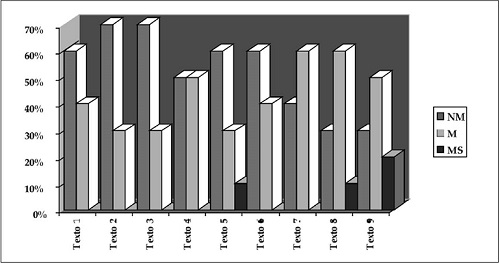
Tabla 1. Síntesis evaluativa de los libros de texto.
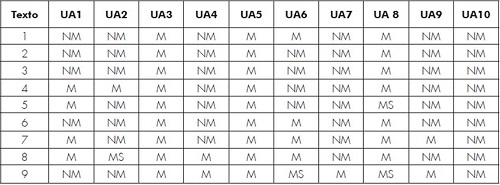
Fuente: elaboración propia del autor.
Además de lo anotado sobre la metodología, se acudió a las reflexiones del trabajo de Cuéllar Fernández [21], por lo que se adoptaron tres niveles de evaluación para cada una de las unidades de análisis o criterios:
No menciona (NM): cuando en el libro de texto no se hace ningún tipo de referencia ni se tienen en cuenta factores asociados a la unidad de análisis.
Menciona (M): cuando en el libro de texto se reconoce la situación a la que hace referencia la unidad de análisis y/o se tienen en cuenta factores asociados a dicha unidad. Menciona satisfactoriamente (MS): cuando en el libro de texto, además de referirse a la unidad de análisis de la que se trata, se desarrollan aspectos fundamentales que permiten establecer claramente el desarrollo históricoepistemológico en el que se identifican tópicos conceptuales y metodológicos para el desarrollo del modelo científico para la electroquímica.
Los resultados para cada una de las unidades de análisis con respecto a los textos que se hicieron objeto de investigación se recogen en la Tabla 1.
Para la Categoría 1, que corresponde a los procesos científicos con referencias históricas e involucra a las unidades de análisis UA1 a UA4, se obtienen las siguientes valoraciones. En la UA1, 55,5% de los textos analizados corresponden a la evaluación NM; 45,5% a la M y ninguno a la MS. En la UA2 ocurre un fenómeno similar: 77,7% de los textos estudiados corresponden a la evaluación NM, solamente 11,1% a la M, y el otro 11,1% a la MS. Para la UA3, 100% de los textos examinados obtuvieron la evaluación M. A la UA4 le corresponde: 77,7% a NM y el restante 22,3% a M.
Los libros de texto examinados, en su mayoría, no presentan la reconstrucción histórica de la elaboración de los conceptos que permitieron el desarrollo del modelo científico para la electroquímica con respecto a los artículos originales. Sin embargo, hay que resaltar, a la luz de la propuesta de M. Faraday, que en los textos analizados se mantienen sus conceptos, aunque casi siempre de forma descontextualizada.
Con respecto a la UA4 (formulación cuantitativa del modelo acudiendo a la ley de Ohm), 78% se clasifican como NM, algo para tener en cuenta en la utilización de los textos, puesto que en la revisión teórica se señala que la primera fase del modelo acude a la ley de Ohm. En lo concerniente a la Categoría 2, que compete a la unidad de análisis UA9, un 77,7% se evalúa como NM, un 22, 3% como M y no hay evaluación para el nivel de evaluación MS.
De estos resultados se infieren algunas reflexiones críticas, en el sentido de que en los textos estudiados omite cualquier referencia a la construcción colectiva del conocimiento en el estudio de los fenómenos que conllevaron al modelo científico de la electroquímica, prevaleciendo una concepción individual.
En atención a la Categoría 3, relacionada con el afianzamiento del modelo de la electroquímica de acuerdo con los resultados experimentales, que implica a las unidades de análisis UA5 a UA8, se presentan los siguientes resultados: En la UA5 la valoración M equivale al 100 %; en la UA6 la NM alcanza 44,44%, M llega a 44,44 % y MS a 11,12%. El 88,88% de la UA7 se evalúa NM y 11,12% como MS. En cuanto a la UA8, 77,77% corresponde a M, mientras que a la evaluación MS se asignó 22,23%.
De los datos obtenidos se destacan los siguientes aspectos: todos los textos analizados asumen la conducción de la electricidad por los electrólitos debido a la transferencia de electrones por migración iónica positiva y negativa hacía los electrodos.Los antecedentes obtenidos en UA6 nos obligan a reflexionar sobre los contenidos de los textos analizados, al no esclarecerse en esta unidad que la corriente transportada por cada uno de los iones no es igual, y que depende de las velocidades de cada uno de los iones.
La categoría 4, de flexibilidad interpretativa, referenciada con las diferentes versiones acerca del modelo para la electroquímica que involucra la unidad de análisis UA10, presenta una valoración del 100% en NM.
La interpretación de estos resultados tiene que ver con una deformación de los textos analizados, referente al modelo de la electroquímica en cuanto al desarrollo histórico y epistemológico del saber científico, presentándolo como algo completo y acabado conceptual y metodológicamente.
Conclusiones
Debido al carácter abierto de las entrevistas, no puede formularse un cuestionario formal. Las entrevistas de tipo abierto profundizan conceptos de las otras pruebas que requieren ampliación y permitan conocer mejor la concepción que tienen los entrevistados y las razones histórico-epistemológicas, didácticas y pedagógicas que tienen los profesores en ejercicio para escoger y recomendar uno o varios libros texto que aborden el modelo de la electroquímica. Algunas de las preguntas centrales para los docentes en ejercicio pueden formularse de la siguiente forma.
- De los textos que Usted emplea para trabajar con los estudiantes la unidad didáctica sobre electroquímica, ¿cuáles recomienda y por qué?
- Señale tres objetivos de formación y conocimiento que Usted persigue con la enseñanza de esa unidad.
- ¿Con qué perspectiva conceptual y metodológica desarrolla Usted esa unidad?
- ¿Qué tipo de aprendizaje espera de los estudiantes?
- ¿Considera Usted que los textos seleccionados y recomendados contemplan contextualizaciones históricas sobre el desarrollo de la electroquímica?
Los resultados obtenidos permiten subrayar que los 9 textos de electroquímica analizados:
Atkins, P. W. Fisicoquímica. México: Fondo Educativo Interamericano, 1985.
Brown, T. L.; H. E. Lemary y B. E. Bursten. Química. La ciencia central. México: Pearson, 1998.
Daub, G y W. Seese. Química. México: Prentice Hall, 1996.
Garzón, G. Química. México: McGraw Hill, 1986.
Levine, I. N. Fisicoquímica, vol. 2, 5 ed. México: McGraw Hill, 2004.
Maron, S y Prutton. Fundamentos de fisicoquímica. México: Limusa-Wiley, 1973.
Sienko, M. y Plane, R. Química. Madrid: Mc- Graw-Hill, 1971.
Umland, J y Bellana, J. Química general. México: Editorial Thomson. (2000).
Larena, A y Russel, J. A Química. España: McGraw-Hill, 1993.
no contribuyen a formar una imagen histórica de la construcción del modelo científico para los fenómenos de la electroquímica y más bien dejan una imagen de vacío en cuanto a los desarrollos históricos, con imprecisiones en las formulaciones de los conceptos en concordancia con el saber sabio, prevaleciendo una visión lineal de este desarrollo.
En cuanto a la génesis y la estructura del conocimiento, que va de la mano con la historia de la ciencia, no existen referencias significativas en los textos analizados, haciendo la excepción del texto 8, en el que se presenta un esbozo breve de historia de la química y se acepta que las teorías puedan representarse como modelos, que muchas veces están solo en la mente del investigador. En términos generales, se puede afirmar que no se manifiesta una preocupación por la producción del conocimiento científico, en lo atinente al modelo de la electroquímica, en sus aspectos lógicos, ideológicos, lingüísticos e históricos.
De conformidad con los datos obtenidos, y teniendo en cuenta una de las reflexiones del marco teórico, en la reconstrucción del modelo para la electroquímica, en la primera fase, la comunidad científica acude al modelo de la ley de Ohm, esta apreciación no se ve reflejada en los textos analizados, si tenemos en cuenta que la valoración en relación con esta temática se puntuó como NM en el 77,7% de los casos.
En los textos analizados predomina una visión de ciencia experimentalista, que promueve una versión de ciencia situada en el siglo pasado, es decir empiropositivista. Y la forma como está organizado el capítulo referente a la electroquímica en los textos analizados no favorece la compresión de las teorías formuladas en los artículos originales. El programa de investigación de Davy-Faraday, que estudia, entre otros, los fenómenos de la química y la electricidad y da origen a la electroquímica, no aparece, y cuando se hace alguna referencia es de forma marginal.
En el estudio de los documentos originales se coteja una agrupación de investigadores que se mueven alrededor de un programa de investigación que abarca los campos de la química y la electricidad con un líder distinguido, con un horizonte de intercambio de conocimiento con la comunidad científica local e internacional; estos hechos, que le dan al proceso del conocimiento científico connotaciones de trabajo comunitario o de construcción colectiva del conocimiento, no aparecen reflejados en los textos de estudio recomendados por los docentes.
Referencias
- Y. Chevallard. La transposición didáctica. Del saber sabio al saber enseñado. Buenos Aires: Aique, 2005.
- J. Cornejo. “El libro de texto de Ciencias Naturales como documento histórico”. Congreso de Promoción de la Lectura y el Libro. Buenos Aires: Fundación El Libro, OEI y Ministerio de Educación, Ciencia y Tecnología, 2005, pp. 219-223.
- S. Gvirtz; A. Aisenstein; J. Cornejo y A. Valerani. “The natural sciences in the schools: Tension in the modernization process of Argentine society (1870- 1950)”. Science and Education, 10(6) (2001): 545-558.
- G. M. Gándara; Q. M. Gil y P. Sanmarti. Del modelo científico de adaptación biológica” en los libros de texto de enseñanza secundaria obligatoria. Enseñanza de las ciencias, 20(2) (2002): 303-314.
- J. Jiménez y J. Perales. “Aplicación del análisis secuencial al estudio del texto escrito e ilustraciones de los libros de física y química de la ESO”. Enseñanza de las Ciencias, 19 (1) (2001): 3-19.
- F. Perales y J. D. Jiménez. “Las ilustraciones en la enseñanza-aprendizaje de las ciencias, análisis de libros de texto”. Enseñanza de las Ciencias, 20 (3) (2002): 369-386.
- F. Cajas. Alfabetización Científica y Tecnológica: La Transposición didáctica del conocimiento tecnológico. Enseñanza de las Ciencias, 19 (2) (2001): 243-254.
- C. González; S. García y C. Martínez. “A qué contenidos relacionados con la fotosíntesis dan más importancia los textos escolares de secundaria?” Enseñanza de las Ciencias, Número Extra (2001), VI Congreso.
- L. Cuéllar F.; R. Gallego B. y R. Pérez M. “El modelo atómico de E. Rutherford. Del saber científico al conocimiento escolar”. Enseñanza de las Ciencias, 26(1) (2008): 45-32.
- J. Camacho G.; R. Gallego B. y R. Pérez M. “La ley periódica. Un análisis histórico epistemológico y didáctico de algunos textos de enseñanza”. Educación Química, 18(4) (2007): 278-285.
- R. Gallego Badillo. “Un concepto epistemológico de modelo para la didáctica de las ciencias experimentales”. Revista Electrónica de Enseñanza de las Ciencias, 3(3) (2004), art. 4. [En línea]. Disponible en: http://www.saum.uvigo.es/rec
- M. del C. Herrera y C. Varela C. “Aplicación de una técnica de análisis textual a textos escolares sobre el sistema solar”. Revista Electrónica de Enseñanza de las Ciencias, 7(1) (2008), art.13. [En línea]. Disponible en: http://www.saum.uvigo. es/rec
- M. Faraday. On electrical decomposition.Philosophical of the Royal Society. 1834. [En línea]. Disponible en: http//chem.. ch.huji.ac.il/history/faraday.htm
- J. Costa. La electroquímica: Cuando el pasado era presente. Departamento de Química Física, Facultad de Química, Universidad de Barcelona, 2005.
- R. Muñoz y J. Bertomeau. “La historia de la ciencia en los libros de textos: La (s) hipótesis de Avogadro”. Enseñanza de las Ciencias, 21(3) (2003): 369-386.
- Svante Arrhenius. “On the dissociation of substances dissolved in water”. Zeitschrift fur physikalische Chemie, I(631) (1887). [En línea]. Disponible en: http:// dbhs.wvusd.k12.ca.us/webdocs/Chem- History/Arrhenius
- N. Bjerrum. “A New Form for the Electrolytic Dissociation Theory”. Proceedings of the Seventh Internacional Congreso of Applied Chemistry Londres, 27 de mayo al 3 de junio de 1909, pp. 55-50. [En línea]. Disponible en: http://dbhs. wvusd.k12.ca.us/webdocs/Chem-History/ Bjerrum-Strong-Electrolyte.html
- P. Debye y E. Huckel. “On the theory of electrolytes. I. Freezing point depression and related phenomena”. Physikalische Zeitschrift, 24(9): 185-206. En línea:
- O. Lombardi. “La noción de modelo en ciencias”. Educación en Ciencias, II(4-5) (2000).
- L. Bardin. El análisis de contenido. Madrid: Akal, 1987.
- L. Cuéllar F. “El modelo atómico de E. Rutherford. Del saber sabio al saber escolar”. Tesis de Maestría Universidad Pedagógica Nacional, Bogotá, 2004.
Creation date: Junio de 2012


.png)




.jpg)