DOI:
https://doi.org/10.14483/udistrital.jour.colomb.for.2006.1.a07Publicado:
01-01-2006Número:
Vol. 9 Núm. 19 (2006)Sección:
Artículos de investigación científica y tecnológicaAislamiento de Cepas de Microcyclus ulei en Colombia
Isolation of Microcyclus ulei Strains in Colombia
Palabras clave:
Aislamiento, cepas, Microcyclus ulei, Hevea brasiliensis, Guaduas, Cundinamarca, Colombia (es).Descargas
Referencias
Blásquez, C. & Owen, J. 1957. Physiological Studies of Dothidella ulei.
Compagnon, P. 1998. El caucho natural. Biología, cultivo y producción. Ed. Consejo Mexicano del Hule. Pp. 148-150.
Junqueira, N. 1985. Factores relacionados con la resistencia del caucho al mal de hojas. Investigación en curso, 54:1-6.
Langdon, K. 1961. Relative resistance or suceptibility of several clones ofHevea brasiliensis and Hevea benthamiana o two races of Dothidella ulei. Phytopatology, 54.
Langford, M. 1965. Enfermedades del jebe y recomendaciones para su control. Boletín. Tec. SIPA, 63.
Miller, J. 1966. Differential clones of Hevea for identifying races of Dothidella ulei. PL. Dis. Preptr, 50.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Artículos de investigación científica y tecnológica
Colombia Forestal, 2006-12-00 vol:9 nro:19 pág:126-135
Aislamiento de cepas de Microcyclus ulei en Colombia
Julia Andrea Pérez Rojas
japerezroj@unal.edu.co
Instituto de Estudios Ambientales IDEA
Javier Darío Burgos
Universidad Distrital Francisco José de Caldas
jdariob@udistrital.edu.co
Jaime Moreno G.
Universidad Distrital Francisco José de Caldas
jmoreno@udistrital.edu.co
Resumen
El estudio de las cepas del patógeno del caucho, conocido como Microcyclus ulei, es un paso fundamental para el establecimiento de cultivos extensivos de Hevea brasiliensis en Colombia, debido al enorme impacto de este hongo en cultivos extensivos de caucho en otros países latinoamericanos.
En el presente trabajo se desarrolla una metodología para aislar cepas de M ulei empleando medios de cultivo a base de papa, sacarosa, fosfato monobásico de potasio y una cuidadosa mezcla de aminoácidos. Además, para obtener mejores resultados, se hizo necesario emplear un segundo medio de cultivo, un medio de crecimiento, para facilitar el desarrollo del hongo in vitro y obtener colonias de mayor tamaño, de las cuales fue posible hacer posteriormente cepas monoconidiales para llevar a cabo los ensayos de infección en condiciones controladas de laboratorio.
Se obtuvieron en total 5 cepas: A-4d, AC-4d2, AC-4d5, AC-6d2, AC-1d, todas de la Biofábrica de Fedecaucho en Guaduas, Cundinamarca.
Palbras claves:
Aislamiento, cepas, Microcyclus ulei, Hevea brasiliensis, Guaduas, Cundinamarca, Colombia.
Abstract
The study of pathogenic fungi strains of Hevea brasiliensis, known as Microcyclus ulei, is a key step in order to establish extensive rubber plantations in Colombia, given the enormous impact that this pathogen exert over rubber plantations of other Latin amencan countries.
In this papen, we develop a method to isolate strains of M ulei using culture media bassed on potatoes, sugar and monobasic potasium phosphate and a carefully combined mixture of aminoacids. We found that, in order to obtain better results, it is necesary to use a second culture media, the growth media, which facilitates the growth and development with these two media, to isolate five strains of M ulei named A-4d, AC-4d2, AC-4d5, AC-6d2, AC-ld, all of them from Biofábrica de Fedecaucho en Guaduas, Cundinamarca.
Key words:
Isolate, strains, Microcyclus ulei, Hevea brasiliensis, Guaduas,Cundinamarca,Colombia.
INTRODUCCIÓN
El mal suramericano de la hoja de Hevea brasiliensis es, sin lugar a dudas, el agente patógeno más importante y devastador de estas plantaciones en América Latina.
El microorganismo causante de la enfermeclád es el hongo Ascomiceto Microcyclus ulei, caracterizado por su difícil aislamiento y muy lento crecimiento.
Para el establecimiento de plantaciones extensivas en el país, teniendo en cuenta los proyectos caucheros para la Orinoquia y otras regiones del país, es en extremo necesario determinar el número de cepas y su variabilidad fisiológica en Colombia, desarrollar métodos confiables y reproducibles para el aislamiento y crecimiento de Microcyclus ulei, y establecer una colección de cepas de referencia del hongo.
En el presente trabajo se dan las bases para aislar por primera vez en el país Microcyclus ulei a partir de material vegetal afectado en diferentes zonas. Además, se emplea un medio de cultivo complementario para el crecimiento del hongo.
Se obtuvieron inicialmente cinco cepas: A-4d, AC-4d2, AC-4d5, AC-6d2 y AC- ld de Microcyclus ulei de los clones GT1, RRIC110 e IAN873 provenientes del jardín clonal de FEDECAUCHO ubicado en el municipio de Guaduas, Cundinamarca.
Este estudio se desarrolló en el laboratorio de sanidad de CONIF, con muestras vegetales infectadas, colectadas en jardines clonales de Cundinamarca, Meta y Santander en los meses de septiembre y octubre de 2005.
OBJETIVOS
-- Establecer un protocolo para aislamiento y crecimiento de cepas de Microcyclus ulei.
-- Establecer una colección de referencia de Microcyclus ulei.
ANTECEDENTES
CICLO BIOLÓGICO DEL Microcyclus ulei
Microcyclus ulei, un hongo que pertenece a la clase de los Ascomicetos, presenta en su ciclo de vida tres estadios morfológicamente diferentes con tres tipos de esporas: conidias, ascosporas y picnidiosporas, los dos primeros ciclos tienen la función infectante.
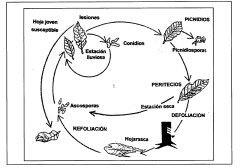
BIOLOGÍA DEL Microcyclus ulei
La forma perfecta se caracteriza por masas estromáticas carbonosas, ubicadas en la cara superior de las hojas, agrupadas unas contra otras y dispuestas en el margen de las lesiones antiguas y de los tejidos necrosados. Estas estructuras forman conceptáculos de 200-400 lam de diámetro, que se pueden fusionar lateralmente. Las paredes celulares del pseudoparénquima son espesas y oscuras. Las ascas en forma de maza, de 56-80 IAM* 12-16 pt,m, contienen 8 ascosporas oblongas, éstas son hialinas, claviformes, bicelulares, un poco estranguladas en el nivel del tabique, las ascosporas miden 12-20 µm x 2-5 µm
Los picnidios y los ascocarpos, agrupados en masas estromáticas pseudo parenquimatosas y carbonáceos de 120-160 µm. de diámetro, provistos-de una apertura en la periferia de los tejidos necrosados o en la extremidad de los limbos, contienen esporas hialinas de 6-10 µM de largo, hinchadas en sus dos extremidades en forma de alteras, que nacen sobre esporóforos de 12-20 µm x 2-3 µm, y son truncadas en una extremidad.
La forma imperfecta (conidiana) está caracterizada por manchas verde olivo o verdinegras en la cara inferior de las hojas jóvenes, redondeadas, dispersas, que se tornan irregulares por coalescencia, pueden alcanzar 2 Jim de diámetro y, cuando están maduras, llevan conidióforos que les dan un aspecto aterciopelado. Estos son pardos o negros, rectos, unicelulares o con tabiques, más anchos en su base, miden 140 µm de largo por 4-7µM de ancho.
Las conidias nacen sucesivamente en la extremidad de los conidióforos, son bicelulares, a veces unicelulares, hialinas en el principio, pasando al pardo oscuro, de forma elíptica. Las bicelulares miden 23-65 µm x 5-10 µm; las unicelulares alcanzan 15-34 µm x 5-9 µm y son rectas. La célula más ancha posee en su extremo una truncadura muy refractiva, punto de agarre sobre el conidióforo. Esta célula presenta también una curvatura característica (Compagnon, 1998).
CULTIVO In vitro DEL Microcyclus ulei
Los primeros cultivos in vitro de Microcyclus ulei los llevó a cabo Langford en 1945, usando malta y un extracto acuoso de hojas de Hevea. Blázquez & Owen (1957) obtuvieron crecimiento empleando un medio similar al de Langford.
En 1962 Jonge y Brookson (1963) obtuvieron cultivos a partir de conidias empleando ácido nicotínico y 1 - inositol en medios ricos en carbohidratos.
Langdon y Miller (1966) obtuvieron el patógeno por primera vez usando lesiones de hojas esterilizadas en medios ricos en aminoácidos, como glicina, leusina y ácido glutárnico.
La obtención de cultivos a partir de una sola ascoespora de apariencia uniforme se llevó a cabo empleando medios basados en PSA (papa, sacarosa) (Newsam, 1968; Taysum, 1996).
VARIABILIDAD DE Microcyclus ulei
Numerosos estudios han demostrado que existen gran cantidad de cepas de Microcyclus ulei, caracterizadas por diversos grados de virulencia, lo cual incide en la prevalencia y el grado de afectación del hongo sobre el Hevea brasiliensis.
La existencia de la variabilidad fisiológica del patógeno es admitida desde 1946 cuando Langdon (1961) notó la presencia de cepas de Microcyclus ulei atacando clones que se creían resistentes, como F409 y F1619, en la región de Santarém, Pará. El mismo autor, en 1961, observó la presencia de razas que atacaban progenies del clon F4542 en Costa Rica.
Langdfor (1965), en prácticas en la Universidad de la Florida, identificó por medio de inoculaciones dos razas de Microcyclus ulei trabajando con aislados de Guatemala y Costa Rica. También descubrió que un aislado del último infectaba y esporulaba abundantemente en todos los clones con germoplasma de F4542, siendo denominado de raza 2. Un aislado de Guatemala que no atacaba clones con germoplasma de F4542 (excepto el clon AlN 717) fue designado raza 1.
Miller (1966), en Florida, identificó dos razas del hongo: la 3 y la 4. La raza 3 proviene de Guatemala y Costa Rica, la cual no atacó progenies de F4542 en Madre de Dios, Perú. La raza 4, proveniente de Belén, norte del Brasil, atacaba los clones F409 y los padres de TAN 710 y TAN 713. Como resultado de ese trabajo,
Miller (1966) probó una serie de clones que servían de referencia para la identificación de razas fisiológicas de M ulei.
Junqueira (1985) estudió en Vicosa, Minas Gerais, una relación de 36 clones de caucho con 10 a 16 aislados de Microcyclus ulei provenientes de los estados de Bahía, Espíritu Santo, Minas Gerais, So Paulo, Mato Grosso, Amazonas, Rondonia, Acre y territorios de Amapá y Roraima. Los autores verificaron un grupo de cinco aislados, infectaron y esporularon abundantemente en todas las progenies de F4542, pero no esporularon en FX985 y MDF180, limitándose apenas a reacciones de hipersensibilidad.
Los aislados presentaron una gran variabilidad fisiológica. La virulencia de un aislado varió de acuerdo con el clon inoculado. Según Junqueira (1985), algunos de estos aislados son descritos de manera semejante a las razas definidas por Miller (1966).
A pesar del número reducido de trabajos que analizan la variabilidad de Microcyclus ulei para la virulencia de Hevea, se presume que la variabilidad es grande, siendo necesarias más investigaciones que confirmen esta teoría. Es necesario realizar investigaciones que procuren estudiar la capacidad de Microcyclus ulei en adquirir o mantener tal variabilidad, en especial sobre el tiempo que es necesario para adquirirla.
MATERIALES Y MÉTODOS
COLECCIÓN DE MATERIAL VEGETAL
Para colectar el material vegetal con fines de aislamiento y cultivo del patógeno, se tomaron muestras de todos los árboles afectados que han sido identificados previamente en el muestreo de prevalencia en los jardines clonales de:
- Fedecaucho, en el municipio de Guaduas, Cundinamarca.
- Cauchopar, en el municipio de Paratebueno, Meta.
- Jardín clonal de Campo Capote, Santander.
- Procaucho, en el municipio de Cimitarra,Santander.
De cada árbol afectado se tomó una muestra de cinco o más folíolos que tuvieran lesiones bien esporuladas. Se almacenaron en bolsas de papel debidamente marcadas, las cuales se colocaron al vacío en bolsas zipper, marcadas con el consecutivo que se llevará en la ficha 1, en la cual se consignaron los datos generales para el muestreo.
METODOLOGÍA DE AISLAMIENTO Y CULTIVO In vitro DE Microcyclus ulei
La estrategia para la obtención de cepas de Microcykus ulei tuvo dos pasos. El primero fue el uso de un medio de cultivo para aislamiento. El segundo consistió en el empleo de un medio para el crecimiento de las cepas aisladas que habían alcanzado un desarrollo de colonias de aproximadamente 2 mm.
Aislamiento
El aislamiento es la inoculación de las conidias tomadas a partir de foliolos que contienen lesiones esporuladas en el medio de cultivo (aislamiento).
Procedimiento
Para aislar las conidias de los folíolos, se conservaron secos y frescos para evitar la germinación de las conidias; la muestra de conidias se tomó raspando el foliolo con un estilete y se colocó en medio de aislamiento.
Previamente a la inoculación, el área de trabajo estuvo estrictamente desinfectada y se debió flamear el estilete cada vez que se llevaran al folíolo y la caja de Petri, para evitar la contaminación del medio.
Como los conidios son secos y polvorientos, se adhieren fácilmente al medio de cultivo. Los aislados se llevaron a incubación a 24°C; el periodo puede variar según el desarrollo de las conidias, manteniendo la identificación y rotulación de colección.
Se mantuvieron en el medio hasta que las conidias se desarrollaron aisladas de contaminantes procedentes del foliolo.
En casos en el que medio se desecara o contaminara, se trasplantó la colonia descontaminada a medio de aislamiento puro. Esto hizo que se fuera purificando la cepa.
Crecimiento
Las cepas aisladas que alcanzaron un desarrollo en crecimiento de más o menos 3 mm, se llevaron a medio de crecimiento y se incubaron a 24°C.
El trasplante al medio de crecimiento se hizo pasados de 8 a 10 días de la inoculación y se revisó periódicamente para evaluar su estado desarrollo y pureza.
Con la utilización de este medio se obtuvieron colonias limpias en las etapas iniciales del proceso.
Protocolo
El protocolo es la metodología que se emplea para la preparación de los medios, de éstos depende el desarrollo o no del patógeno. Se ajustó la cantidad de antibiótico obteniéndose un desarrollo puro de la cepa.
Medio de aislamiento
- Cocinar 250 g de papa descascarada en 700 ml de agua destilada.
- Después del cocimiento de la papa se pasa por un colador de tela fina, se deja enfriar y se mezcla con reactivos.
- En 200 ml de agua destilada, en un vaso de precipitados, mezclar los siguientes productos:
- 10 g de sacarosa
- 2g de fosfato de potasio monobásico (kh2PO4)
- 0,15g. cloramfenicol (disolver antes en1.5 ml de etanol) - Adicionar a la mezcla los aminoácidos en las siguientes proporciones:
- 1 ml de clorhidrato de lisina en concentración de 10.000 ppm
- 0,1 ml de triptófano en concentración de 2.500 ppm
- 0,1 ml de treonina en concentración de 2.500 ppm - Ajustar el pH de la solución a 5,0 t 0,2 con solución de HC1 1M.
- Agregar 20 g de Bacto-Agar y disolver.
- Completar el volumen a 1000 ml con agua destilada.
- Transferir la solución a vasos o cajas de Petri cubiertas, con una cantidad no mayor a 5mm, cubrir con papel aluminio y autoclavar a 121° C (1 atm) por 15 minutos.
- Una vez preparado el medio, se deja en prueba de esterilidad por 24 h a 25°C para certificar que no existe contaminación por otros hongos o bacterias.
- Después de solidificado, guardar en refrigerador hasta el uso.
Medio de crecimiento
- Cocinar 250 g de papa descascarada en 700 ml de agua destilada (aproximadamente 15-20 mm n en microondas).
- Después del cocimiento de la papa, se pasa por una tela fina, se deja enfriar y se mezcla con reactivos.
- En 200 ml de agua destilada, en un vaso de precipitados, mezclar los siguientes productos:
- 10 g de sacarosa
- 2 g de fosfato de potasio monobásico (KH2PO4)
- 0,10 g de cloramfenicol (disolver antesen 0.5 ml de alcohol) - Adicionar a la mezcla los aminoácidos en las siguientes proporciones:
- 1 ml de clorhidrato de lisina en concentración de 10.000 ppm
- 0,1 ml de triptófano en concentración de 2.500 ppm
- 0,1 ml de treonina en concentración de 2.500 ppm - Ajustar el pH de la solución para 5,00,2 con solución de HC1 1M.
- Agregar 20 g de Bacto-Agar y disolver.
- Completar el volumen a 1000 ml con agua destilada.
- Transferir la solución a vasos o cajas de Petri cubiertas con papel aluminio y autoclavar a 121° C. (1 atm) durante 15 minutos.
- Una vez preparado el medio, se deja 24 h en prueba de esterilidad a 25°C para certificar que no existe contaminación por otros hongos o bacterias.
- Después de solidificado, guardar en refrigerador hasta el uso.
RESULTADOS
Aislamiento y crecimiento de Microcyclus ulei "in vitro"
Durante la etapa de determinación del grado de prevalencia de M ulei para cada una de las zonas estudiadas, se colectaron foliolos afectados por la fase conidial del hongo para su aislámiento y cultivo in vitro.
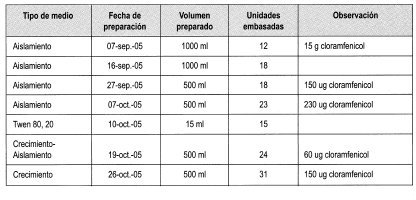
En la Tabla 1 se relacionan todas la fechas de preparación de medios de cultivo a partir del 7 de septiembre de 2005, cuando se hizo el primer ensayo de aislamiento del hongo, hasta el 26 de octubre, cuando se realizó el último. Se anotaron con cuidado las modificaciones al protocolo de aislamiento y crecimiento con relación a la concentración del antibiótico empleado, debido a que esta resulta determinante en el éxito del aislamiento.
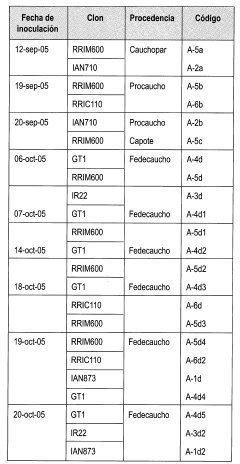
Las inoculaciones se llevaron a cabo como un primer paso para la obtención de cepas de M. ulei en el medio de aislamiento. Estas se hicieron siempre con foliolos frescos en etapa 4 de crecimiento. En la Tabla 3 se relacionan las fechas de inoculación, los clones y las procedencias de los cuales se tomaron los inóculos.
Para la identificación de cada uno de los aislados en laboratorio, se emplea la siguiente clave para asignar el código a cada muestra (Tabla 2).
La razón para anotar la fecha de inoculación es que sirve de guía adecuada para evaluar si los hongos que crecen en los medios de cultivo son M ulei, puesto que su crecimiento debe ser bastante lento de acuerdo con las descripciones de la literatura internacional.
El código asignando a cada muestra representa el medio de inoculación, el clon y su procedencia. Por ejemplo, A-2b, es el clon 2 de la procedencia b; A es el medio de aislamiento.
La Figura 2 muestra como se llevó a cabo la inoculación para el aislamiento (a y b). El desarrollo conidial (c) se obtiene para llevarla a la fase de crecimiento.
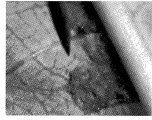
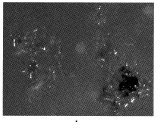
La Tabla 4 relaciona los aislados en medio de crecimiento a partir de hongos cuya morfología y tiempo de crecimiento parecían ser M ulei. Cabe anotar que los aislados que dieron buenos resultados (R en la columna de observaciones) procedían de los clones colectados en la Biofábrica de Fedecaucho.
En cinco oportunidades se realizó cultivo en etapa de crecimiento, con tan solo cinco clones, de los cuales solo tres se desarrollaron y formaron una colonia.
Colección de referencia de Microcyclus ulei
A partir de los inóculos en crecimiento se obtuvieron finalmente 19 colonias de M ulei pertenecientes a 3 clones agrupados en cinco cepas (Tabla 5).
Las cepas que se obtuvieron proceden de la Biofábrica de Fedecaucho en el municipio de Guaduas. En esta zona la escala de afectación es tan alta que la infección está presente en todas sus fases de desarrollo, facilitando así la colección de muestras adecuadas. Las fotografías que siguen (Figura 3) muestran al hongo en sus fases iniciales de crecimiento in vitro.


ANÁLISIS DE RESULTADOS
El aislamiento se dificulta en las etapas iniciales debido a la variedad en las características de desarrollo del hongo en los diferentes huertos que se visitaron; en consecuencia hubo un grado alto de variabilidad en las inoculaciones con respecto al tipo de parásito que se desarrollaba.
Al ser el Microcyclus un patógeno de lento crecimiento, cuando se cultiva in vitro se facilita en gran medida la invasión por otro tipo de microorganismos. Para evitar la contaminación, se hicieron ajustes en la preparación de los medios, sobre todo en lo que respecta con la concentración del antibiótico.
Una vez realizados los ensayos de inoculación, se descubrió que el medio con 0.05 g de cloramfenicol resulta inconveniente, pues no evita la contaminación con otros microorganismos, lo que causó muchas pérdidas en aislados.
Los ensayos en los que la concentración de antibiótico fue 150 ug evitaron la contaminación; además, se observó que el Microcyclus se desarrolla en un intervalo de 4 a 6 días.
Al estandarizar el protocolo de los medios, los aislados presentaban mejores resultados al permitir observar y evaluar solo el Microcyclus ulei.
El hecho de que de algunas procedencias no se obtuvieron cepas puras, se puede atribuir al rápido desarrollo en fase conidial del patógeno en campo, que ocurre de 2 a 3 semanas, y está condicionado por los periodos húmedos y secos.
En zonas donde el hongo es muy abundante y se tiene gran variedad de clones en una área reducida (lha), siempre se encontró Microcyclus en etapa conidial; es el caso de Paratebueno y Guaduas, donde el hongo se dispersa de un clon a otro en su ciclo de vida sin correlacionarse con la época del año.
En Procaucho, el jardín tiene de 5 a 7 ha y los bloques por clon son extensos; allí se presentó M ulei solo en el vivero en tierra. En los individuos de un ario no se presenta, pero el hecho de que los patrones presentan Microcyclus indica que se deben evaluar las plantaciones y las procedencias de la semilla para evitar un ataque masivo. El clima de esta zona presenta temperaturas mayores de 26.75°C, factor que puede influenciar directamente el desarrollo del M ulei.
Dada la baja prevalencia de infección en Capote y el estado de inmadurez y desecamiento del patógeno en la zona, no fue posible aislar el hongo para su posterior cultivo en esta región.
CONCLUSIONES
El aislamiento del Microcyclus ulei depende directamente del grado de desarrollo de la muestra tomada en campo, ya que tiene baja viabilidad y se contaminan con gran facilidad al no encontrarse en hojas en etapa cuatro de desarrollo.
Los inóculos que se realizaron fueron exitosos en la medida en que el desarrollo del patógeno era más joven y las hojas afectadas colectadas se mantenían a una temperatura de 18°C y con baja humedad relativa.
El aislado de Microcyclus. ulei se desarrolló de acuerdo con las experiencias reportadas por Langford, de cuatro a seis días en medio de aislamiento.
Se obtuvo la misma morfología reportada en los estudios de aislamiento realizados a escala mundial, en los que se desarrolla en primer lugar como un punto apenas visible en 40x y va desarrollando los micelios en forma enmarañada hasta conformar una colonia verde oscura en montañas conáceas.
La metodología de obtención de las conidias determina el éxito en el aislamiento de Microcyclus ulei porque, debido a la morfología del patógeno, cuando se hacen las siembras in vitro no se pueden llevar los cuerpos (Hifas), pues estos inducen el desarrollo de contaminación por bacterias y otros microorganismos que acompañan al Microcyclus sobre la superficie del foliolo.
Se encontró una variabilidad significativa en las esporulaciones de las muestras de Microcyclus ulei tomadas en campo.
REFERENCIAS BIBLIOGRÁFICAS
- Blásquez, C. & Owen, J. 1957. Physiological Studies of Dothidella ulei.
- Compagnon, P. 1998. El caucho natural. Biología, cultivo y producción. Ed. Consejo Mexicano del Hule. Pp. 148-150.
- Junqueira, N. 1985. Factores relacionados con la resistencia del caucho al mal de hojas. Investigación en curso, 54:1-6.
- Langdon, K. 1961. Relative resistance or suceptibility of several clones ofHevea brasiliensis and Hevea benthamiana o two races of Dothidella ulei. Phytopatology, 54.
- Langford, M. 1965. Enfermedades del jebe y recomendaciones para su control. Boletín. Tec. SIPA, 63.
- Miller, J. 1966. Differential clones of Hevea for identifying races of Dothidella ulei. PL.Dis. Preptr, 50.
Creation date:
Licencia
Colombia Forestal conserva los derechos patrimoniales (copyright) de las obras publicadas, y favorece y permite la reutilización de las mismas bajo la licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional por lo cual se pueden copiar, usar, difundir, transmitir y exponer públicamente, siempre que:
Se reconozcan los créditos de la obra de la manera especificada por el autor o el licenciante (pero no de una manera que sugiera que tiene su apoyo o que apoyan el uso que hace de su obra).