DOI:
https://doi.org/10.14483/udistrital.jour.colomb.for.2012.2.a08Publicado:
01-07-2012Número:
Vol. 15 Núm. 2 (2012): Julio-DiciembreSección:
Artículos de investigación científica y tecnológicaDEPREDACIÓN DE LAS SEMILLAS DE Sapindus saponaria L. POR Leptostylus gibbulosus Bates (COLEOPTERA: CERAMBYCIDAE) Y SU EFECTO EN LA GERMINACIÓN
Seed predation of Sapindus saponaria L. by Leptostylus gibbulosus Bates (Coleoptera: Cerambycidae) and its effects on germination
Palabras clave:
fruit predation, pre-dispersion predation, seed predation, incidence, severity, germinative fitness. (en).Palabras clave:
depredación de frutos, depredación predispersiva, depredación de semillas, incidencia, severidad, vigor germinativo. (es).Descargas
Referencias
Abreu, O. (2005). Potencial medicinal del genero Sapindus L. (Sapindaceae) y de la especie Sapindus saponaria L. Revista Cubana Plantas Medicinales, 10(3-4), 10-20.
Alcaldía de Anolaima. (2008). Plan de desarrollo económico, social y de obras públicas del municipio de Anolaima, Cundinamarca, 2008-2011 “Administración activa, comprometida y solidaria”. Anolaima: Alcaldía de Anolaima 215 p.
Antillón, C., Arguedas, M., & Miller, C. (1995). Insectos depredadores de semillas forestales en Costa Rica. En R. Salazar (ed.). Memorias de simposio sobre avances en la producción de semillas forestales en América Latina (pp. 295-302). San José de Costa Rica: CATIE.
Arbeláez, E. (1996). Plantas Útiles de Colombia. Texas: Sucesores de Rivadeneyra. 831p.
Armenta, A., Camacho, J., & Apodaca, M. (2009). Control de plagas de granos almacenados con insecticidas biorracionales en el Norte de Sinaloa (Tecnología de Granos y Semillasos: Serie agricultura). México: Universidad Autónoma Indígena de México 129-140
Baker, H.G. (1972). Seed weight in relation to environmental conditions in California. Ecology, 53(6), 997-1010.
Barrera, J.F., Herrera, J., & Gómez, J. (2008). Fluctuación de la población de adultos de Rhabdopterus jansoni (Jacoby) (Coleóptera: Chrysomelidae) en cafetales del Soconusco, Chiapas, México. Entomología Mexicana, 7, 246-251.
Baskin, C.C., & Baskin, J.M. (1998). Seeds - ecology, biogeography, and evolution of dormancy and germination. London: Academic Press. 666 p.
Berkov, A., & Tavakilian, G. (1999). Host utilization of the Brazil nut family (Lecythidaceae) by sympatric wood-boring species of Palame (Coleoptera, Cerambycidae, Lamiinae, Acanthocinini). Biological Journal of the Linnean Society, 67, 181-198.
Boe, A.B., McDaniel, B., & Robbins, K. (1988). Patterns of American licorice seed predation by Achanthocelides aureolus (Horn.) (Coleoptera: Bruchidae) in South Dakota. Journal Range Manage, 41, 342-345.
Bonilla, C., Carmen, R., Kadaffi, L., Sánchez, O., Manuel, S., & Escobar, R. (2007). Morfoanatomía y respuesta fisiológica de las semillas de chambimbe a condiciones de crioconservación. Acta Agronómica, 56 (3), 135-140.
Bonner, F.T., Vozzo, J.A., Elam, W.W., & Land, S.B. (1994). Tree seed Technology training course, instructor manual. New Orleans: United States Department of Agriculture. 162 p.
Briones, M. (2005). Supuestos del análisis de varianza. Recuperado de http://www.docstoc.com/docs/105037442/supuestos-del-analisis-de-varianza.
CATIE. (2000). Manejo de semillas de 100 especies forestales de América Latina (Serie Técnica, Manual Técnico No. 41). Turrialba: CATIE-PROSEFOR-DFSC. 204 p.
Cordazzo, C.V. (2002). Effect of seed mass on germination and growth in three dominant species in southern Brazilian Coastal dunes. Brazilian Journal Biology, 62(3), 427-435.
Csóka, G., & Hirka, A. (2006). Direct effects of carpophagous insects on the germination ability and early abscission of oak acorns. Acta Silver Lign Hungry, 2, 57-68.
Cuya, O., & Lombardi, I. (1991). Influencia del tamaño de semilla en la germinación y crecimiento de plántulas de Schinus molle. Revista Forestal del Perú 18(2), 17-27.
Chacoff, N.P., Morales, J., & Vaquera, M. (2004). Efectos de la fragmentación sobre absorción y depredación de semillas en el Chaco Serrano. Biotropica, 36(1), 109-117.
Dalling, J.W. (2002). Ecología de semillas. En M.R. Guariguata & G.H. Kattan (eds.). Ecología y conservación de bosques neotropicales (pp. 345-375). Texas: Libro Universitario Regional.
De Noir, A., Bravo, S., & Abdala, R. (2002). Mecanismos de dispersión de algunas especies de leñosas nativas del Chaco Occidental y Serrano. Quebracho, 9, 140-150.
Díaz-Fleischer, F., Hernández-Arellano, A., Sánchez-Velásquez, L., Cano-Medina, T., Cervantes-Alday, R., & López-Ortega, M. (2010). Investigación preliminar de la depredación de semillas en la germinación de las bellotas de Quercus candicans Née. Agrociencia, 44, 83-92.
Frausin, G., Trujillo, E., Correa, M., & Gonzalez, V. (2008). Seeds used in handicrafts manufactured by an Emberá-katío indigenous population. Caldasia, 30 (2), 315-323.
Gittins, C., Chartier, M., Ghermandi, L., & Guthmann, N. (2003). Predación predispersiva de semillas de Fabiana imbricata (Solanaceae), un arbusto del noroeste de la Patagonia. Ecolgía Austral, 13, 121-126.
González, M. (2008). Bioestadística: estadística descriptiva. España: Universidad de Extremadura. 37 p.
Guarin, G., Santana, A., & Silva, R. (2000). Notas etnobotánicas de especies de Sapindaceae Jusieu. Acta Botanica Brasilica, 14, 327-334.
Haro, J.M., & Perez, M.J. (2010). Problemas isoperimétricos. Revista Programas, 2, 1-9.
Harper, J., Lovell, H., & Moore, G. (1970). The shapes and sizes of seeds. Annual Review Ecology Systematica, 1, 327-356.
Havely, G. (1974). Effects of gazelles and seed beetles (Bruchidae) on germination and establishment of Acacia species. Israel Journal of Botany, 23, 120-126.
Heithaus, E.R., Stashko, E., & Anderson, P.K. (1982). Cumulative effects of plant-animal interactions on seed production by Bauhinia ungulata, a Neotropical legume. Ecology, 63, 1294-1302.
Hernandez-Jaramillo, A., & Pinzón, O.P. (2010). Observaciones preliminares de la biología de Leptostylus gibbulosus Bates (Coleoptera: Cerambycidae) y daños en semillas de Sapindus saponaria L. Bogotá: XXXVII Congreso de la Sociedad Colombiana de Entomología, SOCOLEN. 49 p.
Hobbs, T., & Young, T.P. (2001). Growing valley oak. Ecology Restoration, 19, 165-171.
Holdridge, L.R. (1947). Determination of world plant formations from simple climatic data. Science, 105(2727), 367-368.
Janzen, D.H. (1971). Seed predation by animals. Annual Review of Ecology and Systematics, 2, 465-492.
Jarma, A., Arbeláez, J., & Clavijo, J. (2007). Germinación de Ischaemum rugosum Salisbury en respuesta a estímulos ambientales y químicos. Temas Agrarios, 12(2), 31-41.
Jiménez, S., Zaragoza, C.A., & Noguera, F. (2009). Variación temporal de la diversidad de estafilínidos (Coleoptera: Staphylinidae) nocturnos en un bosque tropical caducifolio de México. Revista Mexicana de Biodiversidad, 80, 157-168.
Jozivan, F., Teixeira, E., Diniz, M. L., & Costa, T. (2008). Extractos vegetales en el control de plagas. Revista Verde, 3(3), 1-5.
Kikuzawa, K., & Koyama, H. (1999). Scaling of soil water absorption by seeds: an experiment using seed analogues. Seed Science Research, 9, 171-178.
Larrain, P. (2002). Incidencia de insectos y ácaros plagas en pepino dulce (Solanum muricatum Ait.) cultivado en la IV región, Chile. Agricultura Técnica, 62(1), 15-26.
Leishman, M.R., Wright, I.J., Moles, A.T., & Westoby, M. (2000). The evolutionary ecology of seed size. En M. Fenner (ed.). Seeds: The ecology of regeneration in plant communities (pp. 31-57). Wallingford: CABI Publishing.
Lorenzi, H. (1992). Árvores brasileiras: Manual de identificación e cultivo de plantas arbóreas Nativas do Brasil. Nova Odessa: Plantarum. 352 p.
Mack, A. (1998). An advantage of large seed size: tolerating rather than succumbing to seed predators. Biotropica, 30, 604-608.
Martínez, A., Hernández, L., Osorio, R., Alia, I., Lopez, V., Bautista, S., & Guillen, D. (2008). Incidencia y severidad de Botryodiplodia theobromae en frutos de zapote mamey en Jalpa de Mendez, Tabasco, México. Revista UDO Agrícola, 8(1), 29-32.
Méndez, M., Dorantes, A., Dzib, G., Argáez, J., & Durán, R. (2006). Germinación y establecimiento de plántulas de Pterocereus gaumeri, una cactacea columnar, rara y endémica de Yucatán, México. Boletín de la Sociedad Botánica de México, 79, 33-41.
Milberg, P., Anderson, L., Elfverson, C., & Regner, S. (1996). Germination characteristics of seeds differing in mass. Seed Science Research, 6, 191-197.
Morandini, M., & de Viana, M. (2009). Depredación pre-dispersiva de semillas en tres poblaciones del árbol Enterolobium contortisiliquum (Fabaceae). Revista de Biología Tropical, 57:(3), 781-788.
Nevarez, A., & Cox, R.D. (2000). Medicinal plants of the southwest. New Mexico State University. Recuperado de http://medplant.nmsu.edu/.
Noguera, F., Zaragoza-Caballero, A., Chemsak, S., Rodríguez-Palafox, J.A., Ramírez, A., González-Soriano, E., & Ayala, R. (2002). Diversity of the family Cerambycidae (Coleoptera) of the tropical dry forest of Mexico, I. Sierra de Huautla, Morelos. Annals of the Entomological Society of America, 95(5), 617-627.
Peck, D.C., Pérez, A.M., Medina, J.W., Barrios, M., & Rojas, J. (2003). Fenología de Aeneolamia reducta en la costa Caribe de Colombia. Pasturas Tropicales, 24(1), 39-55.
Posada, L. (1989). Lista de insectos dañinos y otras plagas en Colombia (Boletín Técnico 43). Bogotá: ICA. 350 p.
Rodríguez, K., Rivero, R., & García, C. (2002). Estudio de la incidencia de los principales patógenos en semilla de papa (Rhizoctonia, Rosellinia, Spongospora, Erwinia, Streptomyces y Verticillium). Bogota: Universidad Nacional de Colombia. 19 p.
Rohner, C., & Ward, D. (1999). Large mammalian herbivores and the conservation of arid Acacia stands in the Middle East. Conservation Biology, 13, 1162-1171.
Romero, N., Chemsak, J., & Rodriguez, C. (2007). Some notes on natural hystory and Distribution of Leptostylus gibbulosus Bates, 1874 (Coleoptera: Cerambycidae). Acta Zoológica Mexicana, 23(1), 171-173.
Romero, G., Romero, J., Ramos, R.Y., Burgos, A., Valdez, J., & Flores, A. (2009). Gorgojos de la familia Bruchidae (Coleoptera) asociados a semillas de plantas silvestres destinadas para germoplasma. Boletín Sociedad Entomológica Aragonesa, 44, 333-342.
Sánchez, J., Flores, J., & Martinez, E. (2006). Efecto del tamaño de semilla en la germinación de Astrophytum myriostigma Lemaire (Cactaceae), especie amenzada de extinción. Interciencia, 31(5), 371-375.
Sánchez, J., & Silva, L. (2008). Estudio silvicultural de la especie Sapindus saponaria L. (Jaboncillo) como base para su aprovechamiento silvoindustrial. Colombia Forestal, 11, 71-81.
SPSS [Statistical Package for the Social Sciences]. (2008). Statistical package for the social sciences (Versión 17 para Windows). Recuperado de http://www.spss.com.
Steeves, R., Nazari, V., Landry, J., & Lacrolx, C. (2008). Predispersal seed predation by a coleophorid on the threatened Gulf of St. Lawrance aster. The Canadian Entomologist, 140(3), 297-305.
Teketay, D., & Ganstrom, A. (1997). Germination ecology of forest species from the highlands of Ethiopia. Journal Tropical Ecology, 13, 805-831.
Traveset, A. (1991). Pre-dispersal seed predation in Central American Acacia farnesiana: factors affecting the abundance of co-occurring bruchid beetles. Oecologia, 87, 570-576.
Tsuzuki, J., Svidzinski, T., Shinobu, C., Silva, L., Rodrigues-Filho, E., Cortez, D., & Ferreira, I. (2007). Antifungal activity of theextracts and saponins from Sapindus saponaria L. Anais da Academia Brasileira de Ciencias, 79(4), 577-583.
Tungate, K.D., Susko, D.J., & Rufty, T.W. (2002). Reproduction and offspring competitiveness of Senna obtusifolia are influenced by nutrient availability. New Phytologist, 154(3), 661-669.
Vallejo-Marin, M., Dominguez, C., & Dirzo, R. (2006). Simulated seed predation reveals a variety of germination responses of neotropical rain forest species. American Journal of Botany, 93(3), 369-376.
Villela, C. (2005). Tamizaje fitoquímico del fruto del árbol de la Sapindus saponaria (Jaboncillo), identificando las principales familias de metabolitos secundarios, en muestras provenientes de Cunén, departamento del Quiché, Guatemala. Quiché: Universidad de San Carlos de Guatemala.185 p.
Zhang, J., Drummond, F., Liebman, M., & Hartke, A. (1997). Insect predation of seeds and plant population dynamics. Orono: University of Maine. 32 p.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
DEPREDACIÓN DE LAS SEMILLAS DE Sapindus saponaria L. POR Leptostylus gibbulosus Bates (COLEOPTERA: CERAMBYCIDAE) Y SU EFECTO EN LA GERMINACIÓN
Seed predation of Sapindus saponaria L. by Leptostylus gibbulosus Bates (Coleoptera: Cerambycidae) and its effects on germination
Alma Hernandez-Jaramillo1, Olga Patricia Pinzón2 & Ángela Parrado-Rosselli3
1Universidad Distrital Francisco José de Caldas. Bogotá, Colombia. almahernandez.jaramillo@gmail.com. Autor para correspondencia
2Universidad Distrital Francisco José de Caldas. Bogotá, Colombia. opatriciap@udistrital.edu.co
3Universidad Distrital Francisco José de Caldas. Bogotá, Colombia. aparrador@udistrital.edu.co
Recepción. 6 de octubre de 2012 / Aprobación. 30 de noviembre de 2012
RESUMEN
La depredación de semillas es considerada como un proceso selectivo que puede disminuir el éxito reproductivo de las plantas. Para caracterizar la depredación por el cerambícido Leptostylus gibbulosus y su efecto en la germinación, se examinaron frutos y semillas de Sapindus saponaria recolectados durante los años 2009 y 2010 en el municipio de Anolaima. Para tal fin, se evaluó la relación entre la incidencia y la severidad del ataque y el tamaño de los frutos y semillas. Se encontró que L. gibbulosus afectó 20 % de las semillas, prefiriendo semillas grandes y redujo considerablemente la germinación, siendo su efecto más notorio en las semillas de menor tamaño. Se registra por primera vez para Colombia la ocurrencia del longicornio, L. gibbulosus asociado a semillas de S. saponaria.
Palabras clave: depredación de frutos, depredación predispersiva, depredación de semillas, incidencia, severidad, vigor germinativo.
ABSTRACT
Seed predation has been considered as a selective process that decreases reproductive fitness of plant species. Fruits and seeds of Sapindus saponaria collected in Anolaima town, between 2009 and 2010 were used to characterize predation of Leptostylus gibbulosus (Cerambycidae) and its effects on germination based on the relation within incidence and severity attack and size of fruit and seeds. Results show that L. gibbulosus affected 25 % of seed under study and considerably reduced germination and reproductive fitness of predated seeds, principally in large seeds. The association between L. gibbulosus and S. saponaria seeds is registered for the first time in Colombia.
Key words: fruit predation, pre-dispersion predation, seed predation, incidence, severity, germinative fitness.
INTRODUCCIÓN
La capacidad de reproducción y la propagación de las plantas pueden ser alteradas por la depredación que llevan a cabo distintos agentes naturales, tales como insectos, aves y mamíferos (Janzen, 1971). La depredación puede causar la pérdida constante de semillas, reducir su viabilidad y restringir el establecimiento de futuras plántulas (Harper et al., 1970; Zhang et al., 1997). Por lo tanto, es un factor que influye de manera directa en la ecología de las poblaciones vegetales y tiene consecuencias en la abundancia y distribución de las plantas (Harper et al., 1970; Chacoff et al., 2004).
Una de las características que pueden influir de manera significativa en la preferencia de semillas por parte de los depredadores, así como en su capacidad de germinación es el tamaño tanto de frutos, como de semillas (Harper et al., 1970; Baker, 1972; Leishman et al., 2000; Dalling, 2002; Bonilla, et al., 2007). Los depredadores prefieren las semillas de mayor tamaño, por la cantidad de energía que pueden ofrecer (Dalling, 2002; Mack, 1998); por esto, el tamaño de los frutos puede constituir una fuente de atracción para las hembras ya que con un tamaño mayor de fruto hay mayor oferta de alimento que garantizaría el desarrollo de las larvas (Morandini & de Viana, 2009). Adicionalmente, diferentes estudios han encontrado que el tamaño de las semillas puede estar inversamente correlacionado con la velocidad de germinación, en la cual semillas pequeñas tienden a germinar más rápido que las semillas grandes (Cuya & Lombardik, 1991; Milberg et al., 1996; Teketay & Ganstrom, 1997; Tungate et al., 2002; Sánchez et al., 2006). Esto posiblemente se debe a que semillas pequeñas absorben agua más rápido que semillas de gran tamaño y, en otros casos, a estrategias ecológicas para permanecer en bancos de semillas en el suelo durante varios años.
Para el caso particular de Sapindus saponaria L. (Sapindaceae), una especie arbórea de amplio potencial económico y de la cual se obtienen productos forestales maderables y no maderables, principalmente saponinas a partir del fruto (Nevarez & Cox, 2000; Abreu, 2005; Villela, 2005; Tsuzuki et al., 2007; Sánchez & Silva, 2008), observaciones preliminares de campo y laboratorio indican que la semilla de esta especie es depredada por insectos (Antillón, et al., 1995; Romero, et al., 2007). Se ha detectado principalmente la presencia del cerambícido Leptostylus gibbulosus Bates (Coleóptera: Cerambycidae), quien genera una perforación en la testa de la semilla que compromete parte del endospermo (Hernandez-Jaramillo & Pinzón, 2010). Por lo tanto, es posible que afecte la capacidad de germinacion y las posibilidades de manejo silvicultural de la especie.
La presencia de cerambícidos como depredadores de semillas es poco frecuente y al parecer constituye un ejemplo de coevolución entre una especie y su hospedero (Romero et al., 2009). En Colombia, según Posada (1989), existen registros de cerambícidos que atacan en su mayoría cultivos de aguacate, algunas anonáceas, cítricos y vid, con lo cual ocasionan anillamiento de ramas, pero ninguna ocurrencia en semillas. Por ende, este trabajo aporta información que permite mejorar el conocimiento sobre la silvicultura de esta importante especie vegetal.
En este trabajo se estimaron, en condiciones de invernadero, la incidencia y severidad de la depredación de semillas de S. saponaria por insectos y el efecto de la depredación del cerambícido L. gibbulosus sobre la germinación en relación con el tamaño de los frutos y semillas.
MATERIALES Y MÉTODOS
ÁREA DE ESTUDIO
Se recolectaron frutos de S. saponaria en árboles aislados, utilizados como cerca viva, y ubicados en las veredas La Laguna y La Esmeralda del municipio de Anolaima, Cundinamarca, Colombia (4°26� N y 74°29� W). La zona de estudio se encuentra a 1300 m de altitud; allí la temperatura oscila entre los 18 y 22 °C y la humedad relativa entre 86 % y 92 % (Alcaldía de Anolaima, 2008), y está ubicada en la zona de vida de bosque muy húmedo premontano (bmh-PM; Holdridge, 1947). La precipitación es bimodal, con una media anual de 1232 mm y dos picos de lluvia: el primero en abril y mayo y el segundo en octubre y noviembre, mientras que los menores valores se registran entre los meses de junio, julio y agosto (Alcaldía de Anolaima, 2008).
ESPECIE EN ESTUDIO
Sapindus saponaria es una especie arbórea que alcanza los 25 m y se conoce comúnmente como Jaboncillo, Chambimbe, Chumbimbe. La especie habita bosques húmedos tropicales entre 600 y 2000 m de altitud. S. saponaria crece a bajas elevaciones, en climas secos o húmedos y es común en pastizales y bosques secos (CATIE, 2000). El fruto de S. saponaria es la unidad de dispersión y es una drupa modificada amarillenta (De Noir et al., 2002), mientras que la semilla es negra, redonda, de testa dura, impermeable y muy resistente al ataque de hongos e insectos (Nevarez & Cox, 2000), presenta doble latencia y el tratamiento pregerminativo más recomendado es la escarificación con ácido sulfúrico (Nevarez & Cox, 2000). La estructura de protección de la semilla está formada por un tejido grueso y duro, conformada por varias capas, la más externa lignificada y de color negro. El micrópilo y el conducto del micrópilo están sellados o son muy estrechos, lo que dificulta la imbibición y explica la baja germinación de semillas sin escarificar (5 %; Bonilla et al., 2007).
Se considera que los frutos tienen propiedades medicinales (Lorenzi, 1992), y los frutos y semillas producen espuma debido a la presencia de saponinas (hasta 30 %), lo que hace que se puedan utilizar como jabón para lavar la ropa (Guarin et al., 2000; Sánchez et al., 2006) y como insecticida (Armenta et al., 2009; Guarin et al., 2000, Jozivan et al., 2008). Adicionalmente, se utilizan de forma medicinal para curar úlceras, heridas externas e inflamaciones (Lorenzi, 1992). Por su dureza, las semillas también se utilizan para fabricar artesanías (Arbeláez, 1996; Frausin et al., 2008).
TOMA DE REGISTROS
Se recolectaron frutos y semillas de S. saponaria en dos fechas seleccionadas con base en la maduración de los frutos: agosto y abril. En agosto de 2009 se recolectaron frutos de 25 árboles y, en abril de 2010, de 10 árboles. Los frutos se tomaron directamente de las ramas de cada árbol y a cada árbol se le midió el diámetro a la altura del pecho (DAP). La cantidad de frutos obtenidos dependió de la oferta y la posibilidad de acceso a estos. Una vez obtenidos se transportaron al laboratorio de silvicultura de la Facultad del Medio Ambiente y Recursos Naturales, se almacenaron en bolsas Ziploc identificadas según el número del árbol. Adicionalmente, se tomaron muestras botánicas de los árboles, las cuales se preservaron y depositaron como respaldo taxonómico en el Herbario Forestal de la Universidad Distrital Francisco José de Caldas (UDBC).
ESTIMACIÓN DE INCIDENCIA Y SEVERIDAD DE LA DEPREDACIÓN
Para identificar el tipo de daño causado por insectos a las semillas del Jaboncillo, así como para cuantificar la severidad del ataque, se disectaron 1687 frutos semillas-1 obtenidas en las dos épocas de muestreo. La revisión de los frutos y semillas se realizó para cada época en el menor tiempo posible después de la recolección, manteniendo los frutos almacenados en bolsas ziploc en el cuarto climatizado del laboratorio. Las semillas se inspeccionaron con ayuda de un estereoscopio y para cada una se registró la presencia de daños y signos (estado de desarrollo del insecto, estado del endospermo, presencia o ausencia de cotiledones y embrión, cambios en color y apariencia). Los insectos asociados fueron determinados como mínimo al nivel de familia.
Por otro lado, se recolectaron 5393 frutos, los cuales se clasificaron por tamaño aplicando la regla de Sturges (González, 2008) en las siguientes categorías: frutos pequeños (aquellos menores a 13.7 mm), frutos medianos (entre 13.7 mm y 17.4 mm) y frutos grandes (mayores a 17.4 mm). De igual manera, se definieron tres categorías de tamaño para 5400 semillas con base en su diámetro vertical: semillas pequeñas (10.18 � 0.35 mm), semillas medianas (11.45 � 0.52 mm) y semillas grandes (13.05 � 0.57 mm). Para cada semilla atacada por insectos se identificó el organismo asociado al mayor nivel taxonómico posible, y se estimó la incidencia y severidad del ataque. La incidencia del ataque se consideró como el porcentaje de frutos o semillas afectadas respecto al total de semillas evaluadas (Larrain, 2002; Rodríguez et al., 2002). La severidad del ataque se calculó solamente para L. gibolosus pues fue el único que presentó valores importantes de depredación. Estos cálculos se obtuvieron mediante una valoración cuantitativa (Martínez et al., 2008) del diámetro mayor y menor del orificio de salida del adulto y el porcentaje de endospermo consumido por el cerambícido. De esta forma, los niveles de severidad respecto al orificio de salida fueron: leve (orificios menores a 10 mm), moderado (10-12 mm) y severo (mayores a 12 mm), y se clasificó el nivel de daño aplicando la ecuación de Ramanujan (Haro & Perez, 2010). En contraste, los niveles de severidad respecto al estado del endospermo fueron: leve en la que menos del 50 % de los cotiledones fueron afectados (perímetro 6.6 � 2.36 mm), moderado donde más del 50 % de los cotiledones fueron afectados (11.1 � 0.55 mm) y severo cuando se presentó ausencia tanto del cotiledón como del embrión (13.2 � 2.03 mm).
EFECTO DEL DA�O SOBRE LA GERMINACIÓN
Con el fin determinar la capacidad germinativa de las semillas, se tomaron al azar 100 semillas sanas y 100 semillas atacadas, con ellas se realizó una prueba de viabilidad por medio de la disección de la semilla e inmersión en tetrazolio al 2 % durante 48 horas. Aquellas semillas que no tenían cotiledones ni embrión se consideraron vanas.
Por otro lado, se sembraron 546 semillas atacadas y 890 semillas sanas para evaluar la energía germinativa. Las semillas se sembraron a una distancia de 5 cm en un sustrato compuesto por gravas de diferente tamaño, arena, tierra y turba. No se les aplicó ningún tratamiento químico ni mecánico pregerminativo. Además, el riego se aplicó manualmente hasta aproximadamente a capacidad de campo. Para mantener la humedad y la temperatura, se construyó una estructura sencilla en madera cubierta con plástico. Las observaciones se realizaron diariamente por 160 días.
Las semillas se consideraron germinadas cuando la yema terminal sobresalió de la turba (Sánchez et al., 2006). Una vez germinadas se tomaron datos de diámetro a la altura del cuello de la raíz y altura de cada plántula con intervalos de tres días. Las variables utilizadas para la comparación fueron el porcentaje de germinación y el tiempo de germinación en días. El vigor germinativo se calculó con la ecuación 1 (Bonner et al., 1994)
donde, VG es el vigor germinativo, PV es el porcentaje máximo de germinación acumulada en x día por el día y ODM es la relación entre el porcentaje final de germinación y el total de días de prueba.
Al finalizar las pruebas de germinación en invernadero, se realizó una prueba de viabilidad de las semillas no germinadas a los 160 días de la siembra a 200 semillas sanas tomadas al azar del montaje. Adicionalmente, se hizo una inspección de todas las semillas atacadas, con lo cual se hizo una descripción de su apariencia y textura al final del ensayo.
ANÁLISIS DE DATOS
El efecto de la depredación sobre la germinación de las semillas se obtuvo a través de un arreglo factorial 3x2, utilizando como variables independientes el tamaño de la semilla (pequeñas, medianas y grandes) y el nivel de ataque (sanas y presencia de orificio; Jarma et al., 2007), y como variable dependiente el porcentaje de germinación. Se realizaron tres repeticiones de diferente número para cada tipo de semillas (tratamientos), a saber: semillas sanas pequeñas, semillas sanas medianas, semillas sanas grandes, semillas atacadas pequeñas, semillas atacadas medianas y semillas atacadas grandes.
Los valores de porcentaje de depredación en los diferentes tamaños de semilla se transformaron con el uso de la transformación angular de Bliss (Briones, 2005) y se compararon con la prueba no paramétrica de Kruskal Wallis. Para encontrar diferencias entre pares de tratamientos se utilizó la prueba de Mann-Whitney. El tiempo promedio de germinación se comparó mediante un ANOVA de una vía para las 31 semillas germinadas de cada categoría de tamaño.
Se aplicó la prueba de correlación por rangos de Spearman para hallar las relaciones entre el tamaño de la semilla, grado de ataque y la germinación. Para todos los análisis estadísticos se utilizó el software estadístico SPSS version 17.0 (SPSS, 2008).
RESULTADOS
CARACTERIZACIÓN DE LA DEPREDACIÓN DE SEMILLAS
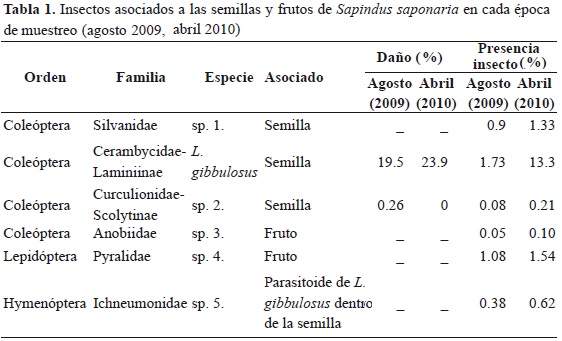
Se colectaron en total 7630 semillas de S. Saponaria, de las cuales 1531 fueron atacadas por alguna de las 6 especies de insectos asociadas a las semillas de S. saponaria (Tabla 1). El cerambícido L. gibbulosus fue el más frecuente (incidencia en 3 % de frutos en abril y 1.7 % de frutos en agosto), seguido de una especie de la familia Pyralidae (incidencia en 1.1 % en abril y 1.5 % en agosto). Ambas especies de depredadores ocurrieron con mayor frecuencia en semillas de los frutos colectados en abril que corresponde a la primera época de lluvias del 2010 y a la primera época de producción de frutos del año. Todos los depredadores de semillas diferentes a L. gibbulosus presentaron valores bajos de semillas depredadas.
Respecto a la severidad del ataque, expresada como porcentaje de endospermo consumido, en el caso particular del L. gibbulosus, la depredación es realizada por la larva, la cual ocasiona barrenación amorfa dentro de la semilla. Esta barrenación se clasificó en tres grados: leve en la que menos del 50 % de los cotiledones fueron afectados (perímetro 6.6 � 2.36 mm); moderada donde más del 50 % de los cotiledones fueron afectados (11.1 � 0.55 mm) y severa cuando se presentó ausencia tanto del cotiledón, como del embrión (13.2 � 2.03 mm) y en el fruto se observaba solamente un orificio de salida (Figura 1). Se encontró que el 38 % (249) de las semillas presentaron ataque moderado; 37.5 % (246), ataque leve, y 161 semillas (24.5 %) presentaron ataque severo.
En promedio se estudiaron 411 frutos por árbol de los cuales 20 % presentaban signos de depredación. En la cosecha de agosto (2009) se observó una incidencia promedio de ataque por L. gibbulosus de 19.5 % frutos por árbol, mientras que en la cosecha de abril (2010) fue mayor y alcanzó un 22.97 % frutos por árbol (U = 202, p = 0.031; Tabla 1).
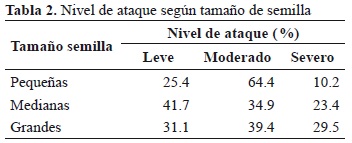
Las semillas con señal de ataque se distribuyeron según el tamaño en 9 % pequeñas (10.18 � 0.35 mm), 70.9 % medianas (11.45 � 0.52 mm) y 20.1 % semillas grandes (13.05 � 0.57 mm). No se encontró relación significativa entre tamaño de semilla y la severidad del ataque (rs = 0.058, p = 0.135). Las semillas pequeñas presentaron el más alto porcentaje de ataque moderado (Tabla 2).
DEPREDACIÓN SEGÚN TAMA�O DE FRUTO Y SEMILLA
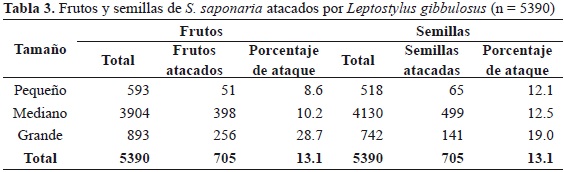
Los frutos de mayor tamaño presentaron mayor porcentaje de ataque que los frutos medianos y pequeños (rs = 0.183, p < 0.0001; Tabla 3). Asimismo, el porcentaje de depredación de los frutos pequeños fue significativamente menor que en los grandes (U = 211070, p << 0.001), así como los frutos medianos respecto a los grandes (U = 1422388, p << 0.001). No se observaron diferencias significativas entre la depredación de frutos pequeños y medianos (U = 1135770, p = 0.153).
La depredación también presentó correlación positiva significativa con el tamaño de la semilla (Chi22 = 25.4, p << 0.001), en donde las semillas grandes presentaron un mayor porcentaje de ataque en comparación con las semillas medianas y pequeñas (34.2 y 36.3 %, respectivamente; rs = 0.096, p <0.0001). Esto también se obtuvo al comparar entre semillas pequeñas y grandes (U = 181497, p = 0.002), así como entre semillas medianas y grandes (U = 1411947, p << 0.001). En contraste, no se observaron diferencias significativas entre semillas pequeñas y medianas (U = 1088688.5, p = 0.872).
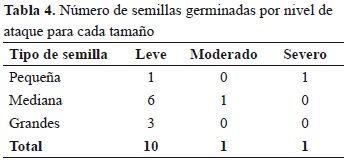
Se encontró una relación inversa entre la presencia del ataque de L. gibbulosus y la cantidad de semillas de S. saponaria germinadas (rs = -0.870, p < 0.0001); es decir, a mayor número de semillas atacadas menor número de semillas germinadas. No se pudo determinar qué tipo de daño causó menor efecto, porque solo germinaron 12 semillas atacadas (Tabla 4).
EFECTOS DE LA DEPREDACION EN LA GERMINACIÓN
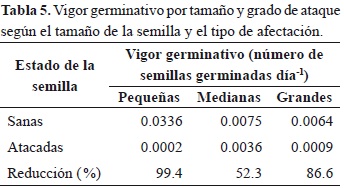
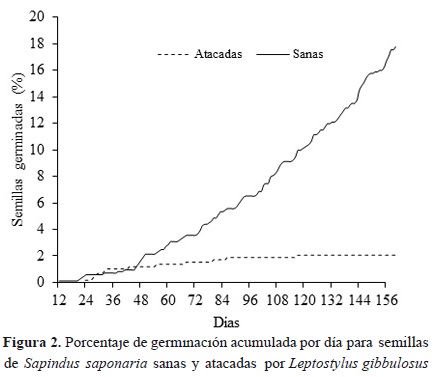
El porcentaje de viabilidad de las semillas sanas de la muestra tomada antes de la siembra fue del 90 %, lo cual contrasta con las semillas depredadas en las cuales la viabilidad fue de 32 %. En estas últimas, el vigor germinativo y la velocidad promedio de germinación disminuyó considerablemente (Tabla 5). Así, las semillas sanas presentaron un porcentaje de germinación 92.4 % mayor que las semillas atacadas, mientras que la velocidad promedio de germinación fue un 36 % mayor que en las semillas afectadas (Figura 2). Las semillas pequeñas sanas presentaron el valor más alto de vigor germinativo (0.03 semillas germinadas día-1), comparado con las otras categorías de tamaño (Tabla 5). El valor más bajo de vigor germinativo lo presentaron las semillas pequeñas atacadas (Tabla 5).
Las semillas sanas grandes fueron las primeras en germinar, pero presentaron un porcentaje de germinación bajo (12.7 %). La primera semilla sana germinó a los 12 días de siembra, mientras que la primera semilla atacada germinó a los 23 días (Figura 2). A partir del día 29 al 46, las semillas depredadas presentaron un porcentaje de germinación superior al de las semillas sanas; hasta el día 117 germinó la última semilla atacada, mientras que las semillas sanas continuaron germinando hasta la finalización del experimento (Figura 2).
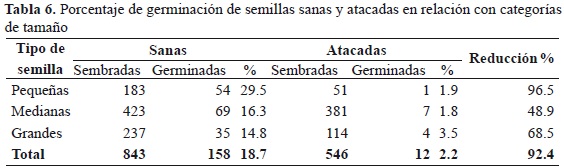
Los porcentajes de germinación en semillas atacadas fueron muy bajos en las tres categorías de tamaño (1.8-3.5 %; Tabla 6), puesto que solo germinó el 4.9 % de las semillas atacadas. Por la misma razón no se presentaron diferencias significativas entre tamaños y porcentaje de germinación de las semillas atacadas (Chi22 = 0.90, p = 0.639); el porcentaje más alto lo presentaron las semillas grandes (3.5 %), seguidas por semillas pequeñas. El menor porcentaje de germinación lo presentaron las semillas medianas. En contraste, se presentaron diferencias significativas entre tamaño y el porcentaje de germinación (Chi22 = 5.6, p = 0.061) de las semillas sanas, pues las semillas pequeñas sanas fueron las de mayor porcentaje de germinación (29.5 %).
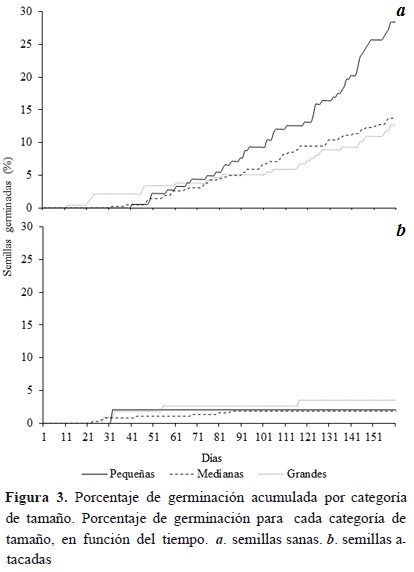
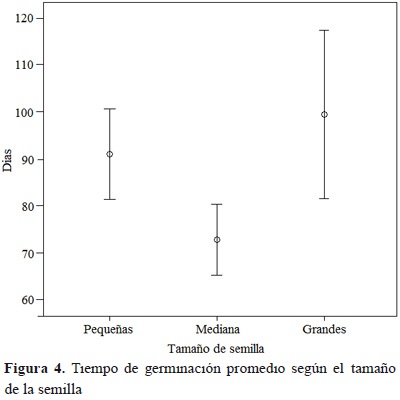
A partir del día 66, las semillas pequeñas sanas incrementaron su porcentaje de germinación y, hasta el final del ensayo, presentaron el porcentaje de germinación más alto. Las semillas medianas sanas superaron el porcentaje de germinación de las semillas grandes después del día 90 (Figura 3). El tiempo de germinación de las semillas medianas sanas (72.7 %) fue menor que las semillas pequeñas y grandes (18.2 días-20.1 %, 26.6 días-26.8 % días, respectivamente). Las diferencias en tiempo de germinación fueron evidentes entre las semillas medianas y semillas grandes (F2,90 = 4.92, p =0.008), pero no entre semillas pequeñas y grandes (F2,90 = 3.94, p = 0.599) ni entre semillas pequeñas y medianas (F2,90 = 3.94, p = 0.095; Figura 4).
De las semillas sanas, que a los 160 días no germinaron, el 88 % eran viables y el 8 % eran no viables, mientras que en las semillas atacadas, el 100 % se encontraban en proceso de descomposición y presentaron textura blanda y color opaco, por lo que se consideraron como no viables. Por lo tanto, se consideró que las semillas sanas aún presentaban capacidad germinativa, pero no habían iniciado actividad metabólica.
DISCUSIÓN
Los resultados de este estudio muestran que la depredación de semillas de S. saponaria es baja (20 %), pero en aquella proporción depredada por L. gibbulosus la viabilidad y capacidad de germinación se afecta de forma importante. Además, independientemente de la depredación, se encontró que el tamaño de la semilla es un determinante crítico sobre la capacidad establecimiento de la especie.
DEPREDACIÓN POR L. gibbulosus
Leptostytus gibbulosus resultó ser el depredador principal de las semillas de S. saponaria y este es el primer registro hecho para Colombia sobre la ocurrencia de este cerambícido asociado al Jaboncillo. En comparación con otros estudios sobre la influencia de depredadores de semillas forestales, el impacto puede considerarse bajo (Romero et al., 2007). Por ejemplo Gibbobruchus guanacaste consume un 25 % de las semillas de Bauhinia ungulata (Heithaus et al., 1982), Acanthoscelides aureolus depreda entre un 17-33 % de las semillas de Glycyrrhisa lepidota (Boe et al., 1988), mientras que en este estudio la depredacion por L. gibbulosus no supera el 14 %. Asimismo, Morandini & de Viana (2009) reportan un máximo de depredación de 34 % para Enterolobium contortisiliquum por el brúquido Merobruchus bicoloripes. Mimosestes nubigens y Mimosestes mimosae depredan un 40 % de las semillas de Acacia farmesiana (Traveset, 1991), Gittins et al. (2003) encontraron un 48 % de ataque para semillas Fabiana imbricata (Solanaceae), Steeves et al. (2008) reportan una alta tasa de depredación de semillas (53 %).
Por otro lado, al parecer la estacionalidad en la precipitación también incide en los niveles de depredación de S. saponaria, pues se observó un 4.4 % más de semillas afectadas durante la primera época de producción de frutos en el año, que coincide con la época de lluvias en la región de estudio. Lo anterior concuerda con resultados de otros estudios de depredadores de semillas, en los cuales los valores más altos en abundancia de insectos se registran en la época de lluvias (Noguera et al., 2002; Barrera et al., 2008; Jiménez et al., 2009), en la que las condiciones son más favorables para la eclosión de los huevos de posibles depredadores (Peck et al., 2003).
CAPACIDAD GERMINATIVA DE LAS SEMILLAS ANTE DEPREDACIÓN
En términos generales, ante depredación o no, el porcentaje de germinación de S. saponaria fue bajo, posiblemente por la testa impermeable de varias capas que protege el endospermo y, además, como reporta Bonilla et al. (2007), el micrópilo y el conducto son muy estrechos en esta semilla lo que dificulta la imbibición. Más aun, en los casos de ataque por parte de L. gibbulosus se redujo sustancialmente (94 %) la capacidad germinativa de las semillas, por lo que se considera que su efecto es importante en la modulación de la germinación, tal y como se ha descrito para otros insectos depredadores de semillas (e.g. Nothofagus, Acacia, Pterocereus; Havely, 1974; Baskin & Baskin, 1998, Rohner & Ward, 1999; Hobbs & Young, 2001; Csóka & Hirka, 2006; Méndez et al., 2006; Díaz-Fleischer et al., 2010). Adicionalmente, L. gibbulosus afectó la capacidad germinativa de semillas de S. saponaria aun cuando la semilla fue parcialmente consumida. Posiblemente, la perforación de la cubierta de la semilla puede, además, facilitar el ataque de patógenos o de otros insectos (Csóka & Hirka, 2006; Vallejo-Marin et al., 2006).
INCIDENCIA DEL TAMA�O DE LA SEMILLA EN LA GERMINACIÓN
Igualmente, se presentó un porcentaje muy bajo de germinación de las semillas depredadas. De estas, las semillas pequeñas presentaron el porcentaje de afectación más bajo, la mayor tasa de germinación y, en semillas sanas, el mayor vigor germinativo. Sin embargo, requirieron un tiempo mayor para germinar. Estos hallazgos coinciden con lo reportado por otros autores quienes han encontrado que las semillas pequeñas germinan más que las semillas grandes (Cordazzo, 2002; Tungate et al., 2002; Sánchez et al., 2006). Tal parece que las semillas pequeñas tardan menos tiempo en absorber agua que las semillas grandes (Harper et al., 1970; Kikuzawa & Koyama, 1999). Para S. Saponaria, al parecer lo más importante para la germinación es la imbibición de las semillas y no la cantidad de reservas que posea.
Las semillas grandes presentaron un porcentaje de afectación alto posiblemente por un gran tamaño de los frutos, esto constituye una fuente de atracción para las hembras, pues hay una mayor oferta de alimento que garantizaría el desarrollo de las larvas (Morandini & de Viana 2009). Berkov & Tavakilian (1999) mencionan que en cerambícidos las antenas funcionan como una respuesta olfativa y son fundamentales en la ubicación de un sitio apropiado para el apareamiento, hábitat y oviposición. En S. saponaria los frutos de mayor tamaño producen semillas de mayor peso, lo que facilitaría la selección del sitio con mayor alimento a la hembra de L. gibbulosus. Las semillas grandes también presentaron una tasa de germinación y vigor germinativo bajo, un tiempo promedio de germinación bajo comparado con semillas medianas y pequeñas.
CONCLUSIONES
En la región de estudio, Leptostylus gibbulosus fue el depredador más importante de las semillas de S. saponaria, en donde puede alcanzar un 23 % de frutos y semillas.
La depredación de Jaboncillo por L. gibbulosus afectó la capacidad reproductiva de la especie, pues la cantidad de semillas depredadas que lograron germinar fue muy baja. Esto se evidenció en las tasas de depredación y en la disminución del vigor germinativo. Asimismo, la tolerancia de la semilla a la depredación es baja, ya que incluso un consumo parcial del tejido interno ocasiona reducción en la germinación.
Se observó una preferencia de L. gibbulosus por semillas grandes y una afectación mayor de la tasa de germinación y el vigor germinativo cuando atacó semillas pequeñas. Las semillas medianas fueron más tolerantes al ataque de L. gibbulosus y presentaron la menor afectación de tasa de germinación y vigor germinativo (52.3 %). Las semillas pequeñas son mucho más sensibles al ataque, pues reducen de manera importante el vigor germinativo y la tasa de germinación (99.4 %), comparadas con semillas sanas. Los mayores valores de germinación de Sapindus saponaria en presencia de ataque se presentaron en semillas medianas, mientras que en ausencia de ataque, en semillas pequeñas.
AGRADECIMIENTOS
Al Centro de Investigaciones y Desarrollo Científico de la Universidad Distrital Francisco José de Caldas, por la financiación de una parte de esta investigación mediante la convocatoria para el apoyo a Semilleros de Investigación 2008. A Alejandro Sánchez, Ana María Hernández, Roy González y David Valbuena por su apoyo logístico y colaboración. A Luisa Fernanda Ruiz y Jairo Silva por las observaciones a versiones previas del manuscrito.
REFERENCIAS BIBLIOGRÁFICAS
Abreu, O. (2005). Potencial medicinal del genero Sapindus L. (Sapindaceae) y de la especie Sapindus saponaria L. Revista Cubana Plantas Medicinales, 10(3-4), 10-20.
Alcaldía de Anolaima. (2008). Plan de desarrollo económico, social y de obras públicas del municipio de Anolaima, Cundinamarca, 2008-2011 �Administración activa, comprometida y solidaria�. Anolaima: Alcaldía de Anolaima 215 p.
Antillón, C., Arguedas, M., & Miller, C. (1995). Insectos depredadores de semillas forestales en Costa Rica. En R. Salazar (ed.). Memorias de simposio sobre avances en la producción de semillas forestales en América Latina (pp. 295-302). San José de Costa Rica: CATIE.
Arbeláez, E. (1996). Plantas Útiles de Colombia. Texas: Sucesores de Rivadeneyra. 831p.
Armenta, A., Camacho, J., & Apodaca, M. (2009). Control de plagas de granos almacenados con insecticidas biorracionales en el Norte de Sinaloa (Tecnología de Granos y Semillasos: Serie agricultura). México: Universidad Autónoma Indígena de México 129-140
Baker, H.G. (1972). Seed weight in relation to environmental conditions in California. Ecology, 53(6), 997-1010.
Barrera, J.F., Herrera, J., & Gómez, J. (2008). Fluctuación de la población de adultos de Rhabdopterus jansoni (Jacoby) (Coleóptera: Chrysomelidae) en cafetales del Soconusco, Chiapas, México. Entomología Mexicana, 7, 246-251.
Baskin, C.C., & Baskin, J.M. (1998). Seeds - ecology, biogeography, and evolution of dormancy and germination. London: Academic Press. 666 p.
Berkov, A., & Tavakilian, G. (1999). Host utilization of the Brazil nut family (Lecythidaceae) by sympatric wood-boring species of Palame (Coleoptera, Cerambycidae, Lamiinae, Acanthocinini). Biological Journal of the Linnean Society, 67, 181-198.
Boe, A.B., McDaniel, B., & Robbins, K. (1988). Patterns of American licorice seed predation by Achanthocelides aureolus (Horn.) (Coleoptera: Bruchidae) in South Dakota. Journal Range Manage, 41, 342-345.
Bonilla, C., Carmen, R., Kadaffi, L., Sánchez, O., Manuel, S., & Escobar, R. (2007). Morfoanatomía y respuesta fisiológica de las semillas de chambimbe a condiciones de crioconservación. Acta Agronómica, 56 (3), 135-140.
Bonner, F.T., Vozzo, J.A., Elam, W.W., & Land, S.B. (1994). Tree seed Technology training course, instructor manual. New Orleans: United States Department of Agriculture. 162 p.
Briones, M. (2005). Supuestos del análisis de varianza. Recuperado de http://www.docstoc.com/docs/105037442/supuestos-del-analisis-de-varianza.
CATIE. (2000). Manejo de semillas de 100 especies forestales de América Latina (Serie Técnica, Manual Técnico No. 41). Turrialba: CATIE-PROSEFOR-DFSC. 204 p.
Cordazzo, C.V. (2002). Effect of seed mass on germination and growth in three dominant species in southern Brazilian Coastal dunes. Brazilian Journal Biology, 62(3), 427-435.
Csóka, G., & Hirka, A. (2006). Direct effects of carpophagous insects on the germination ability and early abscission of oak acorns. Acta Silver Lign Hungry, 2, 57-68.
Cuya, O., & Lombardi, I. (1991). Influencia del tamaño de semilla en la germinación y crecimiento de plántulas de Schinus molle. Revista Forestal del Perú 18(2), 17-27.
Chacoff, N.P., Morales, J., & Vaquera, M. (2004). Efectos de la fragmentación sobre absorción y depredación de semillas en el Chaco Serrano. Biotropica, 36(1), 109-117.
Dalling, J.W. (2002). Ecología de semillas. En M.R. Guariguata & G.H. Kattan (eds.). Ecología y conservación de bosques neotropicales (pp. 345-375). Texas: Libro Universitario Regional.
De Noir, A., Bravo, S., & Abdala, R. (2002). Mecanismos de dispersión de algunas especies de leñosas nativas del Chaco Occidental y Serrano. Quebracho, 9, 140-150.
Díaz-Fleischer, F., Hernández-Arellano, A., Sánchez-Velásquez, L., Cano-Medina, T., Cervantes-Alday, R., & López-Ortega, M. (2010). Investigación preliminar de la depredación de semillas en la germinación de las bellotas de Quercus candicans Née. Agrociencia, 44, 83-92.
Frausin, G., Trujillo, E., Correa, M., & Gonzalez, V. (2008). Seeds used in handicrafts manufactured by an Emberá-katío indigenous population. Caldasia, 30 (2), 315-323.
Gittins, C., Chartier, M., Ghermandi, L., & Guthmann, N. (2003). Predación predispersiva de semillas de Fabiana imbricata (Solanaceae), un arbusto del noroeste de la Patagonia. Ecolgía Austral, 13, 121-126.
González, M. (2008). Bioestadística: estadística descriptiva. España: Universidad de Extremadura. 37 p.
Guarin, G., Santana, A., & Silva, R. (2000). Notas etnobotánicas de especies de Sapindaceae Jusieu. Acta Botanica Brasilica, 14, 327-334.
Haro, J.M., & Perez, M.J. (2010). Problemas isoperimétricos. Revista Programas, 2, 1-9.
Harper, J., Lovell, H., & Moore, G. (1970). The shapes and sizes of seeds. Annual Review Ecology Systematica, 1, 327-356.
Havely, G. (1974). Effects of gazelles and seed beetles (Bruchidae) on germination and establishment of Acacia species. Israel Journal of Botany, 23, 120-126.
Heithaus, E.R., Stashko, E., & Anderson, P.K. (1982). Cumulative effects of plant-animal interactions on seed production by Bauhinia ungulata, a Neotropical legume. Ecology, 63, 1294-1302.
Hernandez-Jaramillo, A., & Pinzón, O.P. (2010). Observaciones preliminares de la biología de Leptostylus gibbulosus Bates (Coleoptera: Cerambycidae) y daños en semillas de Sapindus saponaria L. Bogotá: XXXVII Congreso de la Sociedad Colombiana de Entomología, SOCOLEN. 49 p.
Hobbs, T., & Young, T.P. (2001). Growing valley oak. Ecology Restoration, 19, 165-171.
Holdridge, L.R. (1947). Determination of world plant formations from simple climatic data. Science, 105(2727), 367-368.
Janzen, D.H. (1971). Seed predation by animals. Annual Review of Ecology and Systematics, 2, 465-492.
Jarma, A., Arbeláez, J., & Clavijo, J. (2007). Germinación de Ischaemum rugosum Salisbury en respuesta a estímulos ambientales y químicos. Temas Agrarios, 12(2), 31-41.
Jiménez, S., Zaragoza, C.A., & Noguera, F. (2009). Variación temporal de la diversidad de estafilínidos (Coleoptera: Staphylinidae) nocturnos en un bosque tropical caducifolio de México. Revista Mexicana de Biodiversidad, 80, 157-168.
Jozivan, F., Teixeira, E., Diniz, M. L., & Costa, T. (2008). Extractos vegetales en el control de plagas. Revista Verde, 3(3), 1-5.
Kikuzawa, K., & Koyama, H. (1999). Scaling of soil water absorption by seeds: an experiment using seed analogues. Seed Science Research, 9, 171-178.
Larrain, P. (2002). Incidencia de insectos y ácaros plagas en pepino dulce (Solanum muricatum Ait.) cultivado en la IV región, Chile. Agricultura Técnica, 62(1), 15-26.
Leishman, M.R., Wright, I.J., Moles, A.T., & Westoby, M. (2000). The evolutionary ecology of seed size. En M. Fenner (ed.). Seeds: The ecology of regeneration in plant communities (pp. 31-57). Wallingford: CABI Publishing.
Lorenzi, H. (1992). Árvores brasileiras: Manual de identificación e cultivo de plantas arbóreas Nativas do Brasil. Nova Odessa: Plantarum. 352 p.
Mack, A. (1998). An advantage of large seed size: tolerating rather than succumbing to seed predators. Biotropica, 30, 604-608.
Martínez, A., Hernández, L., Osorio, R., Alia, I., Lopez, V., Bautista, S., & Guillen, D. (2008). Incidencia y severidad de Botryodiplodia theobromae en frutos de zapote mamey en Jalpa de Mendez, Tabasco, México. Revista UDO Agrícola, 8(1), 29-32.
Méndez, M., Dorantes, A., Dzib, G., Argáez, J., & Durán, R. (2006). Germinación y establecimiento de plántulas de Pterocereus gaumeri, una cactacea columnar, rara y endémica de Yucatán, México. Boletín de la Sociedad Botánica de México, 79, 33-41.
Milberg, P., Anderson, L., Elfverson, C., & Regner, S. (1996). Germination characteristics of seeds differing in mass. Seed Science Research, 6, 191-197.
Morandini, M., & de Viana, M. (2009). Depredación pre-dispersiva de semillas en tres poblaciones del árbol Enterolobium contortisiliquum (Fabaceae). Revista de Biología Tropical, 57:(3), 781-788.
Nevarez, A., & Cox, R.D. (2000). Medicinal plants of the southwest. New Mexico State University. Recuperado de http://medplant.nmsu.edu/.
Noguera, F., Zaragoza-Caballero, A., Chemsak, S., Rodríguez-Palafox, J.A., Ramírez, A., González-Soriano, E., & Ayala, R. (2002). Diversity of the family Cerambycidae (Coleoptera) of the tropical dry forest of Mexico, I. Sierra de Huautla, Morelos. Annals of the Entomological Society of America, 95(5), 617-627.
Peck, D.C., Pérez, A.M., Medina, J.W., Barrios, M., & Rojas, J. (2003). Fenología de Aeneolamia reducta en la costa Caribe de Colombia. Pasturas Tropicales, 24(1), 39-55.
Posada, L. (1989). Lista de insectos dañinos y otras plagas en Colombia (Boletín Técnico 43). Bogotá: ICA. 350 p.
Rodríguez, K., Rivero, R., & García, C. (2002). Estudio de la incidencia de los principales patógenos en semilla de papa (Rhizoctonia, Rosellinia, Spongospora, Erwinia, Streptomyces y Verticillium). Bogota: Universidad Nacional de Colombia. 19 p.
Rohner, C., & Ward, D. (1999). Large mammalian herbivores and the conservation of arid Acacia stands in the Middle East. Conservation Biology, 13, 1162-1171.
Romero, N., Chemsak, J., & Rodriguez, C. (2007). Some notes on natural hystory and Distribution of Leptostylus gibbulosus Bates, 1874 (Coleoptera: Cerambycidae). Acta Zoológica Mexicana, 23(1), 171-173.
Romero, G., Romero, J., Ramos, R.Y., Burgos, A., Valdez, J., & Flores, A. (2009). Gorgojos de la familia Bruchidae (Coleoptera) asociados a semillas de plantas silvestres destinadas para germoplasma. Boletín Sociedad Entomológica Aragonesa, 44, 333-342.
Sánchez, J., Flores, J., & Martinez, E. (2006). Efecto del tamaño de semilla en la germinación de Astrophytum myriostigma Lemaire (Cactaceae), especie amenzada de extinción. Interciencia, 31(5), 371-375.
Sánchez, J., & Silva, L. (2008). Estudio silvicultural de la especie Sapindus saponaria L. (Jaboncillo) como base para su aprovechamiento silvoindustrial. Colombia Forestal, 11, 71-81.
SPSS [Statistical Package for the Social Sciences]. (2008). Statistical package for the social sciences (Versión 17 para Windows). Recuperado de http://www.spss.com.
Steeves, R., Nazari, V., Landry, J., & Lacrolx, C. (2008). Predispersal seed predation by a coleophorid on the threatened Gulf of St. Lawrance aster. The Canadian Entomologist, 140(3), 297-305.
Teketay, D., & Ganstrom, A. (1997). Germination ecology of forest species from the highlands of Ethiopia. Journal Tropical Ecology, 13, 805-831.
Traveset, A. (1991). Pre-dispersal seed predation in Central American Acacia farnesiana: factors affecting the abundance of co-occurring bruchid beetles. Oecologia, 87, 570-576.
Tsuzuki, J., Svidzinski, T., Shinobu, C., Silva, L., Rodrigues-Filho, E., Cortez, D., & Ferreira, I. (2007). Antifungal activity of theextracts and saponins from Sapindus saponaria L. Anais da Academia Brasileira de Ciencias, 79(4), 577-583.
Tungate, K.D., Susko, D.J., & Rufty, T.W. (2002). Reproduction and offspring competitiveness of Senna obtusifolia are influenced by nutrient availability. New Phytologist, 154(3), 661-669.
Vallejo-Marin, M., Dominguez, C., & Dirzo, R. (2006). Simulated seed predation reveals a variety of germination responses of neotropical rain forest species. American Journal of Botany, 93(3), 369-376.
Villela, C. (2005). Tamizaje fitoquímico del fruto del árbol de la Sapindus saponaria (Jaboncillo), identificando las principales familias de metabolitos secundarios, en muestras provenientes de Cunén, departamento del Quiché, Guatemala. Quiché: Universidad de San Carlos de Guatemala.185 p.
Zhang, J., Drummond, F., Liebman, M., & Hartke, A. (1997). Insect predation of seeds and plant population dynamics. Orono: University of Maine. 32 p.
Licencia
Colombia Forestal conserva los derechos patrimoniales (copyright) de las obras publicadas, y favorece y permite la reutilización de las mismas bajo la licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional por lo cual se pueden copiar, usar, difundir, transmitir y exponer públicamente, siempre que:
Se reconozcan los créditos de la obra de la manera especificada por el autor o el licenciante (pero no de una manera que sugiera que tiene su apoyo o que apoyan el uso que hace de su obra).