DOI:
https://doi.org/10.14483/23448350.19651Publicado:
05/15/2023Número:
Vol. 47 Núm. 2 (2023): Mayo-Agosto 2023Sección:
ArtículosSíntesis asistida por ultrasonido de Pirazolo[3,4-b]Piridinas policíclicas fusionadas
Ultrasound-Assisted Synthesis of Fused Polycyclic pyrazolo[3,4-b]pyridines
Palabras clave:
5-aminopirazoles, ciclocondensación, derivados fusionados de pirazol, pirazolo[3,4-b]piridina, síntesis por ultrasonido (es).Palabras clave:
5-aminopyrazole, cyclocondensation, fused pyrazole derivatives, pyrazolo[3,4-b]pyridine, ultrasound synthesis (en).Descargas
Referencias
Afsar, J., Zolfigol, M. A., Khazaei, A., Alonso, D. A., Khoshnood, A., Bayat, Y., Asgari, A. (2018). Synthesis and application of a novel nanomagnetic catalyst with Cl[DABCO-NO2]C(NO2)3 tags in the preparation of pyrazolo[3,4-b]pyridines via anomeric based oxidation. Research on Chemical Intermediates, 44(12), 7595-7618. https://doi.org/10.1007/s11164-018-3576-9 DOI: https://doi.org/10.1007/s11164-018-3576-9
Aggarwal, R., Kumar, S. (2018). 5–Aminopyrazole as precursor in design and synthesis of fused pyrazoloazines. Beilstein Journal of Organic Chemistry, 14(1), 203-242. https://doi.org/doi:10.3762/bjoc.14.15 DOI: https://doi.org/10.3762/bjoc.14.15
Aly, A. A., El–Emary, T. I., Mourad, A.-F. E., Alyan, Z. K., Bräse, S., Nieger. M. (2019). 5-carbohydrazide and 5-carbonylazide of pyrazolo[3,4-b]pyridines as reactive intermediates in the synthesis of various heterocyclic derivatives. Journal of Chemical Research, 43(7-8), 219-229. https://doi.org/10.1177/1747519819861625 DOI: https://doi.org/10.1177/1747519819861625
Arias-Gómez, A., Godoy, A., Portilla, J. (2021). Functional pyrazolo[1,5-a]pyrimidines: Current approaches in synthetic transformations and uses as an antitumor scaffold. Molecules, 26, e2708. https://doi.org/10.3390/molecules26092708 DOI: https://doi.org/10.3390/molecules26092708
Arlan, F. M., Javahershenas, R., Khalafy, J. (2020). An efficient one-pot, four-component synthesis of a series of pyrazolo [3,4-b] pyridines in the presence of magnetic LDH as a nanocatalyst. Asian Journal of Nanoscience and Materials, 3(3), 238-250. https://doi.org/10.26655/AJNANOMAT.2020.3.7 DOI: https://doi.org/10.26655/AJNANOMAT.2020.3.7
Baradarani, M. M., Fazlelahi, H. Z., Rashidi, A., Joulec, J. A. (2018). Synthesis of novel pyrazolo[3,4–b]pyridine derivatives in aqueous medium. Arkivoc, 2018, 114-122. https://doi.org/10.24820/ark.5550190.p010.389 DOI: https://doi.org/10.24820/ark.5550190.p010.389
Bhardwaj, N., Pathania, A., Kumar, P. (2021). Naturally available nitrogen-containing fused heterocyclics as prospective lead molecules in medicinal chemistry. Current Traditional Medicine, 7, 5-27. https://doi.org/10.2174/2215083805666190613125700 DOI: https://doi.org/10.2174/2215083805666190613125700
Brandão, P., Pineiro, M., Pinho, Melo, T. M. (2019). Flow chemistry: towards a more sustainable heterocyclic synthesis. European Journal of Organic Chemistry, 2019(43), 7188-7217. https://doi.org/10.1002/ejoc.201901335 DOI: https://doi.org/10.1002/ejoc.201901335
Donaire-Arias, A., Montagut, A. M., Puig de la Bellacasa, R., Estrada-Tejedor, R., Teixidó, J., Borrell, J. I. (2022). 1H-pyrazolo[3,4-b]pyridines: Synthesis and biomedical applications. Molecules, 27, e2237. https://doi.org/10.3390/molecules27072237 DOI: https://doi.org/10.3390/molecules27072237
Dwivedi, J., Sharma S., Jain, S., Singh, A. (2018). The synthetic and biological attributes of pyrazole derivatives: A review. Mini-Reviews in Medicinal Chemistry, 18, 918-947. https://dx.doi.org/10.2174/1389557517666170927160919 DOI: https://doi.org/10.2174/1389557517666170927160919
Dyadyuchenko, L. V., Dmitrieva, I. G. (2020). Microwave-assisted synthesis of pyrazolo[3,4-b]pyridine derivatives (Microreview). Chemistry of Heterocyclic Compounds, 56(11), 1414-1416. https://doi.org/10.1007/s10593-020-02830-1 DOI: https://doi.org/10.1007/s10593-020-02830-1
Eagon, S., Hammill, J. T., Sigal, M., Ahn, K. J., Tryhorn, J. E., Koch, G., Belanger, B., Chaplan, C. A., Loop, L., Kashtanova, A. S., Yniguez, K., Lazaro, H., Wilkinson, S. P., Rice, M. L., Falade, M. O., Takahashi, R., Kim, K., Cheung, A., DiBernardo, … Kiplin Guy, R. (2020). Synthesis and structure-activity relationship of dual-stage antimalarial pyrazolo[3,4-b]pyridines. Journal of Medicinal Chemistry, 63(20), 11902-11919. https://doi.org/10.1021/acs.jmedchem.0c01152 DOI: https://doi.org/10.1021/acs.jmedchem.0c01152
Elsherif, M. A. (2021). Antibacterial evaluation and molecular properties of pyrazolo[3,4-b]pyridines and thieno[2,3-b]pyridines. Journal of Applied Pharmaceutical Science, 11(6), 118-124. https://doi.org/10.7324/JAPS.2021.110614 DOI: https://doi.org/10.7324/JAPS.2021.110614
Ezzati, M., Khalafy, J., Marjani, A. P., Prager, R. H. (2018). An efficient one–pot, four–component synthesis of pyrazolo[3,4-b]pyridines catalyzed by tetrapropylammonium bromide (TPAB) in water. Australian Journal of Chemistry, 71(6), 435-441. https://doi.org/10.1071/CH17642 DOI: https://doi.org/10.1071/CH17642
Gouda, M. A., Berghot, M. A., El Ghani, G. E. A., Khalil, A.-G. M. (2020). Recent development in the chemistry of bicyclic 6+5 systems, part I: Chemistry of pyrazolo[3,4-b]pyridines. Letters in Organic Chemistry, 17(1), 2–23. https://doi.org/10.2174/1570178616666190411102031 DOI: https://doi.org/10.2174/1570178616666190411102031
Hill, M. D., Fang, H., Brown, J. M., Molski, T., Easton, A., Han, X., Miller, R., Hill-Drzewi, M., Gallagher, L., Matchett, M., Gulianello, M., Balakrishnan, A., Bertekap, R. L., Santone, K. S., Whiterock, V. J., Zhuo, X., Bronson, J. J., Macor, J. E., Degnan, A. P. (2016). Development of 1H-pyrazolo[3,4-b]pyridines as metabotropic glutamate receptor 5 positive allosteric modulators. ACS Medicinal Chemistry Letters, 7(12), 1082-1086. https://doi.org/10.1021/acsmedchemlett.6b00292 DOI: https://doi.org/10.1021/acsmedchemlett.6b00292
Hu, H., Peng, Y., Huang, H., Yang, T., Chen, F., Yan, P. (2018). Deacylation during the synthesis of new 4-amino-1h-pyrazolo [3,4-b] pyridines catalysed by SnCl4. Journal of Chemical Research, 42(8), 412-415. https://doi.org/10.3184/174751918X15337230783041 DOI: https://doi.org/10.3184/174751918X15337230783041
Jampilek, J. (2019). Heterocycles in medicinal chemistry. Molecules 24, 3839. https://doi.org/10.3390/molecules24213839 DOI: https://doi.org/10.3390/molecules24213839
Kalhor, S., Zarei, M., Zolfigol, M. A., Sepehrmansourie, H., Nematollahi, D., Alizadeh, S., Shi, H., Arjomandi, J. (2021). Anodic electrosynthesis of MIL-53(Al)-N(CH2PO3H2)2 as a mesoporous catalyst for synthesis of novel (N-methyl-pyrrol)-pyrazolo[3,4-b]pyridines via a cooperative vinylogous anomeric based oxidation. Scientific Reports, 11, 1-20. https://doi.org/10.1038/s41598-021-97801-7 DOI: https://doi.org/10.1038/s41598-021-97801-7
Kuznetsov, A. (Ed.). (2021). Azoles: Synthesis, properties, applications and perspectives. Books on Demand
Leitão, E. P. T. (2020). Chalcones: Retrospective synthetic approaches and mechanistic aspects of a privileged scaffold. Current Pharmaceutical Design, 26(24), 2843-2858. https://doi.org/10.2174/1381612826666200403124259 DOI: https://doi.org/10.2174/1381612826666200403124259
Makar, S., Saha, T., Singh, S. K. (2019). Naphthalene, a versatile platform in medicinal chemistry: Sky-high perspective. European Journal of Medicinal Chemistry, 161, 252-276. https://doi.org/10.1016/j.ejmech.2018.10.018 DOI: https://doi.org/10.1016/j.ejmech.2018.10.018
Mekky, A. E. M., Sanad, S. M. H. (2019). Synthesis, characterization, and antimicrobial evaluation of novel thiohydrazonates and pyrazolo[3,4-b]pyridines. Polycyclic Aromatic Compounds, 41(5), 936-949. https://doi.org/10.1080/10406638.2019.1631194 DOI: https://doi.org/10.1080/10406638.2019.1631194
Mermer, A., Keles, T., Sirin, Y. (2021). Recent studies of nitrogen containing heterocyclic compounds as novel antiviral agents: A review. Bioorganic Chemistry, 114, e105076. https://doi.org/10.1016/j.bioorg.2021.105076 DOI: https://doi.org/10.1016/j.bioorg.2021.105076
Mikie, T., Osaka, I. (2018). Selective synthesis and properties of electron–deficient hybrid naphthalene-based π-conjugated systems. Chemistry – A European Journal, 24(72), 19228-19235. https://doi.org/10.1002/chem.201803208 DOI: https://doi.org/10.1002/chem.201803208
Murlykina, M. V., Morozova, A. D., Zviagin, I. M., Sakhno, Y. I., Desenko, S. M., Chebanov, V. A. (2018). Aminoazole-based diversity-oriented synthesis of heterocycles. Frontiers in Chemistry, 6, e527. https://doi.org./10.3389/fchem.2018.00527 DOI: https://doi.org/10.3389/fchem.2018.00527
Patnaik, S., Basu, D., Southall, Dehdashti, S., Wan, k. K., Zheng, W., Ferrer, M., Taylor, M., Engel, D. A., Marugan, J. J. (2019). Identification, design and synthesis of novel pyrazolopyridine influenza virus nonstructural protein 1 antagonists. Bioorganic & Medicinal Chemistry Letters, 29(9), 1113-1119. https://doi.org/10.1016/j.bmcl.2019.02.027 DOI: https://doi.org/10.1016/j.bmcl.2019.02.027
Polo, E., Ferrer–Pertuz, K., Trilleras, J. Quiroga, J., Gutiérrez, M. (2017). Microwave-assisted one-pot synthesis in water of carbonylpyrazolo[3,4-b]pyridine derivatives catalyzed by InCl3 and sonochemical assisted condensation with aldehydes to obtain new chalcone derivatives containing the pyrazolopyridinic moiety. RSC Advances, 7(79), 50044-50055. https://doi.org/10.1039/c7ra10127a DOI: https://doi.org/10.1039/C7RA10127A
Quiroga, J. (2019). Los 5-aminopirazoles como bloque de construcción de compuestos heterocíclicos fusionados. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales, 43(168), 531-538. https://doi.org/10.18257/raccefyn.762 DOI: https://doi.org/10.18257/raccefyn.762
Quiroga, J., Villarreal, Y., Gálvez, J., Ortíz, A., Insuasty, B., Abonía, R., Raimondi, M., Zacchino, S. (2017). Synthesis and antifungal in vitro evaluation of pyrazolo[3,4-b]pyridines derivatives obtained by Aza-Diels-Alder reaction and microwave irradiation. Chemical and Pharmaceutical Bulletin, 65(2), 143-150. https://doi.org/10.1248/cpb.c16-00652 DOI: https://doi.org/10.1248/cpb.c16-00652
Ramírez, D., Mejía-Gutiérrez, M., Insuasty, B., Rinné, S., Kiper, A. K., Platzk, M., Müller, T., Decher, N., Quiroga, J., de la Torre, P., González, W. (2021). 5-(indol-2-yl)pyrazolo[3,4-b]pyridines as a new family of TASK-3 channel blockers: A pharmacophore-based regioselective synthesis. Molecules 26, e3897. https://doi.org/10.3390/molecules26133897 DOI: https://doi.org/10.3390/molecules26133897
Saranya, S., Radhika, S., Afsina Abdulla, C. M., Anilkumar G. (2021). Ultrasound irradiation in heterocycle synthesis: An overview. Journal of Heterocyclic Chemistry, 58(8), 1570-1580. https://doi.org/10.1002/jhet.4261 DOI: https://doi.org/10.1002/jhet.4261
Shaabani, A., Mohammad, T. N., Ronak, A. (2019). 5-Amino-pyrazoles: Potent reagents in organic and medicinal synthesis. Molecular Diversity, 23, 751-807. https://doi.org/10.1007/s11030-018-9902-8 DOI: https://doi.org/10.1007/s11030-018-9902-8
Trilleras, J., González-López, E., León-Jaramillo, J., Pérez-Gamboa, A., Puello-Polo, E., Romo, P., Ortíz, A., Quiroga, J. (2018). Syntheses, experimental and theoretical studies on absorption/emission properties of pyrazoline-containing aryl/methoxynaphthyl substituents. Journal of the Brazilian Chemical Society, 29, 1210-1217. http://dx.doi.org/10.21577/0103-5053.20170216 DOI: https://doi.org/10.21577/0103-5053.20170216
Tandon, V., Das, P., Kukreti, S. (2018). Synthesis of 3,6-diaryl-1H-pyrazolo[3,4-b]pyridines via one-pot sequential Suzuki-Miyaura coupling. RSC Advances, 8(61), 34883-34894. https://doi.org/10.1039/c8ra07104g DOI: https://doi.org/10.1039/C8RA07104G
Vidali, V. P., Nigianni, G., Athanassopoulou, G. D., Canko, A., Mavroidi, B., Matiadis, D., Pelecanou, M., Sagnou, M. (2022). Synthesis of novel pyrazolo[3,4-b]pyridines with affinity for β-amyloid plaques. Molbank, 2022(1), e1343. https://doi.org/10.3390/M1343 DOI: https://doi.org/10.3390/M1343
Yadav, G. D., Wagh, D. P. (2020). Claisen-Schmidt condensation using green catalytic processes: A critical review. ChemistrySelect, 5, 9059-9085. https://doi.org/10.1002/slct.202001737 DOI: https://doi.org/10.1002/slct.202001737
Zhai, M., Liu, S., Gao, M., Wang, L., Sun, J., Du, J., Guan, Q., Bao, K., Zuo, D., Wu, Y., Zhang, W. (2019). 3,5-diaryl-1H-pyrazolo[3,4-b]pyridines as potent tubulin polymerization inhibitors: Rational design, synthesis and biological evaluation. European Journal of Medicinal Chemistry, 168, 426-435. https://doi.org/10.1016/j.ejmech.2018.12.053 DOI: https://doi.org/10.1016/j.ejmech.2018.12.053
Zhang, S., Neumann, H., Beller, M. (2020). Synthesis of -unsaturated carbonyl compounds by carbonylation reactions. Chemical Society Reviews, 49(10), 3187-3210 https://doi.org/10.1039/C9CS00615J DOI: https://doi.org/10.1039/C9CS00615J
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Recibido: de julio de 2022; Aceptado: de marzo de 2023
Resumen
Este trabajo describe una metodología sintética desarrollada para la obtención de pirazolo[3,4-b]piridinas policíclicas fusionadas. La síntesis se llevó a cabo en dos etapas, iniciando con la obtención de naftonas α,β-insaturadas y su posterior ciclocondensación con 5-amino-1-fenil-3-metil-1H-pirazol. Las ventajas de este enfoque incluyen simplicidad, eficiencia atómica, selectividad y buen rendimiento con un mínimo impacto ambiental. La ruta sintética está orientada hacia la obtención de N-heterociclos con puntos específicos de diversificación estructural que sean interés para la posterior exploración de sus propiedades biológicas.
Palabras clave:
5-aminopirazoles, ciclocondensación, derivados fusionados de pirazol, pirazolo[3,4-b]piridina, síntesis por ultrasonido..Abstract
This work describes a synthetic methodology developed to obtain fused polycyclic pyrazolo[3,4-b]pyridines. The synthesis was carried out in two stages, starting with the preparation of α,β-unsaturated naphthones and their subsequent cyclocondensation with 5-amino-1-phenyl-3-methyl-1H-pyrazole. The advantages of this approach include simplicity, atomic efficiency, selectivity, and good yields with minimal environmental impact. The synthetic route is aimed at obtaining N-heterocycles with specific points of structural diversification that are of interest for later exploration of their biological properties.
Keywords:
5-aminopyrazole, cyclocondensation, fused pyrazole derivatives, pyrazolo[3,4-b]pyridine, ultrasound synthesis..Resumo
Este trabalho descreve a metodologia sintética desenvolvida para a obtenção de pirazolo[3,4-b]piridinas policíclicas fundidas. A síntese foi realizada em duas etapas, iniciando com a preparação das naftonas α,β-insaturadas e sua posterior ciclocondensação com 5-amino-1-fenil-3-metil-1H-pirazol. As vantagens desta abordagem incluem simplicidade, eficiência atômica, seletividade e bom rendimento em condições de mínimo impacto ambiental. Rota sintética para a obtenção de N-heterociclos com pontos específicos de diversificação estrutural que são de interesse para a exploração de suas propriedades biológicas.
Palavras-chaves:
5-aminopirazol, ciclocondensação, derivados de pirazol fundidos, pirazolo[3,4-b]piridina, síntese por ultrassom..Introducción
En el desarrollo de la química orgánica, los compuestos heterocíclicos han contribuido sustancialmente. El remplazo de átomos de carbono/subestructuras de carbono por heteroátomos (N, O, S, Se) en compuestos alifáticos, e incluso en otros heterociclos, genera diversidad estructural y molecular, lo que a su vez implica potenciales aplicaciones que incluyen versatilidad sintética y actividad biológica (Brandão et al., 2019; Jampilek, 2019). Desde el punto de vista químico, estas modificaciones estructurales son posibles porque los remplazos son isostéricos, lo cual genera una variada biblioteca molecular en la que los N-heterociclos se encuentran con mayor frecuencia, con variaciones de la cantidad y posición de los átomos de N, en combinación con otros heteroátomos y en anillos de cinco o seis miembros. Los N-heterociclos, tanto los aislados de fuentes naturales (Bhardwaj et al., 2021) como los sintetizados (Mermer et al., 2021), constituyen más del 60 % de todos los andamios N-heterocíclicos biológicamente activos (Kuznetsov 2021; Murlykina et al., 2018).
Dentro de estos andamios moleculares, los derivados azólicos, específicamente los 5-amino-pirazoles, son considerados núcleos únicos que combinan propiedades estructurales, eléctricas y electrónicas, así como una relación estructura-actividad (Dwivedi et al., 2018), las cuales permiten explorar transformaciones químicas para incorporar diversidad molecular y también aplicaciones como bloques de construcción versátiles en la síntesis de sistemas heterocíclicos fusionados (Arias-Gómez et al., 2021; Shaabani et al., 2019; Murlykina et al., 2018; Polo et al., 2017). A partir de 5-amino-pirazoles, se puede acceder a heterociclos fusionados de tipo pirazolopiridínico (PPd) (Ramírez, et al., 2021) a través de diferentes estrategias sintéticas, que incluyen reacciones convencionales (Zhai, et al., 2019; Baradarani et al., 2018), multicomponentes one-pot (Arlan et al., 2020; Afsar et al., 2018; Ezzati, et al., 2018; Hill et al., 2016), ciclocondensación (Hu et al., 2018) o protocolos tándem (Aggarwal and Kumar 2018). Los sistemas PPd están conformados por cinco isómeros (los [3,4-b], [3,4-c], [4,3-c], [4,3-b] y [1,5-a]), entre los que resaltan las pirazolo[3,4-b]piridinas-PPd, sistemas bicíclicos de variado potencial biológico (Donaire-Arias et al., 2022; Vidali et al., 2022; Ramírez et al., 2021; Eagon et al., 2020; Zhai et al., 2019; Mekky and Sanad, 2019; Patnaik et al., 2019; Quiroga et al., 2017; Hill et al., 2016) combinado con un amplio alcance sintético (Gouda et al., 2020; Aly et al., 2019) (Figura 1).
Figura 1: Estructuras de pirazolopiridinas fusionadas a partir de 5-aminopirazoles
Los reportes incluyen metodologías que incorporan diseño racional para la síntesis y evaluación de pirazolo[3,4-b]piridinas-PPd como nuevos bloqueadores de canales TASK-3 en humanos (Ramírez et al., 2021); en procedimientos quimioselectivos de acoplamiento cruzado Suzuki-Miyaura (Tandon et al., 2018); en pirazolo[3,4-b]piridinas obtenidas vía reacción Aza-Diels-Alder e inducidas por irradiación de microondas (Quiroga et al., 2017); en la síntesis multicomponente entre 5-amino-pirazoles, metilenactivos y derivados carbonílicos (Eagon et al., 2020; Hill et al., 2016) en presencia de catalizadores heterogéneos (Kalhor et al., 2021; Arlan et al., 2020; Afsar et al., 2018; Ezzati et al., 2018), incluyendo procesos de deaminación reductiva (Zhai et al., 2019) y reacciones inducidas por radiación de microondas y ultrasonido (Polo et al., 2017). También hay numerosos reportes de síntesis de pirazolo[3,4-b]piridinas en condiciones de bajo impacto ambiental, anulaciones entre 5-amino-pirazoles y β-dicetonas (Hu et al., 2018) en medio acuoso (Baradarani et al., 2018) y diferentes tipos de reactivos electrofílicos como aldehídos, cetonas, β-cetoésteres, y cetonas α,β-insaturadas (Vidali et al., 2022; Dyadyuchenko and Dmitrieva, 2020; Shaabani et al., 2019; Aggarwal and Kumar, 2018).
Considerando la utilidad y la importancia de los 5-amino-pirazoles en la construcción de derivados de pirazólicos, y continuando con nuestra línea de investigación en síntesis de compuestos heterocíclicos, este manuscrito describe la síntesis en dos etapas de nuevos derivados pirazolo[3,4-b]piridínicos PPd 5 1,4,6-aril sustituidos, a partir de 6-metoxi-2-naftaldehído, cetonas aromáticas y 5-amino-1-fenil-3-metil-1H-pirazol vía reacción de ciclocondensación (Figura 2).
Figura 2: Estructura de pirazolo[3,4-b]piridínicos PPd 5
Metodología
Las cetonas α,β-insaturadas 3 se sintetizaron siguiendo la metodología clásica de Claisen-Schmidt (Leitão, 2020), ampliando el alcance sintético en la obtención de pirazolo[3,4-b]piridinas 5 vía reacción de ciclocondensación de Michael (Trilleras et al., 2018). Los reactivos, solventes y catalizadores empleados en este trabajo fueron adquiridos comercialmente (Sigma-Aldrich o Merck). El progreso de las reacciones se realizó por cromatografía de capa delgada (CCD), con placas Merck sílica 60 F254 que fueron reveladas con luz UV (254 y 365 nm).
Los puntos de fusión se determinaron usando un fusiómetro (Thermo Scientific, modelo IA 9100/Capillary) sin corrección. Los espectros de resonancia magnética nuclear (RMN) 1H y 13C (DEPT-135) se registraron en un espectrofotómetro Bruker Advance operado a 400 y 100 MHz respectivamente, usando TMS como estándar interno (d, 0,0 ppm) y CDCl3 y DMSO-d 6 como solventes. Las señales de RMN se reportan en ppm y las constantes de acoplamiento (J) en Hertz. Los espectros de masas se registraron en un espectrómetro Thermo Fisher Scientific (Waltham, MA, USA) GC-MS, modelo DSQII, utilizando una sonda de inserción directa y la técnica de ionización por impacto de electrones (70 eV).
La inducción de la reacción por radiación ultrasónica se realizó en un baño limpiador ultrasónico Branson, modelo 1510, 115v, 1.9 L, con temporizador mecánico (60 min con retención continua) e interruptor de calentador. Los compuestos 3 y 5 se obtuvieron como sólidos, fueron aislados por filtración y purificados por recristalización de etanol.
Síntesis de (E)-1-aril-3-(6-metoxinaft-2- il)-2-propen-1-onas 3: En un balón esmerilado de 25 mL, se adicionaron 1 mmol del aldehído 1 (6-metoxi-2-naftaldehido) y 1.5 mmol de la cetona aromática 2. Se adicionaron 10 mL de etanol y 1.0 mL de una solución acuosa de NaOH 40 %. Con la mezcla de reacción, al balón se le conectó un condensador simple para controlar vapores, y se llevó a sonicación por 5 a 20 minutos.
Síntesis de 1-fenil-3-metil-6-(aril)-4-(6-metoxinaft-2-il)-1H-pirazol[3,4-b]piridinas: En un balón esmerilado de 25 mL, se adicionaron 1 mmol de naftonas α,β-insaturadas 3, 5 mL de H3CCOOH y 5 mmol de 5-amino-1-fenil-3-metil-1H-pirazol 4. Con la mezcla de reacción, al balón se le conectó un condensador simple para controlar vapores, y se llevó a sonicación por 30 a 60 minutos.
Datos analíticos y espectroscópicos
Los compuestos sintetizados se caracterizaron estructuralmente por técnicas espectroscópicas de RMN (1H, 13C y DEPT-135) y GC-MS. Los datos para cada uno de ellos se detallan a continuación:
(2E)-1-Fenil-3-(6-metoxinaft-2-il)-2-propen-1-ona 3a. Sólido amarillo. Rend. 80 %. P.f.: 165-168 ºC. RMN 1H (400 MHz, DMSO-d 6) δ ppm: 8.26 (s, 1H), 8.17 (d, J = 7.7 Hz, 2H, Ho), 8.05 (d, J = 8.6 Hz, 1H), 7.98 (d, J = 15.6 Hz, 1H, Hβ), 7.90 - 7.86 (m, 3H), 7.68 (t, 1H, Hm), 7.59 (s, 1H), 7.57 (d, J = 15.6 Hz, 1H, Hα), 7.38 (s, 1H), 7.21 (d, 1H), 3.90 (s, 3H, CH3). RMN 13C (100 MHz, DMSO-d 6) δ ppm: 189.2 (C=O), 158.6, 144.4 (Cβ), 137.8 (Ci), 135.6, 133.1 (Cp), 130.7, 130.2, 130.1, 128.8 (Cm), 128.4 (Co), 128.3, 127.4, 125.1 (Cα), 121.2, 119.3, 106.4, 55.4 (CH3). MS (70 eV): m/z (abundancia relativa) 288 (M+, 100 %), 273 (10 %), 211 (18 %), 158 (31 %), 139 (44 %), 77 (80 %).
(2E)-1-(4-Metoxifenil)-3-(6-metoxinaft-2-il)-2-propen-1-ona 3b. Sólido amarillo. Rend. 85 %. P.f.: 189-193 ºC. RMN 1H (400 MHz, CDCl3) δ ppm: 8.06 (d, J = 8.2 Hz, 2H, Ho), 7.96 (s, 1H), 7.93 (d, J = 15.8 Hz, 1H, Hβ), 7.79-7.75 (m, 3H), 7.59 (d, J = 15.8 Hz, 1H, Hα), 7.19-7.14 (m, 2H), 6.99 (d, J = 8.2 Hz, 2H, Hm), 3.94 (s, 3H, OCH3), 3.90 (s, 3H, OCH3). RMN 13C (100 MHz, CDCl3) δ ppm: 188.9 (C=O), 163.5 (Cp), 159.0, 144.5 (Cβ), 135.9, 131.5, 130.9 (Co), 130.6 (Ci), 130.4, 130.3, 128.9, 127.6, 124.6 (Cα), 121.1, 119.6, 113.9 (Cm), 106.2, 55.6 (OCH3), 55.5 (OCH3). MS (70 eV): m/z (abundancia relativa) 318 (M+, 100 %), 303 (18 %), 183 (10 %), 158 (41 %), 135 (85 %), 77 (69 %).
(2E)-1-(3,4-Dimetoxifenil)-3-(6-metoxinaft-2-il)-2-propen-1-ona 3c. Sólido amarillo. Rend. 83 %. P.f.: 126-129 ºC. RMN 1H (400 MHz, CDCl3) δ ppm: 7.96 (s, 1H), 7.93 (s, J = 15.0 Hz, 1H, Hβ), 7.79-7.71 (m, 4H), 7.65-7.60 (m, 2H, Hα), 7.19-7.15 (m, 2H), 6.93 (d, 1H), 3.98 (s, 3H, OCH3), 3.97 (s, 3H, OCH3), 3.94 (s, 3H, OCH3). RMN 13C (100 MHz, CDCl3) δ ppm: 188.8 (C=O), 159.0, 153.3, 149.4, 144.5 (Cβ), 135.9, 131.7, 130.6, 130.4, 130.3, 128.9, 127.6, 124.6 (Cα), 123.1, 120.9, 119.6, 111.0, 110.1, 106.2, 56.23 (OCH3), 56.21 (OCH3), 55.5 (OCH3). MS (70 eV): m/z (abundancia relativa) 348 (M+, 100 %), 317 (33 %), 211 (12 %), 165 (36 %), 139 (35 %), 77 (24 %).
(2E)-1-(4-Clorofenil)-3-(6-metoxinaftalen-2-il)-2-propen-1-ona 3d. Sólido amarillo. Rend. 80 %. P.f.: 166-167 ºC. RMN 1H (400 MHz, CDCl3) δ ppm: 7.98 (d, 2H, J = 8.3 Hz, Ho), 7.97-7.93 (t, 2H), 7.79-7.75 (t, 3H, J = 15.5 Hz, 1H, Hβ), 7.50 (d, J = 15.5 Hz, 1H, Hα), 7.47 (d, J = 8.3 Hz, 2H, Hm), 7.20-7.14 (m, 2H), 3.94 (s, 3H, OCH3). RMN 13C (100 MHz, CDCl3) δ ppm: 189.3 (C=O), 159.2 (C-O), 145.9 (Cβ), 139.2 (Cp), 136.9, 136.1, 130.8, 130.4, 130.2, 130.0, 129.1 (Cm), 128.9, 127.7, 124.5 (Cα), 120.7, 119.7, 106.2, 55.6 (OCH3). MS (70 eV): m/z (abundancia relativa) 322 (M+, 100 %), 321 (76 %), 287 (26 %), 211 (20 %), 158 (28 %), 139 (87 %), 111 (55 %), 75 (30 %).
(2E)-1-(4-Bromofenil)-3-(6-metoxinaftalen-2-il)-2-propen-1-ona 3e. Sólido amarillo. Rend. 80 %. P.f.: 188-191 ºC. RMN 1H (400 MHz, CDCl3) δ ppm: 7.94 (t, 2H), 7.91 (d, J = 8.5 Hz, 2H, Ho), 7.80-7.76 (t, 3H, J = 15.5 Hz, Hβ), 7.65 (d, J = 8.5 Hz, 2H, Hm), 7.52 (d, J = 15.5 Hz, 1H, Hα), 7.20-7.15 (m, 2H), 3.95 (s, 3H, OCH3). RMN 13C (100 MHz, CDCl3) δ ppm:189.5 (C=O), 159.2, 145.9 (Cβ), 137.3, 136.5, 136.1, 132.1, 130.9, 130.4, 130.2, 127.7, 124.5 (Cα), 120.7, 119.7, 106.2, 55.6 (OCH3). MS (70 eV): m/z (abundancia relativa) 368 (51 %), 366 (M+, 54 %), 287 (33 %), 215 (35 %), 183 (62 %), 139 (100 %), 114 (49 %), 77 (32 %).
1.6-Difenil-3-metil-4-(6-metoxinaft-2-il)-1H-pirazol[3,4-b]piridina 5a. Sólido amarillo. Rend. 80 %. P.f.: 248-250 ºC. RMN 1H (400 MHz, DMSO-d 6) δ ppm: 8.60 (s, 1H, H5), 8.30 (t, 2H, Ho 6-Ph), 8.06-7.88 (m, 5H), 7.61-7.44 (m, 7H), 7.28-7.23 (m, 2H), 3.93 (s, 3H, OCH3), 1.94 (s, 3H, OCH3). RMN 13C (100 MHz, DMSO-d 6) δ ppm: 157.9, 149.6, 145.7, 143.4, 141.5, 139.5, 138.5, 134.1, 132.6, 129.7, 129.3, 129.1, 128.5, 128.0, 127.5, 126.5, 124.9, 120.4, 119.5, 119.0, 115.1, 106.0, 55.3 (OCH3), 14.4 (CH3). MS (70 eV): m/z (abundancia relativa) 442 (22 %), 441 (M+, 100 %), 440 (6 %), 440 (63 %).
1-Fenil-3-metil-6-(4-metoxifenil)-4-(6-metoxinaft-2-il)-1H-pirazol[3,4-b]piridina 5b. Sólido amarillo. Rend. 85 %. P.f.: 235-237 ºC. RMN 1H (400 MHz, DMSO-d 6) δ ppm: 8.39 (d, J = 8.1 Hz, 2H, Ho, 1-Ph), 8.26 (d, J = 8.9 Hz, 2H, Ho, 6-aril), 8.16 (s, 1H), 8.01-7.98 (m, 2H), 7.80 (s, 1H, H5), 7.74 (d, 1H), 7.58 (t, 2H, Hm, 1-Ph), 7.45 (s, 1H), 7.31 (t, 1H, Hp, 1-Ph), 7.08 (d, J = 8.9 Hz, 2H, Hm, 6-aril), 3.93 (s, 3H, OCH3), 3.84 (s, 3H, OCH3), 2.25 (s, 3H, CH3). RMN 13C (100 MHz, DMSO-d 6) δ ppm: 160.7, 158.0, 155.6, 151.2, 146.5, 142.2, 139.3, 134.3, 131.1, 130.7, 129.9, 129.1, 128.9, 128.4, 126.7, 120.3, 119.3, 114.7, 114.3, 113.4, 112.9, 105.9, 55.3 (OCH3), 15.4 (CH3). MS (70 eV): m/z (abundancia relativa) 472 (MH+, 35 %), 471 (M+, 100 %), 470 (11 %).
1-Fenil-3-metil-6-(3,4-dimetoxifenil)-4-(6-metoxinaft-2-il)-1H-pirazol[3,4-b]piridina 5c. Sólido amarillo. Rend. 83 %. P.f.: 207-209 ºC. RMN 1H (400 MHz, DMSO-d 6) δ ppm: 8.37 (d, J = 8.0 Hz, 2H), 8.18 (s, 1H, H5), 7.89 (m, 3H), 7.77 (s, 1H), 7.60-7.45 (m, 5H), 7.36-7.24 (m, 2H), 7.10 (t, 1H), 3.93 (s, 3H, OCH3), 3.91 (s, 3H, OCH3), 3.84 (s, 3H, OCH3), 2.26 (s, 3H, CH3). RMN 13C (100 MHz, DMSO-d 6) δ ppm: 172.1, 129.1, 129.0, 126.3, 124.7, 122.7, 120.2, 119.4, 119.0, 113.2, 111.2, 106.0, 55.6 (OCH3), 21.5 (CH3). MS (70 eV): m/z (abundancia relativa) 502 (MH+, 37 %), 501 (M+, 100 %), 500 (18 %), 455 (9 %).
1-Fenil-3-metil-6-(4-bromofenil)-4-(6-metoxinaft-2-il)-1H-pirazol[3,4-b]piridina 5e. Sólido amarillo. Rend. 81 %. P.f.: 222-224 ºC. RMN 1H (400 MHz, DMSO-d 6) δ ppm: 8.78 (s, 1H), 8.36-8.20 (m, 3H), 8.01-7.91 (m, 4H), 7.80-7.46 (m, 6H), 7.36-7.24 (m, 2H), 3.94 (s, 3H, OCH3), 2,29 (s, 3H, CH3). RMN 13C (100 MHz, DMSO-d 6) δ ppm: 158.1, 156.9, 137.7, 135.9, 131.9, 131.7, 129.9, 129.5, 129.4, 129.2, 120.5, 55.3 (OCH3), 24.1 (CH3). MS (70 eV): m/z (abundancia relativa) 521/519 (M+/M++, 100 %/86 %), 520 (38 %), 518 (9 %).
1-Fenil-3-metil-6-(4-fluorofenil)-4-(6-metoxinaft-2-il)-1H-pirazol[3,4-b]piridina 5f. Sólido amarillo. Rend. 80 %. P.f.: 232-235 ºC. RMN 1H (400 MHz, DMSO-d 6) δ ppm: 8.36 (m, 4H), 8.18 (s, 1H, H5), 8.00 (t, J = 7.8 Hz, 2H, Hm, 6-aril), 7.87 (s, 1H), 7.76 (s, 1H), 7.60 (t, J = 7.8 Hz, 2H, Hm, 1-Ph), 7.46 (s, 1H), 7.39-7.32 (m, 3H), 7.26 (d, 1H) 3.93 (s, 1H, OCH3), 2.27 (s, 1H, CH3). RMN 13C (100 MHz, DMSO-d 6) δ ppm: 158.1, 154.7, 151.1, 146.9, 142.3, 139.2, 135.9, 134.4, 131.8, 129.7, 129.2, 128.5, 125.5, 120.4, 119.4, 115.9, 115.6, 115.2, 113.1, 105.9, 55.3, 15.4. MS (70 eV): m/z (abundancia relativa) 460 (MH+, 34 %), 459 (M+, 100 %), 458 (12 %).
Resultados
La exploración de transformaciones químicas, incluyendo las adaptaciones de reacciones clásicas con enfoque de bajo impacto ambiental, mediante protocolos en los que se usa fuente de energía eficiente para promover las reacciones, es uno de los aspectos que se han considerado en la síntesis de N-heterocíclicos (Saranya et al., 2021). Este enfoque constituye un modelo para explorar los alcances sintéticos de 5-amino-1-fenil-3-metil-1H-pirazol 4, junto con la disponibilidad y diversidad de reactantes, a través de secuencias de reacciones conocidas para obtener 1-fenil-3-metil-6-(aril)-4-(6-metoxinaft-2-il)-1H-pirazol[3,4-b]piridinas (PPd 5) (Figura 3).
Figura 3: Análisis retrosintético para la obtención de pirazolo[3,4-b]piridina-PPd 5.
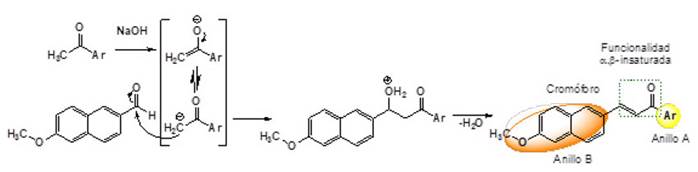
Partiendo de 5-amino-1-fenil-3-metil-1-H-pirazol 4 como el reactivo binucleófilo, la estrategia de construcción de PPd 5 requiere de synthons bielectrofílicos. Entre la variedad de synthons bielectrofílicos, los sistemas dicarbonílicos han sido utilizados para este tipo de anulaciones (Hu et al., 2018; Baradarani et al., 2018). Sin embargo, los sistemas dicarbonílicos limitan la diversidad y la variabilidad estructural, además de aumentar los pasos sintéticos para la obtención de derivados PPd (Zhang et al., 2020). A diferencia de esto, los sistemas α,β-insaturados permiten desarrollar protocolos con menos pasos de síntesis, empleando reactivos baratos y reduciendo la cantidad de desechos generados (Vidali et al., 2022; Dyadyuchenko and Dmitrieva, 2020; Shaabani et al., 2019; Aggarwal and Kumar, 2018). Con esto en mente, se implementó una estrategia sintética de dos etapas para la obtención de PPd, partiendo de la síntesis de cetonas sistemas α,β-insaturadas, a través de la reacción de condensación aldólica cruzada de Claisen-Schmidt (Yadav and Wagh, 2020) (Figura 4).
Figura 4: Síntesis en dos pasos para la obtención de pirazolo[3,4-b]piridinas PPd 5.
La etapa 1 es una reacción clásica y versátil en la construcción de enlaces dobles C=C y la unión de anillos aromáticos con sustituyentes de diferente naturaleza. Bajo estas condiciones, se indujo la reacción por radiación de ultrasonido por un tiempo no mayor a 20 min, produciendo las respectivas chalconas 3 con buen rendimiento (Figura 4). Desde esta etapa, se incluyeron el reconocido cromóforo 6-metoxinaft-2-il (Makar et al., 2019; Mikie and Osaka, 2018; Trilleras et al., 2018) y sustituyentes aromáticos en posición 4 y 6 de la PPd 5, ambos enlazados desde la chalcona inicial. Las chalconas 3 amplían la biblioteca molecular de los derivados PPd 5, y la inducción de la reacción por radiación ultrasonido mejora la conversión y la selectividad de la transformación, lo que deriva en un proceso limpio, de fácil aislamiento del producto, con poca cantidad y complejidad en la utilización del catalizador y con mínima generación de desechos, características de una metodología de bajo impacto ambiental. La reacción de Claisen-Schmidt catalizada por NaOH inició con la eliminación de un protón del Cα de la cetona para formar un ion enolato. La formación del nuevo enlace doble C=C tuvo lugar mediante el ataque nucleofílico del enolato sobre el carbono carbonílico electrofílico del aldehído. Por último, se llevó a cabo la eliminación de agua para formar la chalcona 3 (Figura 5). Preparadas las chalconas 3, se exploró el alcance sintético de estos derivados α,β-insaturados, considerados como herramienta átomo-eficiente en la síntesis de compuestos N-heterociclos, en específico de sistemas PPd 5 policíclicos fusionados.
Figura 5: Mecanismo propuesto para la reacción de Claisen-Schmidt catalizada por base
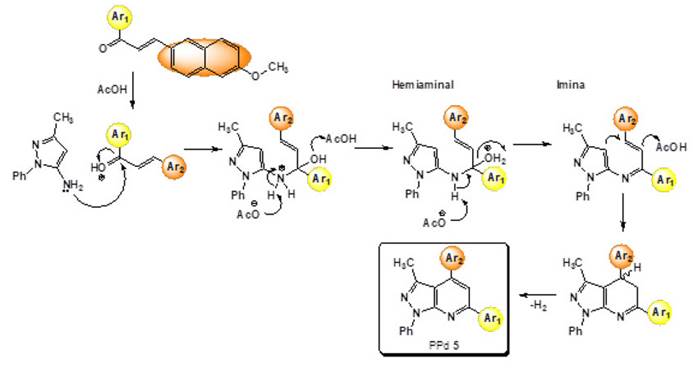
En la etapa 2, la formación de PPd 5 se llevó a cabo a través de una reacción de ciclocondensación de Michael. La variación de los parámetros de la reacción, como el solvente, la catálisis y la razón molar de los reactantes permitió encontrar las condiciones de reacción apropiadas para la obtención de 1-fenil-3-metil-6-(aril)-4-(6-metoxinaft-2-il)-1H-pirazol[3,4-b]piridinas (PPd 5) en menos tiempo y con un mayor rendimiento (Figura 4). La reacción catalizada por ácido acético, con un exceso del reactivo binucleofílico 4, e inducida por radiación de ultrasonido, promueve la reacción de ciclocondensación entre las naftonas α,β-insaturadas 3 y el posterior ataque nucleofílico del 5-amino-1-fenil-3-metil-1H-pirazol 4 y la generación de PPd 5 aromatizada. Bajo las condiciones de la reacción de ciclocondensación, es plausible considerar que el mecanismo inicia con un ataque nucleofílico entre el grupo amino al carbono carbonílico protonado en medio ácido, formando un hemiaminal intermediario, seguido de una deshidratación para generar una imina. La reacción de ciclación de Michael intramolecular entre el doble enlace de la chalcona y el C-4 del 5-amino-1-fenil-3-metil-1H-pirazol 4, debido al carácter π-excedente, y la eliminación de hidrógeno molecular generan el anillo piridínico y proporcionan el producto aromatizado estable PPd 5 (Figura 6). Una probable explicación para la aromatización oxidativa del anillo piridínico bajo estas condiciones de reacción podría ser un aumento en la susceptibilidad de la chalcona al ataque nucleofílico del 5-amino-1-fenil-3-metil-1H-pirazol 4 por la presencia del AcOH. El ion acetato generado in situ favorece el cierre del anillo al abstraer un protón, generando un derivado PPd parcialmente hidrogenado, el cual, bajo las condiciones de la reacción, favorece la oxidación hacia el producto aromático estable, sin incluir un agente oxidante (Polo et al., 2017; Quiroga, 2019).
Figura 6: Formación de PPd 5 a través de una ciclocondensación de Michael intramolecular.
La reacción entre las naftonas α,β-insaturadas 3 y el 5-amino-1-fenil-3-metil-1H-pirazol 4 se llevó a cabo en una ruta sintética selectiva de bajo impacto ambiental para la construcción de sistemas pirazolo[3,4-b]piridínicos 5. Dentro del contexto estructural de las PPd 5, los sustituyentes naftil en posición C-4 y aril en posición C-6 extendieron la conjugación π de estos sistemas, cuyas propiedades luminiscentes se hicieron evidentes (Mikie and Osaka, 2018; Trilleras et al., 2018). Además de esto, se asoció la actividad biológica, de acuerdo con reportes de estudios de relación estructura-actividad (Donaire-Arias et al., 2022; Eagon et al., 2020; Patnaik et al., 2019; Quiroga et al., 2017; Hill et al., 2016).
Ambos protocolos (etapa 1 y 2) muestran tolerancia a la diferente naturaleza de los grupos sustituyentes (electrodonadores y electroatrayentes), lo cual resulta en buenos rendimientos de reacción después de la purificación. Estos valores del rendimiento final calculado no evidencian influencia de la electronegatividad de los sustituyentes sobre las naftonas α,β-insaturadas 3, y tampoco sobre PPd 5. Los compuestos obtenidos fueron caracterizados mediante técnicas espectroscópicas de resonancia magnética nuclear (RMN 1H, 13C y DEPT-135) y análisis de espectrometría de masas. Los espectros de RMN 1H mostraron señales estructurales características. En el caso de las naftonas α,β-insaturadas 3, se observaron, en la región aromática, las señales y el patrón de multiplicidad (doblete) para los protones Hβ y Hα del fragmento enónico, con constantes de acoplamiento (J ) mayores a 15 Hz, lo cual está relacionado con la configuración E- de estos protones. Para los derivados PPd 5, a campo alto se evidenciaron señales para los protones alifáticos; y, a campo bajo, en la región aromática, un singulete entre 8.60 y 7.80 ppm, correspondiente al H5 del anillo piridínico. Los tiempos de reacción para la síntesis de las chalconas α,β-insaturadas 3 y derivados pirazolo[3,4-b]piridínicos 5, así como los datos fisicoquímicos, se detallan en la Tabla 1. Los espectros de los compuestos sintetizados se anexan como información complementaria.
Tabla 1: Datos fisicoquímicos de los compuestos α,β
-insaturados 3 y derivados pirazolo[3,4-b]piridínicos 5
.

Conclusiones
Este trabajo describe la síntesis de naftonas α,β-insaturadas, un reconocido cromóforo, y su conversión a derivados pirazolo[3,4-b]piridínicos con patrones de sustitución policíclicos aromáticos en N1, C3, C4 y C6. La síntesis para esta clase compuestos heterocíclicos se realizó a través de la construcción del anillo piridínico sobre un derivado 5-aminopirazol, que actúa como un 1,3-NCC-binucleófilo, reaccionando con 1,3-CCC-bielectrófilo (naftonas α,β-insaturadas). La reacción asistida por radiación de ultrasonido es efectiva y resulta en productos con buen rendimiento, evitando procesos adicionales de purificación. Además, el procedimiento proporciona varias ventajas, que incluyen condiciones suaves para las reacciones, selectividad y simplicidad de operación, características de protocolos de bajo impacto ambiental. Estos resultados permiten acceder a nuevos sistemas heterocíclicos fusionados, con potenciales aplicaciones que aún se encuentran en estudio.
Acknowledgements
Agradecimientos
Expresamos nuestra gratitud al Grupo de Investigación en Compuestos Heterocíclicos de la Universidad del Atlántico (Puerto Colombia, Atlántico, Colombia).
Referencias
Licencia
Derechos de autor 2023 Jorge Trilleras, Freddy Ríos-De-La-Rotta, Luis-Felipe Pedroza-García

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial-CompartirIgual 4.0.
El (los) autor(es) al enviar su artículo a la Revista Científica certifica que su manuscrito no ha sido, ni será presentado ni publicado en ninguna otra revista científica.
Dentro de las políticas editoriales establecidas para la Revista Científica en ninguna etapa del proceso editorial se establecen costos, el envío de artículos, la edición, publicación y posterior descarga de los contenidos es de manera gratuita dado que la revista es una publicación académica sin ánimo de lucro.



![Estructura de pirazolo[3,4-b]piridínicos PPd 5](https://revistas.udistrital.edu.co/index.php/revcie/article/download/19651/version/18457/19491/131337/2344-8350-cient-47-1-gf2.jpg)
![Análisis retrosintético para la obtención de pirazolo[3,4-b]piridina-PPd 5.](https://revistas.udistrital.edu.co/index.php/revcie/article/download/19651/version/18457/19491/131338/2344-8350-cient-47-1-gf3.jpg)
![Síntesis en dos pasos para la obtención de pirazolo[3,4-b]piridinas PPd 5.](https://revistas.udistrital.edu.co/index.php/revcie/article/download/19651/version/18457/19491/131339/2344-8350-cient-47-1-gf4.jpg)