DOI:
https://doi.org/10.14483/23448350.354Published:
11/30/2006Issue:
No. 9 (2007): Enero-diciembreSection:
Ciencias BásicasEfecto del medio básico, carbón activado, ácido giberélico y calidad de luz en la germinación in vitro de Masdevallia auropurpurea Reich
Effect of basál medium, activated charcoal, gibberellic acid and lightquality in the germination in vitro, of Masdevallia auropurpurea Reich
Keywords:
Masdevallia auropurpurea, orquídea, germinación in vitro, ácido giberélico (GA3 ), carbón activado, calidad de luz (es).Keywords:
Masdevallia auropurpurea, orchids, in vitro germination, gibberellic acid (GA3), activated charcoal, light quality. (en).Downloads
References
Arditti, J.; Ernst, R., Micropropagation of orchids, New York, John Wiley and Sons, 1993, pp. 87-607.
Azcon, J. ; Talon, M., Fundamentos de fisiología vegetal, Madrid, McGraw-Hill, 2000.
Bergareche, C.; Moysset, L., El fotocromo, en Azcon Bieto, J. y Talon, M.
Fisiología y bioquímica vegetal, Bogotá, McGraw-Hill, 1993, pp. 397-417.
Borthwick, A reversible photoreaction controlling seed germination. Proc. Natl. Acad. Sci., U. S., 38: 662-666, 1952, en Moreira de Carvalho, N. y Nakagawa, J. (ed.). Semillas: ciencia, tecnología y producción. Montevideo, Agropecuarioemisferio Sur, 1988, p. 150.
Bowles, M.; Jacobs, K.; Zettler, L.; Delaney, T., Cróssing effects on seed
viability and experimental germination of the federal threatened Platanthera leucophoea (orchidaceae). Rodora 104: 14-30; 2002.
Cañas, B. M., Metodologías in vitro de vegetales, Bucaramanga, UIS, 1993.
Casal, J.,"Fotomorfogénesis: la luz como factor regulador del crecimiento", en Azcon, J. y Talon, M., Fundamentos de fisiología vegetal, Madrid, McGraw-Hill, 2000; pp. 377-388.
Chan, C.; Chang, W. C., "Micropropagation of Cymbidium ensifolium var. Misericors through callus-derived rhizomes", Vitro Cell. Dev. Biol. Plant. 36: 517-520, 2000.
Chen, J.; Chang, W., "Induction of repetitive embryogenesis from seedderived protocorms of Phalaenopsis amabais var. formosa shimadzu", Vitro Cell. Dev. Biol. Plant. 40: 290-293, 2004.
Chen, L.; Pan, R.; Chen, R., "Effects of media, growth'regulators and dividing on the growth of Cymbidium sinense protocorm cultured in vitro", J. Trop. and Subtrop. Bot. 7: 59-64, 1999.
Chen, T.; Cheng, J. T.; Chang, W., "Multiple shoot formation and plant regeneration from stem nodal explants of Paphiopedilum orchids", Vitro Cell. Dev. Biol. Plant. 38:595-597, 2002.
Chen. L.,"A simple tissue culture method developed to accelerate growth of plant tissues", J. Prim. Ind. 6 (2): 116-123; 1978.
Cordonnier, M., "Monoclonal ·antibodies: Molecular probes for the study of phytochrome", Photochemestry and photobiology 49: 821-831; 1989.
Devesa, J. A., "Plantas con semilla'; en Tzco, J. (ed.), Botánica. Madrid, McGraw-Hill, 1997, pp. 541-580.
Dixon, K.,"Raising terrestrial orchids from seed", en Harris,.W. K.,(ed.), Modem orchid growing for pleasure and profit. Adelaide, Orchid Club of South Australia, Inc., 1987, pp. 47-100.
Ernst, R., "The use bf activate charcoal in asymbiotic seedling culture of Phapiopedilum". Am Orch. Soc. Boll., January: 35-38, 1974.
Gómez, K. R., "Cultivó de células y tejidos", en Pérez Ponce, J. N. (ed.), Propagación y mejora genética de plantas por biotecnología,Cuba, Instituto de biotecnología de las plantas, 1998, p. 32.
González, A., Econtro Nacional de orquidófilos pela Sociedad Brasilera de Orquidófilos (SBO), Copacabane Palace, Rio de Janeiro, Brazil, 1980.
Grillo, M.; Peña, E.; Pérez, D., "Germinación masiva in vitro de algunas especies de orquídeas en el Jardín Botánico Nacional", Revista del Jardín Botánico Nacional. (Universidad de la Habana), 6 (2): 95-100,1985.
Hartman, H.; Kester, D.; Davies, F.; Geneve, R., Plant propagation: principies and practices. Sixth edition, New Jersey, Prentice-Hall, Inc., 1997, pp. 192.
Instituto Alexander von Humboldt, Informe nacional sobre el estado de biodiversidad: Especies de plantas superiores amenazadas, Colombia, 1997.
Jiménez, E. A., "Cultivo de ápices y meristemos", en Pérez. Ponce, J. N. (ed.), Propagación y mejora genética de plantas por biotecnología, Cuba, Instituto de Biotecnología de las plantas,1998, pp. 45-56.
Karp, G., Biología celular y molecular, México, McGraw-Hill, 1998.
Knudson, C., "A new nutrient solution for the germination of orchid seeds", Am. Orchid. Soc. Bull. 14: 214-217, 1946.
Krikorian, A. D., "Propagación clonal in vitro", en Roca, W. & Mroginski, L. (eds.), Cultivo de tejidos en la agricultura: fundamentos y aplicaciones, Cali, CIAT, 1991, pp. 96-125.
Kushnir, G. P., Metody massovogo razmnozheniya (Orquídeas: métodos de multiplicación masiva). Jardín Botánico Central A.C. de la RSS de Ucrania, Kiev, URSS. Tsvetovodstvo. 5 (13-14): 33-34; 1985.
Labouriau, L. G., A germinaffio das sementes, Washington, Secretaría General de la OEA: Monografía 24: 174, 1983.
Lee, Y. I; Lee, N.,"Plant regeneration from protocorm-derived callus of Cypripedium formosanum". Vitro Cell. Dev. Biol. Plant 39: 475-482; 2003.
Lin, Y. J.; Chen, C.; Yeh, E; Chiu, N.; Tsay, H., "Tissue culture of Bletilla formosana. 1. The influence of seed maturity and pretreatment on seed germination and seedling development", J. Agric. Res. China. 43: 40-50; 1994.
Margara, J., Multiplicación vegetativa y cultivo in vitro: los meristemos y la organogénesis, Madrid, Mundi-prensa"; 1988.
Martin, K., "Clonal propagation, encapsulation and reintroduction of Ispea malabarica (Reich. f.) J. D. Hook, an endangered orchid", Vitro Cell. Dev. Biol. Plant. 39: 322-328; 2003.
Martínez, A. P.; Rubluo, A., "In vitro mass propagation and population recovery of endangered tropical orchids", en Angarita, A. (ed.), International Congress of plant tissue culture of tropical species (Abstracts), Bogotá, 1997, pp. 56.
Mohr, H., Plant physiology, Berlin, Springer-Verlag, 1995.
Murashige,T.; Skoog, E, "A revised medium for rapid growth and bioassays with tobacco tissue cultures", Physiol. Plant. 15: 473-479; 1962.
Murthy, H.; Pyati. A., "Micropropagation of Aerides maculosum Lindl" (Orchidaceae), Vitro Cell. Dev. Biol. Plant 37: 223-226; 2001.
Navarro, M., Programa de germinación in vitro en el Pahuma. Programa de conservación de la Fundación la Ceiba, para la conservación tropical en la reserva orquideológica el Pahuma, al noroccidente de Quito, Ecuador. Marzo de 2000: 1-11.
Nayak, N.; Rath, S.; Patnaik, S., High frequency plant regeneration from alginate encapsulated protocorm-like bodies of Spatholottis plicata BI, a terrestrial orchid. Phytomorphology 48: 179-186; 1998.
Okada-Katsuo, A., "La biodiversidad y los peligros que la amenazan", en Perea Dallos, M. (ed.), Biotecnología agrícola: un enfoque hacia el mejoramiento de plantas, Bogotá, Editora Guadalupe, 2001, pp. 29 - 41.
Ortiz, P., "Las orquídeas en Colombia", Pérez-Arbelaezia, 5 (11): 72-73; 2000.
Park, S. Y.; Murthy, H. N.; Paek, K. Y., "Rapid propagation of Phalaenopsis from floral stalk-derived leaves", Vitro Cell. Dev. Biol. 38: 168-172; 2002.
Pedroza, J.; Corchuelo, G.; Angarita, A., "Control de la vitrificación en la micropropagación de estatice (Limonium sinuatum Mill cv. Midnight blue)", Agronomía Colombiana, 14 (1): 1-12; 1997.
Pedroza, J.; Fernández, C.; Suárez, A., "Evaluation of the effect of three growth regulators in the germination of Comparettia falcata seeds under in vitro conditions", Vitro Cell. Dev. Biol. Plant. 41: 838-843; 2005.
Peláez, J. M., Embriogénesis somática en Epidendrum ruizianum (Orchidaceae), Bogotá, Universidad Nacional de Colombia, Facultad de Ciencias, Departamento de Biología, 2002. p. 40.
PéreZ, G.; Martínez, J., Introducción a la fisiología vegetal. Madrid, Mundi prensa, 1994, p. 218.
Pierik, R. L. M., Cultivo in vitro de las plantas superiores, Madrid, Mundi-Prensa, 1990.
Pyati, A.; Murthy, H.; Hahn, E. & Paek, K., In vitro propagation of Dendrobium macrostachyum Lindl. A terrestrial threatened orchid. Indian J. Exp. Biol. 40: 620-623; 2002.
Rivera, G., Orquídeas: generalidades y cultivo, Heredia, Efuna, 1998.
Rojas, M., Fisiología vegetal aplicada, 4 ed., México, McGraw-Hill, 1993.
Ruiz, G., "Orquídeas, posible alternativa a cultivos ilícitos", Acopaflor 3(4): 26-27; 1996.
Ruiz, M. C.; Orozco, M., "Efectos de la luz y los reguladores del crecimiento sobre el porcentaje de germinación de Alnus acuminata H. B. K. (Betulaceae)", Pérez-Arbelaezia. 1 (2): 211-224; 1986
Salisbury, E; Ross, C., Fisiología vegetal: desarrollo de las plantas y fisiología ambiental. España, Thomson Editors, Paraninfo, S. A, 2000. pp. 573-574.
Seeni, S. & Latha, P., "Foliar regeneration of the endangered Red Vanda, Renanthera imschootiana". Plant Cell Tiss. Org . Cult. 29: 167-172; 1994.
Shimasaki, K.; Uemoto, S.,"Rhizome induction and plantlet regeneration of Cymbidium goeringii from flower bud cultures in vitro", Plant Cell Tiss. Organ. Cult. 25: 49-52; 1991.
So-Young P.; Hosakatte, N. & Kee-Yoeup, P., "Rapid propagation of Phalaenopsis from floral stalk-derived leaves", Vitro Cell. Dev. Biol. 38: 168-172; 2002.
Steel, R. & Torrie, J., Bioestadística: principios y procedimientos, 2 ed., Bogotá, McGraw- Hill, 1985, pp 328-367.
Taiz, L.; Zeiger, E., Plant physiology, 2 ed., Sunderland, Sinanuer Associates, Inc., 1998.
Takahashi, K.; Ogiwara, I.; Acoda, N., "Seed germination of Habenaria radiata (Orchidaceae: Orchideae) in vitro". Lindleyana 15: 59-63; 2000.
Vij, S.P.; Kondo, K.; Pathak, P. "Regeneration potential of Cymbidium pendulum (Roxb) Sw. Nodal explants: a study in vitro", J. Orch. Soc. India. 8: 19-23; 1994.
Yates, R. C.; Curtis, J. T., "The effect of sucrose and other factors on the shoot-root ratio of orchid seedlings", Am J. Bot. 36: 390-396; 1949.
Zambrano, H., "Estado de la legislación en materia de flora silvestre",
Pérez-Arbelaezia, 5, (11): 87-96; 2000.
Zettler, L.; Stewardt, S.; Bowles, M.; Jacobs, K., "Mycorrhizal fungi and cold-assisted symbiotic germination of the federally threatened eastern prairie fringed orchid, Platanthera leucophaea (Nuttall) Lindley", Am. Midland Nat. 145: 168-175; 2001.
Zhou, H.W.; Li, S.J.; Qian, X. H.; Gong, H.F., "Effects of some factors on plantlet growth of Dendrobium in tissue culture", Journal of Zhejiang Agricultural University, 21: 622-624; 1995.
How to Cite
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Download Citation
Ciencias Básicas
Revista Científica, 2007-08-00 nro:9 pág:117-141
Efecto del medio básico, carbón activado, ácido giberélico y calidad de luz en la germinación in vitro de Masdevallia auropurpurea Reich
Effect of basál medium, activated charcoal, gibberellic acid and lightquality in the germination in vitro ofMasdevallia auropurpurea Reich
Jaime A. Pedroza-Manrique
Universidad Distrital Francisco José de Caldas.
Facultad de Ciencias y Educación.
Proyecto Curricular de Licenciatura en Biología
Teléfonos: 3419618; Fax: 3419619:
Correo electrónico: jpedroza@udistrital.edu.co
Resumen
Un eficiente sistema de germinación fue desarrollado pará Masdevallia auropurpurea Reich., una orquídea endémica y en vías de extinción. En este estudio se evaluó el efecto de la interacción entre los cuatro factores siguientes: medios básicos de cultivo (Murashige y Skoog (1962), Knndson C. (1946), e Hidro-Coljap®), carbón activado (0 y 0.5 %(w/v)), ácido giberélico (0.0, 2.68 y 5.37 uM) y la calidad de luz (luz blanca, luz roja, luz roja lejana y oscuridad) en lá germinación asimbiótica de Masdevallia auropurpureaReich. El mejor porcentaje y tiempo de germinación fue fogrado en el medio básico Hidro-Coljap®, enriquecido con 2.68 ph4 de ácido giberélico, bajo luz roja con un fotoperiodo de 16 horas. La presencia del carbón áciivaclo, aunque no estimuló la germinación, favoreció el desarrollo de las plántulas de M. auropurpureaReich. Este estudio describe un protocolo que permite alcanzar más de 330.000 plántulas dentro de 40 semanas a partir de una cápsula de esta importante orquídea. Este protocolo, un modelo de conservación para especies que se encuentran en vías de extinción, permite la propagación a gran escala de M. auropurpurea Reich.
Palabras clave:
Masdevallia auropurpurea, orquídea, germinación in vitro, ácido giberélico (GA3), carbón activado, calidad de luz.
Abstract
An efficient seed germination system was developed for Masdevallia auropurpurea Reich., an endemic and endangered orchid of the prairies of Bogotá, Colombia. The effects of four facts (Murashige and Skoog salts (1962); Knudson C salts (1946); and Hidro-Coljap® salts), activated charcoal (0 and 0.5 0/0(w/v)), gibberellic acid (0.0; 2.68 and 5.37uM), and four light qualities (white light, darkness, red light and f ar-red light) on asymbiotic germination of Masdevallia auropurpurea Reich., f., were studied. The best germination percentage and germination time was obtained on agar solidified medium supplement with Hidro-Coljap® salts and 2.68 uM gibberellic acid under red light with a photoperiod of 16 h. The addition of activated charcoal did not stimulate either germination or the development of Masdevallia auropurpurea seedlings. This study describes a single medium-based protocol able to achieve more than 330,000 seedlings within 40 wk, starting from a single capsule. This protocol is sufficient for both large-scale propagation and in vitro conservation of this threatened orchid.
Key words:
Masdevallia auropurpurea, orchids, in vitro germination, gibberellic acid (GA3), activated charcoal, light quality.
INTRODUCCIÓN
Masdevallia auropurpurea Reich. se encuentra en vías de extinción como consecuencia de su disminución en número, debido a la pérdida de su hábitat y la alta presión de colección (Instituto Alexander von Humboldt, 1997). Esta especie tiene una muy baja tasa de multiplicación (Grillo et al., 1985; Rivera, 1998). No se han reportado investigaciones acerca del desarrollo de protocolos de propagación o conservación de M. auropurpurea Reich., a pesar de su potencial valor comercial como una flor de excelente fragancia y como planta de maceta. Además, sus flores parecen contener metabolitos secundarios, empleados en la medicina aromática tradicional, que aún no han sido determinados y pueden ser de gran utilidad en los campos farmacéuticos a mediano y largo plazos (Ruiz, 1996; Ortiz, 2000). La propagación a gran escala es un requisito para satisfacer los requerimientos farmacéuticos y evitar la desaparición de esta planta de gran valor y en vías de extinción. Para los requerimientos comerciales y la conservación de esta especie es indispensable establecer métodos de propagación rápida y a gran escala. La germinación in vitro permite la producción de gran número de plántulas en un corto periodo. De hecho, -Varios métodos han sido reportadds para la micropropagación de orquídeas (Dixon, 1987; Margara, 1988; Shimasaki y Uemoto, 1991; Arditti y Ernst, 1993; Seeni y Latha, 1994; Nayak et al., 1998; Chan y Chang, 2000; Takahashi et al., 2000; Murthy y Pyati, 2001; Zettler et al., 2001; Bowles et al., 2002; Peláez, 2002; Pyati et al., 2002; Park et al 2002;Chen et al., 2002; Martin, 2003; Chen y Chang,.2004).
En el caso de una orquídea rara o que se encuentre en vías de extinción, es necesario acudir a métodos artificiales de propagación (por ejemplo, rn. etodologias in vitro) en que el cultivo de semillas es una estrategia de propagación masiva sin la destrucción del material de origen (Krikorian, 1991; Zettler et al., 2001). El cultivo asimbiótico de semillas tiene especial significancia, debido a que en condiciones naturales, con los hongos formadores de micorrizas germinan menos del 5% de las semillas, mientras que esta metodología permite que germinen entre el 90 y el 100% de las semillas (Kushnir, 1985), y logra reducir en 85%, aproximadamente, el tiempo de germinación de semillas de orquídea, que in vivo puede requerir un periodo cercano a los 3 años (Devesa, 1997).
Este estudio describe, por primera vez, el efecto de la interacción entre medios básicos de cultivo, ácido giberélico, carbón activado y calidad de la luz en la germinación de M. auropurpurea Reich. Con la germinación de semillas de Masdevallia auropurpurea Reich. in vitro, se contribuye con un protocolo para la propagación masiva de esta especie, como herramienta para su conservación ecológica, manteniendo la variabilidad natural presentada en los procesos de propagaCión sexual o generativa para el establecimiento de bancos de germoplasma (Okada, 2001) y para su potencial explotación sostenida, que a largo plazo podría ampliarse hacia la comercialización, teniendo en cuenta que la certificación de que una especie ha sido propagada artificialmente puede facilitar su exportación (Zambrano, 2000; Rivera, 1998).
MATERIALES Y MÉTODOS
El establecimiento del protocolo de germinación de Masdevallia auropurpurea Reich. in vitro se obtiene siguiendo estos pasos:
1. Colección de cápsulas. Se colectaron cápsulas maduras de 8 meses de edad, de M. auropurpurea Reich., resultantes de la polinización natural en áreas forestales de la sabana de Bogotá, Cundinamarca, durante los meses de enero y febrero de 2005.
2. Desinfección de las semillas. Las semillas fueron extraídas del fruto y desinfectadas directamente con hipoclorito de sodio al 0.5% por 10 minutos y enjuagadas 10 veces con agua destilada estéril en condiciones asépticas en el laboratorio.
3. Siembra de las semillas in vitro. Las semillas desinfectadas fueron suspendidas en agua destilada estéril y homogeneizadas con la ayuda de un agitador magnético a 6 rpm. Posteriormente, alícuotas de 20 ul fueron inoculadas en cada frasco de cultivo (120 ml de capacidad) con 20 ml de medio de cultivo. Cada alícuota tenía en promedio 1.200 semillas de orquídeas, que fueron cultivadas en los siguientes tres medios básicos de cultivo: Murashige y Skoog (1962); Knudson (1946); Hidro-Coljapp.(Fertilizante inorgánico). Los tres medios básicos fueron suplementados con carbón activado (0 y 0.5 % (w/v)) y ácido giberélico (AG 3) (0.0; 2.68 y 5.37 uM). Además, a todos los medios se les suministró 3% (w/v) de sacarosa y 0.8 % (w/v) de agar. El pH de todos los medios fue ajustado a 5.8 antes de ser esterilizados a una presión de 1.06 kg/cm -2 por 20 minutos.
4.Incubación de las unidades experimentales. Los cultivos fueron incubados en luz blanca (20 umol m-2s-1 dada por luz fluorescente), oscuridad, luz roja filtrada (660 nm; 20 umol m-2s-1 dada por luz fluorescente) y luz roja lejana filtrada (700-800 nm; 20 umol m-2s-1 dada por luz incandes cente), a 20 ± 2° C, hasta alcanzar pequeños protocormos redondos (2.5 mm de diámetro) con un fotoperiodo de 16 h. A continuación, fueron transferidos a condiciones de luz durante 8 semanas a 25-30 umol m-2s-1 (túbos fluorescentes de luz día FL-20D/18, 20 W, China Electric Co., Taipei). La germinación de semillas fue estimada por el registro del tiempo de germinación y el porcentaje de germinación de las semillas con embriones hyalinos redondos u ovoides (embriones viables) para cada tratamiento.
Análisis estadístico
Las semillas fueron distribuidas de acuerdo con un diseño completamente aleatorio con arreglo factorial de 3 x 2 x 3 x 4, tres formulaciones de medios de cultivo (Murashige y Skoog (1962), Knudson (1946), e Hidro-Coljap), dos concentraciones de carbón activado (0; 0.5 %(yv/v)), tres concentraciones de AG3 (0.0; 2.68; 5.37 uM), y cuatro tipos de luz (luz blanca, oscuridad, luz roja y luz roja lejano), para un total de 72 tratamientos que evaluaron el tiempo y el porcentaje de germinación de las semillas de M. auropurpurea Reich. En cada tratamiento se trabajaron diez réplicas, cada una de las cuales estaba representada por un frasco de cultivo, con aproximadamente 1.200 semillas, para un total de 720 frascos. Los datos fueron analizados estadísticamente empleando la prueba de Tukey (Steel y Torrie, 1985) a fin de establecer el mejor tratamiento con respecto al tiempo de germinación y al porcentaje de germinación de las semillas de M. auropurpurea Reich. El análisis estadístico permite evidenciar el efecto interactivo entre las siguientes cuatro variables trabajadas en esta investigación: las tres formulaciones de medios de cultivo, las dos concentraciones de carbón activado, las tres concentraciones de AG3 y los cuatro tipos de luz.
RESULTADOS Y DISCUSIÓN
El efecto de los medios basales, el carbón activado, el ácido giberélico y la calidad de luz señaló diferencias estadísticas altamente significativas (P<0.01) entre los 72 tratamientos evaluados. A continuación se analizan estas diferencias.
Efecto del medio basal
El mayor porcentaje de germinación y el menor tiempo de germinación de las semillas de M. auropurpurea Reich. se obtuvo en el medio de cultivo Hidro-Coljap® (figura 1). Estos resultados muy seguramente se deben a las altas concentraciones de los elementos fósforo y potasio que presenta este fertilizante cuando es comparado con las formulaciones MS y KC. Además, cuando las semillas de orquídeas inician el proceso de germinación en asociaciones simbióticas, mejoran mucho la absorción de fosfatos, nitratos y otros elementos, como el potasio. El medio MS fue inferior en el número de semillas germinadas al compararlo con las formulaciones Hidro-Coljap® y KC. Esto significa que la concentración de las sales de las formulaciones MS y KC se encuentra muy por debajo de la formulación Hidro-Coljap®. La alta densidad de sales presente en la formulación Hidro-Coljap® fue adecuadá en el proceso de germinación de las semillas de M. auropurpureaReich., debido a que el potasio, en su presentación como KH2PO4, KCL y KNO3 juega un papel importante en la regulación osmótica, actividad enzimática y traslocación de azúcares, mientras que la energía celular depende del fósforo, en especial cuando se aporta como NaH2PO4 H20 o KH2PO4 (Cañas, 1993; Karp, 1998; Taiz y Zeiger, 1998; Azcon y Talon, 2000; Salisbury y Ross, 2000).
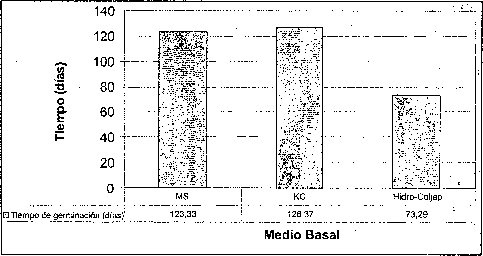
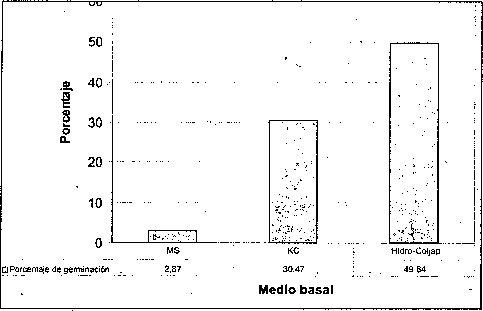
Esto confirma el hecho de que las semillas germinaron mejor en el medio que presenta altas concentraciones de microelementos y macroelementos, donde el 78.2% la germinación tuvo lugar después de 45 días. De hecho, los altos contenidos de amonio y potasio, presentes en la formulación Hidro-Coljar, favorecieron el proceso de germinación, teniendo en cuenta que los iones de amonio y potasio son los más importantes en el cultivo de embriones (Pierik, 1990).
La alta tasa de germinación obtenida en el medio Hidro-Coljarestuvo acompañada por un buen crecimiento de protocormos. Este resultado fue similar a los reportados por Chen (1978), González (1980) y So-Young et al., (2002), quienes obtuvieron una gran proliferación de protocormos al emplear el fertilizante inorgánico Hiponex® como medio de cultivo, en lugar del medio tradicional. Esto es importante porque los requerimientos de conservación y comercialización demandan protocolos para una rápida propagación a gran escala (Navarro, 2000; Lee y Lee, 2003).
Por esta razón, la utilización de fertilizantes inorgánicos como medios basales, favorece sustancialmente la conservación y propagación masiva de especies, sobre todo de las que se encuentran en vías de extinción. Así mismo, la formación de clorofila, seis días después de la siembra, con seguridad fue favorecida por el incremento en la concentración de nitrógeno, magnesio y manganeso. Estos elementos se encontraban en el medio básico Hidro-Coljap®, y son importantes en la síntesis de clorofila (Salisbury y Ross, 2000).
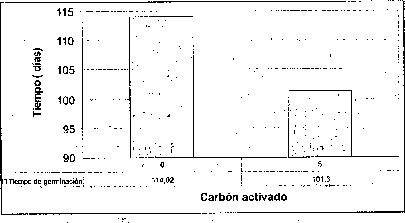
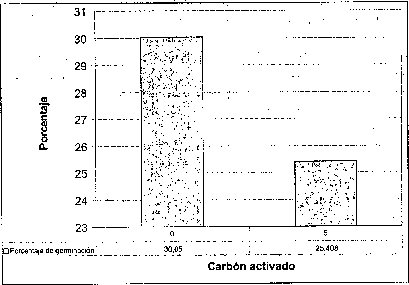
Efecto del carbón activado
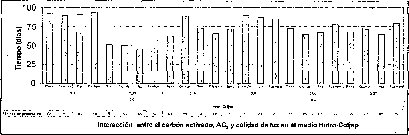
La adición de carbón activado a los tres medios basales evaluados no resultó favorable ni en el tiempo, ni en el porcentaje de germinación de las semillas de M. auropurpurea Reich. (figura 2), presumiblemente como consecuencia de que el carbón activado presenta un efecto inhibidor, porque absorbe los reguladores de crecimiento, compuestos orgánicos e inorgánicos, presentes en el medio de cultivo, así como los compuestos liberados por los tejidos u órganos vegetales cultivados in vitro (Ernst, 1974). Ante esta situación, el efecto de los tres medios basales y los reguladores de crecimiento evidencia que el carbón activado interfiere negativamente el proceso de germinación de las semillas de M. auropurpurea Reich. Estos resultados coinciden con los obtenidos por Lin et al. (1994), quienes observaron que la adición de carbón activado no favorece la germinación de semillas de Bletilla formosana. Es importante señalar que la presencia de carbón activado, sobre todo en el medio Hidro-Coljap®, ejerció un efecto positivo en el desarrollo de las plántulas de M. auropurpurea Reich., esta situación concuerda con los reportes de Vij et al. (1994) y Chen et al. (1999), quienes observaron que el carbón activado mejora el desarrollo de los protocormos y de las plántulas de orquídeas, en concentraciones inferiores a 2 g.l-1 en el desarrollo de plántulas de Dendrobium (Zhou et al., 1995).
De esta forma, se demuestra que el carbón activado no debe estar presente en el proceso de germinación de las semillas de M. auropurpurea Reich. Sin embargo, después de que las semillas han germinado, la presencia del carbón activado es importante para garantizar un buen desarrollo fisiológico de las plántulas y, por tanto, su supervivencia.
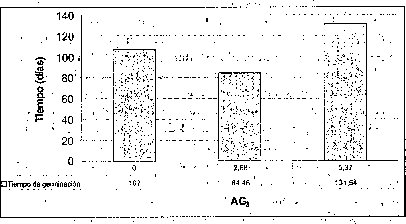
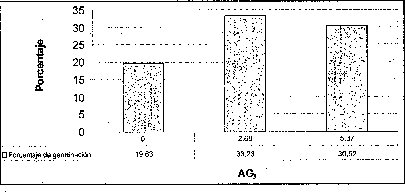
Efecto del AG 3
Añadir 2.68 uM de AG3 favoreció positivamente el tiempo y el porcentaje de germinación de las semillas de M. auropurpurea Reich., mientras que 5.37 uM de AG3 no sólo no estimuló su germinación, sino que además indujo anormalidades tanto en los embriones como en los protocormos en desarrollo. Algunas plántulas de M. auropurpurea Reich. presentaron vitrificación como consecuencia de la interacción entre los factores ambientales e intrínsecos, propios del genotipo que expresa esta alteración fisiológica (Pedroza et al., 1997). Estos resultados probablemente se deben al alto contenido endógeno de hormonas presentes en las semillas, teniendo en cuenta que las zonas de crecimiento activo son áreas de síntesis de hormonas (Jiménez, 1998). Por esta razón, la presencia de 5.37 AM de AG3 es muy alta en el medio de cultivo, y provoca fuertes alteraciones fisiológicas en el desarrollo de los embriones durante su germinación. De hecho, una característica de las giberelinas es que en concentraciones bajas, estimula el metabolismo y desarrollo de los embriones, mientras que lo reprime en concentraciones altas (Rojas, 1993; Salisbury y Ross, 2000; Pedroza et al., 2005). Esta situación muestra que 2.68 uM de AG3 es la mejor concentración evaluada.
En esta investigación se estableció que 2.68 uM de AG3 es favorable para la germinación de semillas de M. auropurpurea Reich. en el medio Hidro-Coljap®, mientras que en los medios MS y KC la adición de giberelinas disminuyó el porcentaje de germinación, sobre todo en el medio MS, donde este proceso fisiológico fue prácticamente inocuo (figura 3). Estos resultados muestran un sinergismo entre las altas concentraciones de macro y micronutrientes presentes en el medio Hidro-Coljap (I) con las giberelinas. Además, se pudo observar que la presencia del AG3 en los medios MS y KC no logra reducir significativamente el tiempo de germinación en semillas de M. auropurpurea Reich.
En la interacción entre el AG3 y el carbón activado, la presencia de este último,junto con las altas concentraciones de AG3 (5.371.uM), o la ausencia de este regulador de crecimiento, desfavorece tanto el tiempo como el porcentaje de germinación de las semillas de M. auropurpurea Reich (figuras 5 y 6). Así mismo, se establece que 2.68 1.1M de AG3 en ausencia del carbón activado, estimula la germinación de esta especie in vitro. De esta forma, se evidencia que el carbón activado disminuye la disponibilidad del AG3 en el procéso de absorción por las semillas. Sin embargo, cuando se utilizan 2.68 uM de AG3, aun en presencia del carbón activado,se observa un ligero mejoramiento tanto en el porcentaje de germinación como en.el tiempo de germinación. Ante esta situación es fácil reconocer que 2.68 uM de AG3 es la concentración adecuada para el desarrollo de este proceso fisiológico.
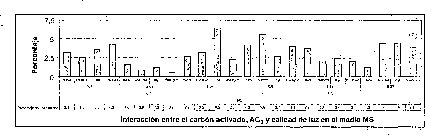
Efecto de la calidad de luz
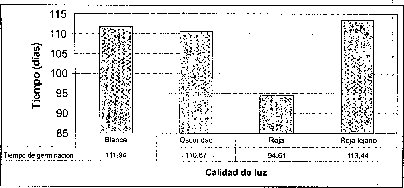
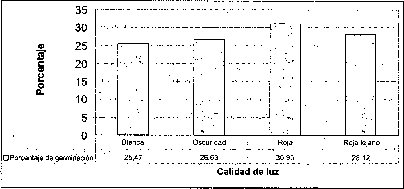
El mayor número de semillas germinadas se presentó en condiciones de luz roja, precedida por la luz rojo-lejana y la oscuridad. La luz blanca .es la menos efectiva en el porcentaje de germinación de semillas de M. auropurpurea Reich (figura 4). De hecho, la calidad o composición espectral,de la luz ejerce diferentes efectos sobre losprocesos fisiológicos en los que interviene, especialmente en la germinación. También afecta la morfogénesis y la organogénesis. Estos efectos no son producidos en igual medida por todos los tipos de luz (radiaciones de cualquier longitud de onda), ya que algunas radiaciones concretas tienen un efecto notable mientras que otras tienen poco o ningún efecto (Mohr, 1995). Ruiz y Orozco (1986) señalan que la calidad de luz y los diferentes reguladores de crecimiento juegan un papel determinante en la germinación de muchos tipos de semillas, porque en ellas se encuentra una gran cantidad de fotorreceptores. Bergareche y Moyseet (1993) afirman que, tanto en monocotiledóneas como en dicotiledóneas, el fitocromo es más abundante en tejidos jóvenes. En el caso de las semillas de M. auropurpurea Reich., el hecho de que el mayor número de semillas germinadas se haya presentado en condiciones de luz roja demuestra que esta respuesta está relacionada con los requerimientos de luz de estas semillás, pues según Cordonnier (1989), existen dos grandes clases de fitocromos: el tipo 1 y el tipo 2. El tipo 1 predomina en las plantas etioladas; el tipo 2, en las plantas verdes.
Cuando las semillas germinan y las plántulas se desarrollan en la oscuridad, contienen 10 a 100 veces más fitocromo total qúe las cultivadas bajo la luz. La abundancia de fitocromo del tipo 1 permite interceptar la luz muy débil en los tejidos que favorecen el desarrollo normal de las plantas verdes (Pérez y Martínez, 1994; Salisbury y Ross, 2000).
En condiciones de oscuridad, los protocormos se desarrollaron con un mayor tamaño, doblando el diámetro de los producidos en las condiciones de iluminación evaluadas. En las plántulas obtenidas en condiciones de oscuridad, se produjo una gran proliferación de brotes alargados, debido al efecto fototrópico, es decir, que los brotes se alargan en búsqueda de la luz. Esto refleja la fotosensibilidad de las plántulas de M. auropurpureaReich., siendo una especie epífita, lo que evidencia su predilección por establecerse en sitios adecuados para recibir la luz (Rivera, 1998). Con respecto a la interacción entre el medio basal y la calidad de luz, se evidencia que el medio MS es el menos favorable en el porcentaje de germinación, mientras que el medio Hidro-Coljapl, en presencia de luz roja, es la mejor condición ambiental para estimular este proceso fisiológico, a pesar de que en el medio KC, y también bajo luz roja, se logran resultados aceptables en cuanto al porcentaje de germinación. El tiempo de germinadón en los medios MS y KC presenta un patrón muy similar de respuesta en que la luz roja favorece la germinación más temprana, mientras que en el medio Hidro-Coljap®, el tiempo degerminación se reduce prácticamente a la mitad, comparado con los otros dos medios de cultivo. Esta condición favorece el proceso de germinación, porque existe una gran disponibilidad de sales y una adecuada señal lumínica que promueve este proceso fisiológico. Además, la temperatura, aunque para todos los tratamientos fue la misma, posiblemente influyó en la respuesta de germinación en condiciones de oscuridad, ya que, en ausencia de luz, el fitocromo es llevado lentamente del estado activo (P fr -P730) al estado inactivo (Pr -P660). Este proceso reversible es causado por una reacción termoquímica en la oscuridad (Borthwick, 1952; Labouriau, 1983).
En la interacción entre la calidad de luz y la presencia de carbón activado, se observa que la calidad de luz tiene un efecto preponderante sobre el tiempo de germinación y el porcentaje de germinación, sobre todo cuando los cultivos se encuentran incubados bajo luz roja (figura 4).
Así mismo, se observó una buena proliferación de brotes con la luz roja, corroborando los planteamientos de Rojas (1993), quien afirma que el mayor efecto morfogenético lo tiene la luz roja. De igual forma, las plántulas obtenidas en luz roja lejana presentaron gran proliferación de brotes y desarrollo de raíces, coincidiendo con Pierik (1990), quien señala que el sistema rojo/rojo-lejano es importante para la formación de raíces y vástagos adventicios, mientras que la luz roja lejana, promueve el crecimiento del tallo en algunas especies (Casal, 2000).
Con respecto a la luz blanca, se encontró que esta calidad de luz no tuvo un efecto significativo en la germinación de semillas, porque aunque promovió una producción de protocormos robustos y alargados, estimuló una amplia proliferación de callos friables, evitando la continuación del desarrollo morfogenético de los protocormos y su conversión en plántulas. De acuerdo con Gómez (1998), estos resultados se deben a la amplia calidad espectral o mayor longitud de onda que posee la luz blanca. De este modo, se evidencia que ejerce un efecto estimulador en la proliferación celular, al parecer por su capacidad de sensibilizar el fitocromo y otros fotorreceptores que regulan el proceso morfogénico, desencadenando una serie de procesos bioquímicos que se traducirán en las respuestas fisiológicas de la planta (Salisbury y Ross, 2000).
Los tiempos de germinación más prolongados se presentaron bajo la calidad de luz roja lejana, en la que se inició la germinación, en algunos casos, luego de 256 días en condiciones de oscuridad. Con la calidad de luz blanca no se produjo una aceleración significativa de la germinación de las semillas. Los mejores tiempos de germinación se lograron con luz roja: el tiempo mínimo requerido para lograr la germinación fue 45 días.
Esto significa que, de acuerdo con las respuestas fisiológicas de las semillas de M. auropurpurea Reich. por efecto de la luz roja, esta especie forma parte del grupo de semillas fotolatentes, a diferencia de otras especies de orquídeas, como Epidendrum nocturnum y Odontoglossum ehrenbergii (Yates y Curtis, 1949; Martínez y Rubluo, 1997).
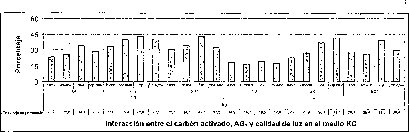
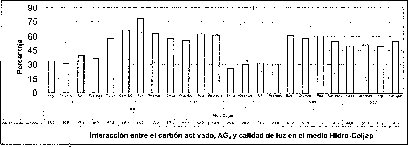
En este experimento se encontró un efecto sinérgico en la interacción entre la calidad de luz y el AG3 cuando las semillas de M. auropurpurea Reich. son cultivadas en condiciones de luz roja y en presencia de 2.68 laM de AG3. Estas condiciones favorecieron el mayor porcentaje de germinación y el menor tiempo de germinación (figuras 5 y 6).
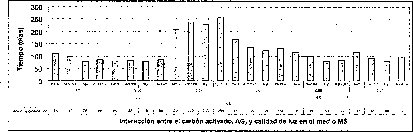
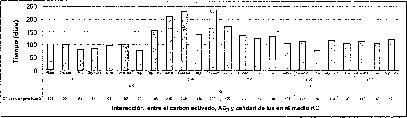
Este estudio demuestra que la luz roja activa el proceso de germinación en estas semillas fotolatentes porque, de acuerdo con Salisbury y Ross (2000), el Pfr (receptor de la luz roja) incrementa el potencial de crecimiento de las células radiculares, disminuyendo su potencial hídrico para absorber agua del medio con más facilidad y, así, puedan germinar. Estos hechos sugieren que el porcentaje de germinación de las semillas de M. auropurpurea Reich., en presencia de luz roja, se ve favorecido porque probablemente esta calidad de luz estimula la síntesis de giberelinas que promueven el empuje de la radícula o debilita las barreras próximas que limitan su crecimiento.
La fotolatencia de semillas no es tan misteriosa cuando se considera que la germinación es una lucha entre el potencial de crecimiento de la radícula y los efectos mecánicos de restricción del movimiento de las capas circundantes a la radícula. Es importante señalar que en muchas semillas fotolatentes la aplicación de giberelinas sustituye a la luz, porque ésta estimula su síntesis en los embriones y entonces ocurre el proceso normal de germinación (Taiz y Zeiger, 1998). En esta investigación, el efecto fisiológico del AG3, en la germinación de las semillas de M. auropurpurea Reich. comprueba una vez más que efectivamente estas semillas son fotolatentes y que el Pfr rompe la fotolatencia provocando la síntesis de giberelinas.
Este modelo experimental permite comprender las relaciones entre la luz y los promotores del crecimiento, por ejemplo las giberelinas, en los procesos fisiológicos de germinación de semillas fotolatentes, en este caso M. auropurpurea Reich. Esta situación justifica que, para la existencia y conservación de esta especie, se requieran adecuadas condiciones medioambientales.
En las figuras 5 y 6 se observa claramente que existe interacción entre los factores evaluados en este trabajo, donde el tiempo y el porcentaje de germinación son afectados por el tipo de medio basal, la presencia del carbón activado, la concentración del AG3 y la calidad de luz de incubación in vitro de las semillas de M. auropurpureaReich. De hecho, las especies fotosensibles se encuentran ubicadas en la categoría de dormancia fisiológica, con semillas fotosensibles caracterizadas por presentar tamaños pequeños, como las especies de orquídeas (Hartman et al., 1997), entre las que se encuentra M. auropurpurea Reich.
CONCLUSIONES
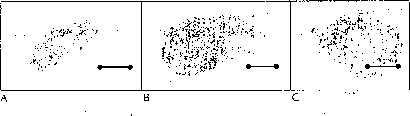
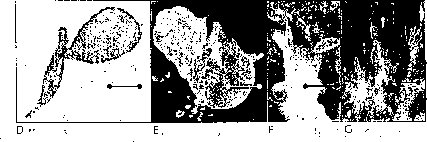
Las semillas de M. auropurpurea Reich. in vitro responden de modo positivo las altas concentraciones de macro y de micronutrientes, presentando la mejor germinación en el medio Hidro-Coljapu, enriquecido con 2.68 uM AG3, en condiciones de luz roja (figura 7). El carbón activado, aunque no estimuló el proceso de germinación, sí favoreció el desarrollo de las plántulas de M. auropurpurea Reich. En estas condiciones, se logra obtener el mayor porcentaje de germinación en el menor tiempo posible con un adecuado desarrollo de las plántulas, optimizando los procesos de producción. El protocolo establecido en este trabajo permite obtener, en corto tiempo y a bajo costo, aproximadamente 330.000 plántulas en 40 semanas a partir de una cápsula madura de M. auropurpurea Reich. Esta situación garantiza evitar la extinción de esta especie y posibilita la apertura del libre comercio de sus productos y de la planta en maceta. De igual forma, este protocolo sirve de modelo para contribuir en la conservación de otras especies que se encuentran en vías de extinción.
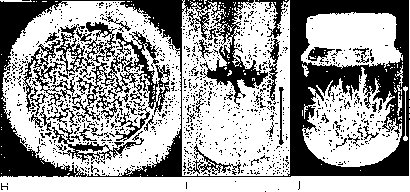
AGRADECIMIENTOS
Este trabajo fue financiado por la Facultad de Ciencias y Educación de la Universidad Distrital Francisco José de Caldas.
BIBLIOGRAFÍA
- Arditti, J.; Ernst, R., Micropropagation of orchids, New York, John Wiley and Sons, 1993, pp. 87-607.
- Azcon, J. ; Talon, M., Fundamentos de fisiología vegetal, Madrid, McGrawHill, 2000.
- Bergareche, C.; Moysset, L., El fotocromo, en Azcon Bieto, J. y Talon, M. Fisiología y bioquímica vegetal, Bogotá, McGraw-Hill, 1993, pp. 397-417.
- Borthwick, A reversible photoreaction controlling seed germination. Proc. Natl. Acad. Sci., U. S., 38: 662-666, 1952, en Moreira de Carvalho, N. y Nakagawa, J. (ed.). Semillas: ciencia, tecnología y producción. Montevideo, Agropecuario-Hemisferio Sur, 1988, p. 150.
- Bowles, M.; Jacobs, K.; Zettler, L.; Delaney, T., Cróssing effects on seed viability and experimental germination of the federal threatened Platanthera leucophoea (orchidaceae). Rodora 104: 14-30; 2002.
- Cañas, B. M., Metodologías in vitro de vegetales, Bucaramanga, UIS,1993.
- Casal, J.,"Fotomorfogénesis: la luz como factor regulador del crecimiento", en Azcon, J. y Talon, M., Fundamentos de fisiología vegetal, Madrid,McGraw-Hill, 2000; pp. 377-388.
- Chan, C.; Chang, W. C., "Micropropagation of Cymbidium ensifolium var. Misericors through callus-derived rhizomes", Vitro Cell. Dev. Biol. Plant. 36: 517-520, 2000.
- Chen, J.; Chang, W., "Induction of repetitive embryogenesis from seedderived protocorms of Phalaenopsis amabais var. formosa shimadzu", Vitro Cell. Dev. Biol. Plant. 40: 290-293, 2004.
- Chen, L.; Pan, R.; Chen, R., "Effects of media, growth'regulators and dividing on the growth of Cymbidium sinense protocorm cultured in vitro", J. Trop. and Subtrop. Bot. 7: 59-64, 1999.
- Chen, T.; Cheng, J. T.; Chang, W., "Multiple shoot formation and plant regeneration from stem nodal explants of Paphiopedilum orchids", Vitro Cell. Dev. Biol. Plant. 38:595-597, 2002.
- Chen. L.,"A simple tissue culture method developed to accelerate growth of plant tissues", J. Prim. Ind. 6 (2): 116-123; 1978.
- Cordonnier, M., "Monoclonal antibodies: Molecular probes for the study of phytochrome", Photochemestry and photobiology 49: 821-831; 1989.
- Devesa, J. A., "Plantas con semilla"; en Tzco, J. (ed.), Botánica. Madrid, McGraw-Hill, 1997, pp. 541-580.
- Dixon, K.,"Raising terrestrial orchids from seed", en Harris,.W. K.,(ed.),Modem orchid growing for pleasure and profit. Adelaide, Orchid Club of South Australia, Inc., 1987, pp. 47-100.
- Ernst, R., "The use bf activate charcoal in asymbiotic seedling culture of Phapiopedilum". Am Orch. Soc. Boll., January: 35-38, 1974.
- Gómez, K. R., "Cultivó de células y tejidos", en Pérez Ponce, J. N. (ed.), Propagación y mejora genética de plantas por biotecnología,Cuba, Instituto de biotecnología de las plantas, 1998, p. 32.
- González, A., Econtro Nacional de orquidófilos pela Sociedad Brasilera de Orquidófilos (SBO), Copacabane Palace, Rio de Janeiro, Brazil, 1980.
- Grillo, M.; Peña, E.; Pérez, D., "Germinación masiva in vitro de algunas especies de orquídeas en el Jardín Botánico Nacional", Revista del Jardín Botánico Nacional. (Universidad de la Habana), 6 (2): 95-100,1985.
- Hartman, H.; Kester, D.; Davies, F.; Geneve, R., Plant propagation: principies and practices. Sixth edition, New Jersey, Prentice-Hall, Inc., 1997,pp. 192.
- Instituto Alexander von Humboldt, Informe nacional sobre el estado de biodiversidad: Especies de plantas superiores amenazadas, Colombia,1997.
- Jiménez, E. A., "Cultivo de ápices y meristemos", en Pérez. Ponce, J. N. (ed.), Propagación y mejora genética de plantas por biotecnología, Cuba, Instituto de Biotecnología de las plantas,1998, pp. 45-56.
- Karp, G., Biología celular y molecular, México, McGraw-Hill, 1998.
- Knudson, C., "A new nutrient solution for the germination of orchid seeds", Am. Orchid. Soc. Bull. 14: 214-217, 1946.
- Krikorian, A. D., "Propagación clonal in vitro", en Roca, W. & Mroginski, L. (eds.), Cultivo de tejidos en la agricultura: fundamentos y aplicaciones, Cali, CIAT, 1991, pp. 96-125.
- Kushnir, G. P., Metody massovogo razmnozheniya (Orquídeas: métodos de multiplicación masiva). Jardín Botánico Central A.C. de la RSS de Ucrania, Kiev, URSS. Tsvetovodstvo. 5 (13-14): 33-34; 1985.
- Labouriau, L. G., A germinaffio das sementes, Washington, Secretaría General de la OEA: Monografía 24: 174, 1983.
- Lee, Y. I; Lee, N.,"Plant regeneration from protocorm-derived callus of Cypripedium formosanum". Vitro Cell. Dev. Biol. Plant 39: 475-482;2003.
- Lin, Y. J.; Chen, C.; Yeh, E; Chiu, N.; Tsay, H., "Tissue culture of Bletilla formosana. 1. The influence of seed maturity and pretreatment on seed germination and seedling development", J. Agric. Res. China. 43: 40-50; 1994.
- Margara, J., Multiplicación vegetativa y cultivo in vitro: los meristemos y la organogénesis, Madrid, Mundi-prensa; 1988.
- Martin, K., "Clonal propagation, encapsulation and reintroduction of Ispea malabarica (Reich. f.) J. D. Hook, an endangered orchid", Vitro Cell. Dev. Biol. Plant. 39: 322-328; 2003.
- Martínez, A. P.; Rubluo, A., "In vitro mass propagation and population recovery of endangered tropical orchids", en Angarita, A. (ed.), International Congress of plant tissue culture of tropical species (Abstracts), Bogotá, 1997, pp. 56.
- Mohr, H., Plant physiology, Berlin, Springer-Verlag, 1995.
- Murashige,T.; Skoog, E, "A revised medium for rapid growth and bioassays with tobacco tissue cultures", Physiol. Plant. 15: 473-479; 1962.
- Murthy, H.; Pyati. A., "Micropropagation of Aerides maculosum Lindl" (Orchidaceae), Vitro Cell. Dev. Biol. Plant 37: 223-226; 2001.
- Navarro, M., Programa de germinación in vitro en el Pahuma. Programa de conservación de la Fundación la Ceiba, para la conservación tropical en la reserva orquideológica el Pahuma, al noroccidente de Quito,Ecuador. Marzo de 2000: 1-11.
- Nayak, N.; Rath, S.; Patnaik, S., High frequency plant regeneration from alginate encapsulated protocorm-like bodies of Spatholottis plicata BI, a terrestrial orchid. Phytomorphology 48: 179-186; 1998.
- Okada-Katsuo, A., "La biodiversidad y los peligros que la amenazan", en Perea Dallos, M. (ed.), Biotecnología agrícola: un enfoque hacia el mejoramiento de plantas, Bogotá, Editora Guadalupe, 2001, pp. 29 — 41.
- Ortiz, P., "Las orquídeas en Colombia", Pérez-Arbelaezia, 5 (11): 72-73;2000.
- Park, S. Y.; Murthy, H. N.; Paek, K. Y., "Rapid propagation of Phalaenopsis from floral stalk-derived leaves", Vitro Cell. Dev. Biol. 38: 168-172; 2002.
- Pedroza, J.; Corchuelo, G.; Angarita, A., "Control de la vitrificación en la micropropagación de estatice (Limonium sinuatum Mill cv. Midnight blue)", Agronomía Colombiana, 14 (1): 1-12; 1997.
- Pedroza, J.; Fernández, C.; Suárez, A., "Evaluation of the effect of three growth regulators in the germination of Comparettia falcata seeds under in vitro conditions", Vitro Cell. Dev. Biol. Plant. 41: 838-843; 2005.
- Peláez, J. M., Embriogénesis somática en Epidendrum ruizianum (Orchidaceae), Bogotá, Universidad Nacional de Colombia, Facultad de Ciencias, Departamento de Biología, 2002. p. 40.
- Pérez, G.; Martínez, J., Introducción a la fisiología vegetal. Madrid, Mundi prensa, 1994, p. 218.
- Pierik, R. L. M., Cultivo in vitro de las plantas superiores, Madrid, Mundi-Prensa, 1990.
- Pyati, A.; Murthy, H.; Hahn, E. & Paek, K., In vitro propagation of Dendrobium macrostachyum Lindl. A terrestrial threatened orchid. Indian J.Exp. Biol. 40: 620-623; 2002.
- Rivera, G., Orquídeas: generalidades y cultivo, Heredia, Efuna, 1998.
- Rojas, M., Fisiología vegetal aplicada, 4 ed., México, McGraw-Hill,1993.
- Ruiz, G., "Orquídeas, posible alternativa a cultivos ilícitos", Acopaflor 3(4): 26-27; 1996.
- Ruiz, M. C.; Orozco, M., "Efectos de la luz y los reguladores del crecimiento sobre el porcentaje de germinación de Alnus acuminata H. B. K. (Betulaceae)", Pérez-Arbelaezia. 1 (2): 211-224; 1986
- Salisbury, E; Ross, C., Fisiología vegetal: desarrollo de las plantas y fisiología ambiental. España, Thomson Editors, Paraninfo, S. A, 2000. pp.573-574.
- Seeni, S. & Latha, P., "Foliar regeneration of the endangered Red Vanda, Renanthera imschootiana". Plant Cell Tiss. Org . Cult. 29: 167-172;1994.
- Shimasaki, K.; Uemoto, S.,"Rhizome induction and plantlet regeneration of Cymbidium goeringii from flower bud cultures in vitro", Plant Cell Tiss. Organ. Cult. 25: 49-52; 1991.
- Steel, R. & Torrie, J., Bioestadística: principios y procedimientos, 2 ed.,Bogotá, McGraw- Hill, 1985, pp 328-367.
- Taiz, L.; Zeiger, E., Plant physiology, 2 ed., Sunderland, Sinanuer Associates, Inc., 1998.
- Takahashi, K.; Ogiwara, I.; Acoda, N., "Seed germination of Habenaria radiata (Orchidaceae: Orchideae) in vitro". Lindleyana 15: 59-63; 2000.
- Vij, S.P.; Kondo, K.; Pathak, P. "Regeneration potential of Cymbidium pendulum (Roxb) Sw. Nodal explants: a study in vitro", J. Orch. Soc.India. 8: 19-23; 1994.
- Yates, R. C.; Curtis, J. T., "The effect of sucrose and other factors on the shoot-root ratio of orchid seedlings", Am J. Bot. 36: 390-396; 1949.
- Zambrano, H., "Estado de la legislación en materia de flora silvestre",Pérez-Arbelaezia, 5, (11): 87-96; 2000.
- Zettler, L.; Stewardt, S.; Bowles, M.; Jacobs, K., "Mycorrhizal fungi and cold-assisted symbiotic germination of the federally threatened eastern prairie fringed orchid, Platanthera leucophaea (Nuttall) Lindley", Am. Midland Nat. 145: 168-175; 2001.
- Zhou, H.W.; Li, S.J.; Qian, X. H.; Gong, H.F., "Effects of some factors on plantlet growth of Dendrobium in tissue culture", Journal of Zhejiang Agricultural University, 21: 622-624; 1995.
Creation date:
License
When submitting their article to the Scientific Journal, the author(s) certifies that their manuscript has not been, nor will it be, presented or published in any other scientific journal.
Within the editorial policies established for the Scientific Journal, costs are not established at any stage of the editorial process, the submission of articles, the editing, publication and subsequent downloading of the contents is free of charge, since the journal is a non-profit academic publication. profit.



