DOI:
https://doi.org/10.14483/23448350.4567Published:
06/15/2013Issue:
Vol. 17 No. 1 (2013): January-April 2013Section:
Science and EngineeringEvaluación de la esterilización húmeda y la esterilización por microondas de dos tipos de suelos
Keywords:
esterilización de suelos, pérdida de humedad, inhibición microbiana, esterilización húmeda, microondas. (es).Downloads
References
Acosta Peñaloza, G.S. (2008). Evaluación por respi-
rometría de la bioestimulación con nutrientes
y de la bioaumentación con Acinetobacter sp.
en la biorremediación de suelos contaminados
con diésel. (Tesis inédita de Maestría). Bogotá:
Pontificia Universidad Javeriana.
Atlas, R. M. & Bartha, R. (2002). Ecología microbia-
na y microbiología ambiental. Madrid: Pearson Educación.
Balba, M. T., Al-Awadhi, N. & Al-Daher, R. (1998). Bioremediation of oil-contaminated soil: microbiological methods for feasibility assessment and field evaluation. Journal of Microbiological Methods, 32, 155-164.
Bento, F. M., Camargo, F. A. O., Okeke, B. C., & Frankenberger, W. T. (2005). Comparative bioremediation of soils contaminated with diesel oil by natural attenuation, biostimulation and bioaugmentation. Bioresource Technology, 96, 1049-1055. doi: 10.1016/j.bior-tech.2004.09.008
Chaîneau, C. H., Rougeux, G., Yéprémian, C., & Oudot, J. (2005). Effects of nutrient concentration on the biodegradation of crude oil and associated microbial populations in the soil. Soil Biology & Biochemistry, 37, 1490-1497. doi: 10.1016/j.soilbio.2005.01.012
Chen, S. Y., Dickson, D. W., & Mitchell, D. J. (1995).
Effects of soil treatments on the survival of soil microorganisms. Journal of Nematology, 27(4S), 661-663.
Ferris, R. S. (1984). Effects of microwave oven treatment on microorganisms in soil. Phytopathology, 74(1), 121-126.
Foght, J. & Aislabie, J. (2005). Enumeration of soil
microorganisms. In: R. Margesin & F. Schinner (eds.), Manual of soil analysis. Monitoring and assessing soil bioremediation (pp. 261-280). Berlin: Springer.
Instituto Geográfico Agustín Codazzi [IGAC]. (2006). Métodos analíticos del laboratorio de suelos. 6a ed. Bogotá: Imprenta Nacional de Colombia.
Madigan, M., Martinko, J., & Parker, J. (2003). Brock Biología de los microorganismos. Madrid: Pearson Prentice Hall.
Margesin, R. & Schinner, F. (1997). Efficiency of indigenous and inoculated cold-adapted soil microorganisms for biodegradation of diesel oil in alpine soils. Applied and Environmental Microbiology, 63(7), 2660-2664.
Margesin, R., Zimmerbauer, A., & Schinner, F. (2000). Monitoring of bioremediation by soil biological activities. Chemosphere, 40, 339-346.
Merini, L. J., Cuadrado, V., Flocco, C. G., & Giulietti, A. M. (2007). Dissipation of 2,4-D in soils of the Humid Pampa region, Argentina: A microcosm study. Chemosphere, 68(2), 259-265.
Razavi darbar, S. & Lakzian, A. (2007). Evaluation of chemical and biological consequences of soil sterilization methods. Caspian Journal of Environmental Science, 5(2), 87-91.
Schoefs, O., Perrier, M.,& Samson, R. (2004). Estimation of contaminant depletion in unsaturated soils using a reduced-order biodegradation model and carbon dioxide measurement. Applied Microbiology and Biotechnology, 64, 53-61. doi: 10.1007/s00253-003-1423-3
Singh, A., Ward, O. P., & Kuhad, R. C. (2005). Feasibility Studies for Microbial Remediation Hydrocarbon-Contaminated Soil. In: R. Margesin & F. Schinner (eds.), Manual of soil analysis. Monitoring and assessing soil bioremediation (pp. 131-153). Berlin: Springer.
Trevors, J. T. (1996). Sterilization and inhibition of microbial activity in soil. Journal of Microbiological Methods, 26, 53-59. doi: 10.1016/0167-7012(96)00843-3.
Velázquez-Martí, B. & Gracia-López, C. (2004). Evaluation of two microwave surface distri- bution systems designed for substratum and agricultural soil desinfection. Spanish Journal of Agricultural Research, 2(3), 323-331.
Viñas, M., Sabaté, J., Espuny, M. J., & Solanas, A.M. (2005). Bacterial community dynamics and polycyclic aromatic hydrocarbon degradation during bioremediation of heavily creosote-contaminated soil. Applied and Environ-mental Microbiology, 71(11), 7008-7018.
How to Cite
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Download Citation
Evaluación de la esterilización húmeda y la esterilización por microondas de dos tipos de suelos1
Evaluation of heat sterilization and microwaves sterilization of two types of soil
Evaluacion da esterilização úmida a esterilizacion por microondas de dois tipos de solos
Gloria Stella Acosta Peñaloza2
Diana Jasbleidy Palacios Rincón
Laura Giselle Carvajal Restrepo
1Artículo de Investigación derivado del proyecto de investigación �Incidencia de la adición de nutrientes en la producción de CO2 como medición de la biorremediación de suelos contaminados con diésel�, financiado por el Centro de investigaciones y Desarrollo Científico de la Universidad Distrital Francisco José de Caldas (CIDC), grupo de investigación Bionemesis.
2Universidad Distrital Francisco José de Caldas, Facultad del Medio Ambiente y Recursos Naturales, Tecnología en Saneamiento Ambiental, Bogotá - Colombia. Contacto: gsacostap@udistrital.edu.co
Fecha de recepción: octubre de 2012 Fecha de aceptación: diciembre de 2012
Resumen
En el estudio se evaluó la esterilización de dos tipos de suelo, uno con recuento microbiano bajo y humedad baja (BB) y otro con recuento microbiano alto y humedad media (AM). Los métodos evaluados fueron esterilización en autoclave a 121�C, por tres días consecutivos, variando el tiempo de esterilización y la temperatura de incubación entre los ciclos de esterilización, y se evaluó irradiación con microondas por 4 minutos. No se obtuvo recuento microbiano (10-2) para el suelo AM después de las esterilizaciones en autoclave y en el suelo BB se disminuyeron los recuentos, pero no se logró esterilización.
En todos los tratamientos en autoclave se observó disminución en la humedad ocasionada por la temperatura diferencial de incubación. Se concluyó que hay relación entre la cantidad de agua del suelo y la eficiencia de la esterilización húmeda y en la esterilización con microondas, relación diferente para los dos métodos.
Palabras clave:esterilización de suelos, pérdida de humedad, inhibición microbiana, esterilización húmeda, microondas.
Abstract
In the present study the sterilization was evaluated in two types of soil, low microbial population and moisture (BB) and another with high microbial population and intermediate moisture (AM). The methods evaluated were autoclaving (121�C) and microwave irradiation (4 min). Three autoclaving treatments were made by three consecutive days and each evaluation varied in the time of sterilization and the temperature of incubation between the cycles of sterilization. For the soil AM was not obtained counts in autoclaving treatments (10-2) and the counts diminished in soil BB, but did not obtained sterilization by any of the methods evaluated. In all treatments in autoclave observed decrease in water content caused by the differential temperature of incubation used. The results showed that there is a relation between the moisture of the soil and the efficiency of the humid sterilization and in the sterilization with microwaves, relation that is different for the two methods.
keywords:soil sterilization, loss moisture, inhibition of microorganisms, moist head sterilization, microwaves.
Resumo
O estudo avaliou a esterilização de dois tipos de solo, um com baixa contagem microbiana e baixa umidade (BB), e outro com altas contagens microbianas e umidade média (AM). Os métodos avaliados foram esterilização em autoclave a 121�C, durante tr�s dias consecutivos, variando o tempo de esterilização e temperatura de incubação entre os ciclos de esterilização, e foi avaliado irradiação com microondas durante 4 minutos. Nao foi obtida contagem microbiana (10-2) para o solo (AM) após esterilização em autoclave e no solo (BB) os recontos foram diminuidos, mas a esterilização não foi conseguida. Em todos os tratamentos em autoclave se observou diminuição na umidade provocada pela temperatura diferencial de incubação. Concluiu-se que existe relação entre a quantidade de água do solo e a efici�ncia da esterilização húmido e na esterilização com microondas, relação diferente para os dois métodos.
palavra-chave:esterilização de solos, perda de umidade, inibição microbiana, esterilização úmida, microondas.
Introducción
La esterilización de suelos es una práctica necesaria para la elaboración de controles abióticos que permitan mediante comparación evaluar los procesos llevados a cabo por los microorganismos en sistemas biológicos (Razavi darbar & Lakzian, 2007).
En estudios de biorremediación de suelos se hace necesaria la elaboración de controles abióticos que indiquen descontaminación por mecanismos diferentes a los mecanismos biológicos; procesos de tipo químico y mecanismos físicos como la evaporación, la lixiviación y la adsorción, entre otros (Balba, Al-Awadhi & Al-Daher, 1998).La esterilización de suelos se ha llevado a cabo por mecanismos diversos. La esterilización húmeda en autoclave ha sido ampliamente reportada en estudios de biorremediación en microcosmos (Bento, Camargo, Okeke & Frankenberger, 2005; Viñas, Sabaté, Espuny & Solanas, 2005; Merini, Cuadrado, Flocco & Giulietti, 2007) y con la irradiación son los métodos más utilizados al no dejar residuos químicos, pero la irradiación tiene la desventaja de alterar las propiedades de suelo (Singh, Ward & Kuhad, 2005). En algunos casos se han reportado otros mecanismos como la esterilización de suelos con microondas (Trevors, 1996; Velázquez-Martí & Gracia-López, 2004) y en calor seco (Trevors, 1996), y es bastante común la esterilización con productos químicos como la azida de sodio (Margesin, Zimmerbauer & Schinner, 2000; Schoefs, Perrier & Samson, 2004), el nitrato de plata (Margesin & Schinner, 1997) y el cloruro de mercurio (Cha�neau, Rougeux, Yéprémian & Oudot, 2005), entre otros.
Esta investigación tuvo como objetivo principal evaluar la eficiencia de algunos métodos de esterilización y medir su efecto sobre los recuentos microbianos y sobre la pérdida en la cantidad de agua en la esterilización.
Materiales y métodos
Este estudio se llevó a cabo en el laboratorio de Microbiología de la Facultad del Medio Ambiente y Recursos Naturales de la Universidad Distrital Francisco José de Caldas, con la financiación del Centro de Investigaciones y Desarrollo Científico (CIDC).
Suelos evaluados en el estudio
Con el objetivo de determinar el efecto de los métodos evaluados de esterilización húmeda y de esterilización con microondas, se evaluaron dos tipos de suelos clasificados, según la humedad del suelo, en suelo de humedad media (20,6�0,7 % p/p) y suelo de humedad baja (14,8�1,8 % p/p). El suelo de humedad media fue tomado de prado en el municipio de La Calera (Colombia) y el suelo con humedad baja del río Guatiquía en el departamento del Meta (Colombia). Las muestras de suelo fueron almacenadas en refrigeración durante el estudio (4�C).
Para determinar la carga microbiana de los suelos del estudio y poder evaluar las metodologías de esterilización se llevaron a cabo recuentos microbianos de heterótrofos totales por diluciones seriadas en solución salina (0,9% p/v) y siembra en placa en agar nutritivo (Foght & Aislabie, 2005), antes y después de las esterilizaciones.
Tratamientos evaluados
Para determinar el efecto de la esterilización en la humedad de los suelos y en la eliminación de los microorganismos se evaluaron cuatro tratamientos: tres tratamientos de esterilización en autoclave (calor húmedo) y un tratamiento de esterilización con microondas.
Para la esterilización con calor húmedo se llenaron recipientes de papel de aluminio con el suelo (1-2 cm) (Trevors, 1996) y se evaluaron los siguientes tratamientos: (1) Esterilización en autoclave a 121�C, aprox. 15 lb /pul2., 30 min., 3 días consecutivos; entre cada ciclo de esterilización el suelo se incubó a 25�C (Trevors, 1996; Bento et al., 2005; Acosta Peñaloza, 2008); (2) esterilización en autoclave a 121�C, aprox. 15 lb /pul2, 1 hora, 3 días consecutivos; entre cada ciclo de esterilización el suelo se incubó a 25�C (Merini et al., 2007); y(3) esterilización en autoclave 121�C, aprox. 15 lb /pul2, 30 min, 3 días consecutivos; entre cada ciclo de esterilización el suelo se incubó a 65�C. Para el tratamiento en microondas (2.450 MHz) se expuso el suelo húmedo 4 min. (Chen, Dickson & Mitchell, 1995). Los tratamientos evaluados se realizaron por triplicado (n=3).
Análisis físicos y microbiológicos
Con el objetivo de evaluar el efecto de la esterilización sobre la disminución de la cantidad de agua de los suelos, se llevaron a cabo determinaciones de humedad (% p/p) antes y después de los tratamientos (n=2). La humedad fue determinada por el método de secado en estufa, 105�C, 24 h, por diferencia de peso (Instituto Geográfico Agustín Codazzi [IGAC], 2006).
Con el objetivo de determinar la eficiencia de la esterilización se llevaron a cabo recuentos microbianos antes y después de los tratamientos, por diluciones seriadas en solución salina (09% p/v) y siembra en placa en agar nutritivo (Foght & Aislabie, 2005). Los recuentos se llevaron a cabo después de 8 d. de incubación a 22�Cy se informaron como Unidades Formadoras de Colonia por gramo (UFC/g).
Análisis estadísticos
Las evaluaciones de los tratamientos de esterilización se hicieron por triplicado (n=3) y los análisis de humedad por duplicado (n=2). Las variables se evaluaron por el test de chi cuadrado (a 0,05) y para determinar diferencia entre los tratamientos se utilizó el test de Tukey (a< 0,05). Para determinar diferencias entre los valores antes de las esterilizaciones y después de ellas se llevó a cabo una comparación de medias (t-student, a=0,05).
Resultados
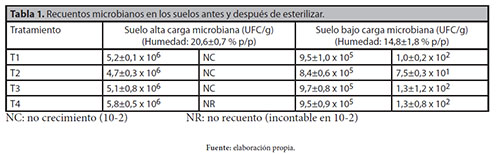
Antes de la evaluación de los tratamientos se llevaron a cabo determinaciones de humedad por secado en estufa y diferencia de pesos (IGAC, 2006) y caracterización microbiológica por determinación de heterótrofos totales por recuento en placa (Foght & Aislabie, 2005). De estas determinaciones previas se halló que el suelo con mayor cantidad de agua (20,6�0,7 % p/p) presentaba mayor recuento microbiano (7,4�0,7 x 106 UFC/g) y que el suelo con menor cantidad de agua (14,8� 1,8 % p/p) presentaba menor cantidad de microorganismos (9,2�1,0 x 105 UFC/g).
En cuanto a los tratamientos del suelo con calor húmedo se logró esterilización en el suelo con mayor recuento microbiano y con mayor humedad, mientras que en el suelo con menor recuento y menor humedad se obtuvo disminución significativa pero no esterilización. En el tratamiento con microondas no se obtuvo esterilización en ninguno de los dos suelos y se obtuvo disminución significativa en el tratamiento por 4 min, en el suelo con recuento y humedad bajos, contrario a lo obtenido en la esterilización húmeda, ya que se obtuvieron mejores resultados en el suelo con menor humedad, pero sin obtenerse esterilización (tabla 1). Estos resultados indican una relación entre la eficiencia de la esterilización con calor húmedo en autoclave y la cantidad de agua presente en el suelo antes de la esterilización, mostrando mayor eficiencia en la disminución del recuento de los microorganismos en suelos con mayor cantidad de agua.
Se presenta el valor promedio de 6 datos (n=6) y la desviación estándar. T1: esterilización en autoclave 121�C, aprox. 15 lb/ pul2, 30 min., 3 d. consecutivos, entre cada ciclo de autoclave el suelo se incubó a 25�C; T2: esterilización en autoclave 121�C,aprox. 15 lb/pul2 , 1 h., 3 d. consecutivos, entre cada ciclo de autoclave el suelo se incubó a 25�C; T3: esterilización en autoclave 121�C, aprox. 15 lb/pul2 , 30 min., 3 d. Tabla 1. Recuentos microbianos en los suelos antes y después de esterilizar. Tratamiento Suelo alta carga microbiana (UFC/g) (Humedad: 20,6�0,7 % p/p) Suelo bajo carga microbiana (UFC/g) (Humedad: 14,8�1,8 % p/p) T1 5,2�0,1 x 106 NC 9,5�1,0 x 105 1,0�0,2 x 102 T2 4,7�0,3 x 106 NC 8,4�0,6 x 105 7,5�0,3 x 101 T3 5,1�0,8 x 106 NC 9,7�0,8 x 105 1,3�1,2 x 102 T4 5,8�0,5 x 106 NR 9,5�0,9 x 105 1,3�0,8 x 102 NC: no crecimiento (10-2) NR: no recuento (incontable en 10-2) consecutivos, entre cada ciclo de autoclave el suelo se incubó a 65�C; T4: esterilización en microondas, 4 min.
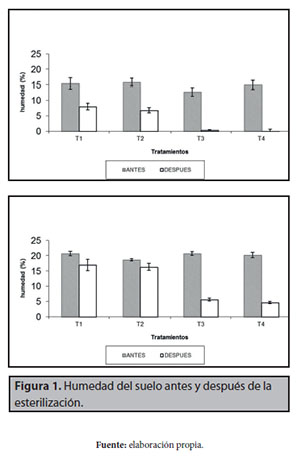
En cuanto a la disminución de la cantidad de agua en el proceso de esterilización, el suelo con mayor humedad esterilizado por 30 min. con incubación de 25�C entre cada ciclo de autoclave (T1) fue el que perdió menos agua. En el caso del suelo con menor humedad (14,8�1,8% p/p) la pérdida de agua en el proceso de esterilización fue menor en este mismo tratamiento (T1) con una disminución de aproximadamente el 8%, y en la esterilización por 1 hora con incubación de 25�C entre cada ciclo de autoclave (T2) con una disminución de aproximadamente el 7%.
Discusión
Aunque hay microorganismos que sobreviven en ambientes con baja cantidad de agua o encuentran eficiencia en la disminución del recuento de los microorganismos en suelos con mayor cantidad de agua.
Se presenta el valor promedio de 6 datos (n=6) y la desviación estándar.
T1: esterilización en autoclave 121�C, aprox. 15 lb/ pul2, 30 min., 3 d. consecutivos, entre cada ciclo de autoclave el suelo se incubó a 25�C; T2: esterilización en autoclave 121�C,aprox. 15 lb/pul2 , 1 h., 3 d. consecutivos, entre cada ciclo de autoclave el suelo se incubó a 25�C; T3: esterilización en autoclave 121�C, aprox. 15 lb/pul2 , 30 min., 3 d. en estos ambientes las condiciones óptimas de crecimiento, en general encontrar recuentos microbianos menores en suelos con menor cantidad de agua es lo esperado, ya que los microorganismos requieren agua para su metabolismo, esperándose disminución de los recuentos a menor humedad del suelo. Es importante recordar que, aunque la cantidad de agua en un suelo influye en el número y tipo de microorganismos en un hábitat, la composición de los suelos que define su clase textural así como sus características químicas también determinan la variedad y la cantidad de microorganismos que ocupan dicho hábitat (Atlas & Bartha, 2002).
La esterilización lograda en el suelo con mayor recuento microbiano y con mayor humedad y solo la obtención de la disminución significativa pero no esterilización en el suelo con menor recuento y menor humedad indicaron la relación entre la eficiencia de la esterilización con calor húmedo en autoclave y la cantidad de agua presente en el suelo antes de la esterilización, lo cual muestra mayor eficiencia en la disminución del recuento de los microorganismos en suelos con mayor cantidad de agua. Estos resultados obtenidos están acordes con lo esperado, ya que las células microbianas son más resistentes al calor a bajas cantidades de agua y las células deshidratadas y secas lo son también, ya que cuando la humedad aumenta el agua fluye libremente hacia el interior de la célula microbiana y de las esporas, y disminuye su resistencia al calor (Madigan, Martinko & Parker, 2003). Este fenómeno da la explicación de la no esterilización exitosa del suelo con baja cantidad de agua o bajo en humedad en la esterilización con calor húmedo en autoclave.
Contrario a lo obtenido en la esterilización con calor húmedo, en la evaluación de la esterilización con microondas se obtuvieron mejores resultados en el suelo con menor humedad. Este resultado no concuerda con lo encontrado por Chen et al. (1995), quienes obtuvieron mejores resultados en un suelo con 5,2%de humedad comparado con uno menor con 3,3% de humedad con 4 minutos de tratamiento. Sin embargo, Ferriss (1984) reportó que los efectos del tratamiento con microondas decrecían con el aumento en el contenido de agua del suelo entre 16 y 37%, en un estudio sobre reducción de la población de patógenos de plantas en el suelo, como fue evidenciado en el presente estudio con humedades aproximadas de 15 y 21%.
Como ya se resaltó en los resultados, el tratamiento T1 fue el que perdió menos agua en el proceso de esterilización en autoclave. La pérdida de agua en el proceso de esterilización puede llevar a pérdida de nutrientes por lixiviación y a cambios en la estructura del suelo, por lo que se recomienda el tratamiento T1 para la disminución del recuento de microorganismos en suelos con humedad cercana al 20%, con una carga microbiana en el orden de 106 UFC/g. En cuanto a suelos con menor cantidad de agua, la esterilización húmeda puede no ser tan eficiente y la pérdida de agua puede ser también considerable (figura 1).
- A. Suelo alta carga microbiana 7,4�0,7 x 106
UFC/g
- B. Suelo bajo en carga microbiana 9,2�1,0 x 105
UFC/g
Se presenta el valor promedio de 6 datos (n=6) y las barras de error.
T1: esterilización en autoclave 121�C, aprox. 15 lb/ pul2 , 30 min., 3 d. consecutivos, entre cada ciclo de autoclave el suelo se incubó a 25�C; T2: esterilización en autoclave 121�C,aprox. 15 lb/pul2 , 1 h., 3 d. consecutivos, entre cada ciclo de autoclave el suelo se incubó a 25�C; T3: esterilización en autoclave 121�C, aprox. 15 lb/pul2 , 30 min., 3 d. consecutivos, entre cada ciclo de autoclave el suelo se incubó a 65�C; T4: esterilización en microondas, 4 min.
Al comparar la humedad de los suelos después de la esterilización de los tratamientos T1 y T2 se determinó que la pérdida de agua no se llevó a cabo por el tiempo de esterilización, sino por la temperatura de incubación entre los diferentes ciclos de autoclave, ya que no se presentó diferencia significativa entre ellos, pero sí se presentó entre los tratamientos T1 y T3; se vio mayor pérdida cuando el suelo se incubó a 65�C (T3).
Conclusiones
En este estudio se concluyó que la eficiencia de la esterilización de un suelo depende de la humedad o cantidad de agua que este contenga y de la técnica de esterilización utilizada, y se confirmó que en la esterilización con calor húmedo, a menor humedad inicial del suelo, mayor dificultad en obtener la disminución de los recuentos microbianos.
De acuerdo con los resultados obtenidos, se recomienda que para la elaboración de controles abióticos se evalúe la metodología de esterilización para cada tipo de suelo, y se establece que no hay un protocolo generalizado de esterilización que abarque todos los tipos de suelo, ya que la eficiencia del tratamiento dependerá del recuento inicial de los microorganismos y del tipo de suelo a trabajar.
Agradecimientos: al Centro de Investigaciones y Desarrollo Científico de la Universidad Distrital Francisco José de Caldas.
Al laboratorio de microbiología de la Facultad del Medio Ambiente y Recursos Naturales de la Universidad Distrital Francisco José de Caldas.
Referencias
Acosta Peñaloza, G.S. (2008). Evaluación por respirometría de la bioestimulación con nutrientes y de la bioaumentación con Acinetobacter sp. en la biorremediación de suelos contaminados con diésel. (Tesis inédita de Maestría). Bogotá: Pontificia Universidad Javeriana.
Atlas, R. M. & Bartha, R. (2002). Ecología microbiana y microbiología ambiental. Madrid: Pearson Educación.
Balba, M. T., Al-Awadhi, N. & Al-Daher, R. (1998). Bioremediation of oil-contaminated soil: microbiological methods for feasibility assessment and field evaluation. Journal of Microbiological Methods, 32, 155-164.
Bento, F. M., Camargo, F. A. O., Okeke, B. C., & Frankenberger, W. T. (2005). Comparative bioremediation of soils contaminated with diesel oil by natural attenuation, biostimulation and bioaugmentation. Bioresource Technology, 96, 1049-1055. doi: 10.1016/j.biortech. 2004.09.008
Cha�neau, C. H., Rougeux, G., Yéprémian, C., & Oudot, J. (2005). Effects of nutrient concentration on the biodegradation of crude oil and associated microbial populations in the soil. Soil Biology & Biochemistry, 37, 1490-1497. doi: 10.1016/j.soilbio.2005.01.012
Chen, S. Y., Dickson, D. W., & Mitchell, D. J. (1995). Effects of soil treatments on the survival of soil microorganisms. Journal of Nematology, 27(4S), 661-663.
Ferris, R. S. (1984). Effects of microwave oven treatment on microorganisms in soil. Phytopathology, 74(1), 121-126.
Foght, J. & Aislabie, J. (2005). Enumeration of soil microorganisms. In: R. Margesin & F. Schinner (eds.), Manual of soil analysis. Monitoring and assessing soil bioremediation (pp. 261- 280). Berlin: Springer.
Instituto Geográfico Agustín Codazzi [IGAC]. (2006). Métodos analíticos del laboratorio de suelos. 6a ed. Bogotá: Imprenta Nacional de Colombia.
Madigan, M., Martinko, J., & Parker, J. (2003). Brock Biología de los microorganismos. Madrid: Pearson Prentice Hall.
Margesin, R. & Schinner, F. (1997). Efficiency of indigenous and inoculated cold-adapted soil microorganisms for biodegradation of diesel oil in alpine soils. Applied and Environmental Microbiology, 63(7), 2660-2664.
Margesin, R., Zimmerbauer, A., & Schinner, F. (2000). Monitoring of bioremediation by soil biological activities. Chemosphere, 40, 339- 346.
Merini, L. J., Cuadrado, V., Flocco, C. G., & Giulietti, A. M. (2007). Dissipation of 2,4-D in soils of the Humid Pampa region, Argentina: A microcosm study. Chemosphere, 68(2), 259- 265.
Razavi darbar, S. & Lakzian, A. (2007). Evaluation of chemical and biological consequences of soil sterilization methods. Caspian Journal of Environmental Science, 5(2), 87-91.
Schoefs, O., Perrier, M.,& Samson, R. (2004). Estimation of contaminant depletion in unsaturated soils using a reduced-order biodegradation model and carbon dioxide measurement. Applied Microbiology and Biotechnology, 64, 53-61. doi: 10.1007/s00253-003-1423-3
Singh, A., Ward, O. P., & Kuhad, R. C. (2005). Feasibility Studies for Microbial Remediation Hydrocarbon-Contaminated Soil. In: R. Margesin & F. Schinner (eds.), Manual of soil analysis. Monitoring and assessing soil bioremediation (pp. 131-153). Berlin: Springer.
Trevors, J. T. (1996). Sterilization and inhibition of microbial activity in soil. Journal of Microbiological Methods, 26, 53-59. doi: 10.1016/0167- 7012(96)00843-3.
Velázquez-Martí, B. & Gracia-López, C. (2004). Evaluation of two microwave surface distribution systems designed for substratum and agricultural soil desinfection. Spanish Journal of Agricultural Research, 2(3), 323-331.
Viñas, M., Sabaté, J., Espuny, M. J., & Solanas, A. M. (2005). Bacterial community dynamics and polycyclic aromatic hydrocarbon degradation during bioremediation of heavily creosote- contaminated soil. Applied and Environmental Microbiology, 71(11), 7008-7018.
License
When submitting their article to the Scientific Journal, the author(s) certifies that their manuscript has not been, nor will it be, presented or published in any other scientific journal.
Within the editorial policies established for the Scientific Journal, costs are not established at any stage of the editorial process, the submission of articles, the editing, publication and subsequent downloading of the contents is free of charge, since the journal is a non-profit academic publication. profit.