DOI:
https://doi.org/10.14483/23448350.343Published:
07/31/2006Issue:
No. 8 (2006): Enero-diciembreSection:
Ciencias Básicas y EducaciónEstudio del comportamiento que presenta la enzima poligalacturonasa en cuatro materailes experimentales de toamate
Downloads
References
BIGGS, A. Effects of calcium salts on growth, poligalacturonase activity, and infection of peach fruit by Monilinia fructk-ola. En: Plant Diseae. (April. 1997). p. 399-403.
CABANNE, C. and DONÉCHE, B. Changes in polygalacturonase acivity and calcium content duing ripening of grape berries. En: Am. J.Enol. Vitic. Vol. 52 no. 4 (2001,) p. 331-335.
CAPRARI, C. etal. Mutagenesis of endopolygalacturonase from Fusarium moniliformes histidine residue 234 is critical for enzimatic and macerating activities and not for binding to poligalacturonase-inhibitingprotein. En: Mol Plant Microb Interact Vol. 9 p. 617-624. Citado por: HADFIELD, K. and BENNETT, A. Poligalacturonases: many genes in search of a function. En: Plant Physiology. Vol 117 (1998), p. 337-343.
CASTRO, J. y OLAYA, A. Análisis próximo y reconocimiento de B- caroteno de materiales experimentales de tomate. Tesis de grado (Licenciatura en química). 2001. Universidad Distrital, Facultad de Ciencias de la Educación, carrera licenciatura en química. Bogotá. p. 155
DELLAPENA, Dean, and BENNETT, Alan B. In vitro synthesis and processing of tomato fruit polygalacturonase. En: Plant Physiology. Vol. 86 no. 4 (1988), p. 1057-1063.
DELLAPENA, Dean and BENNETT, Alan. Polygalacturonase gene expression in Rutgers, rin, nor y Nr tomato fruits. En: Plant Physiology. Vol. 85 (1987), p. 502-507.
GROSS, K. A rapid and sensitive spectróphotometric method for assaying polygalacturonase using 2 - cyanoacetamide. En: HortScience. Vol. 17 (1982) p. 933-935
HADFIELD, K. and BENNETT, A. Poligalacturonases: many genes in search of a function. En: Plant Physiology. Vol 117 (1998), p. 337-343.
HADFIELD, K. and BENNETT, A Polygalacturonase gene expression in ripe melon fruit supports a role for polygalacturonase in ripening-associated pectin disassembly. En: Plant Physiology. Vol. 117 (1998), p. 363-373.
HASEGAWA, S. etal. Polygalacturonase content of dates and its relation to maturity and softness. En: Journal of Food Science. Vol. 34 (1969), p. 527-529.
LOBO, M. eta! Estudios fisiológicos con el mutante "Alcobaca" para postmaduración de los frutos de tomate. En: Revista ICA. Vol. 22 (Octubre, 1987), p. 170-177.
REDENBAUGH, K. etal. Safety assessment of genetically engineers fruits and vegetables. A case study of the Flavr Savrrm tomato. New York: CRC Press, 1993.p 56
REDENBAUGH, K. etal. Regulatory issues for commercialization of tomatoes with an antisense poligalacturonase gene. En : In Vitro Cell. Dev. Biol. (1993). p. 17-26.
SATO, T. eta! Cell-free synthesis of a putative precursor of polygalacturonase in tomato fruit. En: Plant & physiology Vol. 5 no. 6 (1984), p. 1069-1071.
SCOTT-CRAIG, Js. eta! Endopolygalacturonase is not required for pathogenecity
of Cochiobo/us carbonum on maize. En: Plant Cell. Vol 2 (1990) p. 1191-1200. Citado por : HADFIELD, K. and BENNETT, A. Poligalacturonases: many genes in search of a function. En: Plant Physiology. Vol 117 (1998), p. 337-343.
SITRIT, Y. and Bennett, A. Regulation of tomato fruit poligalacturonase mRNA
accumulation by ethylene: A re-examination. En: Plant Physiology. Vol. 116 (1998),
p. 1145-1150.
SITRIT, Yaron eral. Expression of a polygalacturonase associated with tomato seed
germination. En: Plant Physiology. Vol. 121, (October 1999), p. 419-428.
STOSCHECK. . Guide to protein purification. San Diego: Academic press, 1990. p. 55. Citado por: DEUTSCHER, M. Guide to protein purification. San Diego: Academic press, 1990. p.50.
STRATILOVA, E. eta! An essential tyrosine residue of Aspergillus polygalacturonase. En: PEBS Letts Vol. 382 (1996), p. 164-166. Citado por: HADFIELD, K. and BENNETT, A. Poligalacturonases: many genes in search of a function. En: Plant Physiology. Vol 117 (1998), p. 337-343.
VALLEJO, E Mejoramiento genético y producción de tomate en Colombia, Univer-sidad Nacional de Colombia, Sede Palmira: Ed. Feriva, S. A., 1999, p. 216.
How to Cite
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Download Citation
Ciencias Básicas y Educación
Revista Científica, 2006-08-00 vol: nro:8 pág:175-184
"Estudio del comportamiento que presenta la enzima Póligalacturonasaen cuatro materiales experimentales de tomate"
García Urrego Sandra Olga Liliana
Estudiante de Investigación Universidad Distrital.
Moreno Duran Gerardo
Investigador Principal Programa Características de las Plantas Obtenidas con Metodología del Heteroinjerto Bernal, HIB, Pontificia Universidad Javeriana
Ayala Fajardo Adis
Investigadora Grupo Bioquímica y Biología Molecular Universidad Distrital Francisco José de Caldas.
Resumen
El fruto del tomate (Lycopersicon esculenturn), durante su proceso de maduración, sufre numerosos cambios en las sustancias pécticas que conforMan la pared celular produciendo una'pérdida de lozanía y firmeza que ocasiona su senescencia debido al incremento de la actividad de las enzimas pécticas entre las cuales se encuentra la poligalacturonasa (PG). En la Fácultad de Ciencias de la Pontificia Universidad Javeriana, en 1996, mediante el uso de la Metodología del Heteroinjerto Bernal (HIB) se obtuvieron cuatro materiales experimentales de tomate denominados experimentalmente T1 (Tomate Marglobe X Tomate de Árbol), T2 (Tomate Milano X Altamiza), T3 (Tomate Milano X Maciega) y T4 (Tomate Milano X Altramuz). Se ha observado que estos tomates tienen la característica de presentar un período de poscosecha más largo al compararlo con los parentales maternos. El objetivo de este estudio fue determinar la velocidad enzimáticade la poligalacturonasa (PG) de los heteroinjertos de tomate y un tomate comercial (TC) como control en estado de maduración rojo.
Para la extracción de la enzima PG se empleó el método de Redenbaugh (1993). Los cristales de enzima obtenidos se resuspendieron y las proteínas se cuantificaron espectrofotométricamente a 280 nm por el método Stoscheck (1990) hallando valores promedio de 0.850 mg / mL, 0.781 mg / mL, 0.747 mg / mL, 0.750 mg / mL y 0.329 mg / mL para T1, T2, T3, T4 y TC respectivamente. A partir de los extractos de cada heteroi jerto se realizó una electroforesis SDS-PAGE del 12% en donde se observaron cuatro bandas, una de ellas con peso molecular de 44,7 KD que posiblemente corresponde a la isoenzima endo-PG. Posteriormente se midió la actividad enzimática de la PG en los materiales de tomate objeto de estudio espectrofotométricamente por el método de Gross (1982) el cual fue modificado, se halló una disminución de actividad del 44.5%, 46%, 28% y 37% respectivamente para T1, T2, T3 y T4 con relación al control TC. Para caracterizar loS productos de la reacción enzimática de la PG se realizó una cromatografía en capa fina que mostró en . los heteroinjertos un monómero correspondiente al ácido gálacturóÑco con mayór intensidad y otros complejos coloreados muy débiles de mayor peso molecular que pueden corresponder a dímeros, trímeros, tetrámeros, etc., esto se debe pósibiemente, a que la PG presente en los materiales experimentales no hidrolizó el ácido poligalacturónico en un 100% a diferencia de la PG del tomate control.
1. INTRODUCCIÓN
La maduración del fruto de tomate se caracteriza por presentar una serie de cambios bioquímicos y fisiológicos coordinados entre sí, que contribuyen a la textura, color y sabor final del fruto maduro (Dellapenna, 1987). Las enzimas pécticas juegan un papel importante en los cambios de la textura durante el proceso de maduración (Hasegawa, et.al ., 1969). El ablandamiento se ha atribuido a la solubilización de pectinas por efecto de enzimas pécticas como la poligalacturonasa (E.C. 3.2.1.15), que cataliza la hidrblisiS de los enlaces glicosídicos a (1—>4) de las sustancias pécticas generando una disminución de la firmeza de los tejidos. Así mismo la pectinesterasa.(E.C. 3.1.1.11) hidroliza loS grupos metil éster del ácido péctico y de la pectina produciendo grupós cai -boxilo libres. Estas enzimas han sido señaladas cómo las hidrolasas más importantes que influyen en el proceso de ablandamiento del fruto, seguidas por la celulasa (Lobo, 1987).
La actividad de la PG se ha cuantificado mediante la formación . de grupos reductores por los métodos de Somogy-Nelson (1944), Luschinger and Cornesky (1962),,también se utiliza el método de Gross et.al ., (1982), el cual es más fácil y sensible que los ótros métodos debido a que cuantifica nanomoles de azúcares reductores.
Por lo tanto el objetivo de este estudio fue cuantificar, por este último método, la actividad enzimática de la PG en los diferentes materiales experimentales, productos de diferentes heteroinjertos de tomate (T1, T2, T3, T4) con relación a un control ( Tomate Milano).
2. METODOLOGÍA
Se emplearon 10 muestras en estado de maduración rojo de cada uno de los materiales experimentales (T1, T2, T3 y T4) y del tomate "Milano" como control. Estos se lavaron con agua fría, se secaron al aire, se pesaron 20 g de pericarpio sin semillas y se siguió el Protocolo de Redenbaugh (1993), ajustando el buffer de extracción para esta cantidad de 'muestra. Cada extracto crudo se colocó en cajas de petri y se secó en una cámara de flujo laminar a 10 °C hasta la obtención de cristales. De éstos se pesaron 40 mg que fueron resuspendidos en 1 mL de buffer acetato 50 mM pH 4.4. A partir de cada una de estas muestras se realizaron los siguientes procedimientos:
2.1 Cuantificación de Proteínas
Se realizó una curva de calibración de proteína con patrones de Albúmina Sérica Bovina fracción V en concentraciones de 0.5, 1.0, 1.5, 2.0, 2.5 y 3.0 mg / mL. De los cristales resuspendidos de cada material heteroinjertado se tomaron por triplicado 250 pi . y se mezclaron con 750 pl. de buffer acetato 50 mM pH 4.4 y se determinó espectro-fotométricamente por el método de Stoscheck (1990) el contenido de proteína.
2.2 Electroforesis
De cada uno de los cristales resuspendidos se tomaron 40 pL, se trataron con 20μl de buffer muestra (0.125 M Tris-HCI, pH 6.8, 4% SDS, 20% glicerol, 10% β-mercaptoetanol) y fueron incubadas en baño María a 100 °C durante 5 minutos. Posteriormente se sembraron 20&mu:l de esta mezcla en cada pozo, el gel se corrió en una electroforesis SDS-PAGE al 12% a 100 mA y 150 Voltios durante 50 minutos. Los geles se revelaron con tinción de nitrato de plata. El marcador de peso molecular (Pharmacia Biotech) contenía proteínas con pesos moleculares 94, 67, 43, 30, 20 y 14 KD.
2.3 Curva de Calibración para medir la Actividad Enzimática
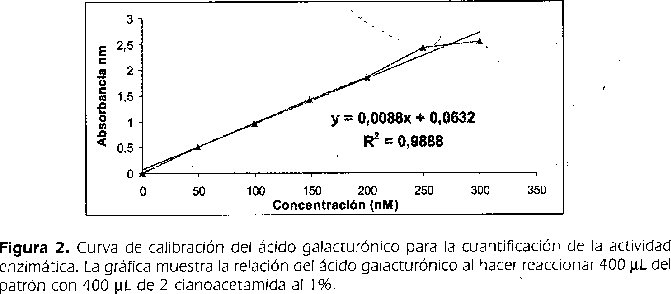
Para la determinación de la actividad enzimática de la PG se realizó una curva de calibración con ácido galacturónico (AGU), con el fin de medir la liberación hidrolítica de los azúcares reductores provenientes del ácido poligalacturónico. El ácido monogalacturónico se lavó con etanol al 80%, se secó en cámara de flujo laminar y se prepararon patrones frescos con concentraciones de 50 a 300 nM. Se utilizó el método de Gross (1982), con las siguientes modificaciones: se tomaron 400μl de cada uno de los patrones adicionándoles 2 mL de buffer borato-fosfato 0.1 M pH 9.0 y 400μl de 2-cianacetamida al 1% en agua. Se agitó en vórtex durante 5 segundos y se incubaron en baño María a 100 °C durante 10 min, se enfrió en baño de hielo durante 9 min y se leyó la absorbancia a 276 nm en un espectrofotómetro (Perkin Elmer;Inc. USA).
2.4 Actividad Enzimática
Para la cuantificación de la actividad enzimática, se empleó como sustrato ácido poligalacturónico (ICN Chemical, referencia 102711, RT), este ácido se lavó con etanol al 80%, se dejó secar en una cámara de flujo laminar. De cada uno de los extractos resuspendidos se tomaron 100μl de enzima, se incubaron a 37 °C durante 1 hora con 300 tL de ácido poligalacturónico al 0.2% preparado en buffer acetato 37 mM pH 4.4. La reacción se detuvo al tratar con 2 mL de buffer borato-fosfato 0.1M pH 9.0 frío y el procedimiento se continuó como en la curva de calibración del ácido galacturónico. El blanco de reactivos se preparó adicionando buffer acetato 50 mM pH 4.4 en lugar de la enzima. La actividad se determinó con la siguiente ecuación:

También se realizó un ensayo enzimático para determinar la actividad específica de la PG, igualando la concentración de proteína al diluir una alícuota de los extractos de los materiales experimentales TI y T2 al valor de proteína presente en el control (0.426 mg/mL).
2.5 Cromatografía en Capa Fina
Para caracterizar los productos liberados por la PG y comparar la hidrólisis de la PG de los diferentes materiales experimentales, se incubaron 300&mu:l del sustrato (ácido poligalacturónico) con 100 tL del extracto enzimático a 37 °C y se realizaron dos ensayos con tiempos de incubación de 1 y 3 horas de manera independiente, se detuvo la reacción en baño de María a 100 °C durante 10 minutos. Se sembraron 5μl del producto de reacción, en una cromatoplaca de sílicagel 60 Merck (10 x 10 cm), a 2 cm del origen y se separaron con una mezcla de butano!, ácido acético, agua 2:1:1, con el fin de hacer la diferenciación del producto se emplearon estándares de galactosa, ácido monogalacturónico y poligalacturónico de 200 mg /dL. Después de la separación cromatográfica se reveló con 0.2% de 1,3-naftalenodiol en etanol al 95% que contenía 2.5% de ácido sulfúrico concentrado.
3. RESULTADOS Y DISCUSIÓN
3.1 Cuantificación de Proteínas
Al cuantificar las proteínas de las 10 muestras de cada material de estudio se hallaron los siguientes valores promedios para los tomates correspondientes a T1 de 0.850 mg/ mL, T2 de 0.781 mg/mL, T3 de 0.747 mg/mL, y T4 de 0.750 mg/ml y para el tomate controlTC de 0.365 mg/mL.
Estos valores indican mayor contenido de proteína en los heteroinjertos que en el tomate control. Este fenómeno se puede relacionar con la influencia que tiene el etanol sobre la expresión y acumulación de proteína PG. En 1998, Sitrit y Bennellt determinaron que esta hormona vegetal juega un papel importante en el proceso 41 - traSIligiiiárfnde transpiración del gen de la PG, para luego traducirse en proteína polígalacturonasa también hallaron que en tomates que no habían sufrido alguna mutación, la PG atuernentaba progresivamente al igual que se sintetizaba el etileno, pero una vez el fruto estuvo maduro disminuyó la concentración de la hormona al tiempo que lo hacía la PG.
Es posible que el etileno esté influyendo en el aumento de la concentración de la proteína a lo largo del período de poscosecha de los materiales experimentales de tomate. T1, T2, T3 y T4. También es posible que la síntesis de esta hormona se esté llevando mpas allá del estado de maduración rojo, pues la proteína se presentó en cantidad.
3.2 Electroforesis
Al separar las proteínas presentes en los cristales solubilizados, de cada uno de los materiales experimentales y el tomate control, por electroforesis SDS-P GE se observaron 4 bandas con pesos moleculares aproximados de 64.7, 55.2, 44.7 y273 KD, con Rfs de 0.26, 0.32, 0.40 y 0.58 respectivamente. Estudios realizados por Delllapenna et.al ., (1988), han reportado para la endopoligalacturonasa un peso molecular de 45 KD en tomate. Sato et.al., (1984), aislaron la PG con un peso molecular de 44 KD, pilar lo tanto es posible que el polipéptido correspondiente a 44.7 KD que se observó en este estudio con un Rf de 0.40 corresponda a esta isoenzíma (Figura 1).
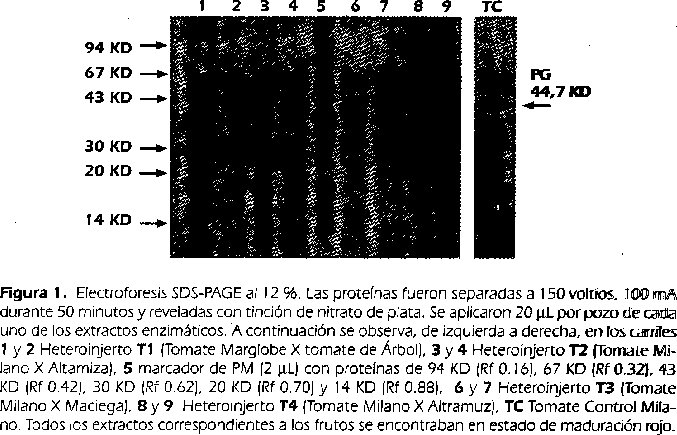
3.3 Actividad Enzimática
Al realizar la curva de calibración con el ácido galacturónico como patrón, se observó una linealidad hasta 250 nM y un límite de detección de 37.5 nM.(Figura 2).
La estabilidad que mostró el complejo formado fue de 1 hora. Al cuantificar la actividad enzimática de cada una de las diez muestras de tomates obtenidos por heteroinjerto y el control, se halló una actividad promedio de 0.116μmol/ min/mg proteína para TI, 0.112μmol/ min/mg proteína para T2, 0.150 y 0.131μmol/ min/mg proteína para T3 y T4 respectivamente. El tomate control presentó una actividad de 0.209μmol/min/ mg proteína. Estos resultados muestran que hubo una disminución de actividad del 44.5%, 46.4%, 28% y 37% para los materiales TI, T2, T3 y T4 respectivamente frente al control. (Figura 3).
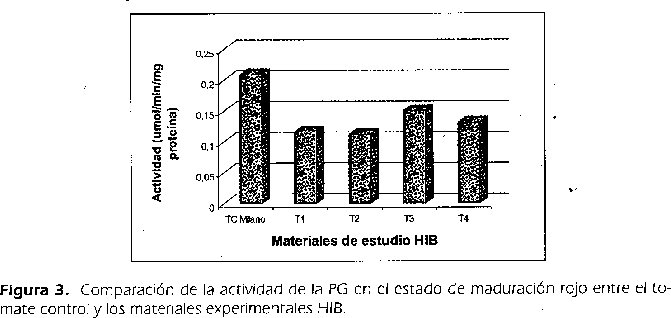
La menor actividad de la PG de los materiales experimentales de tomate (TI , T2, T3 y T4) podría explicar el porque estos tomates productos de los diferentes heteroinjertos presentan en postcosecha mayor tiempo de vida útil y menos pérdida de firmeza y lozaníay por lo tanto una senescencia más lenta; puesto que la enzima PG es la responsable del ablandamiento de los frutos.
Sin embargo se deben realizar estudios moleculares y bioquímicos de los materiales experimentales que expliquen la disminución de velocidad enzimática, debido a que estas enzimas son codificadas por una amplia familia de genes que se diferencian en términos de su expresión espacial y temporal. Así las PGs pueden diferir en sus propiedades bioquímicas, como en la forma de hidrólisis o especificidad del sustrato (Hadfield and Bennett, 1998).
Al determinar la actividad específica de la PG con una concentración igual de proteína 0.426 mg/mL para TI, T2 y TC también se observaron velocidades de actividad enzimática menores en comparación con el control (Figura 4).

roinjertos y la del control tal como se ha reportado para diferentes poligalacturonasas. Por ejemplo, la PG que contribuye al ablandamiento y cambio de la textura en el fruto de tomate tiene solamente 41% de similitud a la PG que se encuentra en la zona de abscisión de dicho fruto y un 60% con relación a la PG presente en el melón. Muchas secuencias de las PGs muestran divergencias en su estructura, así como dominios conservados en los sitios catalíticos y en la región carboxilo terminal.(Scott Craig et.a/.,1990; Caprari et.al., 1996, Stratilova et.al., 1996). Por lo tanto, es importante establecer la razón de esta diferencia de actividad, a pesar de que la región del fruto del tomate de la cual se extrajo la PG fue la misma.
Por otra parte, análisis previos realizados por Castro y Olaya (2001), en estos mismos materiales experimentales, muestran mayor contenido de cenizas, entre los cuales se encuentran minerales como el potasio, hierro y calcio. Es necesario realizar estudios de la concentración del calcio presente en los heteroinjertos de tomate como también de otros inhibidores, debido a que en uvas se reportó que al incrementarse la actividad de la PG a lo largo del proceso de maduración, el contenido de calcio disminuía (Cabanne and Donéche, 2001). Otros estudios mostraron que la enzima PG de la Monilinia fructicola también era inhibida por sales de calcio (Biggs et.al., 1997).
3.4 Cromatografía en Capa Fina
Al incubar de 1 a 3 horas el ácido poligalacturónico con las PGs de los hetereoinjertos T1, T2, T3 y T4 y separar por cromatografía en capa fina los productos de hidrólisis generados, se observaron bandas de mayor intensidad con un Rf de 0.7 cm, que comigraban con el ácido galacturónico, como también complejos coloreados muy débiles de alto peso molecular que posiblemente correspondían a dímeros, trímeros tetrámetros, etc. (Figuras 5 y 6 bandas señaladas con flecha azul).
De acuerdo con los datos encontrados en la cromatoplaca es posible que la PG presente en los tomates heteroinjertos corresponda a la endo.PG debido a que la enzima no hidrolizó el ácido poligalacturónico en un 100%, a diferencia de la PG presnete en el tomate control que sí lo hizo y por lot anto no se observó otros subproductos (Figuras 5 y 6 en L3).
IMAGEN NO DISPONIBLE
4. CONCLUSIONES
En el uso de la metodología de HB se ha caracterizado por permitir una mayor adaptación de las plantas al medio ambiente, mejorar las características bioquímicas y nutricionales de las plantas, aumentar la resistencia a plagas y enfermedades para lograr una cosecha con mayor producción y calidad. En el caso de los frutos un tiempo de almacenamiento y vida útil más prolongada, tal como sucede con los frutos del tomate.
Los materiales experimentales de tomate T3 y T4 fueron los heteroinjertos con menor contenido de proteína en el estado de maduración rojo. Existe una diferencia del 10% y del 11% de estos dos heteroinjertos, respecto a la concentración de Ti, la cual fue la de mayor concentración proteica 0.850 mg/mL. En T2 se observó menor cantidad de proteína que en Ti (8%), y un 2.5% y 3.6% más que T3 y T4 respectivamente. El estudió mostró que el tomate control Milano (TC) fue el fruto con menos contenido proteico, la diferencia hallada con Ti, T2, T3 y T4 fue del 57%, 53%, 52% y 53% en su orden. Por lo anteriormente observado es importante determinar si existe influencia genética en los tomates HIB, por parte de los parentales paternos que incrementen el contenido de proteína y disminuya la actividad enzimática.
En este estudio también se halló una disminución en la actividad enzimática de la PG en los cuatro heteroinjertos con relación al tomate control de un 44.5%, 46.4%, 28% y37% para Ti, T2, T3 y T4 respectivamente. La disminución de la actividad enzimática se vio reflejada en un fruto de mayor durabilidad, mayor tiempo de almacenamiento, con mayor firmeza y lozanía. Estas son condiciones que tanto los productores como consumidores buscan en los frutos durante el proceso de comercialización.
Sin embargo, es necesario realizar investigaciones que relacionen la actividad enzimática o expresión de la PG en los distintos heteroinjertos con las concentraciones de etileno y calcio en las diferentes etapas de maduración de los frutos.
Agradecimientos
A la Facultad de Ciencias de la Pontificia Universidad Javeriana por su colaboración con los materiales experimentales de tomate.
5. BIBLIOGRAFÍA
- BIGGS, A. Effects of calcium salts on growth, poligalacturonase activity, and infection of peach fruit by Monilinia fructk-ola. En: Plant Diseae. (April. 1997). p. 399-403.
- CABANNE, C. and DONÉCHE, B. Changes in polygalacturonase acivity and calcium content duing ripening of grape berries. En: Am. J.Enol. Vitic. Vol. 52 no. 4 (2001,) p. 331-335.
- CAPRARI, C. etal. Mutagenesis of endopolygalacturonase from Fusarium moniliformes histidine residue 234 is critical for enzimatic and macerating activities and not for binding to poligalacturonase-inhibitingprotein. En: Mol Plant Microb Interact Vol. 9 p. 617-624. Citado por: HADFIELD, K. and BENNETT, A. Poligalacturonases: many genes in search of a function. En: Plant Physiology. Vol 117 (1998), p. 337-343.
- CASTRO, J. y OLAYA, A. Análisis próximo y reconocimiento de [3- caroteno de materiales experimentales de tomate. Tesis de grado (Licenciatura en química). 2001. Universidad Distrital, Facultad de Ciencias de la Educación, carrera licenciatura en química. Bogotá. p. 155
- DELLAPENA, Dean, and BENNETT, Alan B. In vitro synthesis and processing of tomato fruit polygalacturonase. En: Plant Physiology. Vol. 86 no. 4 (1988), p. 1057-1063.
- DELLAPENA, Dean and BENNETT, Alan. Polygalacturonase gene expression in Rutgers, rin, nor y Nr tomato fruits. En: Plant Physiology. Vol. 85 (1987), p. 502-507.
- GROSS, K. A rapid and sensitive spectróphotometric method for assaying polygalacturonase using 2 — cyanoacetamide. En: HortScience. Vol. 17 (1982) p. 933- 935
- HADFIELD, K. and BENNETT, A. Poligalacturonases: many genes in search of a function. En: Plant Physiology. Vol 117 (1998), p. 337-343.
- HADFIELD, K. and BENNETT, A Polygalacturonase gene expression in ripe melon fruit supports a role for polygalacturonase in ripening-associated pectin disassembly. En: Plant Physiology. Vol. 117 (1998), p. 363-373.
- HASEGAWA, S. etal., Polygalacturonase content of dates and its relation to maturity and softness. En: Journal of Food Science. Vol. 34 (1969), p. 527-529.
- LOBO, M. eta! Estudios fisiológicos con el mutante "Alcobaca" para postmaduración de los frutos de tomate. En: Revista ICA. Vol. 22 (Octubre, 1987), p. 170-177.
- REDENBAUGH, K. etal., Safety assessment of genetically engineers fruits and vegetables. A case study of the Flavr Savrrm tomato. New York: CRC Press, 1993.p 56
- REDENBAUGH, K. etal. Regulatory issues for commercialization of tomatoes with an antisense poligalacturonase gene. En : In Vitro Cell. Dev. Biol. (1993). p. 17-26.
- SATO, T. eta! Cell-free synthesis of a putative precursor of polygalacturonase in tomato fruit. En: Plant & physiology Vol. 5 no. 6 (1984), p. 1069-1071.
- SCOTT-CRAIG, Js. etal., Endopolygalacturonase is not required for pathogenecity of Cochiobo/us carbonum on maize. En: Plant Cell. Vol 2 (1990) p. 1191-1200. Citado por : HADFIELD, K. and
- BENNETT, A. Poligalacturonases: many genes in search of a function. En: Plant Physiology. Vol 117 (1998), p. 337-343.
- SITRIT, Y. and Bennett, A. Regulation of tomato fruit poligalacturonase mRNA accumulation by ethylene: A re-examination. En: Plant Physiology. Vol. 116 (1998), p. 1145-1150.
- SITRIT, Yaron eral. Expression of a polygalacturonase associated with tomato seed germination. En: Plant Physiology. Vol. 121, (October 1999), p. 419-428.
- STOSCHECK. . Guide to protein purification. San Diego: Academic press, 1990. p. 55. Citado por: DEUTSCHER, M. Guide to protein purification. San Diego: Academic press, 1990. p.50.
- STRATILOVA, E. etal., An essential tyrosine residue of Aspergillus polygalacturonase. En: PEBS Letts Vol. 382 (1996), p. 164-166. Citado por: HADFIELD, K. and BENNETT, A. Poligalacturonases: many genes in search of a function. En: Plant Physiology. Vol 117 (1998), p. 337-343.
- VALLEJO, E Mejoramiento genético y producción de tomate en Colombia, Universidad Nacional de Colombia, Sede Palmira: Ed. Feriva, S. A., 1999, p. 216.
License
When submitting their article to the Scientific Journal, the author(s) certifies that their manuscript has not been, nor will it be, presented or published in any other scientific journal.
Within the editorial policies established for the Scientific Journal, costs are not established at any stage of the editorial process, the submission of articles, the editing, publication and subsequent downloading of the contents is free of charge, since the journal is a non-profit academic publication. profit.



