DOI:
https://doi.org/10.14483/23448350.301Published:
11/30/2007Issue:
No. 10 (2008): Enero-diciembreSection:
Artes y Ciencias SocialesInfluencia del AIA, AG3 y Kinetina en el color, forma y tamaño de los protocormos de Comparettia falcata (Orchidaceae) durante su germinación bajo condiciones in vitro
AIA, agá and Kinetina influence, influence on color, shape and size of the Comparettia falcata (Orchidaceae) protocormos, during the germination under in Vitro conditions
Keywords:
In vitro, IAA, A3, kinetina, Comparettia falcata. (en).Keywords:
In vitro, AJA, AG 3, kinetin, Comparettia falcata (es).Downloads
References
Alarcón, C. (1982). Estudio de los medios simbióticos y asimbióticos para la propagación sexual de orquídeas nativas de la sabana de Bogotá. Bogotá. Trabajo de grado (agrónomo) Universidad Nacional de Colombia. Facultad de Agronomía,116 p.
Alvarez, B. (1997). "Reguladores del crecimiento vegetal", en Hurtado, D. y Merino, M. Cultivo de tejidos vegetales, Cuarta edición, México: Trillas, p.p. 48-70.
Arditti, J. (1971). "Orchid And The Discovery Of Auxin" en American Orchid Society Bulletin, 40 (3), p.p. 210-214.
Arditti, J.; Michaud, J.; Oliva, A. (1982). "Practical Germination Of North American And Related Orchids: I. Epipactis Atrorubens, E. Gigantea And E. helleborine", en American Orchid Society Bulletin, 51 (2), p.p. 162-166;.
Arend De Wilde, Job. (1994). Orquídeas silvestres de Ucumari. Colombia, Corporación Autónoma de Risaralda, 87 p.
Barlow, P. W. (1987). "Hormone Action in 'Plant Development a Critical Appraisal", en: Garcidueñas, M. y Ramírez H. (eds) Control hormonal del desarrollo de la planta: Fisiología tecnología- experimentación,segunda edición, México: Limusa, 53 p.
Bock, I. Comparettia Poepp. (1991). Sociedad Colombiana de arquideología. Orquídeas nativas de Colombia, Medellín: Colina, p.p. 92-93.
Box, M.; Terron, U. P. (1988). Multiplicación vegetativa y cultivo in vitro: Los Meristemos y la organogénesis, Madrid, España: Mundi-Prensa, 76, p.p. 128-140.
Chang, C.; Chang, W. C. (1998). Plant Regeneration From Callus Culture Of Cymbidium Ensifolium Var. Misericors. Plant Cell Rep. 17,p.p. 251-255.
Chen, Y.; Piluek, C. (1995). Effect Of Thidiazuron And N6-Benzylaminopurine On Shoot Regeneration Of Phalaenopsis. Plant Growth Regul. 16, p.p. 99-101.
Christianson, M. L.; Warnick D. A. (1998) "Organogenesis in vitro as a developmental process" en Hort Science, núm. 23 p.p. 515-519.
Davies, P.(1987). Plant Hormones and Their Role in Plant Growth and Development. Boston: Martinus Nijhoff Publishers, 633 p.
De Pauw, M.A.; Remphrey, W. R.; Palmer, C. E. (1995). The Cytokinin Preference For In Vitro Germination And Protocorm Growth Of Cyp-ripedium Candidum. Ann. Bot. 75, p.p. 267-275.
Ernst, R. (1994). Effect of thidiazuron on in vitro propagation of halaenopsis and Doritaenopsis (Orchidaceae). Plant Cell Tiss. Cult. 39, p.p.273-275.
Escobar, G.(1972). "Observaciones sobre el género Comparettia en Colombia"; en Orquideología 7(3), p.p. 141-142.
Garcidueñas, M.; Ramírez H.(1993). Control hormonal del desarrollo de la planta: Fisiología tecnología-experimentación. 2 ed. México: Limusa, p.p. 20 53; 105 111.
George, E. F. (1993). Plant Propagation by Tissue Culture. Part 1: The Technology. Exegetics Limited, Edigton. 574 p.
Gil, F. (1995). Elementos de Fisiología Vegetal.España: Mundi-Prensa, 1147 p.
Gray, W M. (2004). Hormonal regulation of plant growth and development. PLoS Biol. 2(9): 1270 -- 1273.
Hasegawa, A.; Goi, M. (1987). Rhizome formation in Cymbidium goeringii Reichenbach fil. and Cymbidium kanran Makino in shoot-tip culture. Hort. Sci. 56, p.p. 70-78.
Hartman, H.; Kester, D.; Davies, E; Geneve, R. (1997). Plant Propagation: Principies And Practices. Sixth edition. New Jersey: Prentice-Hall, Inc, p.p. 125-144.
Herman, E. (2005). Recent Advances in Plant Tissue Culture IX: Media and Techniques for Growth, Regeneration and Storage 2002-2005. Estados
Unidos: Agritech Consultants, INC, 129 p.
Jones, R.; Stoddart, J. (1980). "Gibberellins And Seeds Germination", en: Khan, A. (ed). The physiology and biochemistry of seed dormancy and germination. Amsterdam: North-Holland,Publishing Company, p.p. 97-104.
Lee, Y. I; Lee, N. (2003). Plant regeneration from protocorm-derived callus of Cypripedium formosanum. In Vitro Cell. Dev. Biol. Plant 39,p.p. 475-48;.
Lin, C. C. (1986). In vitro culture of flower stalk internodes of Phalaenopsis and Doritaenopsis.Lindleyana. 1: 158-- 163.
Martin, K. Clonal (2003). Propagation, Encapsulation And Reintroduction Of Ispea Malabarica (Reich. f.) J. D. Hook, an endangered orchid.In Vitro Cell. Dev. Biol. Plant 39, p.p. 322-328.
Ministerio de Medio Ambiente y Recursos Naturales de el Salvador (2004). Proyecto de Ley Sectorial de Biodiversidad de la República Dominicana 2002. Listado oficial de especies de vida silvestre amenazadas o en peligro de extinción, Acuerdo No. 10 de 2004.
Miyoshi, K.; Mii, M. (1995). Phytohormone pretreatment for the enhancement of seed germination and protocorm formation by the terrestrial
orchid, Calanthe discolour (Orchidaceae), in asymbiotic cultura. Scientia Horticulturae 63,p.p. 263-267.
Murashige, T.; Skoog, F. (1962). A revised medium for rapid growth and bioassays with tobacco tissues cultures. Physiol. Plant. 15, p.p. 473-479.
Murthy, H. N.; Pyati, A. N. (2001). Micropropagation of Aerides maculosum Lindl. (Orchidaceae). In Vitro Cell. Dev. Biol. Plant. 37, p.p.223-226.
Nayak, N. R.; Rath, S. P.; Patnaik, K. (1997). In vitro propagation of three epiphytic orchids, Cymbidium aloifolium (L.) Sw., Dendrobium aphyllum (Roxb.) Fisch. and Dendrobium moschatum (Buch-Ham) Sw. through thidiazuroninduced high frequency shoot proliferation. Sci.Hortic. 71, p.p. 243-250.
Ortiz, V.(1995). Orquídeas de Colombia. 2 ed.Bogotá: Corporación Capitalina de Orquideología, 320 p..
Paek, K. Y.; Yeung, E. C. (1991). The effects of 1-naphthalene acetic acid and N6-benzyladenine on the growth of Cymbidium forrestiirhizomes in vitro. Plant Cell Tiss. Org . Cult. 24, p.p. 65-71.
Palni, L. M; Burch, L. R.; Jorgan, R. (1993) "The effects of auxin concentration on citokynin stability and metabolism" en: Azcon y Talon. (eds.) Fisiología y Bioquímica Vegetal. 1 ed. España:Interamericana Mc.Graw-Hill, 323 p.
Pedroza, J.; Fernández, C.; Suárez, A. (2005). Evaluation Of The Effect Of Three Growth Regulators In The Germination Of Comparettia Falcata Seeds Under In Vitro Conditions. In Vitro Cell. Dev. Biol. Plant. 41, p.p. 838-843.
Peres, L.; Majerowicz, N.; Kerbauy G. (2001). Dry Matter Partitioning Differences Between Shoots And Roots In Two Contrasting Genotypes
Of Orchids And Their Relationship With.Endogenous Levels Of Auxins, Cytokinins And Abscisic Acid. Bras. Fisiol. Veg 13 (2), p.p. 185 195.
Pierik, R. L. M. (1990). Cultivo in vitro de las plantas superiores. Madrid: Mundi-Prensa, 326 p.
Rangel, O. (2000). Amenazas sobre la flora, la vegetación y los ecosistemas de Colombia. Pérez-Arbelaezia. 5 (11), p.p. 18-25;.
Ranjan, N.; Prasad, S.; Patnaik, S. (1997). In Vitro Propagation Of Three Epiphytic Orchids, Cymbidium Aloifolium (L.) SW., Dendrobium Aphyllum (Roxb.) Fisch. And Dendrobium Moschatum (Buch-Ham) SW. Through Thidiazuron-Induced High Frequency Shoot Proliferation. Scientia Horticulturae. 71, p.p. 243-250.
Reyburn, A. (1978). "The Effects of pH on the Expresión of a Darkness-Requiring Dormancy in Seeds of Cypripedium reginae Walt", en American Orchid Society Bulletin 47(9), p.p.798-801.
Rodriguez-Robles, J. A.; Ackerman, J.; Melendez, E. (1990). "Host Distribution and Hurricane Damage to an Orchid Population at Toro Negro
Forest, Puerto Rico", en Caribbean Journal of Science 26(3-4), p.p. 163-164.
Roy, J.; Banerjee, N. (2002). Rhizome and shoot development during in vitro propagation of Geodorum densiflorum (Lam.) Schltr. Scientia
Horticulturae 94, p.p. 181-192.
Salisbury, E; Ross, C. (2000). Fisiología Vegetal: Desarrollo de las plantas y fisiología ambiental.España: Thomson editores Paraninfo, S. A; p.p.
-574.
Sheelavanthmath, S. S.; Murthy, H. N.; Pyati, A.N.; Kumar, H.G.A.; Ravishankar, B. V. (2000). "In vitro propagation of the endangered orchid Geodurum densiflorum (Lam.) Schltr. through rhizome section culture" en Plant Cell Tissue.Org. Cult. Núm. 60, p.p. 151-154.
Sheelavanthmath, S.; Murthy, H.; Hema. B.; Hahn, E.; Paek, K. (2005). "High frequency of protocorm like bodies (PLBs) induction and plant regeneration from protocorm and leaf sections of Aerides crispum" en Scientia Horticulturae 106, p.p. 395-401.
Shimasaki, K.; Uemoto, S. (1990). "Micropropagation of a terrestrial Cymbidium species using rhizomes developed from seeds and pseudobulbs" en Plant Cell Tiss. Org. Cult. 22,p.p. 237-244;
Singh, E (1981). "Differential Staining Of Orchid Seeds For Viability Testing", en Am. Orchid Soc. Bull. 50(4), p.p. 416-418.
Skoog, E; Miller, C. O. (1957). Chemical Regulation Of Growth And Organ Formation In Plant Tissues Cultured In Vitro. Symposium of the Society for Experimental Biology. 11, p.p.118-131.
Steel, R.; Torrie, J.(1985). Bioestadística: Principios y procedimientos. 2 ed. Bogotá: McGraw Hill; p.p. 328-367.
Taiz, L; Zeiger, E. (1998). Plant physiology. Second edition. Sunderland, Massachusetts:Sinauer Associates, Inc., 557 p.
Tanaka, M.; Kumura, M.; Goi, M. (1998). "Optima/ conditions for shoot production from Phalaenopsis flower stalk cultures in vitro". Scientia
Horticulturae. 35, p. 117 - 126.
Thimann, K. V. (1987). "Plant Senescence: A Proposed Integration of the Constituent Proceses" 1987, en Salisbury y Ross (Eds.). Fisiología
Vegetal. México: IBEROAMERICANA, 428 p.
Thomas, T. H. (1980). "Cytokinin active compounds and seed germination", en: Khan,A. A (ed). The physiology and biochemistry of seed dormancy and germination. Ámsterdam: North-Holland, Publishing Company;, p.p. 111 - 137.
Trevawas, A. (1981). How do plant growth substances work? Plant Cell Environ. 4, p.p. 203-228.
Weaver, R. (1996). Reguladores del crecimiento de las plantas en la agricultura. 8 ed. México:Trillas, p.p. 5-544.
Woodward, A.; Bartel, B. Invited Review. (2005), "Auxin: Regulation, Action, and Interaction" en Annals of Botany 95, p.p. 707-735.
How to Cite
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Download Citation
Artes y ciencias sociales
Revista Científica, 2008-08-00 nro:10 pág:119-132
Influencia del AIA, AG3 y Kinetina en el color, forma y tamaño de los protocormos de Comparettia falcata (Orchidaceae) durante su germinación bajo condiciones in vitro
AIA, ag3 and Kinetina influence, influence on color, shape and size of the Comparettia falcata (Orchidaceae) protocormos, during the germination under in Vitro conditions
Jaime A. Pedroza Manrique
Universidad Distrital Francisco José de Caldas, Facultad de Ciencias y Educación, Proyecto Curricular de Licenciatura en Biología. Teléfonos: 3419618, Fax: 3419619. Correo electrónico: jpedroza@udistrital.edu.co
Christian Fernández Lizarazo
Silva Angélica Suárez
Resumen
Comparettia falcata varía los requerimientos hormonales a lo largo de su proceso germinativo bajo condiciones in vitro cultivados en el medio Murashige y Skoog (1962) enriquecido con los siguientes fitoreguladores: Ácido 3-indol Acético (AIA), 6-furfuril aminopurina (Kinetina) y Ácido Giberélico (AG3). Se estableció que 1 mg.L -1 y 3 mg.L-1 de AIA estimulan el aumento del tamaño de los protocormos y la iniciación del sistema radicular y no evita la pérdida progresiva del pigmento fotosintético. 1 y 3 mg. L -1 de Kinetina evita la pérdida acelerada del pigmento fotosintético, aunque reprime el alargamiento celular proporcionalmente al incremento de su concentración. 3 y 5 mg.L -1 de AG3 evitan la pérdida acelerada del pigmento fotosintético más consistentemente que la Kinetina, y estimula tanto el incremento de tamaño de los embriones, como la iniciación de sistema radicular. Además, se evidenció la existencia de un sinergismo entre el AIA y el AG3 en cuanto al alargamiento celular.
Palabras clave
In vitro, AIA, AG3, kinetin, Comparettia falcata.
Abstract
Comparettia falcata varíes hormonal requirements throughout its germinative process under in vitro conditions cultivated in the basal medium Murashige and Skoog (1962) enriched with the following growth regulators: 3-indoleacetic acid (AIA), 6-furfurylaminopurine (Kinetin) and gibberellic acid (AG3). 1 mg.L -1 and 3 mg.L -1 of AIA stimulate the protocorms increase and the initiation of the root system; moreover, does not avoid the progressive loss of the photosynthetic pigment.
1 and 3 mg. L -1 de Kinetina avoids the accelerated los of the photosynthetic pigment, although it represses the cellular extension proportionally to the increase of its concentration. 3 and 5 mg. L -1 of GA3 more consistently avoids the accelerated loss of the photosynthetic pigment than the Kinetina, and stimulates so much the increase of size of the embryos, like the initiation of root system. In addition, the existence of a synergism between the AIA and the GA3 as far as the cellular extension was demonstrated.
Keywords
In vitro, IAA, A3 , kinetina, Comparettia falcata.
Introducción
En las últimas décadas, los investigadores han desarrollado varios trabajos probando medios nutritivos con semillas provenientes de cápsulas maduras e inmaduras de distintas orquídeas así como diversos métodos de cultivo de tejidos vegetales bajo condiciones in vitro (Arditti et al., 1982), los cuales han sido intensamente usados no solo para la propagación de orquídeas, rápida y a gran escala, sino también por su conservación ex-situ (Murthy y Pyati, 2001). Actualmente se considera que la tecnología de semillas sintéticas es un método alternativo y efectivo de propagación (Herman, 2005).
Colombia es uno de los países con mayor biodiversidad en el mundo, especialmente en el campo de las orquídeas. Sin embargo, el número de investigaciones relacionadas con métodos de conservación de germoplasma para prevenir la constante extinción de la riqueza florística nacional son escasas en comparación con el número de especies existentes y con la necesidad de conocerlas y evitar su extinción.
Las plantas de C. falcata son epífitas obligadas de 10 cm. de longitud (Ortiz, 1995). El área de su distribución va desde el sur de Brasil hasta México, incluyendo las Antillas (Bock, 1991); en Colombia se localiza entre los 1500 y 2000 msnm (Escobar, 1972). En Puerto Rico se han establecido alrededor de 15 especies de plantas huésped (forófitos) para esta orquídea. (Rodríguez et al., 1990).
Debido a que se ha ido limitando su hábitat por factores antrópicos, a su difícil germinación en condiciones naturales y a que son confundidas con plantas parásitas, C. falcata está cada vez más cerca de su extinción. En Colombia esta especie fue catalogada como poco común (Arend, 1994; Rangel, 2000), mientras que en Republica Dominicana y El Salvador está incluida en los listado de especies amenazadas (Ministerio de Medio Ambiente y Recursos Naturales de El Salvador, 2004). Por lo tanto, es de vital importancia realizar investigaciones que contribuyan tanto al aumento del número de sus individuos como al conocimiento de su biología a fin de evitar que esta especie entre a formar parte de la lista roja de especies a punto de desaparecer en Colombia, porque una especie poco conocida es tan vulnerable como una especie que se encuentra en vía de extinción.
En esta investigación se determinó por primera vez el efecto cualitativo de fitoreguladores de crecimiento en el desarrollo morfológico de protocormos de C. falcata germinados asimbióticamente bajo condiciones in vitro.
Materiales y métodos:
Material vegetal y desinfección
Un limitado número de cápsulas maduras fueron lavadas con solución jabonosa, seguidas por un tra tamiento con etanol al 70% por 5 min. Las cápsulas fueron posteriormente desinfectadas con una solución de hipoclorito de sodio al 5% durante 5 min. y enjuagadas cuatro veces con agua destilada estéril.
Medio de cultivo y condiciones de incubación.
Tan pronto las cápsulas fueron abiertas, las semillas fueron suspendidas en 100 ml. de agua destilada y agitadas con un magneto a 100 r.p.m. Enseguida, se tomaron alícuotas de 75 µl y se depositaron en los frascos de medio de cultivo (15 ml. de capacidad) con 5 ml. de medio Murashige y Skoog (MS). Cada alícuota contenía aproximadamente 26 semillas de orquídea. El medio fue suplementado con acido 3-indol acético (AIA; 0, 5, 10, 15 µM), ácido giberélico (AG3; 0, 5, 10, 15 µM), 6-furfuril aminopurina (kinetina; O, 5, 10, 15 µM), 3% (w/v) sacarosa y gelificado con 0.6% (w/v) de agar.
El pH del medio fue ajustado a 5.8 con NaOH o HCl previo a la esterilización en un autoclave a una presión de 1.06 kg cm-2 por 20 min. Los cultivos fueron incubados en oscuridad a 25 ± 2.0 por 16 semanas hasta alcanzar el desarrollo de pequeños protocormos redondos, y luego fueron transferidos a condiciones iluminadas por 5 semanas a 25-30 µmol m-2s-1 (Tubos fluorescentes de luz día FL-20D/18, 20 w, China Electric Co., Taipei).
La viabilidad de las semillas fue determinada con la prueba de germinación del cloruro 3, 5-Triphenil tetrazolium (Singh, 1981), y la germinación de las semillas fue estimada por el reporte de semillas con embriones hialinos redondos u ovoides (embriones viables) con 1 o 3 rizoides.
Análisis estadístico.
Los experimentos fueron desarrollados bajo un diseño completamente al azar con un arreglo factorial 4x4x4, con concentraciones de 0; 5; 10 y 15 µM para el IAA, el AG3 y la kinetina. Las cuatro concentraciones de cada fitoregulador fueron probadas contra las cuatro concentraciones de cada uno de los otros fitoreguladores, para un total de 64 tratamientos con 260 semillas por tratamiento. Cada tratamiento fue replicado 10 veces. Se observaron los cambios de coloración, forma, tamaño y presencia de pelos radiculares en los protocormos durante seis periodos de observación directamente bajo microscopio óptico compuesto y estéreo microscopio. Los datos fueron estadísticamente analizados utilizando la prueba de Tukey (Steel y Torrie, 1985).
Resultados y discusión
De acuerdo con la prueba de germinación, las semillas de C. falcata presentan una viabilidad del 98%. Todos los tratamientos presentaron diferencias estadísticamente significativas a lo largo de los seis periodos de observación. La germinación de C. falcata bajo y su desarrollo post-germinativo se logra gracias a la germinación asimbióticamente en medios de cultivo bajo condiciones in vitro (Arditti, 1971; Pedroza et. al., 2005).
Los resultados que se presentan a continuación muestran tendencias claras en cuanto a las respuestas de los protocormos a los fitoreguladores de crecimiento aunque esto implica cierto número de excepciones lo cual puede ser esperado en el cultivo in vitro de semillas de orquídeas debido no sólo a la heterogeneidad propia de las semillas, sino a que existe una población mezclada (Roy y Banerjee, 2002) entre embriones listos para crecimiento activo y embriones dormantes, fenómeno reportado también en Cypridendyum candidum (De Pauw et al., 1995), en Calanthe discolor (Miyoshi y Mii, 1995) y en Aerides crispum (Sheelavanthmath et al., 2005).
Color
Los protocormos de C. falcata perdieron progresivamente su pigmento fotosintético después de la germinación debido posiblemente a procesos de etiolación por el efecto de la oscuridad durante las primeras 16 semanas, a causa de un estrés fotooxidativo provocado por su cambio de la oscuridad a la luz, o por incremento en los niveles de etileno, lo que, en cantidades traza, puede alterar significativamente la actividad de ciertas enzimas sin estrés notorio en la planta (Herman, 2005); sin embargo, se observó que esta pérdida gradual de pigmento fotosintético tuvo patrones diferentes en los distintos niveles de los reguladores de crecimiento aplicados. (tabla 1; figura 1, A-F)
Efecto del AIA
A pesar de que Salisbury y Ross (2000) afirman que en la oscuridad no se forma clorofila y se bloquea el desarrollo de los cloroplastos, los resultados obtenidos coinciden parcialmente con los de Alarcón (1982), quien obtuvo protocormos de orquídeas del género Epidendrum sembrados en medio ms (1962) después de 40 días, que a penumbra presentaron coloración verde oscura. Según Reyburn (1978), la clorofila puede ser producida en estadios muy tempranos del desarrollo de una orquídea.
En ausencia del AIA, se observó por una parte un número mayor de tratamientos con protocormos verdes (fig. 1, A-B) en la sexta semana y por otra, la pérdida total de pigmento fotosintético sólo hasta la semana 21 (tabla 1; fig. 1, E-F); en contraste, los tratamientos con alguna concentración de este regulador, a partir de la semana 15, presentaron un incremento sustancial en el número de tratamientos con embriones tenues (tabla 1; fig. 1, E-F), lo que sugiere que el AIA no evita la pérdida progresiva de pigmento fotosintético (tabla 1). De manera similar, Roy y Banerjee (2002) establecieron el efecto negativo de la auxina ácido naftalén acético (ANA) en la permanencia de la coloración verde en los procormos de Geodorum densiflorum. De otra parte, Sheelavanthmath et al. (2005) determinaron que los protocormos de Aerides crispum, en medios in vitro sin reguladores de crecimiento permanecieron verdes pero no mostraron respuesta en el crecimiento.
Efecto de la kinetina
A concentraciones de O y 5 mg.L -1 de Kinetina en la mayoría de los tratamientos los protocormos perdieron totalmente su coloración en la semana 15 (tabla 1; fig. 1, E-F), mientras que en las concentraciones intermedias se presentó un número importante de tratamientos cuyos protocormos mantuvieron su coloración verde claro hasta la semana 18 (tabla 1; fig. C-D), principalmente en los tratamientos con 1 mg.L -1 de KIN, O y lmg.L -1 de AIA con todos los niveles de AG3 Este resultado sugiere un sinergismo entre una concentración relativamente baja de Kinetina, a todos los niveles de AG3 y en ausencia o poca concentración de AIA, posibilitando que la pérdida de coloración sea más lenta que en otras concentraciones (tabla 1). Thimann (1987), propuso que las citoquininas hacen que se mantenga la integridad de la membrana del tonoplasto reemplazando el efecto de la luz, para que las citoquininas-proteasas de la vacuola no escapen al citoplasma e hidrolicen tanto las proteínas solubles como las membranas del cloroplasto; es decir, las citoquininas dirigen la acumulación de clorofila y además promueven la conversión de etioplastos en cloroplastos (Salisbury y Ross, 2000).
Efecto del AG3
A concentraciones de 3 y 5 mg.L -1 de AG3 el pigmento fotosintético se conservó más consistentemente que con los otros dos reguladores de crecimiento en las semanas 6, 9 y 12 (tabla 1). En la semana 6 los tratamientos con 5 mg.L -1 de AG3 tuvieron predominancia del color verde, mientras que los que tuvieron 3 mg.L -1 de AG3, estuvieron igualmente distribuidos entre verde y verde claro (Tabla 1; Fig. 1, A-D). En estas 2 concentraciones se conservaron los pigmentos fotosintéticos en los protocormos, en la novena semana con los tratamientos 7 y 16, y hasta la semana 12 con los tratamientos 3 y 4 (tabla 1). Según Taiz y Zeiger (1998), en algunas semillas la aplicación de giberelinas sustituye la luz u otro requerimiento ambiental, lo que supone cierta permanencia del color verde en los embriones.
En la mayoría de los tratamientos correspondientes a todos los niveles de AG 3 se observaron embriones tenues sólo a partir de la semana 15 y hubo unos pocos cuya coloración se mantuvo hasta la semana 18 (tabla 1), los cuales coincidían en tener concentraciones bajas de AIA y KIN a todos los niveles de AG 3 (tabla 1). Thomas (1980), afirma que las citoquininas y las giberelinas pueden atenuar el efecto inhibitorio de la oscuridad en la germinación; sin embargo, los resultados sugieren que luego de un tiempo, estos reguladores de crecimiento no pueden suplir esta carencia por lo que no evitaron la pérdida total del pigmento fotosintético.
Forma
Efecto del AIA y el AG3
El mayor número de protocormos con forma elongada (fig. 1, G-J) se presentan en tratamientos con el AIA a 1 y 3 mg.L -1 y con el AG3 a 3 y 5 mg.L -1, además, es de resaltar que, a excepción del tratamiento 53, en ausencia de AIA o AG3 no se produce elongaciones, así este uno de estos dos reguladores presentes (tabla 1).
Álvarez (1997), afirma que si se aplican giberelinas y auxinas consecutivamente a un tejido, se presenta una fuerte respuesta de elongación, situación que indica una parcial dependencia y un efecto sinérgico entre auxinas y giberelinas. Davies (1987), menciona que la síntesis de pared celular, estimulada por el AG3 , no es causante del crecimiento pero funciona para mantener la integridad estructural de la pared celular que sufre elongación rápida, y es precedida por el alargamiento celular.
Por otra parte, el número de protocormos elongados disminuye a medida que aumentan las concentraciones de AIA (tabla 1). Garcidueñas y Ramírez (1993), afirman que la acción inductora de las auxinas es el alargamiento de las células a bajas concentraciones mientras que a altas lo deprimen.
Efecto de la Kinetina
Se observó un número similar de tratamientos con protocormos elongados a O y 1 mg.L -1 mientras que disminuyeron en 3 y 5 mg.L -1 de este regulador de crecimiento (tabla 1). Esta respuesta evidencia que la kinetina a altas concentraciones reprime la elongación celular. En algunos casos las citoquininas causan una mayor plasticidad en las paredes celulares porque pueden reducir los umbrales de cedencia en determinados tejidos sensibles, induciendo respuestas morfológicas en procesos asociados con la micropropagación de orquídeas (Martin, 2003).
Tamaño
Efecto del AIA.
A 1, 3 y 5 mg.L -1 de AIA se incrementó de manera importante el número de tratamientos con protocormos grandes (1.0-2.0 mm) (figura IL; tabla 1); sin embargo, por encima de 1mg.L -1 , el número de tratamientos con embriones grandes disminuyó ligeramente a medida que aumentó la concentración del AIA (tabla 1), lo que sugiere que concentraciones superiores a 1 mg.L -1 son altas para los requerimientos de esta especie en esta etapa del desarrollo. Este resultado es similar al obtenido por Roy y Banerjee (2002) quienes determinaron que el ANA a 1 mg.L -1 tenía el mayor efecto promotor del crecimiento en Geodorum densiflorum. Álvarez (1997), afirma que las auxinas participan en la organización de los procesos vegetales incluyendo la regulación del crecimiento, los cuales son estimulados o inhibidos según la concentración de la auxina presente en las células vegetales.
De otra parte, en presencia del AIA se incrementó el número de protocormos con pelos absorbentes (figura 1,M-N), habiendo mayor cantidad de tratamientos con ellos presentes, a 1 y 3 mg.L -1 de la auxina (tabla 1), confirmando así que en términos generales, las auxinas estimulan la iniciación de la radícula (Pierik, 1990).
Estos resultados coinciden parcialmente con los obtenidos por Nayak et al., (1997) en Cymbidium aloifolium, Dendrobium aphyllum y Dendrobium moschatum con raíces que se desarrollaron saludablemente en presencia de ANA, y con los de Roy y Banerjee (2002) en Geodorum densiflorum, cuyos tratamientos libres de fitoreguladores de crecimiento tuvieron una formación de sistema radicular más baja en comparación con la obtenida con la aplicación de BAP y ANA, siendo este último el promotor principal de la elongación de los rizomas a 1mg.l -1 .
Los resultados señalan que los procesos que determinan el aumento de tamaño e iniciación de sistema radicular en protocormos de C. falcata se encuentran fuertemente influenciados por el ATA en contraste con su baja eficiencia durante la germinación (Pedroza et al., 2005), y sugiere requerimientos secuenciales de reguladores de crecimiento finamente modulados en sus primeros estados de desarrollo.
Efecto del AG3
El AG3 indujo el aumento de tamaño de los protocormos, principalmente a 3 y 5 mg.L -1, cuando interactuó con AIA o en ausencia de los otros dos reguladores (tratamientos 3 y 4) (tabla 1; fig. 1, M-N). Jones y Stoddart (1980) afirman que el AG3 esta comprometido en la activación de la vía pentosa fosfato; entonces, si la multiplicación celular requiere de la síntesis del DNA, el cual puede estar limitado por la disponibilidad de pentosas derivadas de esta ruta metabólica, las giberelinas pueden estimular la multiplicación celular (Hartman et al., 1997); las giberelinas pueden provocar, además, la expansión celular mediante la inducción de enzimas que debilitan la pared celular (Weaver, 1996). Sin embargo, los resultados contrastan con los obtenidos en Calanthe discolor, en cuya germinación el ácido giberélico no ejerció efecto estimulatorio (Miyoshi y Mii, 1995).
El AG3 no fue determinante en cuanto el desarrollo de pelos absorbentes, sin embargo, se observó un incremento de este fenómeno a 3 mg.L -1 del regulador, posiblemente debido a la interacción con el AIA (tabla 1). Según Gil (1995), el AG3 no inicia el sistema radicular, se usa poco en sistemas in vitro porque inhibe la rizogénesis, aunque en asocio con una auxina y en la oscuridad la estimula.
Efecto de la Kinetina
No se observaron diferencias importantes en el tamaño de los protocormos con respecto a los diferentes niveles de este fitoregulador (tabla 1), lo que sugiere que bajo las condiciones de este experimento, la kinetina posiblemente no tuvo influencia directa en los mecanismos de multiplicación celular, extensibilidad de la pared celular ni en la toma osmótica del agua posterior a la germinación de C. falcata. Aunque con base en el importante papel de las citoquininas en la regeneración in vitro de protocormos y otros órganos en otras especies de orquídeas, podría esperarse un aumento posterior del efecto de las citoquininas de manera dependiente del estado de desarrollo y competencia celular y tisular (Lin, 1986; Tanaka et al., 1988; Ernst, 1994; Chen y Piluek, 1995; Nayak et al., 1997; Chang y Chang, 1998; Sheelavanthmath et al., 2000; Murthy y Pyati, 2001; Sheelavanthmath, 2005).
La Kinetina no tuvo efecto en la formación de pelos absorbentes. En este sentido existen varios reportes del efecto inhibitorio de la aplicación de citoquininas en la formación de sistema radicular en orquideas (Hasegawa y Goi, 1987; Shimasaki y Uemoto, 1990; Paek y Yeung, 1991; Roy y Banerjee, 2002).
Interacciones entre los fitoreguladores
En términos generales, en ausencia de AIA las interacciones entre AG3 y KIN no produjeron diferencia de tamaño, lo que indica que la presencia de la auxina es determinante en la formación de protocormos grandes, asimismo, en ausencia de AIA y AG3 los tratamientos con 0, 1, 3 y 5 mg.L -1 de Kinetina no produjeron diferencia de tamaños, lo que sugiere que la aplicación de citoquininas exógenas no es necesaria en la etapa de desarrollo de los protocormos. Barlow (1987), afirma que en ocasiones, diversos fitoreguladores determinan efectos similares, pero hay momentos del desarrollo en los que cada hormona suscita una respuesta específica, lo que conduce a pensar que los otros fitoreguladores están mostrando efectos comunes a la citoquinina, como es el caso de la división celular y es por ello que no se evidencia un efecto determinante de la Kinetina o que en este momento específico del desarrollo de los protocormos, este regulador no es requerido; sin embargo, puede llegar un momento en el cual vuelva a ser evidente la actuación del regulador.
En la semana 21 se determinó que la mayoría de los protocormos pararon su crecimiento debido, probablemente, a una situación de estrés hídrico, por la presencia del etileno o por haber estado en la oscuridad en las 16 primeras semanas, lo que explicaría también la pérdida de pigmento fotosintético.
Dentro del balance hormonal secuencial, por el que pasa la semilla de C. falcata en sus primeros estadios de desarrollo, después de requerir giberelinas y citoquininas ellas requieren de auxinas (Pedroza et al., 2005), las cuales, además de inducir la formación del sistema radicular e influir positivamente en el aumento del tamaño de los protocormos, podrían aumentar la actividad de la citoquinina-oxidasa para la oxidación de la forma transportada de la Ck (Ribósido de zeatina) (Palni et. al., 1993) y de este modo, este fitoregulador no podría volver a actuar sino después que la razón AIA/CKS haya disminuido, debido a que, como han sugerido Skoog y Miller (1957) y George (1993), la organogénesis in vitro en muchas especies es controlada por la relación Auxina/Citoquinina más que por sus niveles absolutos, lo que depende, entre otros, de la competencia celular o tisular (Christianson y Warnick, 1988).
De este modo, la relación hormonal disminuiría por mecanismos que pueden incluir aumento en la biosíntesis de citoquininas (o provisión por parte de la micorriza), aumento en la sensibilidad y recepción de citoquininas, oxidación, conjugación (Peres et al., 2001), cambios en la sensibilidad de los tejidos a la auxinas (Trevawas, 1981) (que podrían incluir regulación a partir de proteólisis por ubicuituinación) (Gray, 2004; Woodward y Bartel, 2005), respuesta activa del genoma u otros mecanismos moleculares y fisiológicos aun desconocidos que puedan variar progresivamente durante el crecimiento del protocormo, es decir, de una manera específica al estado germinativo de la orquídea (Miyoshi y Mii, 1995). Los requerimientos hormonales son específicos a la especie de orquídea y su estado de desarrollo. En otras especies se observan requerimientos iniciales de citoquininas y posteriormente de una relación más alta de auxinas/citoquininas (Ranjan et al., 1997; Lee y Lee, 2003).
Además, de acuerdo con Box y Terron (1988), las combinaciones de reguladores producen en el protocormo numerosos pelos absorbentes sobre toda la superficie del mismo, mientras que en condiciones normales los rizoides quedan localizados sobre una corona ecuatorial.
Esta investigación sugiere que los requerimientos de fitoreguladores en C. falcata son finamente modulados y pueden variar poco después de la germinación.
Por otra parte, a pesar de que el pigmento fotosintético se perdió completamente al final del experimento, se destaca que los protocormos que desarrollaron pelos absorbentes debido principalmente a la presencia del AIA, tuvieron pérdida progresiva del color más acelerada que los tratamientos que carecían de este fitoregulador de crecimiento en el medio de cultivo. En este sentido, los resultados son similares a los obtenidos por Roy y Banerjee (2002) con Geodorum densiflorum y por Sheelavanthmath et al., (2005) con Aerides crispum que reflejan los complejos mecanismos que gobiernan el balance hormonal durante la germinación de una orquídea y su estrecha relación con el desarrollo inicial de la maquinaria fotosintética. De otra parte, el AG3 indujo respuestas en la formación de sistema radicular, incremento del tamaño de los protocormos y mantenimiento del pigmento fotosintético de manera más estable que los otros dos reguladores de crecimiento. Dado el amplio espectro de efectos positivos y consistentes del AG3, este podría tener una ubicación en alguna posición intermedia o cercana a un nodo regulatorio en el intrincado balance hormonal de C. falcata en sus primeros estados de desarrollo.
De acuerdo con los resultados obtenidos, se sugiere que las micorrizas proveen giberelinas y auxinas a las semillas de orquídea y que luego de diferenciar estructural y fisiológicamente la zona radicular, éste órgano sintetiza citoquininas endógenas para la for mación del brote; es decir, primero hay requerimientos de giberelinas y citoquininas, posteriormente un aumento en la relación AIA/CKS que luego disminuye progresivamente para la formación del brote debido a la presencia de las citoquininas.
Los resultados señalan que los procesos que determinan el aumento de tamaño e iniciación de sistema radicular en protocormos de C. falcata se encuentran fuertemente influenciados por una relación alta AIA/CKS en contraste con la baja eficiencia de ATA durante la germinación (Pedroza et al., 2005), sugiriendo requerimientos secuenciales de reguladores de crecimiento finamente modulados, que pueden variar poco después de la germinación y de manera dependiente al estado de desarrollo y competencia celular y tisular, por lo que se podría esperar una variación posterior en el balance hormonal con respecto a la relación Auxinas/Citoquininas y al efecto de Giberelinas, sumado a la interacción hormonal con la micorriza.
CONCLUSIONES
El AIA no evita la pérdida progresiva de pigmento fotosintético y es primordial para el aumento de tamaño y alargamiento de los protocormos, especialmente en concentraciones de 1 mg.L -1, aunque en concentraciones superiores disminuye proporcionalmente este efecto. Entre 1 y 3 mg.L -1 el AIA estimula la formación de pelos absorbentes, mientras que a 3 mg.L -1 aumenta el número de embriones excesivamente largos y con prolongaciones muy evidentes por toda su superficie.
La KIN no tiene efecto evidente sobre el tamaño y la inducción de pelos absorbentes en los embriones. Además, reprime el alargamiento celular proporcionalmente al incremento de las concentraciones trabajadas, tampoco induce el alargamiento y a altas concentraciones lo reprime. Sin embargo, a concentraciones de 1 y 3 mg.L -1 el pigmento fotosintético se conserva más que a concentraciones de O y 5 mg.L -1 Además, se sugiere un sinergismo entre una concentración relativamente baja de Kinetina, a todos los niveles de AG3 y en ausencia o poca concentración del AIA, posibilitando que la pérdida de coloración sea más lenta que en otras concentraciones, aunque luego de un tiempo, estos reguladores de crecimiento no pueden suplir esta carencia por lo que no evitaron la pérdida total del pigmento fotosintético.
3 y 5 mg.L -1 de AG3 evitan la pérdida acelerada de pigmento fotosintético más consistentemente que los otros dos reguladores, e incrementan el tamaño de los embriones. Además, a 3 mg.L -1 se aumenta el número de protocormos con pelos absorbentes.
Existe un sinergismo entre el AI y el AG3 en cuanto a la estimulación del alargamiento celular, principalmente a concentraciones de 1 mg.L -1 de AIA y 3 mg.L -1 de AG3. El AG3 no fue determinante en cuanto al desarrollo de pelos absorbentes; sin embargo, se observó un incremento de este fenómeno a 3mg.L -1 del fitoregulador, posiblemente debido a la interacción con AIA (tabla 1).
Agradecimientos Este trabajo fue financiado por la Facultad de Ciencias y Educación de la Universidad Distrital Francisco José de Caldas.
Tabla 1. Respuesta de los protocormos de Comparettia falcata a tratamientos con AIA (Ácido B-indol Acético), kinetina (N6-furfuril amino purina) y AG3 (Ácido Giberélico) en diferentes concentraciones. Se usaron 10 réplicas por tratamiento. V: Color Verde, Vcl: Color Verde claro, T: Color Tenue, C: Forma Cónica, L: Forma Alargada, Gr: Tamaño 1.0-2.0 mm, Pq: Tamaño 0.4-0.9 mm, A: Ausencia de prolongaciones, P: Presencia de Prolongaciones.
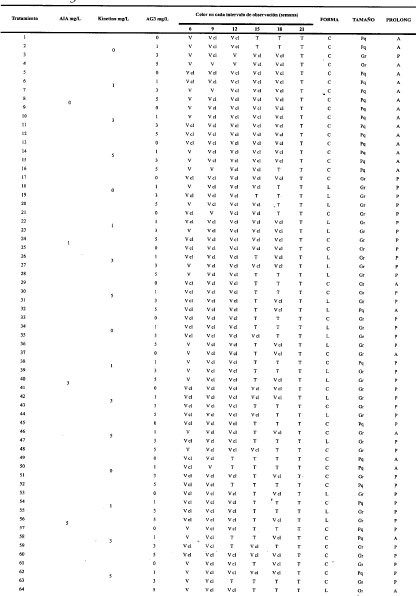

Figura 1. A. Detalle de tejido verde (100x); B. Protocormo verde (1.7x); C. Detalle de tejido verde claro (40x); D. Protocormo verde claro (1.0x); E. Detalle de tejido tenue (40x); F. Protocormo tenue (1.7x); G. Protocormo alargado (1.5x); H. Protocormo cónico (40x); I. Detalle de células de protocormo alargado (40x); Detalle de células de protocormo cónico (40x); K. Embrión tenue excesivamente largo (3.0x); L. Diferencia de tamaños de Protocormos cónicos (1,7x); M. Detalle de prolongaciones alargadas (40x); N. Embrión cónico con prolongaciones en la zona ecuatorial (3.0x).
Bibliografía
- Alarcón, C. (1982). Estudio de los medios simbióticos y asimbióticos para la propagación sexual de orquídeas nativas de la sabana de Bogotá. Bogotá. Trabajo de grado (agrónomo) Universidad Nacional de Colombia. Facultad de Agronomía, 116 p.
- Alvarez, B. (1997). "Reguladores del crecimiento vegetal", en Hurtado, D. y Merino, M. Cultivo de tejidos vegetales, Cuarta edición, México: Trillas, p.p. 48-70.
- Arditti, J. (1971). "Orchid And The Discovery Of Auxin" en American Orchid Society Bulletin, 40 (3), p.p. 210-214.
- Arditti, J.; Michaud, J.; Oliva, A. (1982). "Practical Germination Of North American And Related Orchids: I. Epipactis Atrorubens, E. Gigantea And E. helleborine", en American Orchid Society Bulletin, 51 (2), p.p. 162-166.
- Arend De Wilde, Job. (1994). Orquídeas silvestres de Ucumari. Colombia, Corporación Autónoma de Risaralda, 87 p.
- Barlow, P. W. (1987). "Hormone Action in Plant Development a Critical Appraisal", en: Garcidueñas, M. y Ramírez H. (eds) Control hormonal del desarrollo de la planta: Fisiología tecnología-experimentación, segunda edición, México: Limusa, 53 p.
- Bock, I. Comparettia Poepp. (1991). Sociedad Colombiana de Orquideología. Orquídeas nativas de Colombia, Medellín: Colina, p.p. 92-93.
- Box, M.; Terron, U. P. (1988). Multiplicación vegetativa y cultivo in vitro: Los Meristemos y la organogénesis, Madrid, España: Mundi-Prensa, 76, p.p. 128-140.
- Chang, C.; Chang, W. C. (1998). Plant Regeneration From Callus Culture Of Cymbidium Ensifolium Var. Misericors. Plant Cell Rep. 17, p.p. 251-255.
- Chen, Y.; Piluek, C. (1995). Effect Of Thidiazuron And N6-Benzylaminopurine On Shoot Regeneration Of Phalaenopsis. Plant Growth Regul. 16, p.p. 99-101.
- Christianson, M. L.; Warnick D. A. (1998) "Organogenesis in vitro as a developmental process" en Hort Science, núm. 23 p.p. 515-519.
- Davies, P.(1987). Plant Hormones and Their Role in Plant Growth and Development. Boston: Martinus Nijhoff Publishers, 633 p.
- De Pauw, M.A.; Remphrey, W. R.; Palmer, C. E. (1995). The Cytokinin Preference For In Vitro Germination And Protocorm Growth Of Cypripedium Candidum. Ann. Bot. 75, p.p. 267-275.
- Ernst, R. (1994). Effect of thidiazuron on in vitro propagation of Phalaenopsis and Doritaenopsis (Orchidaceae). Plant Cell Tiss. Cult. 39, p.p.273-275.
- Escobar, G.(1972). "Observaciones sobre el género Comparettia en Colombia"; en Orquideología 7(3), p.p. 141-142.
- Garcidueñas, M.; Ramírez H.(1993). Control hormonal del desarrollo de la planta: Fisiología tecnología-experimentación. 2 ed. México: Limusa, p.p. 20 53; 105 111.
- George, E. F. (1993). Plant Propagation by Tissue Culture. Part 1: The Technology. Exegetics Limited, Edigton. 574 p.
- Gil, F. (1995). Elementos de Fisiología Vegetal. España: Mundi-Prensa, 1147 p.
- Gray, W M. (2004). Hormonal regulation of plant growth and development. PLoS Biol. 2(9): 1270-1273.
- Hasegawa, A.; Goi, M. (1987). Rhizome formation in Cymbidium goeringii Reichenbach fil. and Cymbidium kanran Makino in shoot-tip culture. Hort. Sci. 56, p.p. 70-78.
- Hartman, H.; Kester, D.; Davies, E; Geneve, R. (1997). Plant Propagation: Principies And Practices. Sixth edition. New Jersey: Prentice-Hall, Inc, p.p. 125-144.
- Herman, E. (2005). Recent Advances in Plant Tissue Culture IX: Media and Techniques for Growth, Regeneration and Storage 2002-2005. Estados Unidos: Agritech Consultants, INC, 129 p.
- Jones, R.; Stoddart, J. (1980). "Gibberellins And Seeds Germination", en: Khan, A. (ed). The physiology and biochemistry of seed dormancy and germination. Amsterdam: North-Holland, Publishing Company, p.p. 97-104.
- Lee, Y. I; Lee, N. (2003). Plant regeneration from protocorm-derived callus of Cypripedium formosanum. In Vitro Cell. Dev. Biol. Plant 39, p.p. 475-48.
- Lin, C. C. (1986). In vitro culture of flower stalk internodes of Phalaenopsis and Doritaenopsis. Lindleyana. 1: 158-163.
- Martin, K. Clonal (2003). Propagation, Encapsulation And Reintroduction Of Ispea Malabarica (Reich. f.) J. D. Hook, an endangered orchid. In Vitro Cell. Dev. Biol. Plant 39, p.p. 322-328.
- Ministerio de Medio Ambiente y Recursos Naturales de el Salvador (2004). Proyecto de Ley Sectorial de Biodiversidad de la República Dominicana 2002. Listado oficial de especies de vida silvestre amenazadas o en peligro de extinción, Acuerdo No. 10 de 2004.
- Miyoshi, K.; Mii, M. (1995). Phytohormone pretreatment for the enhancement of seed germination and protocorm formation by the terrestrial orchid, Calanthe discolour (Orchidaceae), in asymbiotic cultura. Scientia Horticulturae 63, p.p. 263-267.
- Murashige, T.; Skoog, F. (1962). A revised medium for rapid growth and bioassays with tobacco tissues cultures. Physiol. Plant. 15, p.p. 473-479.
- Murthy, H. N.; Pyati, A. N. (2001). Micropropagation of Aerides maculosum Lindl. (Orchidaceae). In Vitro Cell. Dev. Biol. Plant. 37, p.p.223-226.
- Nayak, N. R.; Rath, S. P.; Patnaik, K. (1997). In vitro propagation of three epiphytic orchids, Cymbidium aloifolium (L.) Sw., Dendrobium aphyllum (Roxb.) Fisch. and Dendrobium moschatum (Buch-Ham) Sw. through thidiazuroninduced high frequency shoot proliferation. Sci. Hortic. 71, p.p. 243-250.
- Ortíz, V.(1995). Orquídeas de Colombia. 2 ed. Bogotá: Corporación Capitalina de Orquideología, 320 p.
- Paek, K. Y.; Yeung, E. C. (1991). The effects of 1-naphthalene acetic acid and N6-benzyladenine on the growth of Cymbidium forrestii rhizomes in vitro. Plant Cell Tiss. Org . Cult. 24, p.p. 65-71.
- Palni, L. M; Burch, L. R.; Jorgan, R. (1993) "The effects of auxin concentration on citokynin stability and metabolism" en: Azcon y Talon. (eds.) Fisiología y Bioquímica Vegetal. 1 ed. España: Interamericana Mc.Graw-Hill, 323 p.
- Pedroza, J.; Fernández, C.; Suárez, A. (2005). Evaluation Of The Effect Of Three Growth Regulators In The Germination Of Comparettia Falcata Seeds Under In Vitro Conditions. In Vitro Cell. Dev. Biol. Plant. 41, p.p. 838-843.
- Peres, L.; Majerowicz, N.; Kerbauy G. (2001). Dry Matter Partitioning Differences Between Shoots And Roots In Two Contrasting Genotypes Of Orchids And Their Relationship With. Endogenous Levels Of Auxins, Cytokinins And Abscisic Acid. Bras. Fisiol. Veg 13 (2), p.p. 185 195.
- Pierik, R. L. M. (1990). Cultivo in vitro de las plantas superiores. Madrid: Mundi-Prensa, 326 p.
- Rangel, O. (2000). Amenazas sobre la flora, la vegetación y los ecosistemas de Colombia. Pérez Arbelaezia. 5 (11), p.p. 18-25.
- Ranjan, N.; Prasad, S.; Patnaik, S. (1997). In Vitro Propagation Of Three Epiphytic Orchids, Cymbidium Aloifolium (L.) SW., Dendrobium Aphyllum (Roxb.) Fisch. And Dendrobium Moschatum (Buch-Ham) SW. Through Thidiazuron-Induced High Frequency Shoot Proliferation. Scientia Horticulturae. 71, p.p. 243-250.
- Reyburn, A. (1978). "The Effects of pH on the Expresión of a Darkness-Requiring Dormancy in Seeds of Cypripedium reginae Walt", en American Orchid Society Bulletin 47(9), p.p. 798-801.
- Rodriguez-Robles, J. A.; Ackerman, J.; Melendez, E. (1990). "Host Distribution and Hurricane Damage to an Orchid Population at Toro Negro Forest, Puerto Rico", en Caribbean Journal of Science 26(3-4), p.p. 163-164.
- Roy, J.; Banerjee, N. (2002). Rhizome and shoot development during in vitro propagation of Geodorum densiflorum (Lam.) Schltr. Scientia Horticulturae 94, p.p. 181-192.
- Salisbury, E; Ross, C. (2000). Fisiología Vegetal: Desarrollo de las plantas y fisiología ambiental. España: Thomson editores Paraninfo, S. A; p.p. 573-574.
- Sheelavanthmath, S. S.; Murthy, H. N.; Pyati, A.N.; Kumar, H.G.A.; Ravishankar, B. V. (2000). "In vitro propagation of the endangered orchid Geodurum densiflorum (Lam.) Schltr. through rhizome section culture" en Plant Cell Tissue. Org. Cult. Núm. 60, p.p. 151-154.
- Sheelavanthmath, S.; Murthy, H.; Hema. B.; Hahn, E.; Paek, K. (2005). "High frequency of protocorm like bodies (PLBs) induction and plant regeneration from protocorm and leaf sections of Aerides crispum" en Scientia Horticulturae 106, p.p. 395-401.
- Shimasaki, K.; Uemoto, S. (1990). "Micropropagation of a terrestrial Cymbidium species using rhizomes developed from seeds and pseudobulbs" en Plant Cell Tiss. Org. Cult. 22,p.p. 237-244.
- Singh, E (1981). "Differential Staining Of Orchid Seeds For Viability Testing", en Am. Orchid Soc. Bull. 50(4), p.p. 416-418.
- Skoog, E; Miller, C. O. (1957). Chemical Regulation Of Growth And Organ Formation In Plant Tissues Cultured In Vitro. Symposium of the Society for Experimental Biology. 11, p.p. 118-131.
- Steel, R.; Torrie, J.(1985). Bioestadística: Principios y procedimientos. 2 ed. Bogotá: McGraw Hill; p.p. 328-367.
- Taiz, L; Zeiger, E. (1998). Plant physiology. Second edition. Sunderland, Massachusetts: Sinauer Associates, Inc., 557 p.
- Tanaka, M.; Kumura, M.; Goi, M. (1998). "Optimal conditions for shoot production from Phalaenopsis flower stalk cultures in vitro". Scientia Horticulturae. 35, p. 117 - 126.
- Thimann, K. V. (1987). "Plant Senescence: A Proposed Integration of the Constituent Proceses" 1987, en Salisbury y Ross (Eds.). Fisiología Vegetal. México: IBEROAMERICANA, 428 p.
- Thomas, T. H. (1980). "Cytokinin active compounds and seed germination", en: Khan,A. A (ed). The physiology and biochemistry of seed dormancy and germination. Amsterdam: NorthHolland, Publishing Company;, p.p. 111 - 137.
- Trevawas, A. (1981). How do plant growth substances work? Plant Cell Environ. 4, p.p. 203-228.
- Weaver, R. (1996). Reguladores del crecimiento de las plantas en la agricultura. 8 ed. México: Trillas, p.p. 5-544.
- Woodward, A.; Bartel, B. Invited Review. (2005), "Auxin: Regulation, Action, and Interaction" en Annals of Botany 95, p.p. 707-735.
License
When submitting their article to the Scientific Journal, the author(s) certifies that their manuscript has not been, nor will it be, presented or published in any other scientific journal.
Within the editorial policies established for the Scientific Journal, costs are not established at any stage of the editorial process, the submission of articles, the editing, publication and subsequent downloading of the contents is free of charge, since the journal is a non-profit academic publication. profit.



