DOI:
https://doi.org/10.14483/2256201X.20569Publicado:
01-01-2024Número:
Vol. 27 Núm. 1 (2024): Enero-junioSección:
Artículos de investigación científica y tecnológicaModelos de altura dominante para Gmelina arborea Roxb. en Colombia
Dominant Height Models for Gmelina arborea Roxb. in Colombia
Palabras clave:
Site index curves, dynamic equations, polymorphism, forest productivity, cross-validation (en).Palabras clave:
Curvas de índice de sitio, ecuaciones dinámicas, polimorfismo, productividad forestal, validación cruzada (es).Descargas
Referencias
Aguirre-Mendoza, Z., & Aguirre-Mendoza, C. (2014). Especies leñosas y cultivos objetivos para sistemas agroforestales en zonas semiáridas del sur del Ecuador. Bosques. Latitud Cero, 4, 21-30. https://revistas.unl.edu.ec/index.php/bosques/issue/view/30/42
Akbas, U., & Senyurt, M. (2018). Site quality estimations based on the generalized algebraic difference approach a case study in Çankiri forests. Revista Árvore, 42(3), e420311. https://doi.org/10.1590/1806-90882018000300011 DOI: https://doi.org/10.1590/1806-90882018000300011
Bailey, R. L., & Clutter, J. L. (1974). Base-age invariant polymorphic site curves. Forest Science, 20(2), 155-159.
Barrios-Trilleras, A., López-Aguirre, A. M., & Báez-Aparicio, C. A. (2021). Modelamiento de la productividad de Gmelina arborea Roxb con base en variables biofisicas y de rodal. Colombia Forestal, 24(1), 71-87. https://doi.org/10.14483/2256201X.15345 DOI: https://doi.org/10.14483/2256201X.15345
Barrios, A., López A.M., & Nieto V. (2014). Predicción de volúmenes comerciales de Eucalyptus grandis a través de modelos de volumen total y de razón. Colombia Forestal, 17(2), 137-149. https://doi.org/10.14483/udistrital.jour.colomb.for.2014.2.a01 DOI: https://doi.org/10.14483/udistrital.jour.colomb.for.2014.2.a01
Burkhart, H. E., & Tomé, M. (2012). Modeling forest trees and stands. Springer Science & Business Media. http://dx.doi.org/10.1007/978-90-481-3170-9 DOI: https://doi.org/10.1007/978-90-481-3170-9
Cieszewski, C. J., & Bailey, R. L. (2000). Generalized algebraic difference approach: Theory-based derivation of dynamic site equations with polymorphism and variable asymptotes. Forest Science, 46(1), 116-126.
Cieszewski, C., Harrison, M., & Martin, S. (2000). Practical methods for estimating non-biased parameters in self-referencing growth and yield models. http://www.pmrc.uga.edu/TR2000-7.pdf
Cifuentes, J. G. (2010). Evaluación y monitoreo de plantaciones forestales en Guatemala. Instituto Nacional de Bosques.
Clutter, J. L., Forston, J. C., Pienaar, L. V., Brister, G. H., & Bailey, R. L. (1983). Timber Management: A quantitative approach. John Wiley & Sons.
Escobar Quemba, L. (2013). Relacion de parámetros de fertilidad del suelo con el Índice de sitio determinado para plantaciones forestales de melina (Gmelina arbórea) y ceiba (Pachira quinata) en Zambrano-Bolivar (Colombia) [Tesis de maestría, Universidad Nacional de Colombia]. https://repositorio.unal.edu.co/handle/unal/50385
Espitia , M., Murillo, O., & Castillo, C. (2016). Ganancia genética esperada en melina (Gmelina arborea Roxb.) en Córdoba (Colombia). Revista Árvore, 40(1), 71-80. http://dx.doi.org/10.1590/0100-67622016000100008 DOI: https://doi.org/10.1590/0100-67622016000100008
Gómez, E. A., Rios, L. A., & Peña, J. D. (2012). Madera, un potencial material lignocelulósico para la producción de biocombustibles en Colombia. Informacion Tecnológica 23(6), 73-86. http://dx.doi.org/10.4067/S0718-07642012000600009 DOI: https://doi.org/10.4067/S0718-07642012000600009
Guerra-Hernández, J., Arellano-Pérez, S., Gonzáles-Ferreiro, E., Pascual, A., Altelarrea, V. S., Ruiz-González, A. D., & Álvarez-Gonzáles, J. G. (2021). Developing a site index model for Pinus pinaster stands in NW Spain by combining bi-temporal ALS data and environmental data. Forest Ecology and Management, 481, 118690. https://doi.org/10.1016/j.foreco.2020.118690 DOI: https://doi.org/10.1016/j.foreco.2020.118690
Hernández-Cuevas, M., Santiago-Garcia, W., De los Santos-Posadas, H. M., Martinez-Antúnez, P., & Ruiz-Aquino, F. (2018). Modelos de crecimiento en altura dominante e índices de sitio para Pinus ayacahuite Ehren. Agrociencia, 52(3), 437-453. https://www.scielo.org.mx/pdf/agro/v52n3/2521-9766-agro-52-03-437.pdf
Hughell, D. (1991). Modelo preliminar para la predicción del rendimiento de Gmelina arborea Roxb. en América Central. CATIE.
Johansson, T. (2013). A site dependent top height growth model for hybrid aspen. Journal of Forestry Research, 24, 691-698. https://doi.org/10.1007/s11676-013-0365-6 DOI: https://doi.org/10.1007/s11676-013-0365-6
Krkač, M., Bernat-Gazibara, S., Arbanas, Ž., Sečanj, M., & Mihalić-Arbanas , S. (2020). A comparative study of random forests and multiple linear regression in the prediction of landslide velocity. Landslides, 17, 2515-5131. https://doi.org/10.1007/s10346-020-01476-6 DOI: https://doi.org/10.1007/s10346-020-01476-6
López, A. M., Barrios, A., & Nieto, V. (2011). Monitoreo y modelamiento del crecimiento para el manejo de plantaciones forestales comerciales. Intersolugráficas.
Martinez-Zurimendi, P., Dominguez-Dominguez, M., Juárez-Garcia, A., López-López, L. M., De la Cruz, V., & Álvarez, J. (2015). Índice de sitio y producción maderable en plantaciones forestales de Gmelina arborea en Tabasco. Revista Fitotecnia Mexicana, 38, 415-425. http://dx.doi.org/10.35196/rfm.2015.4.415 DOI: https://doi.org/10.35196/rfm.2015.4.415
Melo Cruz, O. A. (2015). Modelación del crecimiento, acumulación de biomasa y captura de carbono en árboles de Gmelina arborea Roxb., asociados a sistemas agroforestales y plantaciones homogéneas en Colombia [Tesis de doctorado, Universidad Nacional de Colombia]. https://repositorio.unal.edu.co/handle/unal/54860
Ministerio de Agricultura y Desarrollo Rural (MADR). (2022). Boletín estadístico forestal. MADR.
Nunes, L., Patricio, M., Tomé, J., & Tomé, M. (2011). Modeling dominant height growth of maritime pine in Portugal using GADA methodology with parameters depending on soil and climate variables. Annals of Forest Science, 68(2), 311-323. https://doi.org/10.1007/s13595-011-0036-8 DOI: https://doi.org/10.1007/s13595-011-0036-8
Nurudeen, T. A., Odeleye, S., Akinyemi, O. D., Salami, K. D., & Lawal, A. A. (2018). Index age for estimating site index of Gmelina arborea (Roxb.) stands in ioluwa forest reserve, South Western Nigeria. Fudma Journal of Sciences, 2(4), 154-158.
http://fusion.fudutsinma.edu.ng/index.php/fjs/article/view/1330
Pacheco-Aguilar, G., Santiago-Juárez, W., Martínez-Santiago, D., & Ortiz-Barrios, R. (2016). Analisis del crecimiento e incremento y estimacion de índice de sitio para Pinus montezumae Lamb. en Santiago Textitlán, Sola de Vega, Oaxaca. Foresta Veracruzana, 2(18), 21-28. https://www.redalyc.org/journal/497/49748829003/html/
Panik, M. J. (2014). Growth curve modeling: Theory and aplications. John Wiley & Sons. https://doi.org/10.1002/9781118763971 DOI: https://doi.org/10.1002/9781118763971
Quiñonez Barraza, G., De los Santos Posadas, H. M., Cruz Cobos, F., Velázquez Martínez, A., Ángeles Pérez , G., & Ramírez Valverde, G. (2015). Índice de sitio con polimorfismos complejos para masas forestales en Durango, México. Agrociencia, 49(4), 439-454.
Refaeilzadeh, P., Tang, L., & Lui, H. (2008). Cross Validation. En L. Liu & M. T. Özsu (Eds.), Encyclopedia of Database Systems (pp. 677-684). Springer. http://dx.doi.org/10.1007/978-1-4614-8265-9_565 DOI: https://doi.org/10.1007/978-1-4614-8265-9_565
Richards, F. J. (1959). A flexible growth function for empirical use. Journal of Experimental Botany, 10(2), 290-301. http://dx.doi.org/10.1093/jxb/10.2.290 DOI: https://doi.org/10.1093/jxb/10.2.290
Sabatia, C. O., & Burkhart, H. E. (2014). Predicting site index of plantation lobolly pine from biophysical variables. Forest Ecology and Management, 326, 142-156. https://doi.org/10.1016/j.foreco.2014.04.019 DOI: https://doi.org/10.1016/j.foreco.2014.04.019
Scolforo, H. F., McTague, J., Burkhart, H., Roise, J., Alvares, C. A., & Stape, J. L. (2020). Site index estimation for clonal eucalypt plantations in Brazil: A modeling approach refined by environmental variables. Forest Ecology and Management, 466, 118079. https://doi.org/10.1016/j.foreco.2020.118079 DOI: https://doi.org/10.1016/j.foreco.2020.118079
Scolforo, J., Maestri, R., Ferraz, A., Mello, J., Oliveira, A., & Assis, A. (2013). Dominant height model for site classification of Eucalyptus grandis incorporating climatic variables. International Journal of Forestry Research, 2013, 139236. https://doi.org/10.1155/2013/139236 DOI: https://doi.org/10.1155/2013/139236
Statistical Analysis System (2021). Statistical Analysis System-SAS. https://www.sas.com/es_co/company-information.html
Talavera García, J. (2013). Modelización de crecimiento de Pinus pinaster l [Tesis de doctorado, Universidad Autónoma de Nuevo León]. http://eprints.uanl.mx/id/eprint/3724
Tamarit-Urias, J. C., Rodríguez-Acosta, M., Quiñonez-Barraza, G., & Santiago-Garcia, W. (2022). New dynamic equation of dominant height and site index for Pinus chiapensis (Martínez) Andresen in Puebla and Veracruz, Mexico. Revista Chapingo Serie Ciencias Forestales y del Ambiente, III(28), 331-347. https://doi.org/10.5154/r.rchscfa.2021.05.030 DOI: https://doi.org/10.5154/r.rchscfa.2021.05.030
Tewari, V. P., & Singh, B. (2018). Total wood volume equation for Tectona grandis linn F. stands in Gujarat, India. Journal of Forest and Environmental Science, 34(4), 313-320. https://doi.org/10.7747/JFES.2018.34.4.313
Trim, K. R., Coble, D. W., Weng, Y., Stovall, J. P., & Hung, I. K. (2020). A new site index model for intensively managed loblolly pine (Pinus taeda) plantations in the west Gulf Coastal Plain. Forest Science, 66(1), 2-13. https://doi.org/10.1093/forsci/fxz050 DOI: https://doi.org/10.1093/forsci/fxz050
Vanclay, J. K., Baynes, J., & Cedamon, E. (2008). Site index equation for smallholder plantations of Gmelina arborea in Leyte Province. Small-Scale Forestry, 7, 87-93. https://doi.org/10.1007/s11842-008-9042-6 DOI: https://doi.org/10.1007/s11842-008-9042-6
Vargas, B., Aguirre , O. A., Corral, J. J., Crecente, F., & Diéguez, U. (2013). Modelo de crecimiento en altura dominante e índice de sitio para Pinus pseudostrobus Lindl. en el noreste de México. Agrociencia, 47(1), 91-106. https://www.scielo.org.mx/pdf/remcf/v7n37/2007-1132-remcf-7-37-00007.pdf
Vásquez, W., & Ugalde, L. (1995). Rendimiento y calidad de sitio para Gmelina arborea, Tectona grandis, Bombacopsis quinatum y Pinus caribaea en Guanacaste, Costa Rica. CATIE.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Recibido: 6 de marzo de 2023; Aceptado: 8 de agosto de 2023
Resumen
El concepto de productividad forestal es biológicamente complejo. En masas forestales, se estima indirectamente mediante modelos de crecimiento en altura dominante e índice de sitio. El objetivo de este estudio fue desarrollar un modelo de altura dominante para Gmelina arborea con datos provenientes de 129 parcelas de monitoreo. Se generaron 9 ecuaciones dinámicas de altura dominante a partir de los modelos teóricos de Hossfeld y Bertalanffy-Richards, ajustadas individualmente y sujetas a validación cruzada. De los modelos evaluados, sobresalió el modelo polimórfico de Bertalanffy-Richards (parámetro c). Este modelo presentó una tendencia biológica realista, con curvas polimórficas y una única asíntota. El modelo seleccionado es una herramienta importante para el manejo de plantaciones forestales de G. arborea en zonas que presenten características de sitio semejantes a las de este estudio.
Palabras clave:
curvas de índice de sitio, ecuaciones dinámicas, polimorfismo, productividad forestal, validación cruzada.Abstract
The concept of forest productivity is biologically complex. In forest masses, it is indirectly estimated via dominant height growth models and site indices. The aim of this study was to develop a dominant height model for Gmelina arborea using data from 129 monitoring plots. 9 dynamic equations were generated from the Hossfeld and Bertalanffy-Richards theoretical models, which were individually fitted and cross-validated. Among the evaluated models, the Bertalanffy-Richards model (parameter c) stood out. This model showed a logical biological trend, with polymorphic curves and a unique asymptote. The selected model is an important tool for the management of G. arborea forest plantations in areas with site characteristics similar to those of this study.
Keywords:
site index curves, dynamic equations, polymorphism, forest productivity, cross-validation.INTRODUCCIÓN
La estimación del crecimiento futuro es una cuestión fundamental en la planificación de las inversiones y la ordenación forestal. Estas proyecciones permiten proyectar la respuesta de un sitio frente a una especie en particular, disminuyendo el sesgo en los supuestos, lo que las hace una herramienta indispensable para la planificación forestal (Aguirre & Aguirre, 2014). Los proyectos forestales, al ser afectados de forma directa por la variación del clima (Sabatia & Burkhart, 2014), necesitan de herramientas que permitan proyectar tasas diferenciales de productividad para realizar prescripciones silvícolas más precisas.
El potencial productivo de las masas forestales habitualmente se determina evaluando la calidad del sitio (Burkhart & Tomé, 2012), que a su vez se evalúa mediante un indicador conocido como el índice de sitio (IS), el cual se ve poco afectado por la densidad de plantación. Este índice consiste en unas curvas de crecimiento donde se relaciona una altura dominante proyectada hasta una edad base definida (Tamarit-Urias et al., 2022). Estas curvas muestran la respuesta de la especie al sitio, relacionando directamente los niveles de productividad de una especie con una ecorregión (Akbas & Senyurt, 2018).
Los métodos para la construcción de las curvas de IS se clasifican en cuatro grupos: el método de la curva guía, el enfoque por diferencias algebraica (EDA) desarrollado por Bailey & Clutter (1974), el método de predicción de parámetros (Clutter et al, 1983) y el enfoque por diferencias algebraicas generalizadas (EDAG) desarrollado por Cieszwski & Bailey (2000). Para el modelado dinámico, es necesario disponer de datos medidos en árboles o rodales al menos en dos ocasiones utilizando parcelas de intervalo, parcelas permanentes o análisis troncal (Hernández-cuevas et al., 2018). El método EDA involucra esencialmente la sustitución de un parámetro del modelo base para expresarlo como una función del sitio. Cieszwski & Bailey (2000) introdujeron una generalización a la metodología EDA (i.e., enfoque EDAG), considerando que la ecuación base se expande para permitir que más de un parámetro dependa de la calidad de sitio y que las familias de curvas obtenidas incrementen su flexibilidad. Una de las ventajas de la metodología EDAG es su capacidad para ampliar la base de ecuaciones de acuerdo con varias teorías sobre las características del crecimiento (asíntota, tasa de crecimiento), incluyendo la posibilidad de simular polimorfismos concurrentes y múltiples asíntotas, que son vistos como propiedades importantes de las ecuaciones de sitio (Guerra-Hernández et al., 2021).
En Colombia, las plantaciones forestales cubren 538 000 ha, localizadas en la Región Andina, la Costa Atlántica y la Orinoquía (MADR, 2022), estimando tan solo un 2.2 % de la superficie potencial para el establecimiento de plantaciones (Gómez et al., 2012). Algunas especies forestales tardan menos tiempo en crecer y ser productivas en comparación con otros países. Para el caso de la Gmelina arborea, se reporta un rendimiento de 20-25 m3.ha.año-1, mientras que, en promedio, países como Bolivia, Brasil, Costa Rica, Filipinas, Indonesia, Malawi y Malasia reportan entre 12 y 19 m3.ha.año-1. G. arborea se encuentra dentro de las diez especies con alto potencial de incrementar sus rendimientos por aumento en la producción, lo que a su vez se asocia con la disminución en los tiempos de rotación, que varían entre los 10 y 14 años (Escobar Quemba, 2013). Esta especie es plantada especialmente en ecosistemas de bosque seco tropical, alcanzando un área estimada de 21 000 ha para la industria de la madera en Colombia (MADR, 2022), lo que la convierte en una de las especies más promisorias para el desarrollo forestal del país (Melo Cruz, 2015). Estudios previos han modelado el crecimiento de Gmelina arborea, proyectando índices de sitio a diferentes intervalos. Esto permite conocer la respuesta de la especie a las condiciones de sitio. Este tipo de investigaciones ha sido reportado para países como Filipinas, México y Nigeria (Vanclay et al., 2008; Martínez-Zurimendi et al., 2015; Nurudeen et al., 2018). En Colombia se desarrolló un modelo empírico para predecir la altura dominante (H) y el IS de plantaciones de G. arborea, relacionando variables biofísicas y de rodal (Barrios et al., 2021). López et al. (2011) modelaron la altura dominante en la costa Atlántica y la región Andina de Colombia bajo el EDA, en el cual los modelos de crecimiento de Chapman-Richards y Korf presentaron el mejor ajuste para la especie. Así, este modelo se convirtió en un predictor caracterizado por la generación de curvas polimórficas con única asíntota.
El objetivo principal del presente estudio es generar un modelo predictor de productividad de sitio para Gmelina arborea en Colombia a partir de datos recolectados en los departamentos de Magdalena y Tolima en múltiples temporalidades. Para ello, se evalúan la calidad de ajuste y la capacidad predictiva en modelos dinámicos derivados de los enfoques EDA y EDAG, seleccionando la ecuación que mejor represente el crecimiento de la especie. Con esta ecuación, se clasifican los niveles de productividad en bajo, medio y alto.
MATERIALES Y MÉTODOS
Área de estudio y base de datos
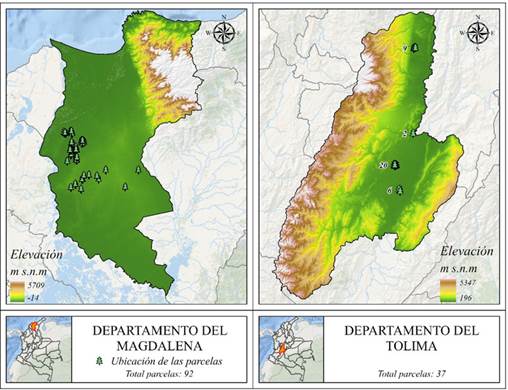
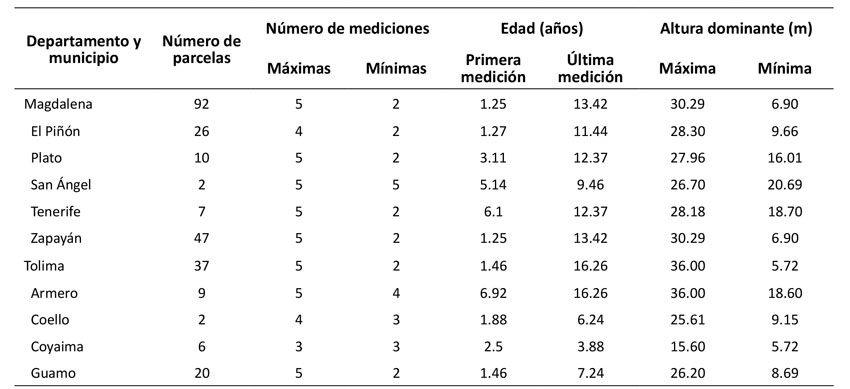
Se empleó una red de 129 parcelas permanentes de monitoreo instaladas durante el periodo 2008-2013. Las parcelas se establecieron en 5 municipios del departamento del Magdalena, ubicado en la región Caribe de Colombia, y en 4 municipios del departamento del Tolima, el cual se encuentra en la región Andina del centro-oeste del país (Figura 1). Se registraron mediciones dasométricas desde el primer año de establecimiento hasta los 16 años, con un total de 2 a 5 remediciones en cada parcela. En cada parcela y medición, se registró el diámetro a la altura del pecho (DAP), tomado a 1.30 m del suelo (DAP) con cinta diamétrica, y la altura total (HT), medida con un hipsómetro laser.
Figura 1: Distribución espacial de las unidades muestrales en los departamentos de Magdalena y Tolima
En el departamento del Magdalena, la altura dominante media fue de 23.28 m, con un rango de 6.9-30.28 m. En el departamento del Tolima, la altura dominante varió entre 5.72 y 36.0 m, con una media de 18.6 m (Tabla 1). La base de datos presenta mediciones a edades tempranas (mayores a un año del establecimiento de la plantación), intermedias (antes de la edad de corta) y mayores a la edad de aprovechamiento, lo que permite afirmar la idoneidad de los datos para el ajuste del modelo predictor.
Tabla 1: Resumen de las mediciones realizadas en parcelas permanentes de G. arborea en cada departamento y municipio
Altura dominante
Existen diferentes criterios para determinar la altura dominante de un rodal. Para este estudio, la altura dominante se considera como la altura media aritmética de los 100 árboles.ha-1 con los diámetros de mayor tamaño, tal como lo explica Johansson (2013). Una correcta predicción de la altura dominante basada en modelos de IS no sesgados y precisos es esencial para modelar el crecimiento y la producción (Vargas et al., 2013).
La Tabla 1 resume las características temporales y los rangos de altura dominante de la base de datos a nivel de departamento y municipio.
Modelos de altura dominante evaluados
Se usó un total de 9 funciones derivadas de 2 modelos de crecimiento (Hossfeld y Bertalanffy-Richards), los cuales han sido reportados por Burkhart & Tomé (2012), Panik (2014) y Tamarit-Urias et al. (2022). Se generaron 4 ecuaciones dinámicas del modelo Hossfeld y 5 ecuaciones del modelo de Bertalanffy-Richards, usando el EDA y el EDAG. En la Tabla 2 se presenta el modelo en su forma base, los parámetros seleccionados para el despeje de cada ecuación y la respectiva forma del modelo dinámico que se utiliza para modelar el IS.
Tabla 2: Modelos de crecimiento ajustados para la predicción del desarrollo en altura dominante

El EDA solo admite una hipótesis de crecimiento respecto a los parámetros, es decir, se tiene una sola asíntota común (modelos polimórficos) o se tienen asíntotas variables (modelos anamórficos), pero no es posible incluir ambas hipótesis en un modelo (Pacheco-Aguilar et al., 2016). Esta metodología, formalizada por Bailey & Clutter (1974), involucra esencialmente la sustitución de un parámetro del modelo base para expresarlo como una función del IS o de una condición inicial de la variable de interés. Estas ecuaciones poseen una asíntota horizontal y generan curvas anamórficas o polimórficas siguiendo un patrón de crecimiento sigmoide y un punto de inflexión correspondiente a un comportamiento esperado para cada especie (Talavera García, 2013).
El enfoque por diferencias algebraicas generalizadas (EDAG), desarrollado por Cieszewski & Bailey (2000), considera dos parámetros como dependientes de la calidad de sitio, lo que permite la generación de curvas polimórficas con múltiples asíntotas. Este procedimiento se considera como un método que produce estimaciones imparciales para ecuaciones invariantes a la edad base (Nunes et al., 2011). Esta es una propiedad deseable al momento de describir el crecimiento en altura dominante y clasificar la productividad de sitio (Pacheco-Aguilar et al., 2016).
Las ecuaciones dinámicas generadas son de la forma Y = f(t, Y 0, t 0, β i ), donde Y y Y 0 indican la altura dominante futura y la altura dominante de referencia respectivamente, t y t 0 son las edades respectivas para cada altura dominante y β i representa los parámetros a estimar.
Aquí, a, b y c son los parámetros propios en cada ecuación; b1, b2 y b3 son los parámetros de la ecuación dinámica; X 0 y L 0 son los parámetros dependientes de la calidad de sitio; ln es el logaritmo natural; y e es la función exponencial.
Ajuste y validación
Los parámetros de estos modelos se estimaron mediante el procedimiento Model en la interfaz del Statistical Analysis System (SAS) 9.4 (Statistical Analysis System, 2021), con el algoritmo de minimización de Marquardt y utilizando el método de máxima verosimilitud con información completa (FIML). Se empleó regresión no lineal ponderada asumiendo que la varianza de los residuales puede ser modelada como una función potencial de la altura dominante predicha w i = ŷ i m (Tamarit-Urias et al., 2022). La potencia (m) se determinó empleando la metodología descrita por Barrios et al. (2014). Adicionalmente, para evitar problemas de autocorrelación, los residuales fueron modelados a través de una estructura autorregresiva en tiempo continuo AR(1), empleando el macro %(ar) del procedimiento Model.
Se usó la técnica de validación cruzada para valorar la precisión de los modelos, la cual permite evaluar la generalización de los resultados empleando un conjunto independiente de datos (Refaeilzadeh et al., 2008). Para ello, los datos se dividieron aleatoriamente en 10 grupos de igual tamaño que contenían 13 parcelas (10 % de los datos totales). El procedimiento de validación cruzada (k-fold cross-validation) consistió en una división aleatoria en k número de grupos. Para este estudio, el total de subconjuntos fue 10; cada grupo contenía 13 parcelas (aproximadamente 10 % de los datos totales). Posteriormente, se realizaron k iteraciones (proceso de validación), de tal manera que, en cada iteración, se mantuvo un conjunto diferente de los datos, mientras que el resto (k-1) se utilizó para ajuste (Krkač et al., 2020). La bondad de ajuste se evaluó considerando el coeficiente de determinación ajustado (Burkhart & Tomé, 2012):
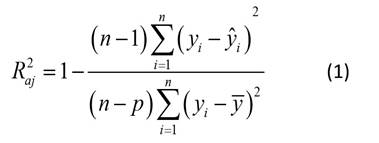
Como medidas de bondad de predicción, se utilizaron el sesgo promedio (Sesgo), el error absoluto medio (EAM) y la raíz del error medio cuadrático (REMC) (Barrios-Trilleras et al., 2021):
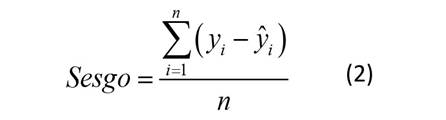
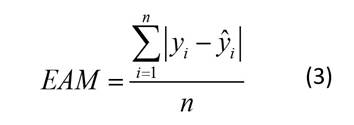
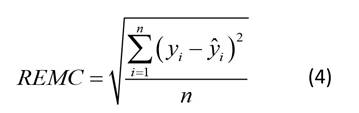
donde y i es la altura dominante observada, ŷ i es la altura dominante predicha, ȳ es la altura dominante media, n es el número de observaciones y p es el número de parámetros del modelo.
La evaluación de la autocorrelación se realizó con el análisis estadístico de Durbin-Watson (DW) (Panik, 2014), y los residuos de cada modelo se graficaron frente a los valores predichos para evaluar su distribución y heterocedasticidad (Barrios-Trilleras et al., 2021).
A partir de los análisis estadísticos de bondad de ajuste y la validación, se construyó un sistema de clasificación donde se establece un orden jerárquico de calidad y desempeño estadístico, en el cual se selecciona el modelo que obtenga la calificación más baja (Tewari & Singh, 2018), que finalmente se utiliza para predecir el IS de cada parcela, considerando una edad base igual a 10 años, usualmente empleada para determinar el IS de G. arborea (López et al., 2011; Martínez-Zurimendi et al., 2015).
RESULTADOS
Modelos ajustados de crecimiento de altura dominante
La Tabla 3 presenta el valor de los parámetros estimados, la bondad de ajuste y la bondad de predicción para los modelos evaluados, así como la calificación total de cada uno. En términos generales, los modelos restantes evaluados presentaron buenos ajustes. Todos los modelos presentaron R2 aj ≥ 0.914, a excepción de los modelos 3 y 4, los cuales presentaron R2 aj = 0.88.
En paréntesis: el intervalo de confianza para cada parámetro estimado.
Tabla 3: Parámetros estimados y bondad de ajuste y predicción para los modelos de crecimiento de altura dominante evaluados
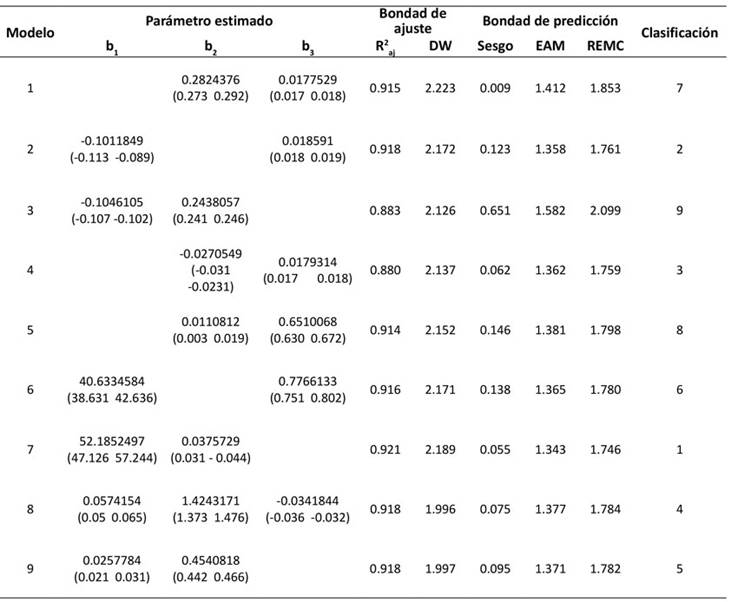
Los datos estadísticos de bondad de predicción se consideran aceptables. Los valores de sesgo indican que los modelos tendieron a subestimar los valores de altura dominante con sesgos entre 0.009 y 0.651 m. Los modelos presentaron EAM entre 1.343 y 1.582 m, y el REMC presentó valores entre 1.746 y 2.099 m.
De acuerdo con los resultados del sistema de clasificación implementado, el modelo 7 (Bertalanffy-Richards), el modelo 2 y el modelo 4 sobresalieron con los mejores datos estadísticos. En relación con el análisis estadístico DW, los valores oscilaron entre 1.996 y 2.223, en general fueron próximos a 2 y, de acuerdo con Trim et al. (2020), se evidencia la inexistencia de autocorrelación.
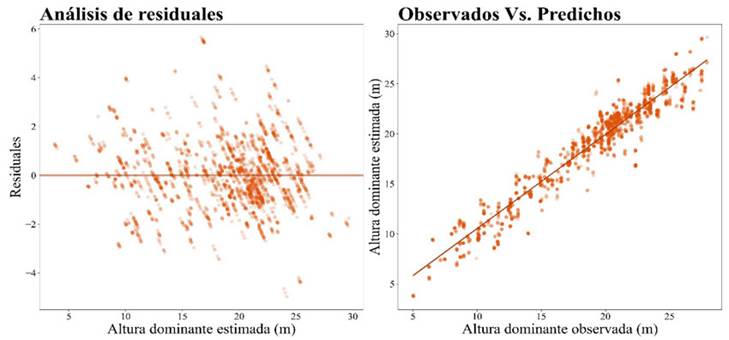
La Figura 2 muestra el comportamiento de los residuales del modelo 7. Como se aprecia, no hay tendencias anómalas, indicando la ausencia de heterocedasticidad. Al graficar los valores observados frente a los predichos, se observa que el modelo 7 no presenta tendencias significativas de sobrestimación o subestimación, lo que lo vuelve una ecuación idónea para la proyección del IS, facilitando la construcción de planes precisos para la planificación de la especie.
Figura 2: Dispersión de residuales y valores observados frente a valores predichos para el modelo 7 (modelo de Richards, parámetro c).
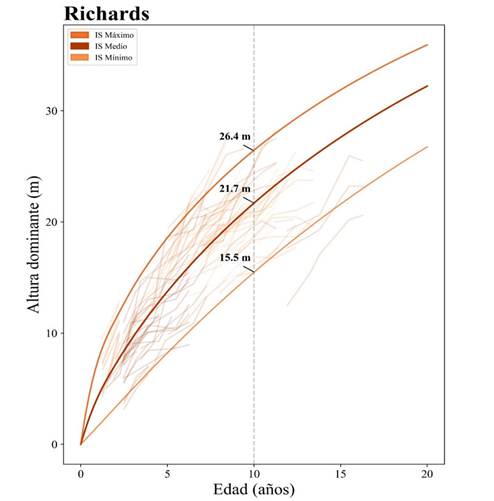
Finalmente, se analiza la familia de curvas generadas por la ecuación de Richards. Se presentan curvas ajustadas a IS con edad de referencia de 10 años superpuestas a las trayectorias de las parcelas observadas a través de la edad. De esta manera, se buscó evaluar el comportamiento biológico de los modelos, representado en una familia de tres curvas generadas para clasificar la productividad de los sitios como alto, medio y bajo, que corresponden al percentil 95, la mediana y el percentil 5 de los datos observados respectivamente.
Las curvas de IS generadas por los modelos presentan diferentes tasas de crecimiento a edades tempranas (de 0 a 5 años). En edades medias o mayores de 5 años, se ve un crecimiento continuo hacia la formación de una asíntota horizontal, lo cual indica un punto de inflexión en los niveles de desarrollo de la especie. Esta información generalmente se utiliza para la planificación de prácticas silvícolas y la proyección de la productividad.
Para el modelo de Richards, parámetro c (modelo 7), se observa en la Figura 3 un ajuste claro para las tres curvas evaluadas, donde, a edades tempranas, se presenta un crecimiento acelerado, marcado por una deflexión donde la tasa de crecimiento se reduce en el tiempo. Esto es bastante acertado para un comportamiento biológico promedio. Este modelo mostró un rango de IS entre los 15.5 y los 26.4 m a una edad base de 10 años. Para clasificar la productividad de plantaciones de Gmelina arborea, se generaron tres rangos basados en las curvas de la Figura 3: sitios con bajas productividades, o aquellos con IS ≤ 18.6 m; sitios con productividades medias entre 18.6 m < IS ≤ 24.1 m; y sitios con productividad alta, con IS > 24.1 m.
Figura 3: Familia de curvas de índice de sitio para G. arborea obtenidas a partir del modelo de Richards, parámetro c (modelo 7)
Finalmente, se contrastan los valores de IS para el modelo 7 para cada uno de los municipios muestreados en ambos departamentos (Tabla 4).
Tabla 4: Índice de sitio promedio para plantaciones de G. arborea por municipio y departamento
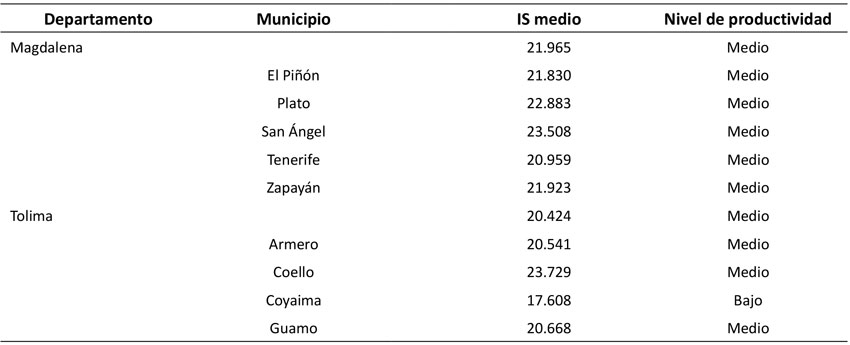
Como se evidencia en la Tabla 4, los departamentos presentan el mismo nivel de productividad. Todos los municipios fueron categorizados como de productividad media, excepto el municipio de Coyaima en el departamento del Tolima, que presenta un valor más bajo de productividad. La Ecuación (5) de IS para G. arborea según el modelo 7 se muestra a continuación:
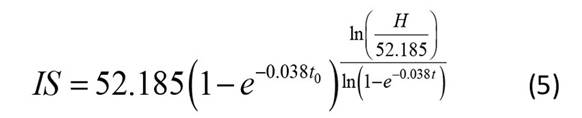
donde t0 hace referencia a la edad base o edad clave (10 años) y H y t son la altura dominante y edad del rodal.
DISCUSIÓN
Este estudio presenta una evaluación de modelos de crecimiento en altura dominante para Gmelina arborea, los cuales son de utilidad para clasificar la productividad de plantaciones de la especie. A partir de dos funciones de crecimiento base, se generaron 9 modelos dinámicos de altura dominante empleando las metodologías EDA y EDAG. Estudios previos han demostrado que el uso de estos enfoques ofrece estimaciones de altura dominante sustancialmente más precisas en comparación con el enfoque de curva guía debido a su naturaleza polimórfica (Scolforo et al., 2020).
Los más destacados fueron los modelos 7, 8 y 2, los dos primeros originados a partir del modelo de Bertalanffy-Richards y el tercero a partir del modelo de Hossfeld. Estudios previos en Colombia (López et al., 2011; Barrios et al., 2021) habían coincidido en que el modelo de crecimiento base de Bertalanffy-Richards representa mejor el crecimiento en altura dominante de Gmelina arborea. Sin embargo, en un estudio realizado para plantaciones forestales de Gmelina arborea en Tabasco, México, se seleccionó el modelo base de Hossfeld para describir el crecimiento de altura dominante (Martínez-Zurimendi et al., 2015). Estos resultados reflejan la complejidad del modelamiento de la calidad de sitio, debido a que el modelo refleja el desarrollo local o regional en altura dominante de los árboles.
En este estudio se selecciona el modelo dinámico 7, el cual se origina a partir del modelo base de Bertalanffy- Richards, dejando el parámetro c dependiente del sitio. El modelo de crecimiento seleccionado para esta especie muestra las características típicas de un modelo de crecimiento biológico, que, según Scolforo et al. (2013) inicia en el punto cero, presenta crecimiento acelerado a edades juveniles, tiene un punto de inflexión donde el crecimiento se desacelera e incluye una asíntota que refleja el valor máximo que puede alcanzar el organismo. Los resultados obtenidos concuerdan con los de López et al. (2011) en cuanto a que el desarrollo de altura dominante de Gmelina arborea se caracteriza por tener diferentes tasas de crecimiento, lo que da lugar a polimorfismos. No obstante, los rodales finalmente alcanzan una altura dominante máxima (asíntota).
La productividad de G. arborea fue categorizada en tres rangos: sitios con bajas productividades con IS ≤ a 18.6 m, sitios con productividades medias con IS entre 18.6 y 24.1 m y sitios con productividad alta con IS > 24.1 m. Estos intervalos se encuentran en los rangos propuestos por diversos autores que evaluaron la productividad de Gmelina arborea (Hughell, 1991; Vásquez & Ugalde, 1995; Cifuentes, 2010; Martínez- Zurimendi et al., 2015). En todos los casos se empleó una edad de referencia de 10 años. En términos generales, la productividad de las plantaciones forestales de G. arborea evaluadas puede ser considerada como media. Sin embargo, es factible que esta incremente a causa del desarrollo genético y la silvicultura. En todo caso, el modelo desarrollado tiene la capacidad de adaptarse a estos cambios y mantener su capacidad predictiva.
CONCLUSIONES
Este estudio evaluó una amplia gama de modelos de proyección de altura dominante, lo que permitió disminuir el error de selección, reduciendo considerablemente las posibilidades de sobreestimar o subestimar la calidad de sitio, pues esto afectaría directamente los supuestos de planificación y liquidez durante el desarrollo de la plantación.
El modelo que mejor se ajustó a los datos y al comportamiento de la especie fue el número 7 (Bertalanffy- Richards, parámetro c), presentando una tendencia biológica acorde con tasas de crecimiento acelerado en edades juveniles y un punto de inflexión donde el crecimiento se desacelera. También e incluye una asíntota que refleja la altura dominante máxima que puede alcanzar el rodal. Por lo tanto, se considera Gmelina arborea como una especie que se ajusta mejor a modelos que generen familias de curvas polimórficas y que tiendan a alcanzar una única asíntota en edades avanzadas. El modelo seleccionado es un modelo integral y funcional que puede ser utilizado para evaluar la calidad de sitio en los departamentos de Magdalena y Tolima.
Acknowledgements
AGRADECIMIENTOS
Los autores agradecen a la Oficina de Investigación y Desarrollo Científico de la Universidad del Tolima por el apoyo financiero otorgado para desarrollar la investigación, a través del proyecto no. 340130516.
REFERENCIAS
Licencia
Derechos de autor 2024 Colombia forestal

Esta obra está bajo una licencia internacional Creative Commons Atribución-CompartirIgual 4.0.
Colombia Forestal conserva los derechos patrimoniales (copyright) de las obras publicadas, y favorece y permite la reutilización de las mismas bajo la licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional por lo cual se pueden copiar, usar, difundir, transmitir y exponer públicamente, siempre que:
Se reconozcan los créditos de la obra de la manera especificada por el autor o el licenciante (pero no de una manera que sugiera que tiene su apoyo o que apoyan el uso que hace de su obra).