DOI:
https://doi.org/10.14483/23448350.299Publicado:
11/30/2007Número:
Núm. 10 (2008): Enero-diciembreSección:
Artes y Ciencias SocialesExtracción e identificación de metabolitos secundarios y actividad antimicrobiana en Chromolaena bullata (Klatt) King & Robinson
Identification and extraction of secondary metabolites and antimicrobial activity on Chromolacna bullana (Klatt) King & Robinson
Palabras clave:
Chromolaena bullata, secondary metabolites, antimicrobial activity, spectroscopic techniques uv, ms, RMN. (en).Palabras clave:
Chromolaena bullata, metabolitos secundarios, actividad antimicrobiana, técnicas espectroscópicas uv, MS, RMN (es).Descargas
Referencias
AHMED A., WHITTEMORE A., MABRY T. 1985. "A Heliangolide From Chromolaena Glaberrima" en Phytochemistry. Vol. 24. No 3. p.605-606.
AUDIER H. "Étude des composes flavoniques par Spectrométrie de masse" en Bulletin de la Société Chimique de France. No. 9, 1966.
BAEZ D., RIOS C., CRESCENTE O., CASERTA, A. 1998. "Antibacterial and chemical evaluation of Chromolaena moritziana" en Journal of Etnopharmacology. No. 59. p.203-208.
BECERRA P. 1992. Estudio fitoquimico de la Chromolaena leivensis y su actividad antibacteriana. Bogotá, Pontificia Universidad Javeriana, Facultad de Ciencias. BILBAO M. R. 1997.Análisis Fitoquímico Preliminar. Armenia, Universidad del Quindío.
BOHLMANN F., ZDERO C., FIEDLER L.,KING R., ROBINSON H. 1981. "A Labdane Derivative From Chromolaena Collina And A P-Hydroxyacetophenone Derivative From Stomatanthes Corumbensis'; en Phytochemistry.Vol. 20. No 5. p.1141-1143.
BOHLMANN E, GUPTA R., KING R., ROBINSON H. 1981. Prostaglandin-Like Fatty Acid Derivative From Chromolaena Morii" en
Phytochemistry. Vol. 20. No 6. p. 1417-1418.
BOHLMANN E, BORTHAKUR N., KING R., ROBINSON H. 1982. "Further ProstaglandinLike Fatty Acids From Chromolaena Morii" en Phytochemistry. Vol. 21. No 1. p.125-127.
BOHLMANN F., SING P., JAKUPOVIC J.,KING R., ROBINSON H. 1982. " Three Cadinene Derivatives And A Prostaglandin-Like Acid From Chromolaena Species" en Phytochemistry. Vol. 21. No 2. p.371-374.
BILLER A., BOPPRE M., WITTE L., HART-MANN T. 1994. "Pyrrolizidine alkaloids in Chromolaena odorata. Chemical and chemoecological aspects", en, Phytochemistry. Vol. 35.No 3. p.615-619.
CASTILLO G., JAKUPOVIC J., BOHLMANN E, KING R., ROBINSON H. 1989. "Ent clerodane derivatives from Chrmolaena connivens'; en
Phytochemistry. Vol. 28. No 2. p.641 642.
CARRERO., M. 1982. Aislamiento de los constituyentes con actividad antimicrobiana de Chromolaena tacotana (Klatt) King & Robinson. Universidad Nacional de Colombia. Facultad de ciencias. Bogotá, Departamento de Farmacia.
ESPITIA, C. 1992. Química del género Chromolaena. Flavanonas de Chromolaena Bogotá, Universidad Nacional de Colombia. Facultad de Ciencias. Departamento de Química.
FUENTES 0. 1987. Introducción a la espectrometría de masas. Bogotá, Universidad Nacional de Colombia, Facultad de Ciencias.
GARCIA., A. 1983. Aislamiento de las sustancias con actividad antimicrobiana de Chromolaena tequendamensis (Hieron) King er Robinson. Bogotá, Universidad Nacional de Colombia. Facultad de Ciencias. Departamento de Farmacia.
GUTIERREZ A., CATALAN C., DIAZ J., HERZ W. 1995. "Sesquiterpene Lactones, A Labdane And Other Constituents Of Urolepis Hecatantha And Chromolaena Arnottiana", en Phytochemistry. Vol. 39. No 4. p. 795-800.
IROBI O. N. 1992. "Activities Of Chromolaena Odorata (Compositae) Leaf Extract Against Psé udomonas Aeruginosa And Streptococcus Faecalis" en Journal of Etnopharmacology. No. 37. p. 81-83.
KLATT F. W. 1887. "Plantae lehmannianae in Guatemala, Costarica et Columbia collectae. Compositae. Botanische Jahrbücher für systematic", en pflanzengeschishte und pflanzengeographie. Vol. 8. p. 32-52.
KING R., ROBINSON H., 1970. "Studies in the Eupatorieae (Compositae). The genus Chromolaena : en Phytologia. Vol. 20. No. 3. p. 196-209.
MABRY T. J., MARKHAM K. R., THOMAS M. B. 1970. The Systematic Identification Of Flavonoids. Berlín, Springer-Verlag.
SAYED N., MISKI M., WHITTERMORE A.,MABRY T. 1988. "Sesquiterpene lactones from Chromolaena opadoclinia", en Phytochemistry. Vol. 27. No 10. p. 3312-3314.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Artes y ciencias sociales
Revista Científica, 2008-08-00 nro:10 pág:101-108
Extracción e identificación de metabolitos secundarios y actividad antimicrobiana en Chromolaena bullata (Klatt) King & Robinson
Identification and extraction of secondary metabolites and antimicrobial activity on Chromolacna bullana (Klatt) King & Robinson
Luís Carlos Sánchez
Director Grupo de Síntesis Orgánica Universidad Distrital (icgarcia@udistritaLedu.co )
John Alexander Corredor Barinas
Licenciado en Química Universidad Distrital.
José Guerrero
Licenciado en Química Universidad Distrital.
Diego Alejandro Navas
Licenciado en Química Universidad Distrital.
Resumen
Se realizó la evaluación de actividad contra los microorganismos Escherichia coli, Staphylococcus aureus, Pseudomonas aeruginosa y Candida albicans de los extractos totales y fracciones de éter de petróleo, diclorometano y etanol de partes aéreas de la especie vegetal Chromolaena bullata (Klatt) King & Robinson; se lograron aislar y purificar dos metabolitos secundarios de hojas de dicha especie, cuyas estructuras fueron elucidadas por medio de propiedades físicas y químicas y por técnicas espectroscópicas (uv, GC-MS y RMN).
Palabras clave
Chromolaena bullata, metabolitos secundarios, actividad antimicrobiana, técnicas espectroscópicas uv, MS, RMN.
Abstract
The activity against the microorganisms Escherichia coli, Staphylococcus aureus, Pseudomonas aeruginosaand Candida albicans of the total extracts and the petroleum ether, dichloromethane and ethanol from the aerial parts of the vegetal species Chromolaena bullata (Klatt) King & Robinson was evaluated; two secondary metabolites were isolated and purified from leaves of this species, whose structures were elucidated through their physical and chemical properties and by spectroscopic techniques (uv, Gc-MS y RMN).
Key Words
Chromolaena bullata, secondary metabolites, antimicrobial activity, spectroscopic techniques UV, MS, RMN.
Introducción
El altiplano cundiboyacense posee una gran variedad de especies vegetales, de las cuales muchas son de uso común en las veredas aledañas en donde se les da uso principalmente medicinal. Se decide investigar la acción de estas especies, sin aparente utilidad (Bilbao, 1997), para encontrar en ellas nuevas sustancias de interés. Este es el caso de la especie vegetal Chromolaena bullata (Klatt) King & Robinson, clasificada por primera vez por el botánico alemán E W. Klatt bajo el nombre de Eupatorium bullatum (Klatt, 1887). Investigaciones realizadas en otras especies del género Chromolaena han permitido conocer una química variada; se han aislado terpenoides, principalmente sesquiterpenos y triterpenos (Bohlmann et al., 1980; El-Sayed et al., 1988; Tamayo et al., 1989; Gutiérrez et al., 1995), siendo de especial interés un grupo de sesquiterpenos particulares, los cadinenos, los cuales pueden considerarse como metabolitos característicos del género. Se han aislado también alcaloides pirrolizídicos (Biller et al., 1994) y ácidos grasos de tipo prostaglandínico (Bohlmann et al., 1981; Bohlmann et al., 1982; Ahmed et al., 1985). Son frecuentes los compuestos flavonoides aislados con estructura de flavonol y flavanona (Barua et al., 1978; Becerra, 1992; Espitia, 1992; Amaro et al., 1993; Gutiérrez et al., 1994; Sanabria et al., 1995; Báez et al., 1997). Igualmente ácidos fenólicos, coumarinas y otros metabolitos han sido reportados (Espitia, 1992). Estudios enfocados a la actividad biológica comprobaron la efectividad de extractos contra microorganismos como Pseudomonas aeruginosa, Streptococcus faecalis, Staphylococcus aureus, Escherichia coli, Mucor sp. y Aspergullius niger (Carrero, 1982; García, 1983; Becerra, 1992; Irobi, 1992; Sanabria et al., 1995; Báez et al., 1998) y atribuyeron la actividad a los ácidos grasos de tipo prostaglandínico y algunas estructuras flavonoides.
Metodología
El material vegetal fue recolectado en inmediaciones del municipio de Sibaté, Cundinamarca. Se realizaron estudios por separado de hojas, tallos y flores utilizando los mismos procedimientos. El material vegetal se secó a temperatura ambiente y fue triturado; 521.3g de hojas fueron sometidos a extracción por reflujo con etanol por cinco días; 452.0g de tallos y 246.1g de flores respectivamente se sometieron a las mismas condiciones. Los extractos obtenidos se concentraron a presión reducida en un rotavapor y posteriormente fueron fraccionados por extracción líquido-líquido continua empleando éter de petróleo y diclorometano, de donde se obtuvieron tres fracciones de cada extracto. Adicionalmente se realizó extracción por maceración de hojas, flores y tallos en donde se utilizó etanol como solvente para realizar las pruebas químicas preliminares, y se empleó el protocolo establecido en la Marcha fitoquímica preliminar (Bilbao, 1997).
Se efectuaron pruebas antimicrobianas a los extractos y fracciones de diferente polaridad, a través del método de difusión en gel por perforación en placa en dos ensayos, tomando como microorganismos indicadores las bacterias Staphylococcus aureus (ATCC 29737), Escherichia coli (ATCC 13706), Pseudomonas aeruginosa (ATCC 25619) y la levadura Candida albicans, se empleó en todos los casos caldo y agar Müeller Hinton. En el primer ensayo realizado, se trabajaron concentraciones de extractos totales de 80, 200 y 400 µg/µl y de fracciones de 40, 100 y 200 µg/µl. Para el segundo ensayo, teniendo en cuenta los resultados del anterior, se trabajaron para extractos y fracciones las concentraciones de 156.25, 312.5, 625, 1250, 2500 y 5000 µg/µl en donde se usó solución salina estéril como solvente. Para ambos ensayos se trabajó como control positivo el antibiótico oxacilina y el antimicótico clotrimazol en concentración de 30 µg/µl.
Las fracciones de diferente polaridad de hojas, flores y tallos, teniendo en cuenta los resultados de las pruebas antimicrobianas, se sometieron a fraccionamientos por medio de sucesivas cromatografías en columna, utilizando como fase estacionaria Sílica Gel 60H y realizando seguimiento de las fracciones eluidas a través de cromatografía en capa fina usando Sílica Gel 60G como adsorbente.
Resultados y discusión
Las pruebas químicas preliminares (Bilbao, 1997) arrojaron resultados positivos para: Hidroxamato férrico para flores y Tollens para tallos (sesquiterpenlactonas); Antrona para hojas y tallos (glicósidos cardiotónicos); Liebermann-Burchard para hojas, tallos y flores (Esteroides y triterpenoides); acetato de plomo y gelatina-sal para las tres partes aéreas (taninos); Shinoda para hojas y flores (flavonoides), entre otros.
Para el caso de la actividad antimicrobiana, en el primer ensayo se observan halos de inhibición contra Staphylococcus aureus superiores a los 13 mm, de alta sensibilidad de acuerdo a la clasificación de antibiogramas de Bauer (Sánchez, 1998), el extracto total de hojas a 400 µg/µl, diclorometano y petrol a 100 µg/µl y 200 µg/µl, las fracciones de diclorometano de flores a 100 µg/µl. y 200 µg/µl, así como la etanólica a 200 µg/µl; los extractos y fracciones de tallos presentaron halos inferiores a los 10 mm y ninguno presentó actividad biológica contra las bacterias gram-positivas Escherichia coli, Pseudomonas aeruginosa ni contra la levadura Candida albicans. Los resultados obtenidos del segundo ensayo mostraron halos de inhibición inferiores a los 5 mm en concentraciones a 5000, 2500 y 1250 µg/µl de extractos y fracciones para Staphylococcus aureus, mientras que para los demás microorganismos el resultado fue negativo en todas las concentraciones empleadas. Esto indica que no se presenta dentro de la especie actividad antibacteriana importante, ya que se requieren concentraciones por encima de los 5000 µg/µl para que exista inhibición de interés farmacológico.
La separación en columna cromatográfica de las fracciones permitió obtener dos metabolitos secundarios, denominados cB1 y cB2. La sustancia cB1 es un sólido blanco que se obtuvo de la fracción de éter de petróleo, eluído por cromatografía en columna con diclorometano, que posteriormente se lavó con metanol y se recristalizó con éter de petróleo. Se tomó su punto de fusión, el cual fue de 57 ± 4°C; se realizaron las pruebas químicas de LiebermannBurchard y Salkowski, que arrojaron resultados negativos.
En el espectro uv de la sustancia cB1, se observaron máximos a 238.96, 248.99 y 260.23 nm, que son acordes en forma y ubicación con las características de los sistemas aromáticos del tipo del benceno, también a 215.99 nm, que no es acorde con el comportamiento de los sistemas aromáticos ni de enlaces dobles conjugados, por lo que se asume la posibilidad de que la sustancia presente algún tipo de impureza, responsable de dicho máximo de absorción. Esta posibilidad es confirmada por cromatografía de gases, donde se observaron varios picos, concluyendo que la sustancia cs1 es efectivamente una mezcla. Se tomó espectro de masas al pico de mayor abundancia en el cromatograma de gases, denominado compuesto CB1-A, con tiempo de retención de 55,233 minutos. El espectro obtenido (figura 1), presenta un pico molecular bajo a m/z 312 (M), señal de que la estructura analizada presenta una cadena alifática larga, lo que se confirma por las señales entre m/z 103 y 257, debidas a una sucesiva fragmentación de dicha cadena. Por otro lado, los picos de m/z 297 (M -15), 281 (M-31) y 269 (M-15-28), son característicos de anillos aromáticos metoxilados (Fuentes, 1987), lo que confirma la presencia de un grupo metoxilo adyacente al anillo presente en la estructura, el cual es de tipo aromático, de acuerdo con las señales a m/z 91 y 77.
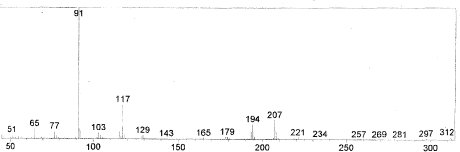
Figura 1. Espectro de masas del compuesto CB1-A; se observan picos a m/z = 312 (ión molecular), 297, 281, 269 (grupo metoxilo unido a anillo aromático), 257 - 103 (fragmentaciones de cadena alifática), 91 y 77 (anillo aromático unido a cadena alifática).
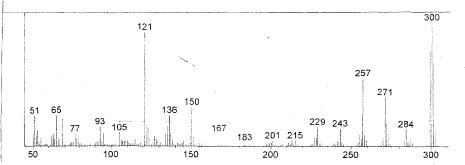
Figura 2. Espectro de masas de la sustancia CB2; se observan, entre otros, picos a m/z = 300 (ión moleuclar), 284, 271 y 257 (grupo metoxilo unido a anillo aromático), así como a m/z = 150 y 121 (atribuibles a sistema de tipo flavon.
La sustancia CB2 se obtuvo a partir de la fracción de diclorometano del extracto total de hojas, posteriormente al lavado de clorofila y separación del sólido así obtenido por cromatografía en columna, eluída con acetona y recristalizada en metanol caliente. Se trata de un sólido amarillo, con punto de fusión de 236 ± 2°C. Se realizó la prueba de Shinoda (Bilbao, 1997), la cual dio resultado positivo, lo cual indica una estructura flavonoide.
Tabla 1. Máximos de absorción observados en la región uy de la sustancia cb2 y comportamiento tras adición de reactivos de desplazamiento.
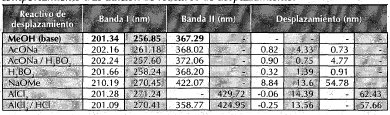
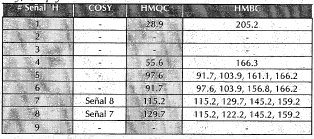
Se aplicó espectroscopía de uv en la región de 200-500 nm a la sustancia disuelta en metanol, empleando reactivos de desplazamiento para flavonoides (Mabry et al., 1970), observando comportamiento de tipo flavonol (tabla 1). Se tomó también un espectro de masas por impacto electrónico de la sustancia (figura 2), en el cual se observan, además de la señal atribuida al ión molecular a m/z 300, se observan picos a m/z 284 (M-15), 271 (M-31) y 257 (M-15-28), característicos de los grupos metoxilo unidos anillos aromáticos (Fuentes, 1987), además picos a m/z 121 y 150, característicos de los sistemas del tipo flavonol (Audier, 1966). Se realizaron finalmente análisis de 1 H RMN (tabla 2) y correlaciones bidimensionales COSY, HMQC y HMBC (tabla 3).
La presencia del grupo metoxilo, la cadena alifática y el anillo aromático, así como el peso molecular de 312, permiten determinar como posible fórmula molecular del compuesto CB1-A C22 H32 O, con un peso de 312,489. Al tener esta fórmula un índice de deficiencia de hidrógeno (IDH) de siete, se atribuyen cuatro instauraciones al anillo aromático y tres a la cadena alifática, proponiendo que posiblemente se trate del grupo farnesilo, de tipo sesquiterpénico. Sin embargo, esta suposición no puede confirmarse debido a la gran cantidad de fragmentaciones y reordenamientos que presentan los hidrocarburos con varias instauraciones, lo que hace más dificil su análisis por Espectrometría de Masas (Fuentes, 1987), tampoco puede establecerse la posición (orto, meta o para) de los dos sustituyentes en el anillo bencénico. No obstante se propone una ruta parcial de fragmentación para la estructura propuesta (figura 3), en la cual los fragmentos obtenidos coinciden con las señales observadas en el espectro de masas.
Tabla 2. Asignación de las señales observadas en el espectro 1h rmn de la sustancia cb2
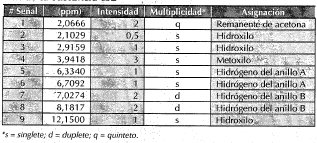
Tabla 3. Correlaciones observadas en los espectros bidimensionales cosy, hmqc y hmbc de la sustancia cb2
La información obtenida por las técnicas anteriormente mencionadas permite proponer para la sustancia CB2 la estructura del 5 ,4'-dihidroxi-7-metoxiflavonol, de fórmula molecular C16 H12 O6 y peso molecular de 300.263, ya que cumple con el comportamiento observado en espectroscopía de uv, el peso del ión molecular en espectrometría de masas y las señales observadas en espectroscopia RMN. Se determinaron para esta molécula sus fragmentaciones en espectrometría de masas (figura 4), las cuales coinciden con las observadas en el correspondiente espectro.
Se simularon por computador los espectros de RMN 1H y 13C de la molécula propuesta, los cuales presentaron gran similitud con los observados para la sustancia cB2. Los valores obtenidos en el espectro simulado de 13C se compararon con los observados en las correlaciones bidimensionales HMQC y HMBC, obteniendo total correspondencia con los datos observados, así como dos nuevas señales, a 135.90 y 175.95 ppm, originadas por los carbonos 3 y 4 de la estructura. Tomando los valores obtenidos en los espectros simulados, fueron comparadas las correlaciones existentes en la molécula propuesta con las observadas en los espectros bidimensionales. Como resultado de esta comparación se establece que la estructura planteada para la sustancia CB2 es correcta.
Finalmente, se descarta la posibilidad de que alguno de los metabolitos aislados sea el responsable de la actividad antimicrobiana observada, teniendo en cuenta los resultados negativos de la evaluación de su actividad contra el microorganismo Staphylococcus aureus.
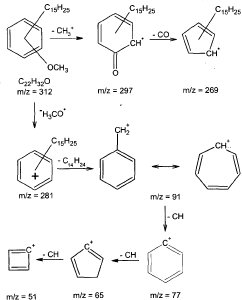
Figura 3. Ruta parcial de fragmentación propuesta para el compuesto CB 1-A. Se muestran rupturas relacionadas principalmente con pérdida del grupo metoxilo, dado que no se fue posible establecer una estructura definida para la cadena alifática.
Conclusiones
La evaluación antimicrobiana de los extractos totales y sus respectivas fracciones por el método de difusión en gel por perforación en placa no mostró inhibición para cepas de Escherichia coli, Pseudomonas aeruginosa y Candida albicans. Para la bacteria Staphylococcus aureus se observó actividad en los extractos totales y fracciones de hojas y flores en el primer ensayo realizado, datos que fueron refutados por los resultados del segundo ensayo, a concentraciones inferiores. No se encontró el compuesto o grupo de compuestos responsables de la actividad observada teniendo en cuenta que los compuestos CB1-A Y CB2, aislados por medio de técnicas cromatográficas e identificados a través de técnicas espectroscópicas, no presentaron actividad.
Agradecimientos
Los autores desean agradecer la ayuda y asesoría brindada por Antonio Guzmán, del Laboratorio de Química de la Universidad Distrital; Coralia Osorio, del Laboratorio de Química de Aromas de la Universidad Nacional de Colombia; Milton Crosby, del Laboratorio de Microbiología de la Facultad de Farmacia de la Universidad Nacional de Colombia; y al personal del Laboratorio de Resonancia Magnética Nuclear de la Universidad Nacional de Colombia.
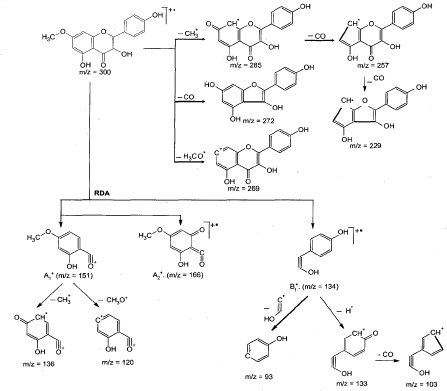
Figura 4. Fragmentaciones propuestas para la sustancia cb2 en espectrometría de masas. Se observan además de la ruptura Retro Diels-Alder (rda), característica del núcleo flavonoide, pérdidas consecutivas de grupo metilo, metoxilo y carbonilo.
Bibliografía
- AHMED A., WHITTEMORE A., MABRY T. 1985. "A Heliangolide From Chromolaena Glaberrima" en Phytochemistry. Vol. 24. No 3. p.605-606.
- AUDIER H. "Étude des composes flavoniques par Spectrométrie de masse" en Bulletin de la Société Chimique de France. No. 9, 1966.
- BAEZ D., RIOS C., CRESCENTE O., CASERTA, A. 1998. "Antibacterial and chemical evaluation of Chromolaena moritziana" en Journal of Etnopharmacology. No. 59. p.203-208.
- BECERRA P. 1992. Estudio fitoquimico de la Chromolaena leivensis y su actividad antibacteriana. Bogotá, Pontificia Universidad Javeriana, Facultad de Ciencias. BILBAO M. R. 1997. Análisis Fitoquímico Preliminar. Armenia, Universidad del Quindío.
- BOHLMANN F., ZDERO C., FIEDLER L., KING R., ROBINSON H. 1981. "A Labdane Derivative From Chromolaena Collina And A P-Hydroxyacetophenone Derivative From Stomatanthes Corumbensis'; en Phytochemistry. Vol. 20. No 5. p.1141-1143.
- BOHLMANN E, GUPTA R., KING R., ROBINSON H. 1981. "Prostaglandin-Like Fatty Acid Derivative From Chromolaena Morii" en Phytochemistry. Vol. 20. No 6. p. 1417-1418.
- BOHLMANN E, BORTHAKUR N., KING R., ROBINSON H. 1982. "Further Prostaglandin-Like Fatty Acids From Chromolaena Morii" en Phytochemistry. Vol. 21. No 1. p.125-127.
- BOHLMANN F., SING P., JAKUPOVIC J., KINGR., ROBINSON H. 1982. " Three Cadinene Derivatives And A Prostaglandin-Like Acid From Chromolaena Species" en Phytochemistry. Vol. 21. No 2. p.371-374.
- BILLER A., BOPPRE M., WITTE L., HARTMANN T. 1994. "Pyrrolizidine alkaloids in Chromolaena odorata. Chemical and chemoecological aspects", en, Phytochemistry. Vol. 35. No 3. p.615-619.
- CASTILLO G., JAKUPOVIC J., BOHLMANN E, KING R., ROBINSON H. 1989. "Ent- clerodane derivatives from Chrmolaena connivens'; en Phytochemistry. Vol. 28. No 2. p.641 642.
- CARRERO., M. 1982. Aislamiento de los constituyentes con actividad antimicrobiana de Chromolaena tacotana (Klatt) King & Robinson. Universidad Nacional de Colombia. Facultad de ciencias. Bogotá, Departamento de Farmacia.
- ESPITIA, C. 1992. Química del género Chromolaena. Flavanonas de Chromolaena Tyleri. Bogotá, Universidad Nacional de Colombia. Facultad de Ciencias. Departamento de Química.
- FUENTES 0. 1987. Introducción a la espectrometría de masas. Bogotá, Universidad Nacional de Colombia, Facultad de Ciencias.
- GARCÍA., A. 1983. Aislamiento de las sustancias con actividad antimicrobiana de Chromolaena tequendamensis (Hieron) King er Robinson. Bogotá, Universidad Nacional de Colombia. Facultad de Ciencias. Departamento de Farmacia.
- GUTIERREZ A., CATALAN C., DIAZ J., HERZ W. 1995. "Sesquiterpene Lactones, A Labdane And Other Constituents Of Urolepis Hecatantha And Chromolaena Arnottiana", en Phytochemistry. Vol. 39. No 4. p. 795-800.
- IROBI O. N. 1992. "Activities Of Chromolaena Odorata (Compositae) Leaf Extract Against PsEUudomonas Aeruginosa And Streptococcus Faecalis" en Journal of Etnopharmacology. No. 37. p. 81-83.
- KLATT F. W. 1887. "Plantae lehmannianae in Guatemala, Costarica et Columbia collectae. Compositae. Botanische Jahrbücher für systematic", en pflanzengeschishte und pflanzengeographie. Vol. 8. p. 32-52.
- KING R., ROBINSON H., 1970. "Studies in the Eupatorieae (Compositae). The genus Chromolaena : en Phytologia. Vol. 20. No. 3. p. 196-209.
- MABRY T. J., MARKHAM K. R., THOMAS M. B. 1970. The Systematic Identification Of Flavonoids. Berlín, Springer-Verlag.
- SAYED N., MISKI M., WHITTERMORE A., MABRY T. 1988. "Sesquiterpene lactones from Chromolaena opadoclinia", en Phytochemistry.Vol. 27. No 10. p. 3312-3314.
Licencia
El (los) autor(es) al enviar su artículo a la Revista Científica certifica que su manuscrito no ha sido, ni será presentado ni publicado en ninguna otra revista científica.
Dentro de las políticas editoriales establecidas para la Revista Científica en ninguna etapa del proceso editorial se establecen costos, el envío de artículos, la edición, publicación y posterior descarga de los contenidos es de manera gratuita dado que la revista es una publicación académica sin ánimo de lucro.



