DOI:
https://doi.org/10.14483/23448350.17592Publicado:
09/30/2021Número:
Vol. 42 Núm. 3 (2021): Septiembre-Diciembre 2021Sección:
Ciencia y TecnologíaEstudio fitoquímico y evaluación de la capacidad antioxidante de flores de Senna spectabilis obtenidas en la región andina colombiana
Phytochemical Study and Evaluation of the Antioxidant Capacity of Senna spectabilis Flowers Obtained in the Colombian Andean Region
Palabras clave:
cafeína, fitoquímica, Senna spectabilis (es).Palabras clave:
Senna spectabilis, caffeine, phytochemistry (en).Descargas
Referencias
Abdelmadjide, S., Mounir, A., Atef, C., Nadia, Z., Neji, B. (2020). Phytochemical study, antioxidant and antimicrobial activities of flavonoids and diethyl ether extracts from leaves and seeds of medicinal plant of Algerian flora: Retama monosperma (L.) Boiss. Ponte International Scientific Researches Journal, 76(4). https://doi.org/10.21506/j.ponte.2020.4.4 DOI: https://doi.org/10.21506/j.ponte.2020.4.4
Acosta, M., González, M., Araque, M., Velazco, E., Khouri, N., Rojas, L., Usubillaga, A. (2003). Composición química de los aceites esenciales de ocimum basilicum L. var basilicum, O. basilicum L. var purpurenscens, O. gratissimum L., y O. tenuiflorum L., y su efecto antimicrobiano sobre bacterias multirresistentes de origen nosocomial. Revista de Facultad de Farmacia, 45(1), 19-74
Ancerewicz, J., Migliavacca, E., Carrupt, P. A., Testa, B., Brée, F., Zini, R., Tillement, J. P., Labidalle, S., Guyot, D., Chauvet-Monges, A. M., Crevat, A., Le Ridant, A. (1998). Structure-property relationship of trimetazidine derivatives and model compounds as potential antioxidants. Free Radic Biol Med., 25(1), 113-120. https://doi.org/10.1016/S0891-5849(98)00072-0 DOI: https://doi.org/10.1016/S0891-5849(98)00072-0
Ashok, D., Sarma, P. (1988). Chemical examination of flower buds of Cassia spectabilis DC. Indian journal chemical, Sect. B: Org. Chem. Incl. Medicina. Chem 27B 862
Barrese, Y., Hernández, M. E., García, O. (2005). Caracterización y estudio fitoquímico de Cassia alata L. Revista Cubana de Plantas Medicinales, 10(2), 1-8
Brand-Williams, W, Cuvelier, M. E., Berset, C. (1995). Use of a free radical method to evaluate antioxidant activity. LWT - Food Science and Technology, 28(1), 25-30 DOI: https://doi.org/10.1016/S0023-6438(95)80008-5
Cabral, E. (2010). Familia Fabaceae. Guía de Consultas Diversidad Vegetal. FaCENA (UNNE) Eudicotiledóneas Escenciales-Clado Rosides-Eurosides I-Fabales: Fabaceae. http://exa.unne.edu.ar/biologia/diversidadv/documentos/ANGIOSPERMAS/Rosideas/Eurosides%20I/3-Clado%20de%20los%20fijadores%20de%20Nitr%F3geno/2-Fabales/1-Fabaceae.pdf
Chaverri, C., Cicció, J. (2015). Leaf and flower essential oil compositions of Gliricidia sepium (Fabaceae) from Costa Rica. American Journal of Essential Oils and Natural Products, 2(3), 18-23
Chávez, R., Plaza, A., Lock, O. (1996). Antioxidantes de origen vegetal. Revista de Química, 10(1), 71-100
Fujiwara, G., Annies, V., de Oliveira, C., Lara, R., Gabriel, M., Betim, F., Nadal, J., Farago, P., Dias, J., Miguel, O., Miguel, M., Marques, F., Zanin, S. (2017). Evaluation of larvicidal activity and ecotoxicity of linalool, methyl cinnamate and methyl cinnamate/linalool in combination against Aedes aegypti. Ecotoxicology and Environmental Safety, 139, 238-244. https://doi.org/10.1016/j.ecoenv.2017.01.046 DOI: https://doi.org/10.1016/j.ecoenv.2017.01.046
Gebrelibanos, M., Asres, K., Veeresham, C. (2007). In vitro radical scavenging activity of the leaf and bark extracts of Senna singueana. Ethiopian Pharmaceutical Journal, 25(2), 77-84 DOI: https://doi.org/10.4314/epj.v25i2.35121
Jäger, S., Trojan, H., Kopp, T., Laszczyk, M., Scheffler, A. (2009). Pentacyclic triterpene distribution in various plants - Rich sources for a new group of multi-potent plant extract. Molecules, 14(6), 2016-2031. https://doi.org/10.3390/molecules14062016 DOI: https://doi.org/10.3390/molecules14062016
Karau, G. M. (2014). Antidiabetic activities of ethyl acetate and aqueous extracts of Pappea capensis, Senna spectabilis, Maytenus obscura, Ocimum americanum and Launaea cornuta. Nairobi, Kenia: Kenyatta University
Mallaiah, K., Kumar, A., Sarma, P., Srimannarayana, G. (1984). Isolation and antiallergic activity of γ-pyrones from the flowers of Cassia spectabilis. Current Science, 53(1), 33-34
Martínez, M., Ocampo, D., Galvis, J., Valencia, A. (2011). Actividad antibacteriana y citotoxicidad in vivo de extractos etanólicos de Bahinia variegata L. (Fabaceae). Revista Cubana Plantas Medicinales, 16(4), 313-323
Matulevich-Peláez, J., Castrillón-Cardona, W., y Chitiva-Chivita , L. (2017). Estudio fitoquímico y evaluación de la capacidad antioxidante de hojas de Senna reticulata obtenidas en la región andina colombiana. Científica, 29(2), 149-163. DOI: https://doi.org/10.14483//udistrital.jour.RC.2017.29.a4
Minciencias. (2016). Colombia, el segundo país más biodiverso del mundo. https://minciencias.gov.co/sala_de_prensa/colombia-el-segundo-pais-mas-biodiverso-del-mundo
Molyneux, P. (2004). The use of the stable radical Diphenylpicrylhydrazyl (DPPH) for estimating antioxidant activity. Songklanakarin Journal of Science and Technology, 26(2), 211-219.
Morales, M., Bachiller, L. (2007). Revisión de la literatura sobre la toxicidad del sen. Revista de Fitoterapia, 7(1), 31-41.
Murugan, K., Aarthi, N., Kovendan, K., Panneerserlvam, C., Chandramohan, B., Mahesh, P., Amerasan, D., Paulpandi, M., Chandirasekar, R., Dinesh, D., Suresh, U., Subramanian, J., Higuchi, A., Alarfaj, A., Nicoletti, M., Mehlhorn, H., Benelli, G. (2015). Mosquitocidal and antiplasmodial activity of Senna occidentalis (Cassiae) and Ocimum basilicum (Lamiaceae) from Maruthamalai hills against Anopheles stephensi and Plasmodium falciparum. Parasitology Research, 114(10), 3657-3664. https://doi.org/10.1007/s00436-015-4593-x DOI: https://doi.org/10.1007/s00436-015-4593-x
Ojeda, Á., Obispo, N., Gil, J., Matute, I. (2015). Perfil cualitativo de metabolitos secundarios en la fracción comestible de especies leñosas seleccionadas por vacunos en un bosque semicaducifolio. Pastos y Forrajes, 38(1), 64-72
Pino, S., Prieto, S., Pérez, M., Molina, J. (2004). Género Erythrina: fuente de metabolitos secundarios con actividad biológica. Acta Farmacéutica Bonaerense, 23(2), 252-258
Prakash, A. (2001). Antioxidant activity. Medallion Laboratories Analytical Progress, 19(2), 1-6
Rižner, A., Hadolin, M., Knez, Ž., Baumann, D. (2000). Comparison of antioxidative and synergistic effects of rosemary extract with α-tocopherol, ascorbyl palmitate and citric acid in sunflower oil. Food Chemistry, 71(2), 229-333 DOI: https://doi.org/10.1016/S0308-8146(00)00161-8
Sanabria, A. (1999). Colección de especies vegetales y análisis fitoquímico preliminar. Bogotá: Universidad Nacional de Colombia
Sangetha, S., Zuraini, Z., Suryani, S., Sasidharan, S. (2009). In situ TEM and SEM studies on the antimicrobial activity and prevention of Candida albicans biofilm by Cassia spectabilis extract. Micron, 40(4), 439-443. https://doi.org/10.1016/j.micron.2009.01.003 DOI: https://doi.org/10.1016/j.micron.2009.01.003
Seigler, D. (2002). Plant Secondary Metabolism. Dordrecht, Países Bajos: Kluwer Academic Publishers
Selegato, D., Monteiro, A., Vieira, N., Cardoso, P., Pavani, V., Bolzani, V., Castro-Gamboa, I. (2017). Update: Biological and chemical aspects of Senna spectabilis. Journal of the Brazilian Chemical Society, 28(3), 415-426. https://doi.org/10.21577/0103-5053.20160322 DOI: https://doi.org/10.21577/0103-5053.20160322
Singh, S., Singh, S., Yadav, A. (2013). A review on Cassia species: Pharmacological, traditional and medicinal aspects in various countries. American Journal of Phytomedicine and Clinical Therapeutics 1, 291-312
Tai, M., Zhang, J., Song, S., Miao, R., Liu, S., Pang, Q., Wu, Q., Liu, C. (2015). Protective effects of luteolin against acetaminophen-induced acute liver failure in mouse. International Immunopharmacology, 27(1), 164-170. https://doi.org/10.1016/j.intimp.2015.05.009 DOI: https://doi.org/10.1016/j.intimp.2015.05.009
Tava, A., Pecceti, L., Ricci, M., Pagnotta, M., Russi, L. (2007). Volatile compounds from leaves and flowers of Bituminaria bituminosa (L.) Stirt. (Fabaceae) from Italy. Flavour and Fragance Journal, 22(5), 363-370. https://doi.org/10.1002/ffj.1806 DOI: https://doi.org/10.1002/ffj.1806
Tavares, C., Sakata, R. (2012). Caffeine in the treatment of pain. Revista Brasileira de Anestesiología, 62(3), 387-401 DOI: https://doi.org/10.1016/S0034-7094(12)70139-3
Torrenegra, R., Jiménez, R. (2002). Estudio fitoquimico de hojas y flores de Senna bicapsularis (L) Roxburgh var. bicapsularis. Actualidades Biológicas, 24(76), 69-74
Valiente, R., Torrenegra, R. (2003). Estudio fitoquímico de las raíces y frutos de Senna bicapsularis (L) Roxburgh var. bicapsularis. Actualidades Biológicas, 25(79), 113-118
Vásquez Cerón, A., Buitrago Castro, A. C. (Dirección editorial) (2011). El gran libro de los páramos. Colombia: Instituto de Investigación de Recursos Biológicos Alexander von Humboldt
Viegas, C., Bolzani, V., Furlan, M., Furlan, M., Barreiro, E., Young, M., Tomazela, D., Eberlin M. (2004). Further bioactive piperidine alkaloids from the flowers and green fruits of Cassia spectabilis. Journal of Natural Products, 67(5), 908-910. https://doi.org/10.1021/np0303963 DOI: https://doi.org/10.1021/np0303963
Viegas, C., Pivatto, M., de Rezende, A., Hamerski, L., Siqueira, D., da Silva, V. (2013). (-)-7-hidroxicassine: A new 2,6-dialkylpiperidin-3-ol alkaloid and other constituents isolated from flowers and fruits of Senna spectabilis (Fabaceae). Journal of the Brazilian Chemical Society, 24(2), 230-235. https://doi.org/10.5935/0103-5053.20130029 DOI: https://doi.org/10.1590/S0103-50532013000200008
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Recibido: de mayo de 2021; Aceptado: de julio de 2021
Resumen
El presente trabajo muestra los resultados del estudio fitoquímico de las flores de Senna spectabilis y la evaluación de su capacidad antioxidante, para esto se recolectó el material vegetal en el municipio de Guaduas (Cundinamarca) y se identificó a través del Herbario Nacional Colombiano con el número de colección COL 600165; tras procesos de extracción por maceración en frío se obtuvieron 100 g de extracto etanólico, el cual fue fraccionado con solventes de polaridad creciente, obteniéndose fracciones de heptano, diclorometano y acetato de etilo, estas fueron sometidas a procesos de separación por cromatografía en capa fina (CCF) y cromatografía en columna (CC), la identificación tentativa de las mezclas obtenidas y los compuestos aislados se llevó a cabo mediante cromatografía de gases acoplada a espectrometría de masas (CG-EM), permitiendo identificar tres mezclas conformadas por compuestos tipo éster, cetona, antraquinona, monoterpenoide y un derivado del ácido cinámico, y los compuestos cinamato de metilo y cafeína. Se estudió la capacidad antioxidante de las fracciones obtenidas y el extracto etanólico por el método DPPH, además se realizó la medición de fenoles totales y la cuantificación de flavonoides. Los resultados indican que la fracción de diclorometano exhibió un porcentaje de inhibición superior a 30 % y que la mayor concentración de fenoles y flavonoides se encuentra en esta misma fracción. De esta manera, el trabajo dio un aporte químico (aislamiento de cinamato de metilo y cafeína, y tres mezclas) y un aporte biológico, tras identificar a la fracción de diclorometano obtenida de las flores de la especie como la que mayor cantidad de sustancias con capacidad antioxidante tiene respecto a otras fracciones y otros extractos.
Palabras clave:
cafeína, fitoquímica, Senna spectabilis..Abstract
The present work shows the results of the phytochemical study of Senna spectabilis flowers and the evaluation of their antioxidant capacity, for this, the plant material was collected in the municipality of Guaduas (Cundinamarca) and identified through the Colombian National Herbarium with the number collection COL 600165, after extraction processes by cold maceration, 100 g of ethanolic extract were obtained, which was fractionated with solvents of increasing polarity, obtaining fractions of heptane, dichloromethane and ethyl acetate, then they were subjected to separation processes by Thin layer chromatography (TLC) and column chromatography (CC), the tentative identification of the obtained mixtures and isolated compounds was carried out by gas chromatography coupled to mass spectrometry (GC-MS), allowing the identification of three mixtures made up of ester, ketone, anthraquinone, monoterpenoid and a derivative of cinnamic acid compounds; and the compounds methyl cinnamate and caffeine. The antioxidant capacity of the obtained fractions and the ethanolic extract were studied by the DPPH method, in addition, the measurement of total phenols and the quantification of flavonoids were carried out. The results indicate that the dichloromethane fraction exhibited an inhibition percentage greater than 30 % and that the highest concentration of phenols and flavonoids is found in this same fraction. In this way, the work gave a chemical contribution (isolation of methyl cinnamate and caffeine, and three mixtures) and a biological contribution after identifying the fraction of dichloromethane obtained from the flowers of the species as the one with the greatest amount of substances with antioxidant capacity. has respect to the other fractions and extracts.
Keywords:
caffeine, phytochemistry, Senna spectabilis..Resumo
O presente trabalho apresenta os resultados do estudo fitoquímico de flores de Senna spectabilis e a avaliação de sua capacidade antioxidante, para isso, o material vegetal foi coletado no município de Guaduas (Cundinamarca) e identificado através do Herbário Nacional da Colômbia com a coleção numérica COL 600165, após processos de extração por maceração a frio, foram obtidos 100 g de extrato etanólico, o qual foi fracionado com solventes de polaridade crescente, obtendo-se as frações de heptano, diclorometano e acetato de etila, a seguir foram submetidos a processos de separação por cromatografia em camada delgada (CCD) e cromatografia em coluna (CC), a identificação tentativa das misturas obtidas e dos compostos isolados foi realizada por cromatografia gasosa acoplada a espectrometria de massa (GC-MS), permitindo a identificação de três misturas constituídas de éster, cetona, antraquinona, monoterpenóide e um derivado de compostos de ácido cinâmico; e os compostos cinamato de metilo e cafeína. A capacidade antioxidante das frações obtidas e do extrato etanólico foram estudadas pelo método DPPH, além disso, foi realizada a dosagem de fenóis totais e a quantificação de flavonóides. Os resultados indicam que a fração diclorometano exibiu um percentual de inibição superior a 30 % e que a maior concentração de fenóis e flavonóides é encontrada nesta mesma fração. Desta forma, o trabalho deu uma contribuição química (isolamento de cinamato de metila e cafeína, e três misturas) e biológica após identificar a fração de diclorometano obtida das flores da espécie como aquela com maior quantidade de substâncias com antioxidante. capacidade. tem relação com as outras frações e extratos.
Palavras-chaves:
cafeína, fitoquímica, Senna spectabilis..Introducción
Colombia es reconocido mundialmente como el segundo país megadiverso (Minciencias, 2016), debido a factores como la posición geográfica, los accidentes geográficos (lo que influye en la variedad de pisos térmicos existentes) y la ausencia de estaciones (que facilita el crecimiento y la conservación de distintas especies de flora y fauna).
En lo que concierne a la riqueza vegetal, Colombia con 0,7 % del área continental contiene 10 % de la diversidad total de las plantas angiospermas (Vásquez y Buitrago, 2011), lo que convierte a este tipo de plantas en objeto de investigación, especialmente las que presentan actividad de tipo medicinal.
Teniendo en cuenta lo anterior, las especies vegetales que conforman la familia Fabaceae están distribuidas mayoritariamente en Suramérica y Centroamérica (Cabral, 2010). La especie vegetal Senna spectabilis (Fabaceae) posee un gran valor medicinal, razón por la cual se ha empleado para tratar dolores de cabeza, inflamaciones, gripes, heridas, entre otros usos etnobotánicos (Viegas et al. 2004). Tradicionalmente es conocida como “flor amarillo”, “vainillo” o “monedero” en Colombia, y se encuentra distribuida en los departamentos de Antioquia, Boyacá, Caldas, Cauca, Cesar, Caquetá, Casanare, Cundinamarca, Guajira, Huila, Magdalena, Meta, Nariño, Norte de Santander, Quindío, Risaralda, Santander, Tolima y Valle (Catalogo de la Biodiversidad Colombiana, 2009).
Algunas de las especies vegetales que conforman a la familia Fabaceae son reconocidas por tener compuestos químicos que presentan actividad biológica, estos se encuentran presentes en la corteza, las hojas y las raíces principalmente; en esta familia se han reportado y caracterizado químicamente metabolitos secundarios tales como alcaloides, flavonoides y polifenoles (Pino et al., 2004). Los estudios químicos y biológicos muestran que la bioactividad de estos metabolitos secundarios está asociada a efectos antidiabéticos, antimicrobianos, antiinflamatorios y anticancerígenos (Ojeda et al., 2015).
En el género Senna se puede destacar la presencia de metabolitos tales como esteroides, quinonas y senósidos, que se encuentran principalmente en hojas y tallos (Torrenegra y Jiménez, 2002). Paralelamente, los estudios biológicos en el género Senna han demostrado numerosas bioactividades, de las cuales se pueden destacar antimicrobiana, hematológica, antiinflamatoria, antiproliferativa y anticancerígena (Morales y Bachiller, 2007). En la especie Senna spectabilis (especialmente en corteza, hojas y raíces) se han determinado numerosas sustancias químicas con bioactividad antifúngica, antibacterial, antioxidante, anticonvulsiva y sedante (Sangetha et al., 2009). De esta especie vegetal se han caracterizado y reportado alcaloides, flavonoides y polifenoles mayoritariamente (Viegas et al., 2013). Por otra parte, la especie Senna spectabilis ha presentado estudios en hojas, tallos y raíces, en los cuales ha presentado una diversidad fitoquímica interesante (Selegato et al., 2017).
Teniendo presente que Colombia es uno de los países en los que Senna spectabilis se distribuye, este trabajo de investigación se orientó a realizar un aporte al conocimiento químico y biológico de esta especie, por medio del estudio fitoquímico de sus metabolitos fijos y la evaluación de su capacidad antioxidante.
Metodología
Recolección del material vegetal
La especie fue obtenida en el municipio de Guaduas, Cundinamarca (5° 05’ 16,4” N 74° 36’ 54,3” O). Se recolectaron 3773 g de flores frescas, las cuales fueron secadas a temperatura ambiente de Bogotá (18 °C y humedad relativa de 77 %); una muestra testigo se envió al Herbario Nacional de Colombia para su determinación taxonómica, la cual fue clasificada bajo el código COL 600165 como Senna spectabilis.
Obtención de extractos y fracciones
Las flores secas y trituradas de Senna spectabilis (2000 g) fueron sometidas a una extracción con etanol al 96 % a temperatura ambiente por el método de maceración en frío. El extracto obtenido (E.EtOH.Ss.F) se filtró y concentró a presión reducida de 120 mbar y a una temperatura de 40 °C obteniendo 100 g de extracto total, luego fue floculado en una proporción 1:1 EtOH/H2O para continuar con el fraccionamiento. Se realizaron pruebas químicas de precipitación y coloración para determinar la posible presencia de metabolitos secundarios mayoritarios en la muestra (Sanabria, 1999).
100 g de E.EtOH.Ss.F fueron sometidos a un proceso de extracción líquido-líquido continuo con solventes de polaridad creciente, obteniéndose las fracciones de heptano (Fx.Hept.Ss.F 0,85 g, 0,85 %), diclorometano (Fx.DCM.Ss.F 14,9 g, 14,9 %), acetato de etilo (Fx.AcOEt.Ss.F 0,55 g, 0,55 %) y un residuo hidroalcohólico (Fx.Hidroalcohólico.Ss.F, 83.7 g, 83,7 %). Cada una de estas fracciones fue sometida a separaciones continuas a través de CC y CCF para finalmente aislar dos compuestos y tres mezclas.
A 0,6 g de la fracción de (Fx.Hept.Ss.F) después de una CC, utilizando como fase móvil heptano: AcOEt en una proporción 8:2, se obtuvieron 92 fracciones, las cuales después del monitoreo por CCF fueron reunidas en 9 subfracciones. La fracción número 2 (Fx.Hept.Ss.F2) produjo 0,18 g de un sólido color naranja denominado Mezcla SsF1, el cual fue analizado por CG-EM. En la fracción número 3 (Fx.Hept.Ss.F3) se obtuvieron 0,096 g de un sólido naranja denominado Mezcla SsF2, el cual fue analizado por CG-EM.
1,5 g de la fracción de diclorometano (Fx.DCM.Ss.F) se fraccionaron por CC, utilizando como fase móvil DCM: MeOH en una proporción 9:1, obteniendo 70 fracciones, las cuales después del monitoreo por CCF fueron reunidas en 12 subfracciones. En la fracción 1 (Fx.DCM.Ss.F1) se obtuvieron 0,040 g de un sólido color amarillo denominado Mezcla SsF3, el cual fue analizado por CG-EM. En la fracción 8 (Fx.DCM.Ss.F8) se obtuvieron 0,146 g, los cuales fueron nuevamente fraccionados por CC utilizando como fase móvil AcOIs: MeOH en una proporción de 9,8:0,2, obteniendo 128 fracciones, las cuales después del monitoreo por CCF fueron reunidas en 15 subfracciones. En la fracción número 10 (Fx.DCM.Ss.F8.SF10) se obtuvieron 3,3 mg de un sólido color blanco denominado Compuesto SsF4, el cual fue analizado por CG-EM.
0,4 g de la fracción de acetato de etilo (Fx.AcOEt.Ss.F) se fraccionaron por CC utilizando como fase móvil AcOEt - DCM en proporciones 9.5:0.5, obteniendo 209 fracciones reunidas en 27 subfracciones. Posteriormente, en la fracción 4 (Fx.AcOEt.Ss.F4) se obtuvieron 0,9 mg de un sólido blanco denominado Compuesto SsF5, el cual fue analizado por CG-EM.
Técnicas para la elucidación estructural y la caracterización de los compuestos aislados
Para determinar tentativamente la mezcla y los compuestos obtenidos se utilizó un cromatógrafo de gases con detector selectivo de masas Shimadzu QP2010 plus, ubicado en el laboratorio de química de la Universidad Distrital Francisco José de Caldas. La separación se realizó en una columna capilar SHRXi-5MS de 30 m de longitud x 0,25 mm x 0,25 μm con una inyección en modo Split (10:1); el gas de arrastre utilizado fue helio (grado 5,0) con flujo constante de 1,2mL/min. La programación de la temperatura del horno fue de 50 °C (2 min) con incrementos de 15 °C/min hasta 200 °C (2 min), finalmente se incrementaron 10 °C/min hasta 300 °C (10 min) para un tiempo total de análisis de 34 min; la temperatura de la línea de transferencia fue de 275 °C y la de la cámara de ionización de 230 °C. Los espectros de masas de los compuestos aislados fueron tomados en un equipo Shimadzu QP2010 plus dotado con una sonda de inserción directa y un analizador de masas cuadrupolar, utilizando un modo de ionización electrónica (IE) a 70 eV y una temperatura de la cámara de ionización de 230 ºC.
Evaluación de la capacidad antioxidante
Para la evaluación de la capacidad antioxidante se utilizó el extracto etanólico (E.EtOH.Ss.F) y las fracciones de heptano (Fx.Hept.Ss.F), diclorometano (Fx.DCM.Ss.F) y acetato de etilo (Fx.AcOEt.Ss.F).
El ensayo se realizó utilizando 10 mg del radical DPPH disueltos en 10 mL de metanol grado analítico y mediante su lectura en un espectrofotómetro FLUOstar Optima BMG Labtech, se estableció la absorbancia entre 0.7- 0.9 a una longitud de onda de 516 nm, en donde el radical tiene su máximo pico de absorción y por ende un comportamiento lineal de las absorbancias al mezclarse con el extracto, lo que permite que los datos sean más precisos (Molyneux, 2004). Cada extracto se diluyó en diferentes volúmenes de etanol obteniendo concentraciones entre 50 y 5.000 ppm.
A 25 μL de cada fracción y extracto de la especie Senna spectabilis se agregaron 275 μL de solución DPPH y se leyó su absorbancia a 520 nm; las absorbancias se registraron teniendo en cuenta intervalos de tres min ente 0 y 120 min respectivamente. Para conocer la capacidad antioxidante de los tratamientos ensayados se elaboraron curvas estándar de ácido ascórbico y un antioxidante sintético de referencia (Trolox). (Metodología modificada de Brand-Williams et al., 1995)
Cuantificación de compuestos fenólicos y flavonoides
La cuantificación de compuestos fenólicos se realizó preparando una curva de calibración con ácido gálico en agua desionizada con concentraciones de entre 50 y 500 mg L-1 a partir de un stock de ácido gálico de 1.000 mg L-1. A 125 µL de los patrones, blanco y muestras (diluidas a 1.000 mg L-1) se agregaron 200 µL de agua destilada y 25 µL del reactivo Folin-Ciocalteu, se dejó incubar por 6 min a temperatura ambiente para después adicionar 12 µL de carbonato de sodio al 5 % y se incubó por 30 min a 42 °C para favorecer la reacción; posteriormente se realizaron las lecturas de absorbancia a 740 nm en intervalos de 10 min durante 2 h.
Para la cuantificación de flavonoides se preparó una curva de calibración de quercetina en etanol al 96 % a concentraciones entre 1 y 50 mg L-1 a partir de un stock de 1.000 mg L-1 de quercetina. A 125 µL de los patrones, blanco y muestras (diluidas a 1.000 mg L-1) se agregaron y se mezclaron 125 µL de cloruro de aluminio al 2 %, se incubó por 30 min a 42 °C para favorecer la reacción y seguido a esto se realizó la lectura de absorbancias a 420 nm en intervalos de 10 min por 2 h.
Resultados
Análisis fitoquímico preliminar
Los resultados del análisis fitoquímico preliminar de la especie Senna spectabilis (Tabla 1) dan indicios de la presencia de metabolitos secundarios como taninos, alcaloides, terpenos y probablemente flavonoides (solo una de las tres pruebas dio resultado positivo). Por el contrario, no presenta cumarinas, saponinas y carotenoides, esto coincide con reportes químicos de especies de la familia Fabaceae como Bauhinia purpurea, Bauhinia variegata (Martínez et al., 2011), Senna reticulata (Matulevich-Peláez, 2017), Senna alata y Senna bicapsularis que no reportan este tipo de metabolitos secundarios (Barrese et al., 2005).
(+) Prueba positiva; (-) Prueba negativa
Tabla 1: Análisis fitoquímico preliminar para flores de Senna spectabilis
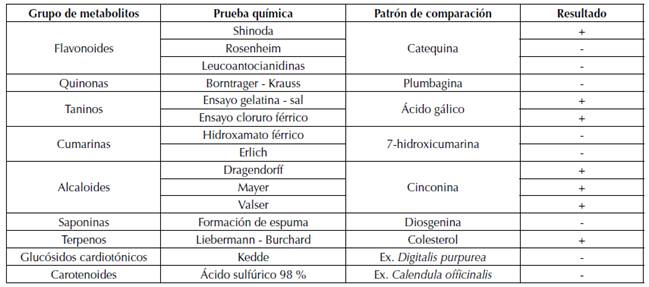
Para la especie Senna spectabilis los resultados son consecuentes, debido a que presenta flavonoides (Singh et al., 2013), terpenos (Mallaiah et al., 1984; Ashok y Sarma, 1988) y alcaloides aislados en diferentes órganos de la especie vegetal (Viegas et al., 2004; Jäger et al. 2009; Viegas et al. 2013).
Metabolitos secundarios aislados
La separación y purificación de las fracciones de heptano, diclorometano y acetato de etilo obtenidas a partir del extracto etanólico total de las flores de la especie Senna spectabilis permitió la identificación tentativa de tres mezclas y dos compuestos: la primera mezcla conformada por dos ésteres (9-oxo-nonanoato de etilo y palmitato de etilo) y una cetona (pentadecan-2-ona) fue designada como Mezcla SsF1. En la mezcla designada como SsF2 se encontró nuevamente al palmitato de etilo junto con una antraquinona (1,8-dihidroxi-3-metil-antraquinona). La tercera mezcla conformada por un monoterpeno oxigenado (Linalool) y un derivado de ácido cinámico (cinamato de metilo) fue designada como Mezcla SsF3. Los compuestos aislados y designados como SsF4 y SsF5 fueron identificados como cinamato de metilo y cafeína respectivamente.
Composición de la mezcla SsF1
La mezcla SsF1 (18,3 mg) se obtuvo como un sólido color naranja a partir de la fracción de heptano, la cual en el monitoreo por CCF presentó manchas naranjas, rojas y azules en el revelado con luz ultravioleta a 366 nm. Por otra parte, la corriente iónica total (TIC) del análisis por CG-EM arrojó tres señales significativas de alta intensidad con tiempos de retención de 11,273 min, 15,163 min y 16,192 min. La comparación de los espectros de masas de las respectivas señales con los de la librería NIST-08 indican que corresponden al 9-oxo-nonanoato de etilo, palmitato de etilo y pentadecan-2-ona, con porcentajes de coincidencia de 94 %, 97 % y 94 % respectivamente. El compuesto 9-oxo-nonanoato de etilo se reporta por primera vez en las flores de la especie vegetal objeto de estudio. La pentadecan-2-ona ha sido reportada en la familia Fabaceae (Chaverri y Cicció, 2015), particularmente en las hojas y flores de la especie vegetal Gliricidia sepium, la cual se emplea como expectorante y febrífugo, además como antimalárico. El palmitato de etilo ha sido reportado en la familia Fabaceae, particularmente en la especie vegetal Retama monosperma, especie que demostró tener alta capacidad antioxidante específicamente en la fracción de acetato de etilo (Abdelmadjide et al., 2020).
Composición de la mezcla SsF2
La mezcla SsF2 (8,1 mg) se obtuvo como un sólido de color naranja también obtenido de la fracción de heptano, la cual en el monitoreo por CCF presentó manchas naranjas y amarillas en el revelado con luz ultravioleta a 366 nm. La corriente iónica total (TIC) del análisis por CG-EM arrojó dos señales significativas de alta intensidad en tiempos de retención de 16.172 min y 19.896 min. La comparación de los espectros de masas de las respectivas señales con los de la librería NIST-08 fueron identificados como palmitato de etilo y 1,8-dihidroxi-3-metil-antraquinona con un porcentaje de coincidencia de 93 % y 97 % respectivamente. El palmitato de etilo había sido previamente encontrado en la mezcla SsF1; la 1,8-dihidroxi-3-metil-antraquinona ha sido reportada en la familia Fabaceae y en el género Senna (Valiente y Torrenegra, 2003), particularmente en la especie vegetal Senna bicapsularis (L) que posee ciertas características de color y pigmentación en las especies vegetales, debido a los dobles enlaces conjugados que presenta la estructura química de 1,8-dihidroxi-3-metil-antraquinona; además se ha demostrado su actividad antimicrobiana en las hojas y raíces (Torrenegra y Jiménez, 2002)
Composición de la mezcla SsF3
La mezcla SsF3 (40,7 mg) se obtuvo como un sólido amarillo a partir de la fracción de diclorometano, la cual en el monitoreo por CCF presentó manchas azules y verdes en el revelado con luz ultravioleta a 366 nm y en el revelado con Vainillina/H2SO4. Por otra parte, la corriente iónica total (TIC) del análisis por CG-EM arrojó dos señales en tiempos de retención de 7.480 min y 10.333 min, la comparación de los espectros de masas de las respectivas señales con los de la librería NIST-08 permitió establecer la presencia de Linalool y cinamato de metilo, con porcentajes de coincidencia del 98 % y 96 % respectivamente. El Linalool ha sido reportado en la familia Fabaceae, en el género Senna y está presente en la especie vegetal Senna spectabilis (Sangetha et al., 2009) que posee ciertas características en el aroma debido a varios compuestos volátiles presente en el aceite esencial y que entre los más destacados son compuestos terpénicos. El cinamato de metilo ha sido reportado en la familia Fabaceae (Tava et al., 2007) en las hojas y flores de la especie vegetal Bituminaria bituminosa, la cual ha mostrado actividad larvicida contra Aedes aegypti (Fujiwara et al., 2017). En el género Senna este compuesto ha sido identificado en la especie Senna occidentalis (Murugan et al., 2015), de la cual se destaca la actividad mosquitocida y antiplasmódica contra Anopheles stephensi y Plasmodium falciparum (Murugan et al., 2015)
Compuesto SsF4
El compuesto SsF4 (3,3 mg) se obtuvo como un sólido blanco a partir de la fracción de diclorometano. La corriente iónica total (TIC) del análisis por CG-EM exhibió una señal de alta intensidad en el tiempo de retención de 10.329 min. La comparación de los espectros de masas de la respectiva señal con los de la librería NIST-08 fue identificada como cinamato de metilo con un 97 % de coincidencia, este compuesto es reportado por primera vez en la especie vegetal; sin embargo, ha sido encontrado en otras especies vegetales como Ocimum basilicum L. var basilicum, O. basilicum L. var purpurenscens, O. gratissimum L. y O. tenuiflorum L. (Acosta et al., 2003).
Compuesto SsF5
El compuesto SsF5 (6,5 mg) se obtuvo como un sólido blanco cristalino a partir de la fracción de acetato de etilo, el cual en el monitoreo por CCF presentó una marcha negra intensa en el revelado con luz ultravioleta a 254 nm. Por otra parte, la corriente iónica total (TIC) del análisis por CG-EM arrojó una señal de alta intensidad en un tiempo de retención de 12.741 min, tras la comparación de los espectros de masas de la respectiva señal con los de la librería NIST-08 que fue identificada como cafeína con un 97 % de coincidencia. La cafeína ha sido reportada en la familia Aquifoliaceae, en las hojas de las especies Ilex paraguariensis e Ilex guayusa, que es usado en América del sur como brebaje para controlar afecciones estomacales (Seigler, 2002). En la especie Senna spectabilis se ha reportado la presencia de cafeína en el extracto etanólico de hojas, tallo y raíces (Selegato et al., 2017). Por otra parte, la cafeína posee una conocida y extensa historia como ayudante analgésico. Se han realizado estudios sobre la acción antinociceptiva intrínseca de la cafeína, en los que se establece que la dosis antinociceptiva se encuentra en el rango de 25 a 100 mg L-1 (Tavares y Sakata, 2012). La cafeína es reportada por primera vez para las flores de Senna spectabilis en Colombia.
Evaluación de la capacidad antioxidante
Para realizar la determinación de la capacidad antioxidante del extracto etanólico y las correspondientes fracciones se utilizaron datos cuyo valor de porcentaje de inhibición estaba en el rango entre 30 % y 90 %, esto tomándose como referencia el equivalente medio de la actividad presentada por los patrones de Trolox y Vitamina C, estos porcentajes correspondientes al IC50, cuyo cálculo se realizó teniendo en cuenta los valores estadísticos de la pendiente, la intersección que presentaba con el eje y el coeficiente de correlación (R2), estableciéndose así una relación lineal de pendiente positiva entre la inhibición al 50 % y la concentración. Fueron analizadas cuatro muestras a diferentes concentraciones para DPPH; sin embargo, la fracción de heptano (Fx.Hept.Ss.F) no presentó porcentajes de inhibiciones con valores superiores al 30 %, probándose en concentraciones superiores a 5000 mg L-1; los resultados obtenidos para el método de DPPH se muestran en la Tabla 2, siendo el mejor resultado el de la fracción de diclorometano (Fx.DCM.Ss.F), pues el tiempo transcurrido fue de 78 min, a este tiempo se obtuvo un coeficiente de correlación de 0,9846, que refleja un coeficiente de variación del 3,35 % entre el promedio y la desviación estándar (328,7 ppm ± 11,0294).
Tabla 2: Resultados obtenidos para el método DPPH
Los resultados obtenidos de la capacidad antioxidante de cada uno de los tratamientos ensayados comparados con el patrón de vitamina C y Trolox se ilustran en la figura 1. En esta se muestra que el extracto etanólico (E.EtOH.Ss.F) y las fracciones de diclorometano y acetato de etilo (Fx.DCM.Ss.F; Fx. AcOEt.Ss.F) presentan un porcentaje de inhibición superior al 30 %; en todas las muestras se evidencia la relación directamente proporcional entre la concentración y el porcentaje inhibitorio.
Figura 1: Resultados obtenidos por el método DPPH
Los mejores resultados en la capacidad antioxidante los muestra la fracción de diclorometano, pues a bajas concentraciones (comparadas con las concentraciones que requirieron las otras fracciones y el extracto) presenta un aceptable porcentaje de inhibición. Comparado con los patrones, es posible notar que es semejante con la capacidad antioxidante del Trolox, pues a bajas concentraciones es capaz de inhibir el radical. Por lo tanto, solo la fracción de diclorometano (Fx. DCM.Ss.F) obtenido a partir de la especie vegetal Senna spectabilis presenta promisoria capacidad antioxidante según la evaluación del método DPPH; esto concuerda con los resultados obtenidos en la cuantificación de flavonoides donde en la fracción de diclorometano se encontró la mayor concentración.
Con respecto al tiempo que tardaron los compuestos en completar la reacción, se tiene esto como una ventaja del método pues permite que reaccione toda la muestra y se da el tiempo necesario para que el DPPH reaccione frente a antioxidantes débiles (Prakash, 2001). Sin embargo, es importante mencionar que el DPPH es sensible a algunos tipos de bases y solventes de Lewis, así como al oxígeno (Ancerewicz et al., 1998). Una investigación realizada a la especie Senna reticulata (Matulevich-Peláez, 2017) evidenció potencial antioxidante en la fracción etanólica y de diclorometano, lo cual coincide con los resultados hallados en este estudio, los cuales destacan a la fracción de diclorometano (Fx.DCM.Ss.F) como la que presenta mayor capacidad antioxidante. Por otra parte, estudios realizados a las flores de Senna multiglandulosa (Ojeda et al., 2015) mostraron que la fracción con mejor capacidad antioxidante es la de cloroformo, la cual es una fracción con polaridad muy similar a la de diclorometano. Una investigación realizada a fracciones de diversas polaridades a hojas y tallos de Senna singueana muestra que los valores más altos de IC50 se dieron en la fracción obtenida por éter de petróleo, seguido de cloroformo, metanol y acetona (Gebrelibanos et al. 2007).
Karau realizó estudios a la capacidad antioxidante con DPPH en las hojas y la corteza del tallo de la especie Senna spectabilis, reportando un 88,98 % y 90,95 % de inhibición para hojas y tallo respectivamente (Karau, 2014); a nivel comparativo con esta investigación, se encuentra que estos órganos tienen mayor porcentaje de inhibición respecto a las flores. Sin embargo, la investigación no reporta las concentraciones de las fracciones, por lo que no se podría dar una veracidad en cuanto a la comparación entre la capacidad antioxidante de diferentes órganos.
La capacidad antioxidante evidenciada en la fracción de diclorometano (Fx.DCM.Ss.F) se debe a los compuestos presentes en esta fracción que son de polaridad intermedia-baja, principalmente compuestos hidroxilados y nitrogenados (alcaloides), ya que los alcaloides de cualquier tipo de estructura han mostrado capacidad antioxidante ante compuestos que tienen alta tendencia a ser oxidados (Chávez et al. 1996). Es importante recordar que en otros estudios a la misma especie vegetal se encontró presencia de metabolitos secundarios como flavonoides, alcaloides (como la cafeína) y antraquinonas hidroxiladas, que por su estructura y los estudios previos que se han realizado, muestran capacidad antioxidante (Selegato et al., 2017).
Cuantificación de fenoles
Con la curva de calibración realizada con los patrones de ácido gálico (Tabla 3) se encontró la función lineal que representaba la relación (Absorbancia = 0,0019* (concentración de ácido gálico en mg L-1) - 0,0143), se realizó la lectura espectrofotométrica del extracto y las fracciones, se hizo la correlación entre la curva y los valores obtenidos, los cuales se muestran en la tabla 4.
Tabla 3: Datos de la curva de calibración para cuantificación de fenoles totales

Tabla 4: Concentración de fenoles en muestra
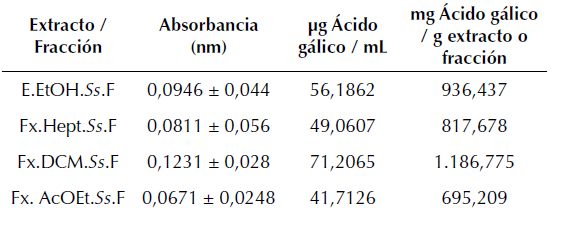
La tabla 4 muestra que la mayor cantidad de compuestos fenólicos está presente en la fracción de diclorometano (Fx.DCM.Ss.F), seguida por el extracto total (E.EtOH.Ss.F), el de heptano (Fx.Hept.Ss.F) y en menor cantidad la fracción de acetato de etilo (Fx.AcOEt.Ss.F). Esto puede relacionarse con los resultados obtenidos en la capacidad antioxidante, que muestran a la fracción de diclorometano (Fx.DCM.Ss.F) como la de mayor capacidad inhibitoria oxidante, a su vez esto permite establecer que aproximadamente el 70 % de los compuestos presentes en la fracción de diclorometano son polifenoles (Viegas et al., 2013; Tai et al., 2015).
Cuantificación de flavonoides
Con la curva de calibración realizada con los patrones de quercetina (Tabla 5), se realizó la relación lineal que arrojó la función lineal absorbancia = 0,02296* (concentración de quercetina) - 0,0739. Bajo las mismas condiciones se midieron las absorbancias de las soluciones del extracto y las fracciones, y tras realizar la correlación entre la curva y los valores obtenidos se tienen los resultados consignados en la tabla 6:
Tabla 5: Datos de la curva de calibración paracuantificación de flavonoides

Tabla 6: Cantidad de flavonoides presentes en cada extracto/ fracción
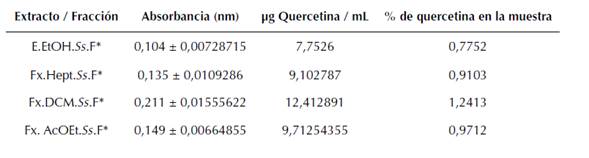
La tabla 6 muestra que la fracción de diclorometano (Fx.DCM.Ss.F) tiene la mayor cantidad de flavonoides (según el patrón de quercetina) entre las muestras, lo que coincide también con la mayor cantidad de polifenoles totales medidos.
Los resultados obtenidos concuerdan con lo mostrado por Viegas et al (2013), quienes han reportado en la especie, flavonoides como la luteolina y la metoxiluteolina en las flores y los frutos verdes. Por su parte, Singh et al. (2013) estudiaron las partes aéreas de Senna spectabilis aislando dos flavonas glicosiladas, la 6-hidroxi-4’-metoxiflavona-6-O-arabinopiranosa y la 3,5-dihidroxi-7,3’,4’-trimethoxi-flavona-3-O-arabinopiranosa del extracto etanólico de la planta; adicionalmente, Singh et al. encontraron la presencia de otros flavonoides como la 5,4’-dihidroxi-7,3’-dimethoxiflavona-5-O-β-D(+)- glucopiranosa (Singh et al., 2013).
Es importante señalar que la capacidad antioxidante está relacionada con los compuestos fenólicos totales determinados en los extractos y las fracciones, además como mencionan Rižner et al. (2000), se deben tener en cuenta aspectos como la existencia de agliconas libres y su incorporación a la determinación, además el hecho de que pueden ocurrir interacciones entre los componentes del extracto, esto recordando que la sinergia de los flavonoides con tocoferoles, ascorbil palmitato y ácido cítrico ya ha sido reportada (Rižner et al., 2000).
Los resultados mostrados en la presente cuantificación de flavonoides arroja valores menores a los determinados en la cuantificación de fenoles, esto está dentro de lo esperado, debido a que los flavonoides son un subgrupo de los compuestos fenólicos.
Conclusiones
El trabajo fitoquímico desarrollado realizó el aporte al conocimiento químico de las flores de la especie vegetal Senna spectabilis, permitió el aislamiento y la purificación de dos compuestos denominados cinamato de metilo y cafeína; y tres mezclas, la primera conformada por dos ésteres (9-oxo-nonanoato de etilo y palmitato de etilo) y una cetona (pentadecan-2-ona), en la segunda mezcla se encontró nuevamente al palmitato de etilo junto con una antraquinona (1,8-dihidroxi-3-metil-antraquinona), y la tercera mezcla conformada por un monoterpeno oxigenado (Linalool) y un derivado de ácido cinámico (cinamato de metilo). En cuanto al conocimiento biológico, se muestra que la fracción de diclorometano de las flores de Senna spectabilis (Fx.DCM.Ss.F) tiene los resultados más efectivos para actuar como una mezcla de sustancias con capacidad antioxidante; así mismo, esta fracción mostró la mayor cantidad de fenoles, evidenciando así la relación entre la capacidad antioxidante y la cantidad de polifenoles y flavonoides presentes en la fracción de diclorometano de las flores de la especie Senna spectabilis.
Acknowledgements
Agradecimientos
Expresamos nuestros agradecimientos al Grupo de Investigación Productos Naturales Vegetales de la Universidad Distrital Francisco José de Caldas por la financiación, las instalaciones, los equipos y la formación; a la Pontificia Universidad Javeriana por el préstamo de sus instalaciones y equipos, y al biólogo Nelson Salinas por la determinación taxonómica de la muestra de flores de la especie.
Referencias
Licencia
Derechos de autor 2021 Javier-Andres Matulevich-Pelaez, William-Fernando Castrillon-Cardona, Laura-Marcela Rodriguez-Renuma, Juan-Pablo Medina-Doncel

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial-CompartirIgual 4.0.
El (los) autor(es) al enviar su artículo a la Revista Científica certifica que su manuscrito no ha sido, ni será presentado ni publicado en ninguna otra revista científica.
Dentro de las políticas editoriales establecidas para la Revista Científica en ninguna etapa del proceso editorial se establecen costos, el envío de artículos, la edición, publicación y posterior descarga de los contenidos es de manera gratuita dado que la revista es una publicación académica sin ánimo de lucro.




