DOI:
https://doi.org/10.14483/23448393.16503Published:
2022-04-25Issue:
Vol. 27 No. 2 (2022): May-AugustSection:
Environmental EngineeringValidación de un protocolo fotográfico digital para análisis macroscópico de la anatomía y colorimetría en madera de especies arbóreas de Costa Rica
Validation of a Digital Photographic Protocol for Macroscopic Analysis of Wood Anatomy and Colorimetry of Tree Species in Costa Rica
Keywords:
natural forest, wood anatomy, CIELAB (en).Keywords:
bosque natural, anatomía de la madera, CIELAB (es).Downloads
References
K. Brownson, E. P. Anderson, S. Ferreira, S. Wenger, L. Fowler, and L. German, “Governance of payments for ecosystem services influences social and environmental outcomes in Costa Rica”, Ecol. Econ., vol. 174, 2020. https://doi.org/10.1016/j.ecolecon.2020.106659 DOI: https://doi.org/10.1016/j.ecolecon.2020.106659
M. T. van Wijk, M. Williams, and G. R. Shaver, “Tight coupling between leaf area index and foliage N content in arctic plant communities”, Oecologia, vol. 142, no. 3, pp. 421-427, 2005. https://doi.org/10.1007/s00442-004-1733-x DOI: https://doi.org/10.1007/s00442-004-1733-x
I. Shaver et al., “Coupled social and ecological outcomes of agricultural intensification in Costa Rica and the future of biodiversity conservation in tropical agricultural regions”, Glob. Environ. Chang., vol. 32, pp. 74-86, 2015. https://doi.org/10.1016/j.gloenvcha.2015.02.006 DOI: https://doi.org/10.1016/j.gloenvcha.2015.02.006
I. Havinga, L. Hein, M. Vega-Araya, and A. Languillaume, “Spatial quantification to examine the effectiveness of payments for ecosystem services: A case study of Costa Rica’s Pago de Servicios Ambientales”, Ecol. Indic., vol. 108, 2020. https://doi.org/10.1016/j.ecolind.2019.105766 DOI: https://doi.org/10.1016/j.ecolind.2019.105766
J. Saporiti Machado, F. Pereira, and T. Quilhó, “Assessment of old timber members: Importance of wood species identification and direct tensile test information”, Constr. Build. Mater., vol. 207, pp. 651-660, 2019. https://doi.org/10.1016/j.conbuildmat.2019.02.168 DOI: https://doi.org/10.1016/j.conbuildmat.2019.02.168
M. Fioravanti, G. Di Giulio, and G. Signorini, “A non-invasive approach to identifying wood species in historical musical instruments”, J. Cult. Herit., vol. 27, pp. S70-S77, 2017. https://doi.org/10.1016/j.culher.2016.05.012 DOI: https://doi.org/10.1016/j.culher.2016.05.012
V. de Micco and G. Aronne, “Seasonal dimorphism in wood anatomy of the Mediterranean Cistus incanus L. subsp. incanus”, Trees - Struct. Funct., vol. 23, no. 5, pp. 981-989, 2009. https://doi.org/10.1007/s00468-009-0340-1 DOI: https://doi.org/10.1007/s00468-009-0340-1
K. Kobayashi, S.-W. Hwang, T. Okochi, W.-H. Lee, and J. Sugiyama, “Non-destructive method for wood identification using conventional X-ray computed tomography data”, J. Cult. Herit., vol. 38, pp. 88-93, 2019. https://doi.org/10.1016/j.culher.2019.02.001 DOI: https://doi.org/10.1016/j.culher.2019.02.001
G. Giachi, M. C. Guidotti, S. Lazzeri, L. Sozzi, and N. Macchioni, “Wood identification of the headrests from the collection of the Egyptian Museum in Florence”, J. Archaeol. Sci. Reports, vol. 9, pp. 340-346, 2016. https://doi.org/10.1016/j.jasrep.2016.08.027 DOI: https://doi.org/10.1016/j.jasrep.2016.08.027
A. Glabasnia, and T. Hofmann, “Sensory-directed identification of taste-active ellagitannins in American (Quercus alba L.) and European oak wood (Quercus robur L.) and quantitative analysis in bourbon whiskey and oak-matured red wines”, J. Agric. Food Chem., vol. 54, no. 9, pp. 3380-3390, 2006. https://doi.org/10.1021/jf052617b DOI: https://doi.org/10.1021/jf052617b
F. Reinig et al., “Introducing anatomical techniques to subfossil wood”, Dendrochronologia, vol. 52, pp. 146-151, 2018. https://doi.org/10.1016/j.dendro.2018.10.005 DOI: https://doi.org/10.1016/j.dendro.2018.10.005
X. Tang, G. Zhao, and L. Ping, “Wood identification with PCR targeting noncoding chloroplast DNA”, Plant Mol. Biol., vol. 77, no. 6, pp. 609-617, 2011. https://doi.org/10.1007/s11103-011-9837-2 DOI: https://doi.org/10.1007/s11103-011-9837-2
D. A. Ayala-Usma, R. E. Lozano-Gutiérrez, and C. González Arango, “Wood anatomy of two species of the genus Chrysochlamys (Clusiaceae: Clusioideae: Clusieae) from the northern Andes of Colombia”, Heliyon, vol. 5, no. 7, 2019. https://doi.org/10.1016/j.heliyon.2019.e02078 DOI: https://doi.org/10.1016/j.heliyon.2019.e02078
I. Malik, Ł. Pawlik, A. Ślęzak, and M. Wistuba, “A study of the wood anatomy of Picea abies roots and their role in biomechanical weathering of rock cracks”, Catena, vol. 173, pp. 264-275, 2019. https://doi.org/10.1016/j.catena.2018.10.018 DOI: https://doi.org/10.1016/j.catena.2018.10.018
C. P. Pérez-Olvera y R. Dávalos-Sotelo, “Algunas características anatómicas y tecnológicas de la madera de 24 especies de Quercus (encinos) de México”, Madera y Bosques, vol. 14, no. 3, pp. 43-80, 2008. https://doi.org/10.21829/myb.2008.1431206 DOI: https://doi.org/10.21829/myb.2008.1431206
V. De Micco, G. Aronne, and P. Baas, “Wood anatomy and hydraulic architecture of stems and twigs of some Mediterranean trees and shrubs along a mesic-xeric gradient”, Trees - Struct. Funct., vol. 22, no. 5, pp. 643-655, 2008. https://doi.org/10.1007/s00468-008-0222-y DOI: https://doi.org/10.1007/s00468-008-0222-y
J. L. Marcelo-Peña, L. Santini, and M. Tomazello Filho, “Wood anatomy and growth rate of seasonally dry tropical forest trees in the Marañón River Valley, northern Peru”, Dendrochronologia, vol. 55, pp. 135-145, 2019. https://doi.org/10.1016/j.dendro.2019.04.008 DOI: https://doi.org/10.1016/j.dendro.2019.04.008
F. Ma, and A. Huang, “Rapid identification and quantification three chicken-wing woods of Millettia leucantha, Millettia laurentii and Cassia siamea by FT-IR and 2DCOS-IR”, J. Mol. Struct., vol. 1166, pp. 164-168, 2018. https://doi.org/10.1016/j.molstruc.2018.04.037 DOI: https://doi.org/10.1016/j.molstruc.2018.04.037
A. Pacheco, J. J. Camarero, M. Pompa-García, G. Battipaglia, J. Voltas, and M. Carrer, “Growth, wood anatomy and stable isotopes show species-specific couplings in three Mexican conifers inhabiting drought-prone areas”, Sci. Total Environ., vol. 698, 2020. https://doi.org/10.1016/j.scitotenv.2019.134055 DOI: https://doi.org/10.1016/j.scitotenv.2019.134055
I. G. Andrade Bueno et al., “Wood anatomy of field grown eucalypt genotypes exhibiting differential dieback and water deficit tolerance”, Curr. Plant Biol., vol. 22, 2020. https://doi.org/10.1016/j.cpb.2020.100136 DOI: https://doi.org/10.1016/j.cpb.2020.100136
J. C. Valverde, D. Arias, E. Mata, G. Figueroa y N. Zamora. “Determinación de las condiciones fotográficas óptimas para la caracterización anatómica de diez especies maderables de Costa Rica“ Rev. Cubana Cien. For. vol. 8, no. 3, pp. 439-455, 2020. http://cfores.upr.edu.cu/index.php/cfores/article/view/613
J. C. Valverde et al., “Identificación de patrones de reflectancia espectral y colorimétricos en madera seca de Peltogyne purpurea Pittier“ Rev. Cubana Cien. For. vol. 8, no. 2, pp. 262-281, 2020.
G. Figueroa, E. Mata, J. C. Valverde, and D. Arias. “Automated image-based identification of forest species: Challenges and opportunities for 21st century xylotheques“, IWOBI, vol. 1, 2018. https://doi.org/10.1109/IWOBI.2018.8464206 DOI: https://doi.org/10.1109/IWOBI.2018.8464206
G. Figueroa, E. Mata, J. C. Valverde, and D. Arias. “Evaluating the significance of cutting planes of wood samples when training CNNs for forest species identification“, CONCAPAN XXXVIII, vol. 1, 2018. https://doi.org/10.1109/CONCAPAN.2018.8596406 DOI: https://doi.org/10.1109/CONCAPAN.2018.8596406
J. C. Valverde, and D. Arias. “Variation of physiological parameters in juvenile treetops of Eucalyptus tereticornis from a three-dimensional perspective“. Esp. Rev. Multi. Inv, vol. 2, no. 23, 2018. https://doi.org/10.31876/re.v2i23.399 DOI: https://doi.org/10.31876/re.v2i23.399
ASTM. D2244 “Standard Practice for Calculation of Color Tolerances and Color Differences from Instrumentally Measured Color Coordinates”, ASTM International, vol. 1, 2012.
W. Cui, P. Kamdem, and T. Rypstra. “Diffuse reflectance infrared Fourier transform spectroscopy (Drift) and color changes of artificial weathered wood”, Wood Fiber Sci, vol. 36, no. 3, pp. 291-301, 2004.
G. Figueroa, E. Mata, J. C. Valverde, and D. Arias. “using deep convolutional networks for species identification of xylotheque samples“, IWOBI, vol. 1, 2018.
How to Cite
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Download Citation
Recibido: 13 de septiembre de 2021; Revisión recibida: 23 de septiembre de 2021; Aceptado: 4 de octubre de 2021
Resumen
Contexto:
El proceso de digitalización de muestras de madera para su identificación y estudio ha tomado relevancia en la última década, por lo que es necesario considerar los aspectos fotográficos que generen representatividad de las imágenes con respecto a la muestra física.
Método:
Se utilizaron diez especies maderables con no menos de diez árboles muestreados. De cada individuo se extrajeron cinco cubos de madera de 10 mm de arista y se fotografiaron mediante un estereoscopio con un aumento de 20x bajo cuatro protocolos de luminosidad. En el proceso se evaluaron variaciones del color (bajo las coordenadas L*, a* y b*), el diferencial de color (∆E*) y el chroma (∆C*), además de la densidad y diámetro de vasos.
Resultados:
Los resultados mostraron que la luminosidad del 50 % fue la que mostró la mayor similitud con la colorimetría de la madera, obteniendo valores de ∆E* inferiores a 6 en todas las especies y valores de ∆C* dentro del rango óptimo de 5 a 7. Con respecto a la anatomía de los individuos, se dio el mismo comportamiento con las diez especies; se encontró que los tratamientos de luminosidad al 25 y 50 % no mostraron diferencias significativas, mientras que las luminosidades al 75 y 100 % tendieron a subestimar los valores.
Conclusiones:
El tratamiento de luminosidad al 25 % es poco efectivo por el oscurecimiento de la superficie, mientras que las exposiciones al 75 y 100 % tendieron a aclarar la superficie y subestimar las características anatómicas.
Palabras clave:
bosque natural, anatomía de la madera, CIELAB.Abstract
Context:
The process of digitizing wood samples for identification and study has become increasingly relevant over the past decade, which is why it is necessary to consider photographic aspects that generate representation of the images with respect to the physical sample.
Method:
Ten timber species were used with no less than ten sampled trees. From each individual, five wooden cubes with a 10 mm edge were extracted and photographed with a stereoscope at 20x magnification under four luminosity protocols. During the process, variations in color (under the coordinates L*, a*, and b*), color differential (E*), and chroma (C*) were evaluated in addition to the density and diameter of the vessels.
Results:
The results showed that a 50 % brightness showed the greatest similarity to the colorimetry of the wood, obtaining E* values of less than 6 in all species, as well as C* values within the optimal range of 5 to 7. Regarding the anatomy of the individuals, the same behavior was observed in the ten species; it was found that the luminosity treatments at 25 and 50 % showed no significant differences, while the luminosities of 75 and 100 % tended to underestimate the values.
Conclusions:
The treatment with 25 % luminosity is ineffective due to the darkening of the surface, while exposures of 75 and 100 % tended to clarify the surface and underestimate anatomical characteristics.
Keywords:
natural forest, wood anatomy, CIELAB.Introducción
El trópico es una de las regiones con mayor biodiversidad del mundo 1, aspectos climáticos y edafológicos han incidido en una amplia diversidad de especies de flora y fauna 2, permitiendo que más del 40 % de la biodiversidad conocida a nivel mundial se ubique en esta región geográfica 1. Solo en Costa Rica se reportan más de 500.000 especies (6 % de la diversidad mundial) 3, con una presencia de más de 2.200 especies arbóreas, de las cuales únicamente se ha aprovechado un 10 % para fines comerciales en el país 4.
Ante tal biodiversidad se hace necesario el desarrollo de expediciones de colecta botánica que permitan la identificación, la caracterización y la geolocalización de las especies 5. Tradicionalmente las colectas se han enfocado en la colección de muestras de ramas y hojas, debido a su facilidad de recolección, manipulación y almacenamiento 6. Pero también existe otro tipo de colecta de material, de mayor dificultad en el caso de árboles, y que consiste en la colecta de muestras de madera para el estudio posterior. Generalmente, las piezas de madera que se obtienen del tronco o una rama gruesa 7, la muestra es secada y se mantiene en colecciones especializadas denominadas xilotecas 5
Las xilotecas cuentan con una basta información de la diversidad maderable de un país o una región, permiten además entender procesos de crecimiento de las especies 8, concentraciones de acumulación de carbono y variabilidad anatómica de una especie 9. Su implementación ayuda no solo a la identificación o caracterización de las especies, sino también al entendimiento de los procesos metabólicos y anatómicos que generan la madera, los procesos de acumulación de carbono y la similitud de las especies en cuanto a su composición anatómica por familias 10. Sin embargo, las xilotecas han tenido un retardo tecnológico en las últimas décadas debido a la poca implementación en el desarrollo de plataformas de acceso virtual 11. Tradicionalmente, la xiloteca se ha considerado un sitio de consulta presencial, en el que se debe localizar y analizar la muestra física y con un espacio de utilización de tecnología muy reducido; aspectos que han incidido en que el impacto científico de las xilotecas sea reducido a especialistas o a consultas específicas e imposibilitando el desarrollo de consultas en conjunto de colecciones de diferentes regiones o países en tiempo real 8. En la última década se ha iniciado un proceso de digitalización de material biológico con el fin de aumentar la accesibilidad de las colecciones, ampliar su utilización y permitir el desarrollo de investigaciones internacionales o poblacionales que consideren varias regiones 12. Para el proceso de digitalización de muestras de xiloteca a nivel macroscópico se deben considerar tres elementos fundamentales, según mencionan 13: i. la versión digital de la muestra debe preservar las características de dimensionalidad, estabilidad y colorimetría de la muestra física, ii. la manipulación de las propiedades de la muestra debe ser mínima, para evitar un sesgo en la imagen que pueda inducir en un sesgo en el entendimiento e identificación por parte del usuario y iii. se debe respetar y mantener toda la información complementaria presente en la muestra, para lo cual se debe considerar la ficha de metadatos de las muestras y anotaciones existentes en el material. Conforme mayor sea la similitud entre las propiedades visuales presentes en la muestra física y digital, mayor será la representatividad y la aplicabilidad de la especie con fines científicos.
A nivel mundial la creación de xilotecas se ha desarrollado en su mayoría en especies de climas templados, destacando colecciones en Europa (Alemania, Francia e Inglaterra) y en Estados Unidos con The Forest Laboratory in Madison, que cuenta con la colección más grande del mundo 14. En América Latina resaltan colecciones en Brasil, Argentina, Colombia y México, que cuentan con muestras de especies templadas y tropicales en menor cantidad 15, 16. Si el análisis se enfoca en colecciones con especies del trópico 16, se destaca el sureste asiático donde crearon una colección de tres especies nativas de la región con fotografías a tamaño natural y 10 X. Por su parte 8, en el oeste asiático desarrollaron una colección de muestras de dos especies arbóreas con imágenes de microscopio (40 X) y estereoscopio a 10 X. Mientras en México se han creado “demos” de colecciones de xiloteca hasta de cien especies en escala natural 17, en Colombia se dispone de amplias colecciones de especies tropicales que en su mayoría cuentan con pocos estudios y caracterización anatómica, física y mecánica de la madera 18; en cambio, en Italia desarrollaron un equipo de homologación fotográfica a escala natural para veinte especies arbóreas de la región 19. Sin embargo, no se cuenta con estudios que estandaricen las condiciones fotográficas óptimas para análisis anatómicos y colorimétricos de imágenes macroscópicas de especies maderables. Por lo que el presente estudio consistió en determinar las condiciones de luminosidad óptimas en fotografías macroscópicas para la identificación de variables anatómicas y colorimétricas en diez especies arbóreas tropicales de Costa Rica.
Métodos
Sitio de estudio y especies
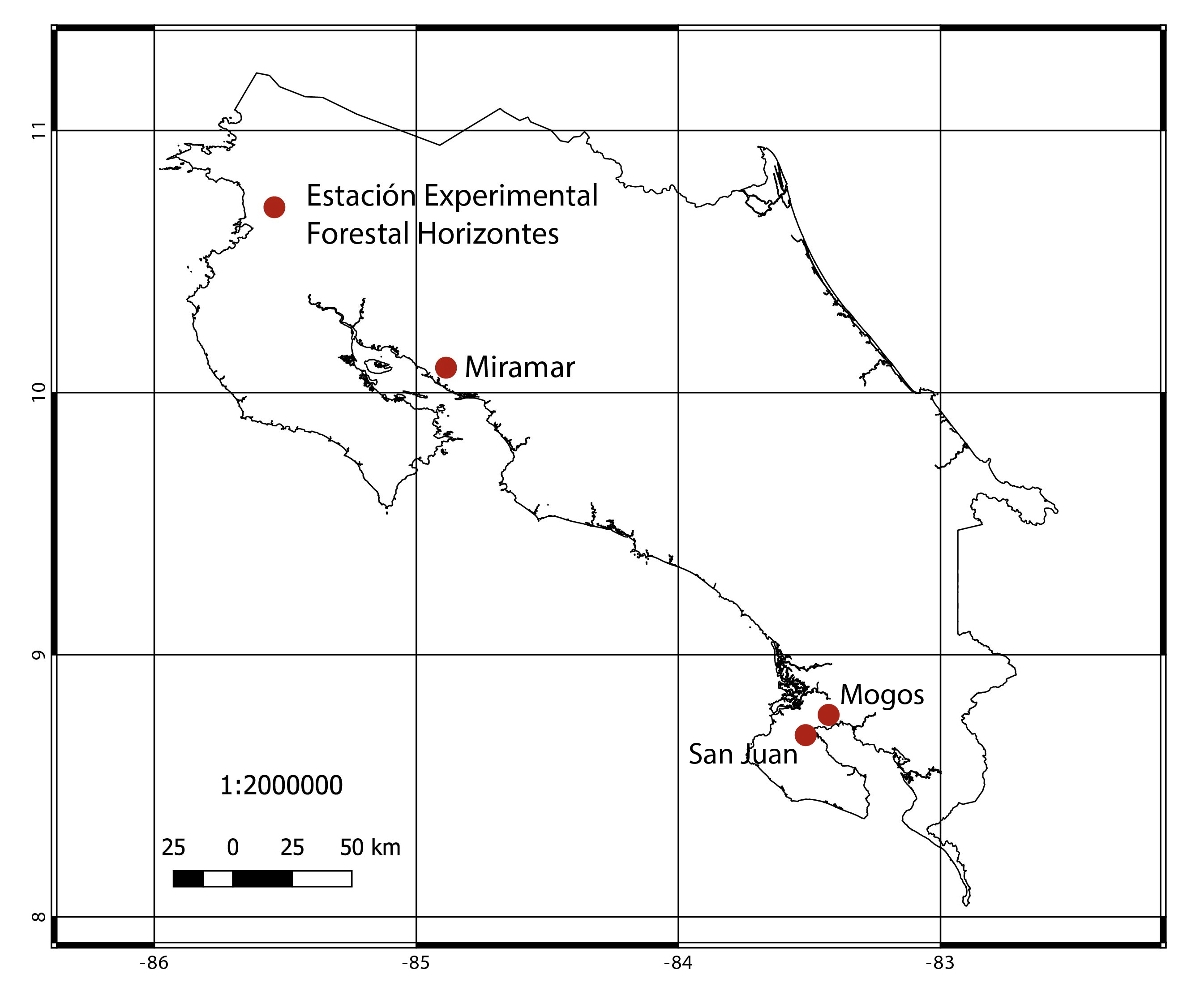
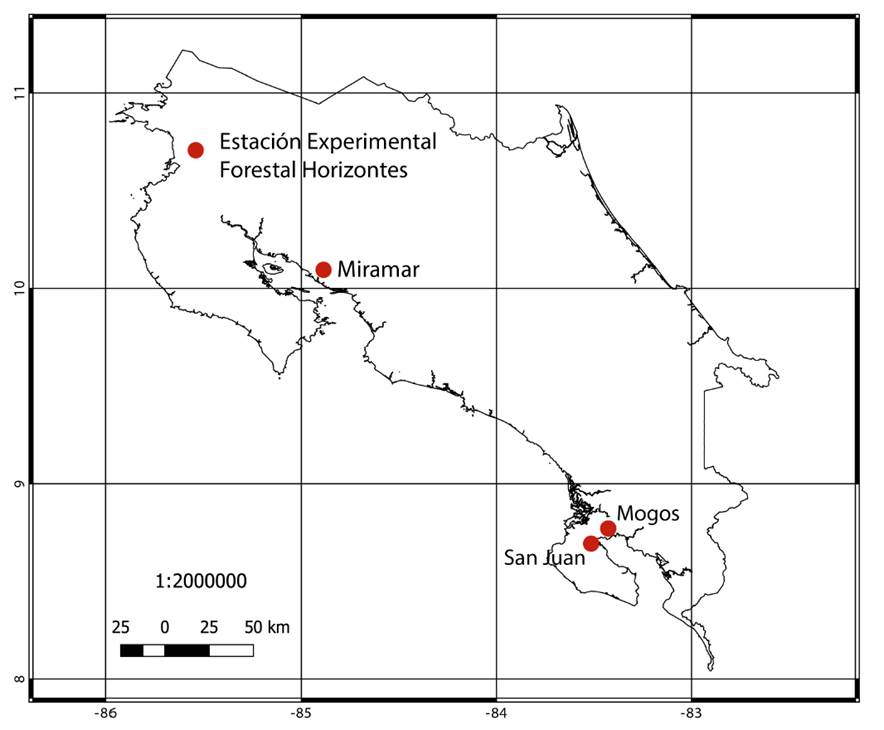
El estudio se desarrolló en la costa pacífica de Costa Rica (figura 1), región que cuenta con una amplia variedad de bosques tropicales que en la actualidad se han enfocado en un uso forestal sostenible para la obtención de madera con múltiples propósitos 21. Los cuatro sitios seleccionados mostraron una diversidad de especies representativa de la región; a continuación se presenta una caracterización de cada bosque seleccionado: Estación Forestal Experimental Horizontes ubicada en Guanacaste (10°42’10”N, 85° 33’12”O) a una altitud de 120 m, bosques en la región de Miramar, Puntarenas (10° 01’ 29” N, 84° 14’ 04” O) a una altitud de 270 m, en ambas regiones los bosques se caracterizaron por ser de tipo seco con régimen hídrico anual inferior a los 2.000 mm, temperaturas que oscilaron de 27 a 34°C y una estación seca definida de diciembre a mayo. También se colectaron muestras en la Península de Osa, Puntarenas, específicamente el bosque de los Mogos (8° 45’ 00” N, 83° 22’ 59” O) a una altitud de 40 m y San Juan (8° 39’ 02” N, 83° 27’ 53”O) a una altitud de 35 m; estos sitios se caracterizaron por tener una época seca muy reducida (de enero a abril), con una precipitación anual de 4.000 a 4.300 mm y temperatura anual con variación de 27 a 33 °C y con una humedad relativa anual de 70 a 90 %.
Figura 1: Sitios de colección de las diez especies arbóreas de estudio en Costa Rica
Se trabajó con diez especies forestales maderables, seleccionadas por su amplio uso en la industria en Costa Rica, además de que se encuentran consideradas en los programas de conservación y manejo sostenible de bosque natural, por lo que contar con información anatómica de alta calidad de las especies permite su correcta identificación 21. Por especie se seleccionaron como mínimo diez individuos a partir de estudios previos desarrollados por Valverde et al. [22], que determinaron que la cantidad mínima de individuos necesarios para este tipo de estudios es de nueve árboles.
En la tabla I se muestra la cantidad exacta colectada por especie en cada sitio, la variación entre especies se debió a facilidad de ubicación y colección de los árboles de cada especie, se utilizaron los criterios de Valverde et al. 21, con árboles que presentaron un diámetro superior a 30 cm con una distancia entre árboles superior a 15 m (esto con fin de aumentar la variedad de la especie en el sitio).
Tabla I: Especies y cantidad de muestras analizadas en el estudio para validación del protocolo fotográfico de muestras
Familia botánica
Especie
Sitio
Cubos fotografiados
EEFH
Miramar
Mogos
Total
Anacardiaceae
Spondias mombin L.
6
6
-
12
60
Bignoniaceae
Tabebuia rosea (Bertol.) DC.
6
4
-
10
50
Caryocaraceae
Caryocar costarricense Donn. Sm.
-
-
12
12
60
Clusiaceae
Symphonia globulifera L.f.
8
4
-
12
60
Fabaceae
Schizolobium parahyba (Vell). S.F.Black
2
8
2
12
60
Malvaceae
Pachira quinata (Jacq.) W.S. Alverson
-
1
15
16
80
Meliaceae
Cedrela odorata L.
3
3
9
15
75
Phyllanthaceae
Hieronyma alchorneoides L.
-
1
9
10
50
Rutaceae
Zanthoxylum ekmanii (Urb.) Alain
-
3
7
10
50
Vochysiaceae
Vochysia gentryi Marc.-Berti
-
-
12
12
60
Total
121
605
Proceso de colecta del material
Por cada árbol evaluado se extrajo una única muestra (121 muestras en total para el estudio), cada muestra se caracterizó por tener un tamaño de 75 mm de longitud y 25 mm de diámetro, fue obtenida mediante un muestreo no destructivo que consistió en el uso de una broca de tipo cortadora de tapones en espiral, implementada en un taladro de batería de 20 v. En cada árbol a una altura de 1,3 m sobre nivel del suelo se limpió un área de 4 cm2 , la cual se liberó de la corteza y se colocó la broca para perforar el fuste, la perforación se realizó con una velocidad de 1.750 RPM; posterior a que se realizara la perforación con la broca, la pieza de madera se extrajo con una pinza y se introdujo en una bolsa con una disolución acuosa de alcohol al 15 %, esto con el fin de impedir pérdida de contenido de humedad del material para el posterior procesamiento, además de evitar la formación de hongos que afectaran el color y la calidad de las muestras.
Procesamiento del material
Cada muestra cilíndrica se segmentó en cinco subcilindros de 13 mm de longitud, en cada cara transversal se realizó un pulido para dejarla lo más lisa posible; posteriormente, cada subcilindrose convirtió de manera manual mediante cortes en cubos de 10 mm de cara con superficies lo más lisas posibles y libres de defectos. Seguidamente, se secaron a una temperatura de 65 °C por 72 horas acorde a trabajos previos de Valverde et al. 22 que mostraron que muestras de tamaños reducido deben tener un secado paulatino para evitar contracciones significativas y defectos por madera juvenil, esto con el fin de no tener contracciones drásticas de la madera al ser expuesta en poco tiempo a altas temperaturas. Posterior al secado, los cubos se rectificaron en vías de disponer una cara transversal lo más limpia posible, libre de torceduras, defectos de secado o marcas del proceso de corte, en total se obtuvieron 605 cubos de madera, el detalle de la cantidad de cubos por especie se presenta en la Tabla I.
Procedimiento de fotografiado
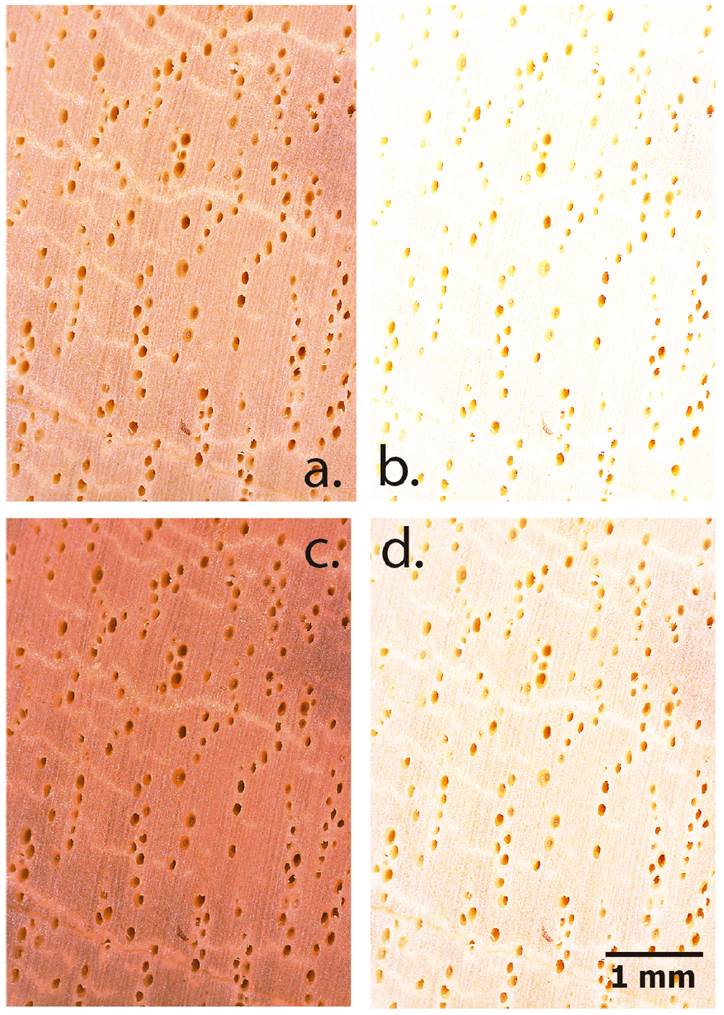
Se implementó el uso de un estereoscopio electrónico marca Celestron© con una resolución de 5 MP y un aumento de 20 X (aumento que presenta la mayoría de lupas comerciales y que permiten los celulares de gama, además de que es ampliamente usado en entrenamiento de algoritmos de identificación automática 23; las imágenes se tomaron en la cara transversal de la madera, esto debido a que estudios previos desarrollados por Figueroa 24 determinaron que es la cara óptima para la identificación de especies tropicales mediante fotografías macroscópicas (con aumentos inferiores a 100 X), es la cara transversal. El uso de cara radial y longitudinal tiende a presentar mayores problemas en análisis macroscópico 20, por tanto el estudio no consideró ambos cortes. Se manejó con una luminosidad estándar LED para hacer que el área de fotografía fuera uniforme, la temperatura de la luz empleada fue de 4500 K. En el estudio se probaron cuatro intensidades de luminosidad en las piezas de madera que fueron: i. 25 %, en este tratamiento se utilizó la fuente de luz del estereoscopio con una intensidad de 75 lux combinada con la luz ambiente que fue de 150 lux (figura 2a) generando una luminosidad total de 225 lux; ii. 50 %, se implementó la luz LED del microscopio con una intensidad de 150 lux (luminosidad total con la ambiental de 300 lux) (figura 2b); iii. 75 %, se implementó la luz LED del microscopio a una intensidad de 225 lux (luminosidad total de 375 lux) (Figura 2c ) y iv. 100 % se implementó la luminosidad en máxima capacidad de 300 lux (luminosidad total de 450 lux) (figura 2d). El control de la luminosidad se realizó con dos luxómetros marca UNI-T modelo UT382, uno de estos se utilizó únicamente para verificar que la luminosidad ambiental se mantuviera homogénea durante el estudio, mientras el segundo se utilizó para verificar que la luminosidad de cada tratamiento se mantuviera constante en el proceso de fotografiado.
Figura 2: Muestra de la fotografía de corte transversal de Symphonia globulifera, empleando cuatro luminosidades
Análisis anatómicos considerados
Cada fotografía se procesó con el programa “Image J” y se estimó la densidad y el diámetro promedio de los vasos, además de la relación vasos-fibras, para lo cual se implementó la metodología de Valverde y Arias 25 para especies arbóreas latifoliadas del trópico, la configuración del programa se realizó de manera automática con la relación de 1 mm equivalente a 240 px, una angulación de procesamiento de 90° y una constante dimensional de áreas de submuestreo de 300 x 300 px con un total de cinco subáreas de análisis ubicadas de forma aleatoria con la restricción que no se repitieran puntos de muestreo. Complementariamente se utilizó el método tradicional de observación con estereoscopio que implementó el mismo aumento y puntos de medición empleadas en la metodología fotográfica.
Medición del color
El color se evaluó posterior al secado del material, esto debido que el estándar de uso de muestras en xiloteca cuenta con material seco (contenido de humedad inferior al 30 %), por tanto la valoración del color no se realizó en condición de presecado [21], 22, se analizó tanto en la muestra física como la imagen fotografiada. Con las muestras físicas, la medición del color se realizó con un espectrofotómetro NIX Pro de cromatografía CIE estandarizado. El color se determinó entre el rango de los 400 a 700 nm con un puerto de medición de 10 mm de diámetro. Para la observación de la reflexión del componente especular (SCI modo) se incluyó en un ángulo de 10°, que es normal para la superficie de la madera (D65 / 10); y con un D65 (correspondiente a la luz del día en 6500 K). En cada muestra se midió el color en la cara transversal de la muestra y en total se recolectaron tres mediciones. En el caso de las fotografías, el color se determinó con el programa Adobe Photoshop CC2020, se implementó la herramienta a cuentagotas y por cada fotografía se analizaron 25 mediciones en áreas que no correspondieran a vasos.
El color se evaluó en formato CIELAB, el cual generó tres parámetros para explicar el color que consistieron en: L* (luminosidad), a* (tendencia de color de rojo a verde) y b* (tendencia de color de amarillo a azul).
Diferencial del color
El diferencial de color (∆E*) se definió como la variación neta del color entre dos escenarios, según lo establecido por la norma ASTM D 2244 26, cuya fórmula es detallada en la ecuación 1. El ∆E* se implementó para encontrar diferencias en el color entre las fotografías y las muestras físicas y con ello identificar el grado de representatividad del color utilizando las categorías de Cui et al. 27, que establecen cinco niveles de cambio de color percibido por el ojo humano: si 0 < ∆E* > 0,5, el cambio de color no es percibido por el ojo humano; si 1,5 < ∆E* > 3, el cambio de color apenas se percibe; si 3 < ∆E* >6, se percibe el cambio; si 6 < ∆E* > 12, el cambio de color es bastante notable para el ojo humano, y finalmente si ∆E* > 12, hay un cambio total de color.
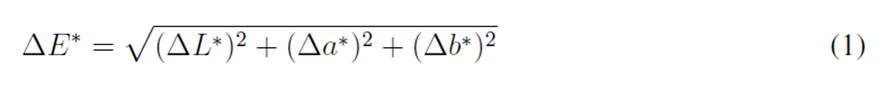
Donde: ∆E* es el diferencial del color; ∆L* corresponde a la diferencia entre la luminosidad estimada a partir de la fotografía y la luminosidad medida en la muestra física; ∆a* corresponde a la diferencia entre el valor a* promedio estimado a partir de la fotografía y la medida en la muestra física; ∆b* es b* corresponde a la diferencia entre el valor b* promedio estimado a partir de la fotografía y la medida en la muestra física.
Diferencial chroma
Se evaluó el diferencial chroma (∆C*), que se definió como la variación neta de la saturación del color (a* y b*) entre dos escenarios, según lo establecido por la norma ASTM D 2244 26, cuya fórmula es detallada en la ecuación (2). Este parámetro permite estimar si hay pérdida o ganancia de color, indiferente de la luminosidad.
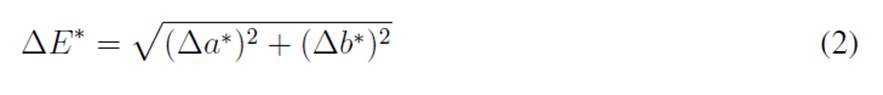
Donde: ∆C* es el diferencial del chroma; ∆a* es a* del protocolo de fotografía analizado - a* en la muestra física; ∆b* es b* del protocolo de fotografía analizado - b*en la muestra física.
Análisis estadístico
Primeramente se generó una caracterización colorimétrica de las muestras físicas con los parámetros L*, a* y b* con el fin de identificar variaciones de color entre la albura (definida como la parte joven de la madera, correspondiente a los últimos anillos de crecimiento del árbol) y duramen (definido como la parte del tronco que forma parte del llamado xilema, leño, o tejido leñoso) de cada muestra, y a su vez establecer las diferencias estadísticas, para lo cual se realizó un análisis de varianza (ANDEVA de una vía), una validación de los supuestos y en caso de determinar un efecto significativo se aplicó una prueba de Tukey para identificar las diferencias.
Posteriormente, se analizó la diferencia entre los valores de color y la saturación del color de la muestra física con respecto a los distintos protocolos de fotografía, con el fin de identificar los valores que generaron menor diferencial del color, para lo cual se aplicó nuevamente un ANDEVA con las condiciones anteriormente descritas.
Todos los análisis se realizaron con una significancia de 0,05 y se utilizó el programa OriginPro 2020.
Resultados
Caracterización inicial de la madera
Se encontraron distintos patrones entre la albura y el duramen de las diez especies en estudio (tabla II), para T. rosea no se encontraron diferencias significativas entre albura y duramen, mostrando una coloración rojizo-amarillenta con luminosidad baja (L* de 40,3; a* de 8,1 y b* de 12,0); las restantes nueve especies sí mostraron variaciones entre la albura y el duramen con los tres parámetros de color. Con el parámetro de luminosidad (L*), únicamente V. gentryi no mostró diferencias en la albura y el duramen, con un valor promedio de 49,01, las restantes nueve especies sí mostraron diferenciación entre ambas secciones, encontrándose que el duramen mostró un mayor oscurecimiento que la albura, que varió del 5 al 20 %. Con respecto al parámetro a* que evaluó tendencia de rojo a verde, se encontraron tres tendencias, con C. costarricense, T. rosea, P. quinata y V. gentryi no se dieron diferencias significativas entre albura y duramen, encontrándose tendencias de coloración a ser rojizas, por su parte con S. mombin y H. alchorneoides se dio un decrecimiento de a* en el duramen de un 10 a 15 % con una reducción en la escala del color rojo, finalmente la tercera agrupación se conformó por S. globulifera, S. parahyba, C. odorata y Z. ekmanii en las que se dio un incremento en la rojosidad de la madera en el duramen de un 5 al 20 %.
Nota: Valores entre paréntesis corresponden a la desviación estándar. Letras diferentes muestran diferencias con un nivel de significa α = 0,05
Tabla II: Valores de color L*, a* y b* obtenidos en forma directa en la cara trasversal de la madera seca de diez especies arbóreas en Costa Rica
Especie
Color Albura
Color Duramen
L*
a*
b*
L*
a*
b*
S. mombin
58,4 A (8,9)
7,6 A (1,3)
13,7 A (3,5)
54,0 B (3,8)
5,0 B (2,2)
10,8 A (1,8)
T. rosea
40,6 A (6,2)
7,9 A (0,9)
12,1 A (4,2)
39,2 A (2,5)
8,2 A (3,1)
11,9 B (1,5)
C. costarricense
43,7 A (6,6)
13,4 A (1,6)
16,3 A (2,7)
37,0 B (4,0)
11,8 A (1,9)
12,6 A (1,6)
S. globulifera
59,0 A (5,2)
5,8 A (1,9)
13,5 A (2,5)
48,0 B (3,3)
7,2 B (1,8)
11,6 B (1,7)
S. parahyba
66,2 A (4,4)
8,4 A (1,3)
17,6 A (2,0)
54,2 B (2,8)
11,5 B (2,1)
13,9 A (1,4)
P. quinata
43,4 A (3,9)
13,5 A (2,1)
18,8 A (1,9)
34,3 B (3,5)
12,4 A (2,0)
11,6 A (1,7)
C. odorata
53,9 A (3,5)
11,9 A (1,5)
17,2 A (2,1)
46,9 B (2,7)
14,9 B (2,2)
14,2 A (2,0)
H. alchorneoides
57,8 A (2,9)
16,4 A (1,5)
13,4 A (1,5)
45,4 B (3,6)
12,3 B (2,5)
9,2 B (2,2)
Z. ekmanii
42,2 A (3,3)
-2,4 A (0,9)
4,9 A (1,7)
30,9 B (3,8)
0,2 B (2,2)
5,2 B (2,3)
V. gentryi
49,1 A (5,5)
9,7 A (1,1)
11,3 A (20)
49,2 A (3,6)
8,4 A (1,8)
16,7 A (2,5)
Con el parámetro b*, la tendencia de la mayoría de las especies fue la disminución de b* en el duramen de un 6 a 20 %, siendo las especies S. mombin, C. costarricense, S. parahyba, P. quinata y C. odorata las que mostraron dicho comportamiento y manteniendo una coloración levemente amarillenta. Mientras las especies S. globulifera, H. alchorneoides y Z. ekmanii no mostraron diferencias entre el color de la albura y el duramen, presentando valores promedio de b* de 12,4. Finalmente, con la especie V. gentryi se incrementó el amarillamiento del duramen en un 9 %.
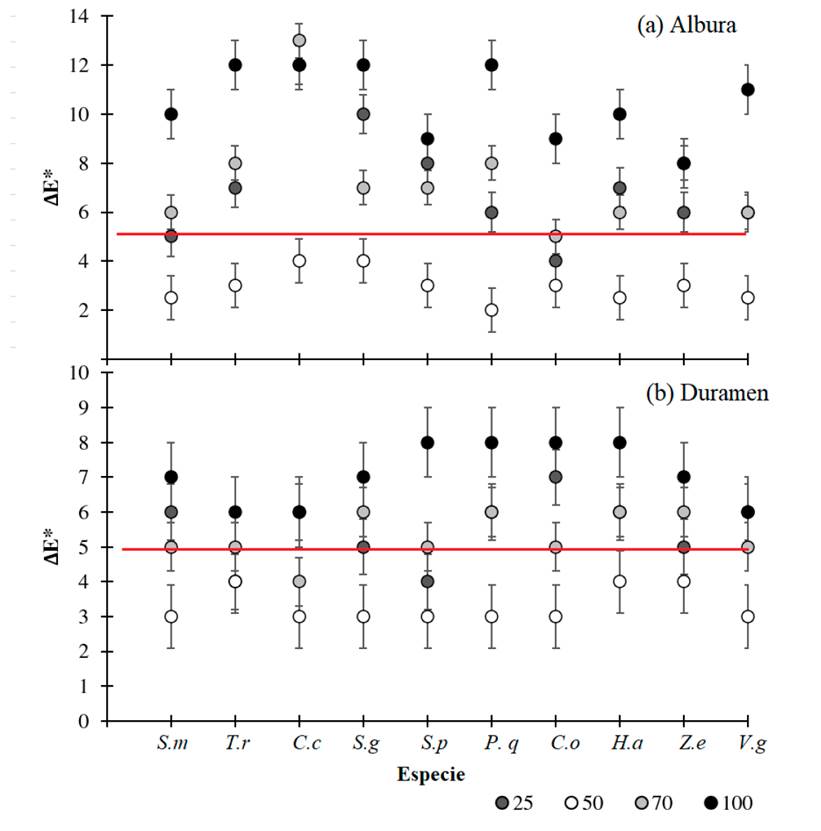
En la figura 3 se presenta el diferencial del color ∆E*, obtenido entre los colores tomados a las muestras físicas, y el color generado por cada protocolo de fotografiados aplicado tanto a la parte de albura como de duramen, a partir de ello se obtuvieron las siguientes características del estudio: i. todas las especies mostraron un patrón de comportamiento similar, con valores de ∆E* similares por tratamiento (con una variación inferior al 18 %); ii. el patrón también se mantuvo entre la albura y el duramen de las muestras teniendo comportamientos similares de los dos segmentos de la madera; iii. se determinó que la luminosidad al 50 % fue la que presentó valores ∆E* inferiores a 6, considerados como cambios percibidos por el ojo humano, este patrón fue constante con todas las especies; iv. el tratamiento de luminosidad al 100 % fue el tratamiento menos funcional con valores de ∆E* superiores a 8 en albura y a 6 en duramen, lo cual se considera como cambios bastante notables del color por el ojo humano; v. los tratamientos de luminosidad al 25 y 75 % mostraron variaciones en especie y albura y duramen, encontrando de manera general percepción de cambio notable del color de la madera y siendo tratamientos menos funcionales que la luminosidad al 50 %.
Figura 3: Valores de diferencial de color (∆E*) o según luminosidad en las secciones de albura y duramen en madera de diez especies arbóreas
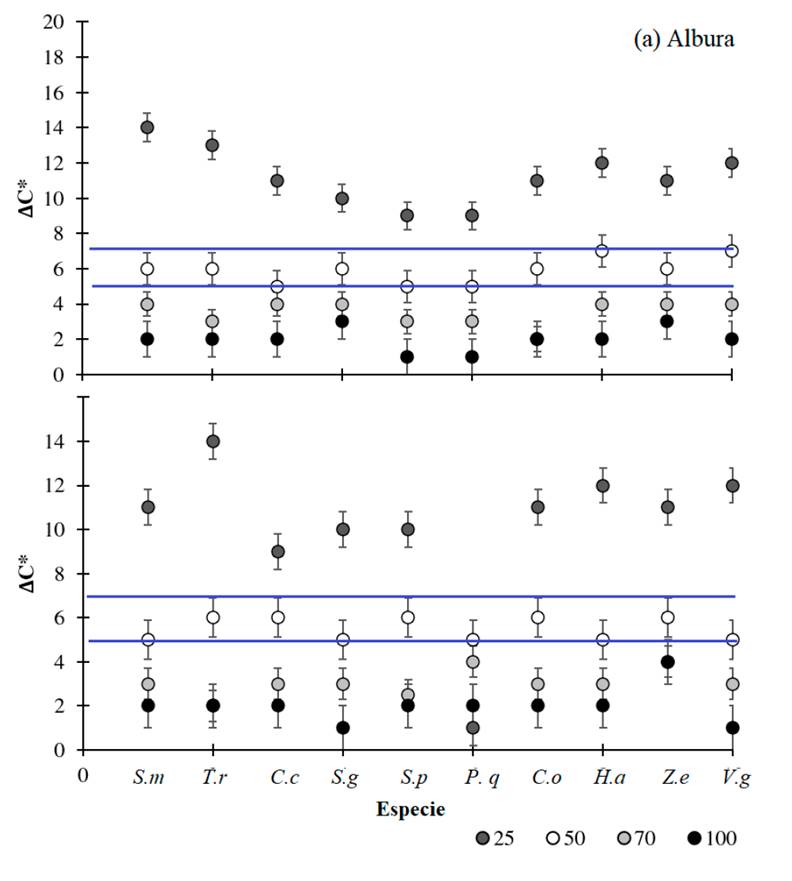
Al analizar el diferencial de saturación del color (∆C*), se determinó un mismo patrón para todas las especies, tanto en albura como en duramen (figura 4). Conforme la luminosidad se incrementó. el diferencial disminuyó, encontrándose que la luminosidad al 25 % generó una saturación muy alta del color con valores de ∆C* superiores a 10, mientras la saturación al 75 y 100 % fue muy baja (inferior a 5), lo que incidió en que la saturación de color fuese menor y los colores parecieran grisáceos; únicamente la luminosidad al 50 % presentó un mejor comportamiento en cuanto ∆C*, obteniendo valores entre 5 y 7, considerados como el nivel de saturación óptimo del color fotográfico con respecto a la muestras físicas: valores superiores a 7 denotan una alta saturación del color, mientras valores inferiores a 5 denotan poca saturación de colores y por ende una coloración muy tenue.
Figura 4: Valores de diferencial de chroma (∆C*) en función a la luminosidad de las imágenes de albura y duramen de diez especies arbóreas
Variación anatómica
En la tabla III se presenta la variación de la densidad y el diámetro promedio de los vasos con los cuatro tratamientos implementados. Con respecto a la densidad de vasos, se estimó un valor de 6 a 11 vasos por mm2, no encontrándose diferencias significativas en la luminosidad de 25 a 50 % de las diez especies, siendo valores estadísticamente similares; aspecto que varió con la luminosidad al 75 %, la cual únicamente en las especies S. mombin, P. quinata y H. alchorneoides no mostró diferencias con los tratamientos de luminosidad al 25 y 50 %, caso opuesto con el tratamiento de luminosidad al 100 %, que mostró diferencias significativas con los demás tratamientos en las diez especies y subestimando hasta en un 50 % la densidad de vasos, esto con respecto a la cantidad de vasos identificados con los métodos tradicionales con estereoscopio, obteniendo que los más exactos son al 25 y 50 %. Con respecto al diámetro de vasos, se determinó una variación de 95 a 185 µm, no encontrándose diferencias significativas en los tratamientos de luminosidad de 25 y 50 % y mostrando valores significativamente similares a los métodos tradicionales con estereoscopio, pero con diferencias entre los tratamientos de 75 y 100 %, que mostraron valores considerablemente inferiores (subestimaciones) del diámetro.
Nota: Valores entre paréntesis corresponden a la desviación estándar. Letras diferentes muestran diferencias con un nivel de significa α = 0,05.
Tabla III: Densidad de vasos y diámetro de vasos de diez especies arbóreas de Costa Rica generados por cuatro niveles de luminosidad en fotografía macroscópica
Especie
Densidad de vasos (vasos*mm-2)
Diámetro vasos (µm)
Tradicional
25 %
50 %
75 %
100 %
Tradicional
25 %
50 %
75 %
100 %
S. mombin
10 A (2)
11 A (2)
10 A (3)
11 A (2)
8 B (2)
103 A (24)
113 A (23)
102 A (23)
78 B (23)
57B (38)
T. rosea
11 A (2)
12 A (2)
12 A (2)
9 B (3)
6 B (3)
100 A (20)
115 A (21)
95 A (22)
59 B (35)
50 B (42)
C. costarricense
9 A (3)
9 A (3)
9 A (2)
7 B (2)
5 B (3)
105 A (23)
126 A (26)
109 A (28)
75 B (38)
58 C (39)
S. globulifera
6 A (2)
6 A (2)
5 A (3)
4 B (3)
3 B (2)
180 A (27)
189 A (29)
178 A (30)
108 B (36)
95 B (39)
S. parahyba
7 A (3)
6 A (3)
7 A (2)
5 B (3)
4 B (3)
228 A (31)
237 A (33)
228 A (26)
201 B (37)
195 B (44)
P. quinata
5 A (2)
5 A (2)
5 A (2)
4 A (3)
3 B (2)
130 A (20)
135 A (26)
125 A (31)
98 B (36)
81 B (39)
C. odorata
7 A (3)
6 A (3)
6 A (3)
4 B (2)
3 B (3)
229 A (20)
239 A (24)
224 A (28)
195 B (39)
161 B (45)
H. alchorneoides
4 A (2)
4 A (2)
4 A (3)
3 A (3)
2 B (2)
123 A (30)
135 A (36)
122 A (22)
96 B (37)
76 B (41)
Z. ekmanii
8 A (3)
8 A (3)
8 A (2)
6 B (3)
4 B (2)
109 A (23)
108 A (27)
98 A (32)
68 B (38)
58 B (42)
V. gentryi
11 A (3)
11 A (3)
12 A (3)
9 B (3)
5 B (3)
2186 A (25)
204 A (28)
185A (38)
157 B (44)
138 B (40)
Discusión
Diferenciación entre albura y duramen y su efecto en la fotografía
La diferenciación en la colorimetría entre la albura y el duramen de la madera se debe a que el primero cuenta con una acumulación de ceras, taninos y enzimas que se van acumulando debido a los procesos fisiológicos del árbol. Ayala et al. 13 mencionan que xilema que forma parte del duramen se caracteriza por tener una actividad fisiológica limitada y es considerado un reservorio de agua que es utilizado cuando el individuo entra a un estrés por déficit hídrico, esto permite acumular residuos y nutrientes que afectan significativamente el color de la madera; aspectos que según Marcelo-Peña et al. 17 se debe a compuestos orgánicos como: ceras, taninos y enzimas que tiende a oxidarse y reducirse al momento del secado la madera, lo que produce un cambio en la coloración en la madera. En el caso de la albura que forma parte del floema y las partes más activas del xilema, la dinámica fisiológica es mayor por el transporte de agua y nutrientes, con lo que la reserva de agua es menor y por tanto la acumulación de extraíbles, de ahí que se denote la madera con una mayor luminosidad y menores valores de a* y b* 12.
En el proceso de creación de la digitalización de material se deben tener claras las condiciones de fotografía y cómo la claridad de la albura y el duramen puede afectar la calidad de la imagen, Fioravanti et al. 6 mencionan que conforme mayor sea el conocimiento de la variación de color de una especie y cómo este debe ser considerado en la digitalización de material, la calidad de las imágenes será mayor. Ma y Min 18 destacan, para especies tropicales, la necesidad de conocer los rangos de luminosidad en los que se debe ajustar el microscopio en la secciones de albura y duramen, ya que pueden variar dependiendo las características de la especie 19.
Efecto del protocolo en la colorimetría de las muestras
En el proceso de virtualización de xilotecas, el color es una variable fundamental que debe ser controlada y manejada de forma protocolaria con el fin de mantener la reproducibilidad y representatividad de la imagen con respecto a la muestra física. Giachi et al. 9 consideraron fundamental la creación de estándares que homogenicen las condiciones de fotografiado y se minimice el sesgo por cambios de luminosidad o de equipo utilizado, ya que cambios no reportados del proceso pueden generar pérdida de precisión al momento de realizar análisis anatómicos o caracterización de las imágenes por parte de los expertos.
En el estudio se determinó que la potencialidad de reproducir el material a nivel macroscópico con una representatividad a la muestra física es posible, siempre y cuando las condiciones ambientales sean homogéneas y se realicen pruebas de calidad de imágenes. Bueno et al. 20 destacan que disponer de sistemas de fotografiado validados que sean reproducibles a nivel de región (por ejemplo el trópico), permite mejorar el desarrollo de investigaciones a nivel internacional y comparar y analizar poblaciones o especies a nivel macro, permitiendo tener un entendimiento más global de su comportamiento y desarrollo.
Ventajas y desventajas del protocolo propuesto
La metodología propuesta de luminosidad al 50 % mantiene valores de color y calidad de imagen suficientes para ser comparados directamente con las muestras en físico, aspecto que mantiene exactitud y precisión en comparación con la muestra real; Valverde et al. 22 destacan como fundamental para el proceso de digitalización de colecciones de xilotecas mantener la representatividad de las propiedades del material físico. En la actualidad hay una carencia de protocolos estandarizados para la representación de muestras, cada colección y organización ha propuesto protocolos que en muchos casos carecen de una metodología clara o validada 28, por tanto la propuesta actual permite mostrar una opción con una validez científica. Estudios previos desarrollados por Figueroa et al. 24 mostraron que los protocolos tradicionales se han enfocado en el escaneo de muestras con un control mínimo de la colorimetría y del efecto de luminosidad en las visualización de vasos y fibras en la cara transversal de la madera, por lo que la calidad de imágenes en mucho casos es difícil de comparar con otras xilotecas o colecciones académicas de fotografías.
Otra de las ventajas que muestra el protocolo es que se ha desarrollado por completo para especies tropicales, aspecto que es interesante ya que la diversidad colorimétrica y anatómica de las especies es mayor que en las regiones templadas, por tanto, estandarizar un procedimiento permitiría generar colecciones homogéneas que sean funcionales para procesos de aprendizaje con inteligencia artificial y creación de claves tradicionales de identificación 21. Pero también presenta limitaciones; primeramente, cuenta con un aumento específico de fotografiado de imagen, en este caso de 20 X, el cual debe ser nuevamente calibrado si se implementan otros aumentos, igualmente debe ser analizado con más especies forestales y es recomendable un nuevo estudio en el que se analicen especies comerciales ampliamente estudiadas en regiones tropicales, aspecto que permitiría hacer comparaciones con estudios previos. Además, sería relevante su realización con distintas marcas de instrumentación y condiciones de uso, con fin de afinar la metodología, la cual en primera instancia puede ser considerada como una línea base para la homogenización fotográfica bajo estándares en común 28.
Conclusiones
Se determinó que es posible generar un protocolo de ajuste fotográfico macroscópico en que la colorimetría de la imagen sea representativa a la muestra física. Los resultados no mostraron un patrón claro para las diez especies entre la albura y el duramen, encontrándose variaciones en los valores de color con énfasis en la luminosidad. Con respecto a la selección del mejor protocolo, se determinó para las diez especies tanto en albura como duramen que el uso una luminosidad al 50 % (correspondiente a 300 lux) es la óptima para tener coloraciones similares a la muestra física. Usar mayores luminosidades genera un aclaramiento de la muestra, lo cual se evidencia con mayor cambio del ∆E* y disminución del ∆C*, lo cual infiere que la representación no sea la mejor y en los análisis anatómicos se tienda a una subestimación de la densidad y el diámetro de los vasos. En cambio, el uso de una luminosidad inferior al 50 % generó un cambio susceptible del color, con un incremento de la saturación del color ∆C*, lo cual no repercutió en la parte del análisis anatómico y no mostró diferencias significativas con el tratamiento de luminosidad al 50 %.
Se debe considerar la propuesta metodológica como una línea base para el proceso de homogenización y estandarización de imágenes macroscópicas en especies tropicales, aspecto que permitiría en el futuro hacer estudios de mayor impacto al comparar especies desarrolladas en distintas regiones, o evaluar procesos de aprendizaje con inteligencias artificiales, igualmente se recomienda continuar con esta línea de estudios comparando especies comerciales ampliamente estudiadas y equipos con distintas características bajo las condiciones óptimas identificadas.
Acknowledgements
Agradecimientos
Se agradece a la Vicerrectoría de Investigación y Extensión del TEC por el financiamiento al proyecto “Implementación de tecnologías y aplicaciones de bajo costo para el estudio de la fisiología de especies arbóreas del trópico mesoamericano como herramienta para su conservación” Código 1401094
Referencias
License
Copyright (c) 2022 Juan Carlos Valverde, Dagoberto Arias, Geovanni Figueroa, Erick Mata, Nelson Zamora

This work is licensed under a Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.
From the edition of the V23N3 of year 2018 forward, the Creative Commons License "Attribution-Non-Commercial - No Derivative Works " is changed to the following:
Attribution - Non-Commercial - Share the same: this license allows others to distribute, remix, retouch, and create from your work in a non-commercial way, as long as they give you credit and license their new creations under the same conditions.




2.jpg)