DOI:
https://doi.org/10.14483/23448393.15993Published:
2020-10-05Issue:
Vol. 25 No. 3 (2020): September - DecemberSection:
Environmental EngineeringInfluencia de los suelos en la dinámica de transferencia de nutrientes en la interfase suelo-agua en un embalse tropical
Influence of Soils on Nutrient Transfer Dynamics at the Soil-Water Interface of a Tropical Reservoir
Keywords:
Water quality, Reservoir, Eutrophication, Flood, Nutrients (en).Keywords:
Calidad del agua, Embalse, Eutrofización, Inundación, Nutrientes (es).Downloads
References
R. G. Wetzel, Limnology: Lake and river ecosystem. San Diego: Academic Press, 2001.
D. Cunha, M. Carmo y W. K. Dodds, “Trends in nutrient and sediment retention in Great Plains reservoirs (USA)”, Environmental Monitoring and Assessment, vol. 186, n.° 2, pp. 1143–1155, 2014. https://doi.org/10.1007/s10661-013-3445-3
S. Wang, W. Rao, J. Qian, C. Mao y K. Li, “Phosphorus species in bottom sediments of the Three Gorges Reservoir during low and high water level periods”, Environmental Science and Pollution Research, vol. 27, pp. 17923–17934, 2020. https://doi.org/10.1007/s11356-020-08348-5
M. Lopera, L. Oviedo, D. C. Rodríguez y G. Peñuela, “Aplicación de ensayos en discontinuo para la determinación de flujos de metano y dióxido de carbono en la degradación del material vegetal en el embalse Topocoro”, Ingenierías USBMed, vol. 7, n.° 2, pp. 67-73, 2016. https://doi.org/10.21500/20275846.2598
B. Lim, B. Ki y J. H. Choi, “Evaluation of Nutrient Release from Sediments of Artificial Lake”, Journal of Environmental Engineer-ing, vol. 137, n.° 5, pp. 347–354, 2011. https://doi.org/10.1061/(ASCE)EE.1943-7870.0000337
A. Jorcin y M. G. Nogueira, “Temporal and spatial patterns based on sediment and sediment–water interface characteristics along a cascade of reservoirs (Paranapanema River, south-east Brazil)”, Lakes and Reservoirs: Science, Policy and Management for Sustainable Use, vol. 10, n.° 1, pp. 1–12, 2005. https://doi.org/10.1111/j.1440-1770.2005.00254.x
J. R. Zeldis, C. Depree, C. Gongol, P. South, A. Marriner y D. Schiel, “Trophic Indicators of Ecological Resilience in a Tidal Lagoon Estuary Following Wastewater Diversion and Earthquake Disturbance”, Estuaries and Coasts, vol. 43, pp. 223–239, 2020. https://doi.org/10.1007/s12237-019-00637-8
K. Y. Gin y A. P. Gopalakrishnan, “Sediment Oxygen Demand and Nutrient Fluxes for a Tropical Reservoir in Singapore”, Journal of Environmental Engineering, vol. 136, n.° 1, pp. 78–85, 2010. https://doi.org/10.1061/(ASCE)EE.1943-7870.0000119
R. Margalef, Limnología. Barcelona: Ediciones Omega S. A, 1983.
L. Zhu, C. Jiang, P. Zhang, D. Li y X. Zhu, “Eutrophication in the newly built Laohutan Reservoir during the initial im-poundment period: the role of nutrient loading”, Environmental Earth Sciences, vol. 74, n.° 6, pp. 4803–4812, 2015. https://doi.org/10.1007/s12665-015-4469-5
P. Tendaupenyu y C. H. D. Magadza, “Enrichment and geoaccumulation of metals in the superficial sediments of Lake Chivero, Zimbabwe”, Lakes and Reservoirs: Science, Policy and Management for Sustainable Use, vol. 24, pp. 275– 286, 2019. https://doi.org/10.1111/lre.12282
S. Rahutomo, J. L. Kovar y M. L. Thompson, “Inorganic and Organic Phosphorus in Sediments in the Walnut Creek Watershed of Central Iowa, USA”, Water, Air, and Soil Pollution volume, vol. 229, n.° 72, 2018. https://doi.org/10.1007/s11270-018-3721-5
Y. Chen, L. Wang, T. Liang, J. Xiao, J. Li, H. Wei y L. Dong, “Major ion and dissolved heavy metal geochemistry, distri-bution, and relationship in the overlying water of Dongting Lake, China”, Environmental Geochemistry and Health, vol. 41, pp. 1091–1104, 2019. https://doi.org/10.1007/s10653-018-0204-y
Y. C. Wang, F. X. Niu, S. B. Xiao, D. F. Liu, W. Z., Chen, Y. Li y L. Wang “Phosphorus Fractions and Its Summer’s Re-lease Flux from Sediment in the China's Three Gorges Reservoir”, Journal of Environmental Informatics, vol. 25, n.° 1, pp. 36–45, 2015. https://doi.org/10.3808/jei.201400260
L. Zhang, S. Wang y Z. Wu, “Coupling effect of pH and dissolved oxygen in water column on nitrogen release at wa-ter–sediment interface of Erhai Lake, China”, Estuarine, Coastal and Shelf Science, vol. 149, pp. 178–186, 2014. https://doi.org/10.1016/j.ecss.2014.08.009
X. Liu, R. Watts, J. Howitt y N. McCasker, “Carbon and nutrient release from experimental inundation of agricultural and forested floodplain soil and vegetation: influence of floodplain land use on the development of hypoxic blackwater during floods”, Marine and Freshwater Research, vol. 71, pp. 213-228, 2019. https://doi.org/10.1071/MF18452
M. W. Beutel, T. M. Leonard, S. R. Dent y B. C. Moore, “Effects of aerobic and anaerobic conditions on P, N, Fe, Mn, and Hg accumulation in waters overlaying profundal sediments of an oligo-mesotrophic lake”, Water Research, vol. 42, n.° 8-9, pp. 1953–1962, 2008. https://doi.org/10.1016/j.watres.2007.11.027
M. Ruiz, D. C. Rodríguez, E. Chica y G. Peñuela, “Calibration of two mathematical models at laboratory scale for pre-dicting the generation of methane and carbon dioxide at the entrance point of the Chucurí river to the Topocoro Reservoir”, Ingeniería y Competitividad, vol. 21, n.° 1, pp. 11-22, 2019. http://dx.doi.org/10.25100/iyc.v20i1.7651
International Hydropower Associate, GHG measurement guidelines for freshwater reservoir. London: International Hydropower Associate, 2010.
IPCC Guidelines for National Greenhouse Gas Inventories, “Intergovernmental Panel on Climate Change”, IPCC Guidelines for National Greenhouse Gas Inventories, 2006.
Instituto de Hidrología, Meteorología y Estudios Ambientales, “Protocolo para la estimación nacional y subnacional de biomasa-carbono en Colombia”, Instituto de Hidrología, Meteorología y Estudios Ambientales, 2010.
S. A. Orrego, J. I. Del Valle y F. H. Moreno, Medición de la captura de carbono en ecosistemas forestales tropicales de Colombia. Medellín: Universidad Nacional de Colombia, 2002.
Secretaría de Medio Ambiente y Recursos Naturales, “Norma Oficial Mexicana NOM-021-SEMARNAT-2000”. [En línea]. Disponible en: http://www.ordenjuridico.gob.mx/Documentos/Federal/wo69255.pdf
Instituto Geográfico Agustín Codazzi [IGAC], Métodos Analíticos del Laboratorio de Suelos. Bogotá D.C.: IGAC, 2006.
J. E. Rodriguez, D. C. Rodriguez y G. A. Peñuela, “Comparison of in Batch Aerobic and Anaerobic Processes for the Degradation of Organic Matter in a Tropical Reservoir”, Revista Facultad de Ingeniería, vol. 29, n.° 54, 2020. https://doi.org/10.19053/01211129.v29.n54.2020.10892
R. Baird, A. Eaton y E. Rice (Eds.), Standard methods for examination of water and wastewater. Washington: Ameri-can Public Health Association, American Water Works Association y Pollution Control Federation, 2017.
C. Zago, G. Capodaglio, S. Ceradini, G. Ciceri, L. Abelmoschi, F. Soggia y G. Scarponi, “Benthic fluxes of cadmium, lead, copper and nitrogen species in the northern Adriatic Sea in front of the River Po outflow, Italy”, Science of the Total Environment, vol. 246, n.° 2-3, pp. 121–137, 2000. https://doi.org/10.1016/S0048-9697(99)00421-0
R. L. Anckerman, “Soil and plant analysis. Agricultural Laboratories”. [En línea]. Disponible en: http://www.fao.org/3/ar117e/ar117e.pdf
R. Campillo y A. Sadzawka, “La acidificación de los suelos. Origen y mecanismos involucrados”. [En línea]. Disponible en: https://puntoganadero.cl/imagenes/upload/_5cc0957281b85.pdf
USDA, “Guía para la evaluación de la calidad y salud del Suelo”. [En línea]. Disponible en: http://www.nrcs.usda.gov/Internet/FSE_DOCUMENTS/stelprdb1044786.pdf
O. Casanova, “Introducción a la ciencia del suelo. Consejo de desarrollo científico venezolano”, Consejo de Desarrollo Científico y Humanístico (CDCH-UCV) de la Universidad Central de Venezuela, 2002.
W. H. Nowlin, J. L. Evarts y M. J. Vanni, “Release rates and potential fates of nitrogen and phosphorus from sediments in a eutrophic reservoir”, Freshwater Biology, vol. 50, n.° 2, pp. 301–322, 2005. https://doi.org/10.1111/j.1365-2427.2004.01316.x
R. A. Vollenweider, “Scientific fundamentals of the eutrophication of lakes and flowing waters, with particular reference to nitrogen and phosphorus as factors in eutrophication”, Technical report, Organisation for Economic Co-operation and Development, 1968.
How to Cite
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Download Citation
Recibido: 4 de marzo de 2020; Revisión recibida: 11 de agosto de 2020; Aceptado: 26 de agosto de 2020
Resumen
Contexto:
La construcción de un embalse implica inundar diferentes tipos de suelo, lo cual genera un gradiente de concentración que favorece la transferencia de nutrientes desde el suelo hacia la columna de agua. Los suelos proveen al embalse una entrada importante de nutrientes, lo cual, junto con otras fuentes, contribuye a futuro al proceso de eutrofización.
Método:
Este estudio evaluó, bajo condiciones anóxicas, la dinámica de transferencia del nitrógeno y el fósforo en la interfase suelo-agua, empleando tres tipos de suelos, caracterizados previo al proceso de inundación de un embalse tropical. Los ensayos se realizaron por medio de ensayos batch, los cuales se monitorearon por periodos de 30 días.
Resultados:
Los resultados indicaron que la máxima concentración de fósforo en la interfase agua-suelo se alcanzó en el día 24, la de nitrógeno amoniacal en el día 15 y la de nitrato en el día 30, donde el suelo asociado a la cobertura vegetal rastrojo alto tuvo el mayor aporte de nutrientes en todos los ensayos.
Conclusiones:
Se comprobó que la transferencia de nutrientes está asociada con la degradación de la materia orgánica presente en los suelos y a la reducción del oxígeno disuelto, lo que favorece una mayor liberación de amonio del suelo al agua. Además, se encontró que el gradiente de transferencia fue proporcional al tipo de textura del suelo.
Palabras clave:
Calidad del agua, embalse, eutrofización, inundación, nutrientes.Abstract
Context:
The construction of a reservoir implies flooding different types of soil, which generates a concentration gradient that favors nutrient transfer from the soil to the water column. Soils provide the reservoir with an important nutrient input, which, along with other sources, contributes to the eutrophication process.
Method:
This study evaluated, under anoxic conditions, the dynamics of nitrogen and phosphorus transfer at a soil-water interface using three types of soil, which was prior to the flooding process of a tropical reservoir. Batch tests were carried out and monitored for periods of 30 days.
Results:
The results indicated that the maximum phosphorus concentration in the water-soil interface was reached on day 24, on day 15 for ammoniacal nitrogen, and on day 30 for nitrate, where the soil associated with the high plant cover Rastrojo (Ra) had the highest nutrient intake in all trials.
Conclusions:
It was found that the transfer of nutrients is associated with the degradation of organic matter present in soils, as well as with the reduction of dissolved oxygen, which favors a greater release of ammonia from the soil to the water. Furthermore, it was found that the transfer gradient was proportional to the type of soil texture.
Keywords:
Eutrophication, flood, nutrients, reservoir, water quality..Introducción
Los embalses son cuerpos de agua artificiales que presentan características similares a los lagos naturales [1]- [3]. Generalmente son construidos para el abastecimiento de agua, el control de inundaciones y la generación de energía eléctrica; sin embargo, su proceso de construcción implica inundar una amplia extensión de suelo e introducir importantes modificaciones en el ambiente, ya que se transforma un ecosistema terrestre en uno acuático[4], [5].
Los diferentes tipos de suelos que son inundados se convierten en una fuente importante de nutrientes para los embalses, puesto que gran parte de la materia orgánica y los nutrientes que contienen estos, son transferidos a la columna de agua del embalse [6]. Como consecuencia de la oxidación de la materia orgánica contenida en el suelo, en los embalses nuevos se generan condiciones anóxicas que favorecen la liberación de nutrientes [7]- [9]. De esta manera, los suelos contribuyen a la contaminación del agua y, en conjunto con otras fuentes, a la eutrofización de los embalses [10].
Durante el proceso de transferencia, los nutrientes contenidos en el suelo fluyen hacia la columna de agua del embalse como respuesta al gradiente de concentración que se presenta entre ambas fases, siendo la difusión el principal mecanismo de transporte [11], [12]. Este es un proceso altamente complejo que depende no solo de los factores ambientales del agua como son el pH, potencial redox, oxígeno disuelto y temperatura, sino también de la actividad microbiana y de las características del suelo [13]- [15].
Dado que el ingreso de nutrientes a los embalses no solo se da a través del suelo, sino también por medio de sus afluentes, las dos vías en conjunto pueden conducir los embalses a un estado de eutrofización, es decir, a un enriquecimiento de nutrientes que estimula el crecimiento excesivo de plantas y algas acuáticas [16], situación que es particularmente grave en el trópico por la alta disponibilidad de luz y las cálidas temperaturas durante todo el año [8]. Lo anterior da lugar a que la transferencia de nutrientes sea un proceso que afecta la calidad del agua de los embalses, motivo por el cual es fundamental caracterizar los aportes de nutrientes que se dan desde el suelo, al ser una vía para la movilización de estos [14], [17]. Este es un aspecto indeseado, puesto que influye sobre la operación de los embalses y tiene un impacto negativo en los ambientes circundantes.
La mayoría de los estudios evalúan la transferencia de nutrientes a partir de los sedimentos de los cuerpos de agua continentales [3], [8], [11], [15]; no obstante, son muy pocos los estudios que evalúan la transferencia de nutrientes que tienen los suelos en los embalses previo al proceso de inundación o en embalses jóvenes, siendo un ejemplo el estudio realizado por Zhu et al. [10], en el cual se encontró que los embalses jóvenes son más frágiles al deterioro y que altas cargas de nutrientes son una condición necesaria la eutrofización. Una de las razones por la que existen pocos estudios sobre el tema es la falta de seguimientos y estudios de línea base que se realizan a los embalses antes de su llenado.
Este es un estudio pionero en Colombia, el cual tuvo como finalidad evaluar bajo condiciones anóxicas, la transferencia de nutrientes desde el suelo hacia la columna de agua, previo al proceso de llenado de un embalse tropical, a partir de tres tipos de suelo y mediante la aplicación de ensayos batch. Este artículo contribuye a mejorar el entendimiento de la influencia de los suelos en el ingreso de nutrientes y el proceso de eutrofización de los embalses nuevos, siendo importante para la toma de decisiones y para la gestión del recurso hídrico.
Materiales y métodos
Área de estudio
El embalse tropical está localizado en el departamento de Santander, Colombia, en el cañón donde el río Sogamoso cruza la Serranía de La Paz, a 75 km aguas arriba de su desembocadura en el río Magdalena y 62 km aguas abajo de la confluencia de los ríos Suárez y Chicamocha. La presa y el embalse se localizan en la jurisdicción de los municipios de Girón, Betulia, Zapatoca, Los Santos, Lebrija y San Vicente de Chucurí. El clima de la zona es tropical, caracterizado por tener una temperatura que oscila entre 24,6 y 30,0 °C, velocidad promedio de los vientos de 0,2 m/s, porcentaje de humedad de 51% y precipitación media de 3000 mm/año [18].
Definición del muestreo
Se definió un muestreo aleatorio estratificado teniendo en cuenta los lineamientos establecidos por [19] - [22]. De esta manera, a partir de imágenes aéreas y del estudio de impacto ambiental realizado en la zona, se delimitaron los tres estratos a muestrear correspondientes a las coberturas: rastrojo bajo (RB), rastrojo alto (RA) y pastizales arbolados (PA). A cada una de las coberturas se le calculó el área para conocer la proporción del estrato con respecto al área total del embalse y determinar el número de muestras requeridas dentro de cada uno de estos para muestreos estratificados. La asignación del tamaño de la muestra se realizó teniendo en cuenta factores como el número de árboles por hectárea, la importancia que tiene la estimación del carbono para cada estrato y la disponibilidad de información sobre el área.
Tipo y tamaño de las parcelas
La cuantificación de las coberturas ubicadas en el área del vaso del embalse tropical se llevó a cabo en parcelas cuadradas de 25 _ 25 m. El tamaño de las parcelas se seleccionó teniendo en cuenta la densidad arbórea (menor a 1111 árboles/ha), el área basal (árboles con DAP > 10 cm) y la cantidad de carbono almacenado (por tipo de cobertura). El número de parcelas se calculó usando tres criterios: el de matrices de decisión para la selección del número de parcelas de acuerdo con el tamaño y error requerido usando las tablas para bosque húmedo tropical no estacional definidas por el IDEAM [21], la mínima unidad estadística con cobertura de área para muestreos de bosques naturales [20] y las ecuaciones establecidas por Orrego et al. [22] para muestreos estratificados. Con el primer criterio se estableció que el número de parcelas n que debían muestrearse con el tamaño de la parcela seleccionada (25 _ 25 m) era de doce, con un porcentaje de error del muestreo definido por el límite superior del error promedio calculado para la estimación de la biomasa igual a 14,5% con el fin de obtener un nivel de esfuerzo en el monitoreo de carbono según la relación B-C (biomasa-carbono). Usando el criterio de la unidad mínima estadística, tres por estrato y teniendo en cuenta que el área a muestrear fuera igual a 0,05 ha y no inferior (área de muestreo para inventarios forestales de carbono), se obtuvieron las doce parcelas.
En la selección del sitio se utilizaron los siguientes criterios: condiciones locales de sitio que incluye el clima y la edafología, factores de disturbio, viabilidad y la logística (acceso, cercanía a sitio de residencia, seguridad de la zona). Con la finalidad de disminuir los factores disturbios de las parcelas permanentes establecidas y tratar en lo posible que el efecto de borde sea el mínimo, se dejó una franja amortiguadora de 100 m, tal como lo sugiere IDEAM [21]. Se tuvo en cuenta que no se hubiesen realizado procesos de tala de árboles con diámetro mayor a 10 cm (D > 10 cm) y que todas las parcelas estuvieran ubicadas por debajo de la cota 300 que corresponde a la cota de inundación del embalse. La ubicación del primer punto de la parcela se determinó al azar, usando un muestreo sistemático con el fin de evitar la selección subjetiva de las áreas para la ubicación de las parcelas que eventualmente podrían generar sesgos en las estimaciones.
Análisis de suelo
Las muestras objeto de estudio fueron obtenidas de las diferentes coberturas vegetales presentes en el embalse tropical previo al proceso de llenado. Se emplearon muestras de suelos denominadas S1RB, S2RA y S3PA provenientes de las coberturas vegetales RB, RA y PA, respectivamente, dado que estas presentaron un mayor contenido de materia orgánica y una mayor concentración de nutrientes en relación con el resto de los suelos evaluados en estudios previos como parte del establecimiento de la línea base de la investigación. Siguiendo las recomendaciones establecidas en la Norma Oficial Mexicana NOM-021-SE- MARNAT-2000 [23], por cada tipo de suelo se tomaron en campo muestras compuestas de 1 kg a una profundidad de 0-5 cm, las cuales se almacenaron en bolsas plásticas Ziploc y se refrigeraron a 4 °C para conservar sus características fisicoquímicas y evitar la pérdida o el ingreso de nutrientes.
Con la finalidad de determinar las condiciones iniciales de los suelos antes de empezar los experimentos, fue necesario realizar el análisis de sus propiedades fisicoquímicas. Para esto se tomaron submuestras de los tres tipos de suelo y se analizó el porcentaje de humedad, pH, capacidad de intercambio catiónico (CIC), textura, densidad aparente, contenido de materia orgánica, nitratos, nitrógeno amoniacal, nitrógeno total Kjeldahl (NTK) y fósforo disponible según las metodologías analíticas del Instituto Geográfico Agustín Codazzi [24], [25]. Los análisis se realizaron en el laboratorio del Grupo Diagnóstico y Control de la Contaminación (GDCON) de la Universidad de Antioquia, laboratorio acreditado por el Instituto de Hidrología, Meteorología y Estudios Ambientales (IDEAM) en la norma 17025:2005 bajo la resolución 3564/2014.
Sistema experimental en batch
Los ensayos en batch se realizaron utilizando botellas ámbar de vidrio de un litro de capacidad para evitar la interferencia de la luz y simular las condiciones del fondo del embalse. Las botellas fueron mufladas previamente a una temperatura de 550 °C durante cuatro horas para eliminar cualquier traza de material orgánico que pudiera interferir en los experimentos. Para cada ensayo se usaron 50 g de suelo y una altura de columna de agua 0,15 m, empleando 650 ml de agua desionizada. Las botellas fueron cerradas herméticamente y se ubicaron en el laboratorio durante todo el experimento a temperatura ambiente (25 °C). Para inducir las condiciones anóxicas que se presentan un embalse, se burbujeo nitrógeno gaseoso durante un minuto. La duración del experimento se definió de 30 días siguiendo los estudios realizados por Gin y Gopalakrishnan [8] y Zhu et al. [10]. El diseño experimental utilizado fue análisis estadístico de tres factores (tipo de suelo), diez niveles (número de lecturas realizadas) y una réplica, la cual se realizó por duplicado.
Análisis de laboratorio
La transferencia de nutrientes se determinó a partir de las concentraciones de nitrógeno y fósforo medidas en el agua de cada botella. La lectura de los parámetros fisicoquímicos en las muestras, tales como nitratos, nitrógeno amoniacal, fosfatos y DQO, se realizaron siguiendo las metodologías establecidas en el Standard Methods [26]. Los parámetros directos (pH, potencial redox, oxígeno disuelto y temperatura) se realizaron empleando una sonda multiparamétrica (Quanta-hidrolab).
Estimación de flujo de nutrientes
La expresión propuesta por Zago et al. [27] permite estimar los flujos de nutrientes a partir de los gradientes de concentración obtenidos en las muestras de agua en intervalos de tiempo determinados. Valores positivos del flujo indican que la especie química de interés es liberada desde el suelo hacia la columna de agua, mientras que valores negativos del flujo indican que el suelo actúa como un sumidero, es decir, que la transferencia ocurre del agua hacia el suelo.

Donde Fi es el flujo en el intervalo de tiempo considerado (g/m2/d), Ci es la diferencia de concentración en el intervalo de tiempo considerado (g/m3), H altura de la columna de agua (m) y ti es el intervalo de tiempo entre las mediciones i yi + 1(d):
Análisis estadístico
Por medio del programa R, versión 3.2.4, se realizaron los estadísticos básicos: máximo, mínimo, promedio y desviación estándar.
Resultados y discusión
Caracterización de los suelos
En la Tabla I se presentan las características fisicoquímicas de los tres tipos de suelo utilizados en los ensayos. De acuerdo con los resultados obtenidos, los suelos S1RB y S2RA se clasificaron como moderadamente ácidos, ya que presentaron valores de pH en el rango de 5,5-6,4 [23], [28], lo cual, según Campillo [29], está asociado con una deficiencia en las concentraciones de nitrógeno y fósforo. Por su parte, el suelo S3PA se clasificó como ácido por tener un valor contenido en el rango de 4,6-5,4 [23], [28] y de forma opuesta se puede asociar con un leve incremento en la concentración de estos nutrientes. La medida del pH es fundamental en la caracterización de los suelos debido a que este parámetro afecta la disponibilidad de nutrientes, la actividad microbiana y la toxicidad asociada a ciertos metales en forma disuelta.
Tabla I: Características físicas y químicas de los suelos usados en el experimento.
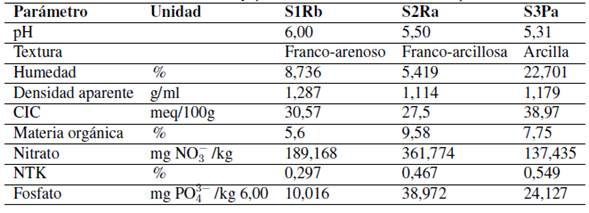
Tomando como referencia el triángulo textural propuesto por la USDA [30] y los criterios establecidos por Casanova [31], el suelo S1RB fue clasificado como franco-arenoso; por lo tanto, en este suelo las posibilidades de infiltración del agua y procesos de lavado serán mucho mayores, disminuyendo la capacidad para retener agua y liberar nutrientes. El suelo S2RA clasificó como franco-arcillosa, en este tipo de suelo se ve favorecida la porosidad y, por tanto, la capacidad de infiltración del agua, la actividad microbiana, el proceso de descomposición de la materia orgánica y la movilización de los nutrientes. Finalmente, dado que el suelo S3PA presentó una textura arcillosa, su capacidad de retener agua y nutrientes es alta y la de movilización de nutrientes tiende a ser baja en comparación con los otros tipos de suelo.
Al comparar los valores del contenido de materia orgánica cuantificados en los tres tipos de suelos con la clasificación establecida por [23], [28], se encuentra que los tres suelos presentaron un alto contenido (> 4,01 %), siendo mayor el porcentaje de materia orgánica en S2RA (9,58 %), seguido de S1RB (5,60 %) y finalmente, S3PA (7,55 %). Teniendo en cuenta esta misma clasificación, el contenido de fósforo fue clasificado como moderadamente bajo (10-15 mg/kg) para S1RB, moderadamente alto (21-25 mg/kg) para S3PA y muy alto (> 36 mg/kg) para S2RA. En general, los tres tipos suelos mostraron un alto contenido de NTK (> 0,221 %) y bajo contenido de amonio, pero para los nitratos los suelos S1RB y S2RA presentaron un contenido medio y el suelo S3PA un contenido bajo. Al relacionar los resultados de las características fisicoquímicas iniciales encontradas para los tres tipos de suelo, se esperaría que la transferencia de nutrientes desde el suelo hacia la columna de agua sea mayor para el suelo S2RA, puesto que se verá favorecida por el mayor contenido de materia orgánica y el tipo de textura que presenta.
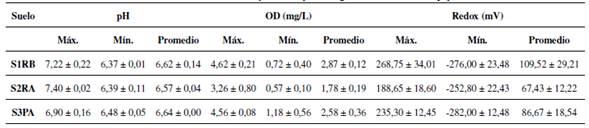
Variables fisicoquímicas en el agua
En la Tabla II se encuentran los valores máximos, mínimos y promedios para las variables de pH, oxígeno disuelto y potencial redox, los cuales se obtuvieron a partir de las mediciones realizadas en la columna de agua en los ensayos en batch. En general, para los tres tipos de suelo no se presentaron grandes fluctuaciones en el valor del pH, teniendo un valor promedio de 6,61 ± 0,05 para todos los experimentos. Por otra parte, las concentraciones de oxígeno disuelto (OD) variaron durante el experimento, pero de acuerdo con los valores promedios obtenidos para los tres tipos de suelo, lo hicieron alrededor de las condiciones anóxicas (1,78 mg/L - 2,97 mg/L). En forma general, el OD fue disminuyendo a lo largo del periodo de análisis, situación debida a la demanda de oxígeno ejercida por la degradación de la materia orgánica presente en los tres tipos de suelo. Sin embargo, como el suelo S2RA registró un mayor contenido de esta, sus valores de OD medidos fueron más bajos respecto a los otros suelos. En cuanto al potencial redox, los valores fueron positivos al inicio de los experimentos y luego negativos durante el transcurso del periodo de estudio, alcanzando valores mínimos de -274,00 mV para S1RB, -252,80 mV para S2RA y -282.00 mV para S3PA.
Este comportamiento se relacionó directamente con la disminución que presentó el oxígeno. De acuerdo con lo encontrado por Zhang yWang [15], la variabilidad en los valores del pH y OD en la columna de agua de los ensayos desempeña un papel importante en la liberación de nutrientes del suelo al cuerpo de agua, ya que condiciona la solubilidad y, por lo tanto, la disponibilidad de estos.
Tabla II: Valores de las variables fisicoquímicas pH, oxígeno disuelto (OD) y potencial redox.
Dinámica de la transferencia de nutrientes
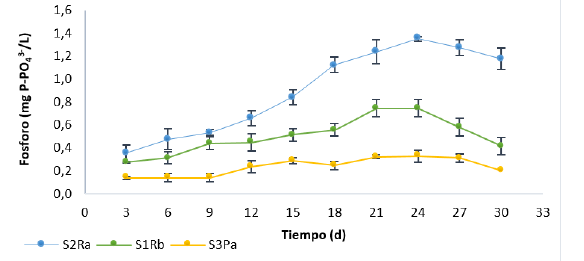
En la Figura 1 se muestra el comportamiento del fosfato en el agua para los tres tipos de suelos. Los resultados muestran un incremento en la concentración de PO3/4 en el agua contenida en el suelo S2RA que corresponde, a su vez, al suelo con mayor contenido de materia orgánica y fósforo disponible en su composición inicial y que, además, se caracterizó por una textura franco-arcillosa, situación que favorece los procesos de transferencia de nutrientes desde y hacia el medio. La menor concentración de fosfatos en el agua se dio para el suelo S3PA, lo que está relacionado con su textura arcillosa, la cual suele retener los nutrientes y no permite un adecuado proceso de intercambio suelo-agua.
Figura 1: Concentración de fosfato (PO3 4 ) en la columna de agua de los ensayos batch para los tres tipos de suelo
Tanto para los ensayos con S1RB como S2RA se evidenció un incremento en la concentración de fosfato hasta el día 24 y, posteriormente, se dio lugar a una disminución. Este fenómeno se correlacionó con el pH, donde valores de pH por encima de 7 fueron determinados en los días 27 y 30, con valores de 7,17 y 7,40 para S1RB y 7,24 y 7,05 para S2RA respectivamente, para los demás días los valores de pH oscilaron entre 6,37 a 6,82. En el caso de los suelos, valores de pH por encima de 7 afectaron la disponibilidad del fosforo, ya que este se acompleja con el calcio presente, formando precipitados. Para los ensayos con el suelo S3PA, esta tendencia no estuvo tan marcada y las concentraciones de fosforo fueron muy constantes a lo largo de todos los ensayos, al igual que el pH, con valores que oscilaron entre 6,48 y 6,90.
Adicionalmente, se encuentra que existe una relación directa entre el comportamiento del oxígeno disuelto y la transferencia de fosfato desde el suelo hacia la columna de agua. A medida que se reducen las concentraciones de oxígeno disuelto en el agua como consecuencia de la mineralización de la materia orgánica y se logran condiciones anóxicas, la concentración de fosfato se incrementa, lo cual puede evidenciarse en la Figura 1, donde para los tres tipos de suelo la máxima concentración de PO3- 4 se alcanza entre los días 21 y 24 con concentraciones de oxígeno entre 1,45 y 1,71 mg/L, comportamiento similar al encontrado por Zhu et al. [10], en cuyo estudio el fósforo influenció el cuerpo de agua durante los primeros 20 días. De acuerdo con Wetzel [1], las condiciones anóxicas asociadas a la reducción del oxígeno disuelto y de los valores del potencial redox favorecen la liberación de PO3- 4 desde el suelo.
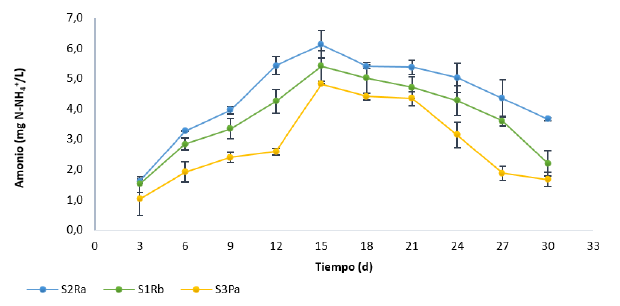
En cuanto al nitrógeno amoniacal (NH+ 4), se observó un comportamiento similar al descrito para el fosfato, es decir, se da en el transcurso del experimento un incremento progresivo de las concentraciones (Figura 2). Sin embargo, a diferencia de este, la máxima concentración de NH+ 4 se presentó el día 15, mucho más rápido en comparación con el fosfato, y a partir de este empieza un decaimiento en la concentración de amonio en el agua para los tres tipos de suelos. La liberación de NH+4 desde el suelo es el resultado de las bajas tasas de nitrificación biológica y asimilación de NH+ 4, lo cual se debe a la reducción en las concentraciones de oxígeno disuelto, de modo que al no favorecerse la oxidación del NH+ 4 a nitritos y nitratos se da su liberación al medio acuoso [1], [15]. Esta situación se ve reflejada hasta el día quince, donde se alcanza el máximo de transferencia y predominio de las condiciones necesarias para llevar a cabo esta y, posteriormente, se da un decaimiento, indicando un cambio en la cinética de transferencia de la interfase suelo-agua.
Figura 2: Concentración de nitrógeno amoniacal (NH+4) en la columna de agua de los ensayos batch para los tres tipos de suelos.
Un pH entre 7 y 8 es requerido para un óptimo crecimiento de las bacterias nitrificantes [8], rango del cual se alejan un poco los valores promedio de pH obtenidos en los experimentos, lo que resulta en una baja tasa de conversión de NH+ 4 a nitrato (NO - 3 ). En estas condiciones anóxicas la tasa de mineralización del amonio excede a la de nitrificación [32].
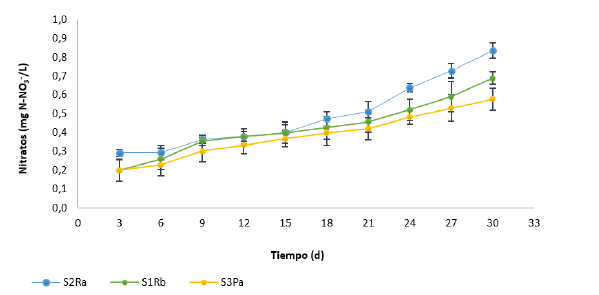
Lo descrito previamente se ve reflejado claramente en la Figura 3, donde la transferencia del nitrato es mucho más lenta que la de nitrógeno amoniacal y tiende a ser más estable hasta aproximadamente el día quince. A partir de esta fecha, se incrementa el proceso de transferencia por la disminución del oxigeno disuelto, lo que favorece las condiciones anóxicas, alcanzándose la máxima concentración de NO- 3 al día 30 que fue la máxima experimentación.
Figura 3: Concentración de nitrato (NO3 ) en la columna de agua de los ensayos batch en los tres tipos de suelo.
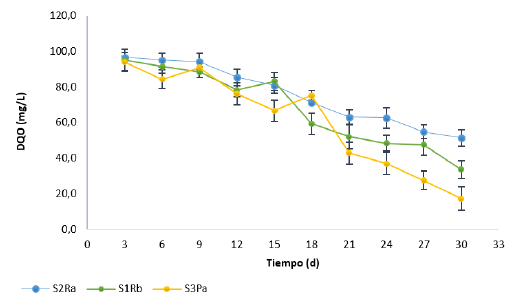
Finalmente, de acuerdo con el comportamiento de la DQO en el agua (Figura 4), se observa que esta disminuye su concentración durante toda la experimentación, indicando procesos de degradación anóxicos y anaerobios de la materia orgánica presente. Comparando los tres tipos de suelo se encuentra que la mayor degradación de materia orgánica se dio en el suelo S3PA, suelo de características arcillosas.
Figura 4: Concentración de la DQO en la columna de agua de los ensayos batch en los tres tipos de suelo.
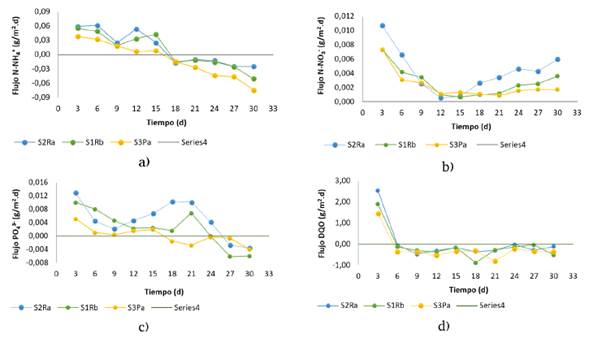
Análisis de flujos
Se encontró que los tres tipos de suelo liberaron nitrógeno y fósforo (Figura 5), en función del gradiente de concentración que presentaron entre la columna de agua y el agua contenida en los poros del suelo. Este resultado está asociado con la mineralización de la materia orgánica y es similar a lo observado por [10]. Para el caso del amonio (Figura 5a), resultados de flujos fueron positivos hasta el día quince, con valores promedio de 0,0397 g/m2.d, 0,0450 g/m2.d y 0,0206 g/m2.d para los suelos S1RB, S2RA y S3PA, respectivamente. Posteriormente, los flujos fueron negativos, indicando flujos de amonio desde la columna de agua hacia los suelos, es decir, una retención de estos y en mayor proporción para el suelo S3PA, dadas sus características arcillosas. Este fenómeno corrobora lo encontrado en las concentraciones de amonio en la columna de agua, donde la cinética de transferencia disminuyó a partir del día quince. En el caso de los flujos de nitrato (Figura 5b), todos los flujos fueron positivos durante toda la experimentación, es decir, fueron desde el suelo hacia la columna de agua; sin embargo, en el día quince se evidencia una disminución de los flujos en los tres tipos de suelos, lo que coincide con los resultados de amonio y se asocia con procesos de desnitrificación posterior a los quince días por el agotamiento del oxígeno disuelto, lo cual favorece este proceso.
Figura 5: Flujos de nutrientes y materia orgánica en los ensayos en bacth.
La Figura 5c muestra los flujos para el fosfato, en este caso se da una liberación hacia la columna de agua hasta el día 24 para los suelos S1RB y S2RA y, posteriormente, un cambio de flujo de la columna al suelo, lo que fue asociado con el aumento de pH. Esto favorece la formación de especies insolubles por el acomplejamiento del calcio presente en los suelos con los fosfatos. En este sentido, los suelos analizados se caracterizan por acumular sales solubles, principalmente calcio y magnesio, donde el contenido de calcio depende principalmente del contenido de arcilla, de la materia orgánica presente y de los procesos de meteorización y lixiviación. De este modo, la presencia de calcio permite dominar el complejo de intercambio a pH cerca de la neutralidad o ligeramente alcalino.
Finalmente, para la DQO (Figura 5d) se dio un fenómeno de transferencia desde la columna de agua al suelo durante todo el tiempo, ya que los resultados de flujo fueron negativos para los tres tipos de suelos estudiados. Este fenómeno da lugar a la formación de sumideros de carbono en los embalses, lo que contribuye a reducir las emisiones de gases de efecto invernadero en los embalses. Los resultados de flujo permiten inferir que, en el caso del embalse influenciado por estas coberturas de suelo, el amonio podría tener la tendencia a liberarse en la columna de agua en los primeros días de inundación y, posteriormente, podría ocurrir un agotamiento. En el caso de los nitratos, el proceso puede ser a largo plazo por el proceso de desnitrificación. Para el caso del fosfato, la liberación a la columna de agua podría ser más extensa que el amonio, lo que contribuiría en mayor grado con el aumento en la eutrofización. De igual forma, se concluye que los suelos analizados son una fuente de nutrientes y que pueden contribuir con los procesos de eutrofización en el embalse, estos mismos resultados fueron obtenidos por [33].
Conclusiones
Los ensayos batch bajo condiciones anóxicas mostraron que los tres tipos de suelo evaluados pertenecientes al vaso del embalse, previo al llenado de este, transfieren tanto nitrógeno como fósforo del suelo a la columna de agua, incrementando las concentraciones de estos nutrientes en el tiempo y asociado a fenómenos de degradación de la materia orgánica y a los cambios en el gradiente de concentración en la interfase suelo-agua. A su vez, se evidenció que la liberación tanto de fosfato como amonio estuvo asociada a la reducción en la concentración de oxígeno disuelto, por lo tanto, el flujo de nitrógeno amoniacal fue más alto en comparación con el flujo de nitrato, situación presentada por la inhibición en los procesos de nitrificación. Adicionalmente, la transferencia de nutrientes fue proporcional tanto a la concentración de materia orgánica como al tipo de textura del suelo, puesto que la transferencia fue mayor desde el suelo asociado a la cobertura vegetal rastrojo alto (S2RA), el cual presentó el mayor contenido de materia orgánica y una textura franco-arcillosa que favorece los procesos de intercambio suelo-agua. Con este estudio se concluye que los suelos evaluados son una fuente importante de nutrientes que pude afectar la calidad del agua del embalse en el tiempo posterior a su llenado y que junto con otras fuentes antropogénicas puede conducir a la eutrofización.
Acknowledgements
Agradecimientos
Los autores agradecen el apoyo financiero brindado por el Programa Científico Colombiano,en el marco de la convocatoria de propuestas Ecosistema Científico (Contrato No. FP44842-218-2018). Además, agradecen a la empresa ISAGEN y al grupo GDCON de la Universidad de Antioquia por el financiamiento a través del acuerdo 47/26: “Cuantificación de las emisiones de GEI para el Proyecto Hidroeléctrico Sogamoso”.
Referencias
License
Copyright (c) 2020 Diana Catalina Rodriguez Loaiza, Tatiana Arias, Gustavo Peñuela

This work is licensed under a Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.
From the edition of the V23N3 of year 2018 forward, the Creative Commons License "Attribution-Non-Commercial - No Derivative Works " is changed to the following:
Attribution - Non-Commercial - Share the same: this license allows others to distribute, remix, retouch, and create from your work in a non-commercial way, as long as they give you credit and license their new creations under the same conditions.





2.jpg)