DOI:
https://doi.org/10.14483/23448393.15298Publicado:
2020-03-12Número:
Vol. 25 Núm. 1 (2020): Enero - AbrilSección:
Ingeniería de PetróleosDiseño Conceptual de una Planta de Extracción de Saponinas Presentes en el Jugo de Fique
Conceptual Design or a Plant of Extraction of Saponins Presents in the Fique’s Juice
Palabras clave:
decision matrix, extraction, fique, saponins (en).Palabras clave:
Extracción, fique, matriz de decisión, saponinas (es).Descargas
Referencias
Cadena Productiva Nacional del Fique, “Guía ambiental del subsector fiquero”. [En línea]. Disponible en: https://www.finagro.com.co/sites/default/files/node/basic-page/files/guia_ambiental_subsector_fiquero.pdf.
Ministerio de Agricultura de Colombia, “Evaluaciones agropecuarias municipales”, 2016. [En línea]. Disponible en: http://www.agronet.gov.co/Documents/Fique.pdf#search=fique
Ministerio de Agricultura de Colombia, “Sistema de información de gestión y desempeño de organizaciones de cadenas”, 2016. [En línea]. Disponible en: https://sioc.minagricultura.gov.co/Pages/SIOC.aspx
M. A. Velásquez, Biotransformación de compuestos esteroidales provenientes de jugo de fique, Tesis de grado, Universidad Pontificia Bolivariana, Medellín, 2012.
P. Galeano y D. García, Optimización del proceso de biotransformación del jugo de fique empleando Cunninghamella spp, Tesis de grado, Universidad Pontificia Bolivariana, Medellín, 2006.
M. E. Ramírez et al., Aprovechamiento integral del fique: usos alternativos y su potencial. Medellin: Isagen, 2010.
E. Moghimipour y S. Handali, “Saponin: Properties, methods of evaluation and applications”, Annual Research and Review in Biology, vol. 5, n.◦ 1, pp. 207-220, 2015. https://doi.org/10.9734/ARRB/2015/11674
I. Arslan y A. C¸ elik, “Saponin rich fractions (SRPs) from soapwort show antioxidant and hemolytic activity”, APCBEE Procedia, vol. 7, pp. 103-108, 2013. https://doi.org/10.1016/j.apcbee.2013.08.019
J. Sidana, B. Singh y O. P. Sharma, “Saponins of agave: Chemistry and bioactivity”, Phytochemistry, vol. 130, pp. 22-46, 2016. https://doi.org/10.1016/j.phytochem.2016.06.010
O. Benavides, O. Arango, A. Hurtado y M. Rojas, “Cuantificación de sapogeninas de jugo fresco y fermentado de fique (Furcraea gigantea) mediante cromatografía líquida de alta resolución (HPLC-PDA)”, Información Tecnológica, vol. 23, 2012. http://dx.doi.org/10.4067/S071807642012000300009
C. Y. Cheok, H. A. Salman y R. Sulaiman, “Extraction and quantification of saponins: A review”, Food Research International, vol. 59, n.◦ 5, pp. 16-40, 2014. https://doi.org/10.1016/j.foodres.2014.01.057
M. Y. Heng, S. N. Tan, J. W. Yong y E. S. Ong, “Emerging green technologies for the chemical standarization of botanicals and herbal preparations”, TrAC Trends in Analytical Chemistry, vol. 50, 2013. https://doi.org/10.1016/j.trac.2013.03.012
K. W. Chan, S. Iqbal, N. M. Khong, D. J. Ooi y M. Ismail, “Antioxidant activity of phenolics-saponins rich fraction prepared from defatted kenaf seed meal”, LWT-Food Science and Technology, vol. 56, pp. 181-186, 2014. https://doi.org/10.1016/j.lwt.2013.10.028
Ö. Güçlü-Üstündağ y G. Mazza, “Extraction of saponins and cyclopeptides from cow cockle seed wuith pres- ˘ surized low polarity water”, LWT-Food Science and Technolgy, vol. 41, n.◦ 11, pp. 1600-1606, 2008. https://doi.org/10.1016/j.lwt.2007.10.019
Ö. Güçlü-Üstündağ, J. Balsevich y G. Mazza, “Pressurized low polarity wather extraction of saponins from cow cockle seed”, Journal of Food Engineering, vol. 80, n.◦ 5, pp. 619-630, 2007. https://doi.org/10.1016/j.jfoodeng.2006.06.024
P. S. Saravana, A. T. Getachew, R. Ahmed, Y. J. Cho, Y. B. Lee y B. S. Chun, “Optimization of phytochemicals production from the ginseng by-products using pressurized hot water: Experimental and dynamic modelling”, Biochemical Engineering Journal, vol. 113, n.◦ 9, pp. 141-151, 2016. https://doi.org/10.1016/j.bej.2016.06.006
Y. Liu et al., “New steroidal saponins from the rhizomes of Paris delavayi and their cytotoxicity”, Fitoterapia, vol. 111, n.◦ 6, pp. 130-137, 2016. https://doi.org/10.1016/j.fitote.2016.04.018
A. Estrada, G. S. Katselis, B. Laarveld y B. Barl, “Isolation and evaluation of immunological adjuvant activities of saponins from Polygala senega L.”, Comparative Immunology, Microbiology and Infectious Diseases, vol. 23, n.◦ 1, pp. 27-43, 2000. https://doi.org/10.1016/S01479571(99)00020-X
Y. Sun, J. Liu, H. Yu y C. Cong, “Isolation and evaluation of immunological adjuvant activities of saponins from the roots of Pulsatilla chinensis with less adverse reactions”, International Immunopharmacology, vol. 10, n.◦ 5, pp. 584-590, 2010. https://doi.org/10.1016/j.intimp.2010.02.006
Y. Ren, Y. Chen, B. Hu, H. Wu, F. Lai y X. Li, “Microwave-assisted extraction and a new determination method for total steroid saponins from Dioscorea zingiberensis C.H. Wright”, Steroids, vol. 104, n.◦ 12, pp. 145-152, 2015. https://doi.org/10.1016/j.steroids.2015.09.008
Y. Chen, M. Y. Xie y X. F. Gong, “Microwave-assisted extraction used for the isolation of total triterpenoid saponins from Ganoderma atrum”, Journal of Food Engineering, vol. 81, n.◦ 7, pp. 162-170, 2007. https://doi.org/10.1016/j.jfoodeng.2006.10.018
M. Vinatoru, “An overview of the ultrasonically assisted extraction of bioactive principles from herbs”, Ultrasonics Sonochemistry, vol. 8, n.◦ 7, pp. 303-313, 2001. https://doi.org/10.1016/S1350-4177(01)00071-2
J. Azmir et al., “Techniques for extraction of bioactive compounds from plant materials: A review”, Journal of Food Engineering, vol. 117, n.◦ 8, pp. 426-436, 2013. https://doi.org/10.1016/j.jfoodeng.2013.01.014
M. G. Cares, Y. Vargas, L. Gaete, J. Sainz y J. Alarcon, “Ultrasonically assisted extraction of bioactive principles ´ from Quillaja saponaria Molina”, Physiscs Procedia, vol. 3, n.◦ 1, pp. 169-178, 2010. https://doi.org/10.1016/j.phpro.2010.01.024
J. Wu, L. Lin, F. Chau, “Ultrasound-assisted extraction of ginseng saponins from ginseng roots and cultured ginseng cells”, Ultrasonics Sonochemistry, vol. 8, n.◦ 10, pp. 347-352, 2001. https://doi.org/10.1016/s1350-4177(01)00066-9
R. M. Prado, Evaluación de técnicas de extracción de saponinas de la quinua (Chenopodium quinoa Willd) como alternativa de mejoramiento de la cadena productiva en Cundinamarca, Tesis de grado, Universidad Nacional Abierta y a Distancia, Bogotá, 2018.
V. Gianna, Extraccion, cuantificación y purificación de saponinas de semillas de Chenopodium quinoa Willd provenientes del noroeste argentino, Tesis doctoral, Universidad Nacional de Córdoba, Córdoba, 2013.
K. Ruiz, B. Khakimov, S. Engelsen, S. Bak, S. Biondi y S. Jacobsen, “Quinoa seed coats as an expanding and sustainable source of bioactive compounds: An investigation of genotypic diversity in saponin profiles”, Industrial Crops and Products, vol. 104, pp. 156-163, 2017. https://doi.org/10.1016/j.indcrop.2017.04.007
M. A. García-Parra, N. Z. Plazas-Leguizamon, D. C. Carvajal Rodríguez, S. K. Ferreira Torrado y J. D. Parra, “Descripción de las saponinas de quinua (Chenopodium quinoa Willd) en relación con el suelo y el clima: una revisión”, Informador Técnico (Colombia), vol. 82, n.◦ 2, pp. 241-249, 2018. https://doi.org/10.23850/22565035.1451
M. F. Jiménez-Reyes, H. Carrasco, A. F. Olea y E. Silva-Moreno, “Natural compounds: A sustainable alternative to the phytopathogens control”, Journal of the Chilean Chemical Society, vol. 64, n.◦ 2, 2019. http://dx.doi.org/10.4067/S0717-97072019000204459
S. Resnik, “Quillaja extracts Type 1 and Type 2”, Chemical and Technical Assessments of Food Additives, n.◦ 61, 2004.
A. R. El Barky, S. A. Hussein, A. Alm-Eldeen, Y. Hafez y T. M. Mohamed, “Saponins and their potential role in diabetes mellitus”, Diabetes Management, vol. 7, n.◦ 1, pp. 148-158, 2017.
H. Bonilla, Y. Carbajal, M. Gonzales, V. Vasquez y A. López, “Determinación de la actividad insecticida de la saponina de la quinua (Chenopodium quinoa) en larvas de Drosophila melanogaster”, Scientia Agropecuaria, vol. 10, n.◦1, pp. 39-45, 2019. https://doi.org/10.17268/sci.agropecu.2019.01.04
U. Aregueta-Robles et al., “Cytotoxic activity of a black bean (Phaseolus vulgaris L.) extract and its flavonoid fraction in both in vitro and in vivo models of lymphoma”, Revista de Investigación Clínica, vol. 70, pp. 32-39, 2018. https://doi.org/10.24875/RIC.17002395
M. Medoza, “Inducción de metabolitos de interés nutracéutico en germinados de fríjol (Phaseolus vulgaris L.) y el efecto de su consumo en un modelo de dislipidemia”, Tesis de grado, Universidad Autónoma de Querétaro, Santiago de Queretaro, 2018.
S. Verstraeten, M. Deleu, M. Janikowska-Sagan, E. Claereboudt, L. Lins, D. Tyteca y M. P. Mingeot-Leclercq, “The activity of the saponin ginsenoside Rh2 is enhanced by the interaction with membrane sphingomyelin but depressed by cholesterol”, Scientific Reports, vol. 9, pp. 1-14, 2019. https://doi.org/10.1038/s41598-019-43674-w
M. Hussain et al., “Role of Saponins in Plant Defense Against Specialist Herbivores”, Molecules, vol. 24, n.◦ 11, p. 2067, 2019. https://doi.org/10.3390/molecules24112067
J. Wisetkomolmat, P. Suppakittpaisarn y S. R. Sommano, “Detergent Plants of Northern Thailand: Potential Sources of Natural Saponins”, Resources, vol. 8, n.◦ 10, p. 10, 2019. https://doi.org/10.3390/resources8010010
M. Castillo-Ruíz, H. Cañon-Jones, T. Schlotterbeck, M. A. López, A. Tomas y R. San Martín, “Safety and efficacy of quinoa (Chenopodium quinoa) saponins derived molluscicide to control of Pomacea maculata in rice fields in the Ebro Delta, Spain”, Crop Protection, vol. 111, pp. 42-49, 2018. https://doi.org/10.1016/j.cropro.2018.04.016
S. Kumar y A. Sheba, “A study on phytochemicals, antimicrobial, and synergistic antimicrobial activities of Hibiscus sabdariffa”, Asian Journal of Pharmaceutical and Clinical Research, vol. 12, n.◦ 4, pp. 198-201, 2019. https://doi.org/10.22159/ajpcr.2019.v12i4.31597
The Express Wire, “Saponin Industry 2019-2024 by Manufactures Types, Applications, Market Size, Regions and Forecast to 2024”, 2019. [En línea]. Disponible en: https://www.theexpresswire.com/pressrelease/Saponin-Market-2019-Global-Industry-Analysis-Size-Share-Growth-Trends-Key-Players-and-Forecast-to-2024_10454200.
International Trade Center, “Estadísticas del comercio para el desarrollo internacional de las empresas”, [En línea]. Disponible en: https://bit.ly/2PWazly
Sicex-Promoting Global Trade, “Sicex Reports”, 2019. [En línea]. Disponible en: https://sicex.com/en/reportes-2/webapp/imports/colombia/2019/schedule-b-code-product/2938902000/
S. Bottcher y S. Drusch, “Saponins - Self-assembly and behavoir at aqueous interfaces”, Advances in Colloid and ¨ interface Science, vol. 243, n.◦ 5, pp. 105-113, 2017. https://doi.org/10.1016/j.cis.2017.02.008
R. Pajuelo, “Posibilidades de la saponina de Quinua en la industria cosmética”, Euroecotrade, Lima, Perú, 2016.
C. Smith, “Credence Research”, [En línea]. Disponible en: https://www.credenceresearch.com/press/quillaia-extract-market
Ministerio de Justicia y del Derecho, Resolución 0001, Bogotá: Imprenta Nacional de Colombia, 2015.
S. C. Peña Cruz y H. E. Parra Gutiérrez, Diseño y construcción de un liofilizador para el secado de plantas aromáticas, Tesis de grado, Universidad Santo Tomas, Bogotá, 2015.
Ministerio de Agricultura, Ganadería y Pesca, “Alternativas de aplicación del proceso de liofilización en frutas y hortalizas compatible con la normativa orgánica”, Buenos Aires: Talleres gráficos.
S. E. Ramírez, “Innovar por innovar”, 2019. [En línea]. Disponible en: https://pivot.com.mx/innovar-por-innovar/
Emerson Electric Co., “Emerson Electric Co.”. [En línea]. Disponible en: https://www.emerson.com/global
Rificor, “Rificor”. [En línea]. Disponible en: http://www.rificor.com.ar/
ThermoFisher Scientific, “ThermoFisher Scientific”. [En línea]. Disponible en: https://www.thermofisher.com/co/en/home.html
Yangzhou Sanfa Electronics Co., “Yangzhou Sanfa Electronics Co.”. [En línea]. Disponible en: https://sanfa-instument.en.made-in-china.com
MyM Instrumentos Técnicos, “MyM Instrumentos Técnicos”. [En línea]. Disponible en: http://www.myminstumentostecnicos.com/
Sineo Micowave Chemistry Technology Co., “Sineo Micowave Chemistry Technology Co.”. [En línea]. Disponible en: http://sineomicrowave.com/
J. N. Hierro, T. Herrera, M. R. García-Risco, T. Fornari, G. Reglero y D. Martín, “Ultrasound-assisted extraction and bioaccessibility of saponins from edible seeds: quinoa, lentil, fenugreek, soybean and lupin”, Food Research International, vol. 109, n.◦ 7, pp. 440-447, 2018. https://doi.org/10.1016/j.foodres.2018.04.058
C. G. Silva, E. Cassel, R. M. Vargas y L. D. Marczak, “Selective extraction of saponins from Ilex paraguariensis St. -Hil, unripe fruits”, Food and Bioproducts Processing, vol. 111, n.◦ 9, pp. 72-82, 2018. https://doi.org/10.1016/j.fbp.2018.07.001
R. N. Almeida, R. G. Neto, F. M. Barros, E. Cassel, G. L. Poser y R. M. Vargas, “Supercritical extraction of Hypericum caprifoliatum using carbon dioxide and ethanolwather as co-solvent”, Chemical Engineering and Processing: Process Intensification, vol. 70, n.◦ 8, pp. 95-102, 2013. https://doi.org/10.1016/j.cep.2013.05.002
J. Yan, Z. Wu, Y. Zhao y C. Jiang, “Separation of tea saponin by two-stage foam fractionation”, Separation and Purification Technology, vol. 80, n.◦ 7, pp. 300-305, 2011. https://doi.org/10.1016/j.seppur.2011.05.010
C. Yuan, Y. Li, Q. Li, R. Jin y L. Ren, “Purification of Tea saponins and evaluation of its effect on alcohol dehydrogenase activity”, Open Life Sciences, vol. 13, n.◦ 4, pp. 56-63, 2018. https://doi.org/10.1515/biol-2018-0008
Y. Q. Wu y W. D. Man, “Study on Ultrasonic Assisted-precipitation method combined purification of tea saponin”, Advanced Materials Research, vol. 1, pp. 1552-1556, 2013. https://doi.org/10.4028/www.scientific.net/AMR.634-638.1552
S. Gafner et al., “Evaluation of the efficiency of three different solvent systems to extract triterpene saponins from roots of Panax quinquefolius using High-Performance Liquid Chromatography”, Journal of Agricultural and Food Chemistry, vol. 52, n.◦ 3, pp. 1546-1550, 2004. https://doi.org/10.1021/jf0307503
J. Li, et al., “Optimization of microwave-assisted extraction of triterpene saponins from defatted residue of yellow horn (Xanthoceras sorbifolia Bunge) kernel and evaluation of its antioxidant activity”, Innovative Food Science and Emerging Technologies, vol. 11, n.◦ 10, pp. 637-643, 2010. https://doi.org/10.1016/j.ifset.2010.06.004
V. Mandal y S. C. Mandal, “Design and performance evaluation of a microwave based low carbon yielding extraction technique for naturally occurring bioactive triterpenoid: Oleanicacid”, Biochemical Engineering Journal, vol. 50, n.◦ 6, pp. 63-70, 2010. https://doi.org/10.1016/j.bej.2010.03.005
L. Santos-Zea, J. A. Gutierrez-Uribe y J. Benedito, “Effect of ultrasound intensification on the supercritical fluid ´ extraction of phytochemicals from Agave salmiana bagasse”, The Journal of Supercritical Fluids, vol. 144, n.◦ 2, pp. 98-107, 2019. https://doi.org/10.1016/j.supflu.2018.10.013
A. J. Pérez et al., “Phytotoxic steroidal saponins from Agave offoyana leaves”, Phytochemisty, vol. 105, n.◦ 9, pp. 92-100, 2014.https://doi.org/10.1016/j.phytochem.2014.05.014
P. Y. Chen, C. H. Chen, C. C. Kuo, T. H. Lee, Y. H. Kuo y C. K. Lee, “Cytotoxic steroidal saponins from Agave sisalana”, Planta Médica, vol. 77, n.◦ 1, pp. 929-933, 2011. https://doi.org/10.1055/s-0030-1250672
X. Qi et al., “Preparative isolation and purification of ginsenosides Rf, Re, Rd and Rb1 from the roots of Panax ginseng with a salt/containing solvent system and flow step-gradient by High Performance Counter-current Chromatography coupled with an ELSD detector”, Journal of Chromatography A, vol. 1217, n.◦ 3, pp. 1995-2001, 2001. https://doi.org/10.1016/j.chroma.2010.01.057
Y. Cheng et al., “Two-step preparation of ginsenoside-Re, Rb1, Rc and Rb2 from the root of Panax ginseng by High Performance counter-current Chromatography”, Separation and Purification Technology, vol. 77, n.◦ 3, pp. 347-354, 2011. https://doi.org/10.1016/j.seppur.2011.01.003
J. Mi, M. Zhang, G. Ren, H. Zhang, Y. Wang y P. Hu, “Enriched separation of protopanaxatriol ginsenosides, malonyl ginsenosides and protopanaxadiol ginsenosides from Panax ginseng using macroporous resins”, Journal of Food Engineering, vol. 113, n.◦ 12, pp. 577-588, 2012. https://doi.org/10.1016/j.jfoodeng.2012.06.027
Q. Cui et al., “Enhanced extraction and preconcentration of main target saponins from Panax notoginseng root using green and efficient formulated surfactant aqueous system”, Journal of Cleaner Production, vol. 210, n.◦ 2, pp. 1507-1516, 2019. https://doi.org/10.1016/j.jclepro.2018.11.142
Ministerio de Agricultura, “Sistema de información de gestión y desempeño de organizaciones de cadenas”. [En línea]. Disponible en: https://sioc.minagricultura.gov.co/Pages/SIOC.aspx.
Cinética Química, “Policloruro de Aluminio”. [En línea]. Disponible en: https://policlorurodealuminio.com/default.html.
C. Ritcher y L. Canepa de Vargas, Manual de tratamiento de agua. Programa regional HPE/OPS/CEPIS de mejoramiento de la calidad del agua para consumo humano. Lima: CEPIS, 1992.
K. M. Yao, “Theoretical study of high-rate sedimentation”, Journal (Water Pollution Control Federation), vol. 42, pp. 218- 228, 1970.
C. Henao, Simulacion y evaluación de procesos químicos. Herramientas básicas. Medellín: Universidad Pontificia Bolivariana, 2006
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Recibido: 5 de septiembre de 2019; Revisión recibida: 23 de enero de 2020; Aceptado: 28 de febrero de 2020
Resumen
Contexto:
Las saponinas corresponden a un grupo de moléculas con aplicabilidad industrial, especialmente para el sector alimenticio como estabilizante de espuma en bebidas gaseosas. En el período comprendido entre el 2013 y 2017, su mercado incrementó aproximadamente un 50%, convirtiéndose en un sector económico importante que ha promovido un marcado interés en la optimización de diversos procesos de extracción desde diferentes fuentes naturales.
Método:
Se realizó una revisión bibliográfica evaluando aplicabilidad, extracción y aspectos económicos de las saponinas a nivel mundial. Se realizó el diseño conceptual de una planta piloto para la extracción de saponinas de jugo de fique con base en los resultados obtenidos del análisis de una matriz de decisión.
Resultados:
Una alternativa viable para extraer saponinas de jugo de fique es la floculación, cuyas ventajas radican en sus implicidad tecnológica, bajo consumo energético, aplicabilidad directa a la matriz de interés y uso de solventes como agua y etanol.
Conclusiones:
Al utilizar como floculante el policloruro de aluminio (PAC), debido a su capacidad de remover materia orgánica y a su selectividad, se favorece la recuperación de las saponinas en el clarificado. En el diseño conceptual, se presenta una planta piloto con una capacidad de 67.462 L/h y una eficiencia de 87,45%.
Palabras clave:
Extracción, Fique, Matriz de decisión, Saponinas..Abstract
Context:
Saponins belong to a group of molecules with industrial applications, particularly in the food industry as a foam stabilizer in soft drinks. During 2013 to 2017, its market increased about 50%, becoming an important economic sector that has promoted a strong interest in the optimization of different extraction processes from different natural sources.
Method:
A technological surveillance report wasma de evaluating the applicability, extraction and economic aspects of saponins worldwide. The conceptual design of a pilot plant for the extraction of saponins from fique’s juice was carried out based on the results obtained from the analysis of a decision matrix.
Results:
A viable alternative for the extraction of saponins from fique’s juice is flocculation, which advantages lie on its technological simplicity, low energy consumption, direct applicability to the matrix of interest and use of solvents such as water and ethanol.
Conclusions:
Using Aluminum Polychloride (PAC) as a flocculant, due to its ability to remove organic matter and its selectivity, saponins are recovered in the clarification. The conceptual design presents a pilot plant with a capacity of 67.462 L/h and an efficiency of 87,45%.
Keywords:
Decision matrix, Extraction, Fique, Saponins..Introducción
El fique (Furcraea andina) es una planta originaria de América tropical cultivada principalmente en países como Venezuela, Perú, Ecuador, Brasil y en las regiones andinas de Colombia [1], el mayor productor a nivel mundial. Según el Ministerio de Agricultura y Desarrollo Rural, en Colombia se obtuvieron 15.806 toneladas de la planta en 2014 [2], siendo cultivada principalmente en los departamentos de Nariño, Santander, Antioquia, Guajira y Cauca como el mayor productor[3].
En el proceso de desfibrado de la penca, sea provecha solo el 4% de la planta como fibra y el otro 96% son subproductos que se componen principalmente en un 30% de bagazo y 70% de jugo de fique [4], produciéndose de este último alrededor de 96.000 m3/año que son vertidos en diferentes afluentes, afectando su biodiversidad[5]. En 2004, se realizó un estudio donde se demuestra que una vez se procede al lavado de las fibras de fique, los niveles de demanda química de oxígeno (DQO) y demanda biológica de oxígeno (DBO5) aumentan de 17,8 mg/L a 180 mg/L y de 171,3 mg/L a 537,3 mg/L, respectivamente[1].
El jugo de fique es una matriz compleja compuesta por azúcares, saponinas (glucósidos esteroidales o triterpénicos) y sapogeninas (agliconas de saponinas), ácidos grasos, entre otros, los cuales generan diferentes efectos en los organismos y afluentes[6]. Las saponinas son metabolitos secundarios ampliamente distribuidos en el reino vegetal, están presentes en diferentes partes de la planta como la corteza, las hojas, las raíces e incluso las flores[7]. Las saponinas se componen de una aglicona de tipo esteriodal (C27) otriterpénica (C30) unidas a fracciones de glicósidos hidrofílicos, lo que le confiere características anfifílicas[8].
En la actualidad, existe suficiente bibliografía en la que se demuestra la presencia de saponinas en diferentes tipos de plantas, incluyendo la familia Agavaceae[9]. Sin embargo, la información disponible es escasa para el fique, ya que, aunque se han estudiado sus sapogeninas [10], la saponina que origina su biosíntesis no ha sido identificada, caracterizada ni estudiada bajo su uso industrial.
En esta revisión, se estudian diferentes alternativas para la extracción de saponinas provenientes del jugo de fique y se propone el diseño conceptual de una planta productora, lo anterior como un insumo para la generación de valor agregado para los residuales de la industria fiquera.
Importancia de las saponinas en el mercado mundial
Técnicas de extracción de saponinas
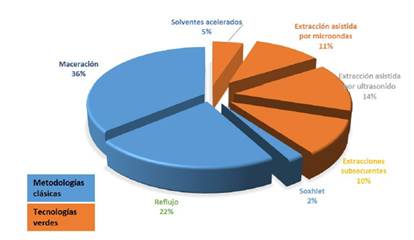
Las extracciones de las saponinas se pueden clasificar en dos categorías: las metodologías clásicas y las tecnologías verdes[11]. Las metodologías clásicas normalmente son extracción Soxhlet, extracción sólido líquido empleando grandes cantidades de solventes, mientras que las metodologías verdes emplean ultrasonido, líquidos ultrapresurizados, entre otros[12]. Otra alternativa para una extracción previa a una purificación es la mezcla de metodologías convencionales y tecnologías verdes; por ejemplo, realizar extracciones con solventes, evaporar empleando rota evaporación, redisolución en agua y liofilización, evitando que las características fisicoquímicas del extracto se vean afectadas[13]. En la Figura 1, se puede observar que el tipo de extracción utilizada por los investigadores se centra en métodos convencionales (con un 75%), aunque estos consuman grandes cantidades de solventes[11].
Figura 1: Distribución del tipo de extracciones en las saponinas.
Se ha empleado agua presurizada de baja polaridad para extraer las saponinas provenientes de la semilla de berberecho de vaca (Vaccaria hispánica) [14], con lo que se alcanzan rendimientos del orden del 63%modificando los tiempos de extracción y la concentración de solvente[15].Utilizando agua caliente presurizada se ha logrado extraer hasta7,12g de saponinas/100g de subproductos fibrosos que se desprenden de los procesos productivos del ginseng rojo[16].
A partir del triturado de rizomas de Paris de la vayi, se extrajeron las saponinas esteroidales por medio de reflujo con etanol, resuspendiendo el extracto en agua y realizando extracciones con solventes de diferente polaridad. Se separa el extracto final por cromatografía en columna con detección por cromatografía de capa fina [17].
De las raíces del Polygala senega L. se aislaron sus saponinas empleando extracción Soxhlet con metanol y separando los compuestos con butanol[18]. El reflujo con solventes también se ha empleado para extraer las saponinas del salvado desengrasado de arroz (Oryza sativa L.), seguido por la separación con butanol [13] y la obtención de saponinas de las raíces de Pulsatillachinensis[19].
Por medio de una técnica de extracción asistida con microondas, se separaron las saponinas esteroidales de la Dios coreazingiberensis C.H. Wright[20].La técnica anterior también fue empleada para extracción de saponinas triterpénicas del Ganoderma atrum, una planta conocida por sus propiedades medicinales[21].
El ultrasonido es otro método de extracción utilizado en la obtención de compuestos bioactivos de las plantas [22] por medio del fenómeno de cavitación, el cual acelera los procesos de transferencia de masa de los compuestos activos presentes en la célula [23]. Por ejemplo, de la Quillaja saponaria Molina, se han extraído sus saponinas triterpénicas con eficiencias cercanas al 70%[24], además, se ha encontrado que es tres veces más rápida que los métodos convencionales para extraer las saponinas de las raíces y de células cultivadas del ginseng[25].
La extracción de saponinas con solventes a alta presión es una técnica alternativa a las técnicas convencionales de extracción, la cual permite obtener tiempos más cortos de extracción, menores consumos de disolvente y mayores rendimientos en la extracción. La alta presión y temperatura favorece la difusión del solvente a través de los poros de la matriz, lo que permite la extracción de los analitos[16]. Esta técnica es reportada como una aplicación para la remoción del contenido de saponinas en los aquenios de Chenopodium quinoa, favoreciendo el desamargado del grano para su consumo como alimento[27].
Aplicaciones industriales de las saponinas
Se afirma en [28] que las semillas de quinua pueden representar una fuente sostenible de saponinas en grandes cantidades debido al aumento en la producción y expansión mundial del cultivo, siendo importante la identificación de los nichos de mercado y la evaluación de su uso potencial en favor de la conservación del medio ambiente y el aprovechamiento sostenible de la biodiversidad. Se han realizado investigaciones encaminadas a la sanidad vegetal, donde se le ha reconocido la capacidad del control de plagas y enfermedades principalmente de origen fúngico, como Botrytis sinerea, Aspergillus y Fusarium[29], [30].
Los extractos de Quillaja son extractos acuosos obtenidos de Quillaja saponaria Molina, árbol nativo de China y algunas regiones de Suramérica como Perú, Chile y Bolivia. En la actualidad, existe la Quillaja tipo 1 que contiene más de 100 saponinas triterpénicas y es tratada con estabilizantes como la albúmina de huevo y PVP (contiene entre 20% y 26% de saponinas), y la tipo 2, la cual se obtiene a partir de la tipo 1 al someter el extracto por ultrafiltración o cromatografía de afinidad, removiendo sólidos indeseados y confiriéndole mejores propiedades emulsificantes y mayor contenido de saponinas que está alrededor de 75% al 90%. Ambos tipos de extractos se emplean principalmente como emulsificantes en la industria alimenticia. Los extractos de alta pureza no se emplean como aditivos alimenticios, sino como auxiliares en la producción de vacunas animales[31].
Las saponinas han recibido importante atención debido a su actividad biológica como hepatoprotector, antitumoral, antimicrobiano [29] y antiinflamatorio; además, en la actualidad se han reportado sus propiedades antidiabéticas, lo que genera un prometedor panorama para el desarrollo de nuevos medicamentos[32], [33]. Un estudio mostró que la fracción rica en saponina de frijol negro (Phaseolus vulgaris L.) estimula el sistema inmune contra las células cancerosas [34] y se ha reportado su poder reductor de colesterol[35]. Muchos de esos efectos se han relacionado con su capacidad para interactuar con la membrana plasmática y modificar su fluidez y permeabilidad, cuyos mecanismos no están completamente estudiados[36]. Se afirma en [37] que la actividad de las saponinas puede atribuirse a las propiedades anfipáticas de las moléculas que la constituyen (un triterpeno hidrofóbico o esqueleto esterólico y una cadena hidrofílica de carbohidrato).
Industrialmente,se ha dado uso a las saponinas como tenso activos en formulaciones para la fabricación de jabones, especialmente por su seguridad para el medio ambiente, su biodegradabilidad, por ser un producto renovable y ecológicamente adaptable. Además de ello, se ha reportado el uso de extractos de saponinas de quinua como agente de control biológico contra nematodos en cultivos de papa, orugas en cultivos de maíz o Drosophila melanogaster, cuyo estudio se realizó evaluando el contenido de saponinas por medio del método afrosimétrico que se basa en la propiedad de las saponinas para disminuir la tensión superficial del agua, formándose una espuma estable cuya altura está relacionada con el contenido del analito en el sustrato evaluado[38].
En[39]se evalúa la capacidad molusquicida de un extracto desaponinas proveniente de cáscaras de quinua (Chenopodium quinoa Willd.), obtenido por tratamiento con agua destilada, seguido de tratamiento con soda cáustica a 95-100 ◦C por dos horas con agitación, la cual después de enfriar se neutralizó con HCl para, finalmente, secarlo al aire. El polvo fino marrón obtenido se cuantific´ o por RP-HPLC, indicando un contenido de saponinas de 36% p/p. Este extracto mostró un control de 100% a 7-10 ppm de saponinas después de 72 horas y con un extracto de 5 ppm de saponinas después de 96 horas. Se observó que los moluscos tratados (Pomacea canaliculata) cerraron su opérculo 20-60 min después de la aplicación del extracto, lo que les impediría su capacidad de alimentación y con lo cual podría ser utilizado como control biológico en cultivos de arroz[39].
Utilizando extractos de hojas de flor de Jamaica (Hibiscussabdariffa), se evaluó su actividad antimicrobiana, encontrando efectividad inhibitoria contra S.aureus y P.aeruginosa a concentraciones de 20-160 mg/mL[40].
Mercado mundial de las saponinas
El mercado de las saponinas ha venido en aumento y se proyecta un crecimiento a una tasa de 0,2% en los próximos cinco años, pasando de USD 950 millones en 2017 a USD 970 millones en 2023[41].
Entre 2013 y 2017, las importaciones de las saponinas han crecido aproximadamente un 50%, incrementándose de USD 680 millones a USD 1.022 millones, donde Estados Unidos se destaca como el mayor importador a nivel mundial con un 20% del mercado total en el 2017, mientras que países como China, Malasia, Francia, Irlanda, Alemania y Rusia tienen el 5% del mercado global en 2017[42]. En Colombia, los mayores importadores de saponinas entre el 2013 y 2017 se muestran en la Figura 2, estos cuentan con un promedio de compra de USD 311/kg en 2017[43].
Figura 2: Principales importadores de saponinas en Colombia entre 2013 y 2017. Fuente: Elaboración propia con base en[43].
En cuanto a las exportaciones, entre los años 2013 y 2017 se ha observado un incremento aproximado de 23%, pasando de USD 1.101 millones a USD 1.359 millones, donde China se destaca como el mayor exportador a nivel mundial con un 36% del mercado global en el 2017, seguido de Francia y Malasia con un 12% y 8%, respectivamente [42]. Los grandes productores/comercializadores de saponinas son: Laozhiqing Group, Hubei Jusheng Technology, Weihe Pharma, Yunan Notoginseng y Yunnan Baiyao Group[41].
En América Latina, Chile es el país más destacado en exportaciones de saponinas provenientes de Quillaja saponaria Molina (único extracto de saponinas aprobado para el uso en alimentos) [44], obtenidas de la corteza del árbol y valorizadas entre e 20 a 25/kg[45]. Este mercado se valor´ o en 2015 en USD 1.569,9 millones, proyectando un ritmo de crecimiento del 5% hasta alcanzar un valor de USD 2.426 millones en 2024[46]. Los mayores comercializadores se muestran en la Figura 3.
Figura 3: Principales comercializadores de extractos de Quillaja.
Otro importante mercado de saponinas a nivel mundial proviene del Ginseng (Panax notoginseng), cuyas importaciones mostraron una reducción cercana al 7% entre 2013 y 2017, siendo la ciudad de Hong Kong el mayor importador con un 43% del mercado global en el 2017, seguido de Japón, China y Estados Unidos con un 12%, 11% y 8% respectivamente[42]. En cuanto a las exportaciones a nivel mundial, entre 2013 y 2017 el mercado presentó una contracción del 12%, donde se destaca Canadá como el mayor exportador con un 34% del mercado global en el 2017, seguido con China, Corea del Sur, Japón y Estados Unidos con un 26%, 13%, 12% y 11% respectivamente[42].
Metodología de matriz de decisiones para la selección del métododeextracción de saponinas
Con el fin de proponer una adecuada metodología para la extracción de saponinas provenientes del jugo de fique, se aplica la metodología Pugh, donde se valora en términos de pérdida o ganancia una alternativa tecnológica, basado en la revisión bibliográfica realizada para metodologías de extracción de saponinas en diferentes tipos de plantas, ello con el fin de considerar un amplio espectro de tecnologías y no reservarse únicamente a matrices acuosas similares al jugo de fique. Las metodologías seleccionadas para evaluación corresponden a extracciones a escala piloto o laboratorio. Para crear la matriz de decisión se tuvieron en cuenta las consideraciones mencionadas a continuación.
-
Calentamiento: Operaciones que involucren etapas de calentamiento en los procesos de extracción o pretratamientos que puedan afectarla integridad de las saponinas o generar costos adicionales.
-
Consumo energético: Se cuantificó con respecto a lo expuesto en cada metodología. Si la información de algún equipo no se encuentra disponible dentro de la metodología, se emplea un equipo genérico con información detallada que cumpla las expectativas. Si la información de tiempos no se encuentra disponible, se estiman tiempos aproximados según la experiencia en condiciones similares.
-
Solvente empleado en la extracción: Para el caso de Colombia, se debe tener en cuenta el listado de sustancias químicas controladas definidas en la Resolución 0001 de enero de 2015 [47], por lo cual se tuvo preferencia por solventes como el agua o el etanol que no poseen restricciones mayores. Otro tipo desolventes como el butanol o el metanol no solo pueden ser controlados, sino que pueden generar condiciones indeseadas en los productos terminados, lo que conlleva a procesos posteriores de purificación.
-
Secado al vacío: El secado al vacío implica tiempos de tratamiento largos y altos consumos energéticos.
-
Liofilización: Procesos de purificación que impliquen el uso de liofilización son indeseados, ya que estos aumentan de manera exponencial los costos asociados debido al alto gasto energético y tiempos de espera prolongados, así como escalamientos restrictivos de la metodología debido al volumen de trabajo[48].
-
Secado previo (con respecto al fique): Debido a que todas las matrices evaluadas no son iguales al fique, es posible que se deba realizar un secado previo del jugo para adaptarse a la metodología en cuestión. El secado previo es indeseado, no solo por el aumento en los costos, sino porque el jugo contiene diferentes tipos de azúcares que, bajo esta condición operacional, podrían generar importantes cambios en las propiedades organolépticas del producto obtenido.
-
Tiempo de extracción (días): Tiempos altos son indeseados. En caso de no disponerse de esta información, se consideró que una liofilización toma alrededor de 46 horas [49], un secado al vacío demora un día, la rota evaporación toma quince minutos como mínimo, la centrifugación demora quince minutos y el secado del fique veinticuatro horas.
-
TRL (siglas del inglés Technology Readiness Levels): Nivel de madurez de una tecnología evalúa el estado de un proceso en términos de la innovación y nivel de investigación. ELTRL se califica en una escala de 1 a 9[50].
Cada una de las consideraciones se calificó en un rango de 1 a 10 (a excepción del TLR), donde 1 es escenario no deseado y 10 escenario altamente deseado. En la Tabla I se muestra la información de la potencia de los equipos genéricos considerados.
Tabla I: Consideraciones de potencia de los equipos empleados en los diferentes procesos analizados.

Generalmente, la recuperación del producto final en cualquier proceso de extracción es un parámetro de elevada importancia en la toma de decisiones para la viabilidad de un proyecto. Sin embargo, las recuperaciones descritas en cada uno de los procesos no son comparables entre sí debido a que cada cálculo tiene tratamientos matemáticos diferentes que dependen de cada autor y, por tanto, se obtendría una ponderación adecuada, por lo cual no se consideran dentro de la ponderación.
En la Tabla II, se observan los resultados de las consideraciones técnicas evaluadas para los diferentes procesos estudiados. En la Tabla III, se recogen las referencias bibliográficas para cada proceso. En la Tabla IV se encuentra la ponderación final de la matriz de decisión.
Tabla II: Resultados de la evaluación de cada proceso.
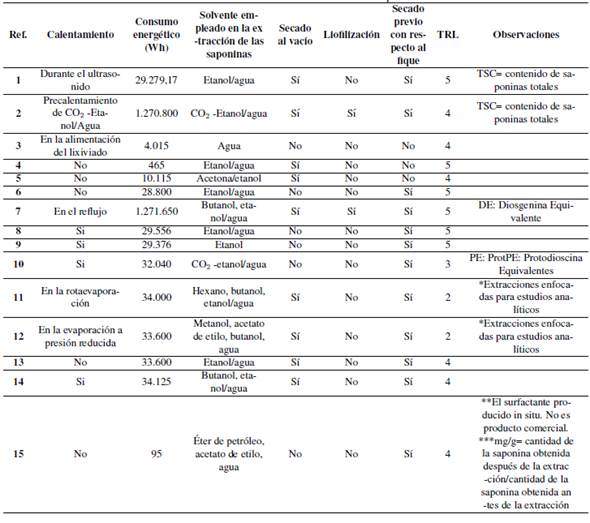
Tabla III: Bibliografía, planta y metodología empleada por cada proceso.
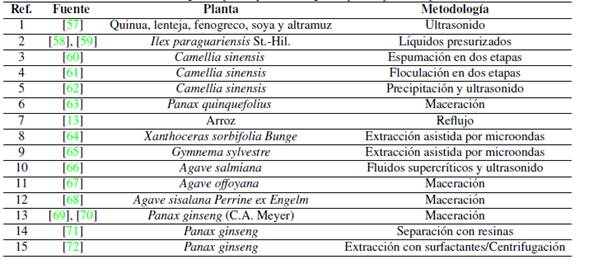
Tabla IV: Ponderación final de la matriz de decisión.

A partir de los resultados ponderados mostrados en la Tabla IV, se puede observar que los procesos 3 y 4 alcanzan el mismo puntaje (76 puntos); estos procesos corresponden a espumación en dos etapas y floculación en dos etapas respectivamente. Se elige el método 4, que corresponde al proceso por floculación, debido a la facilidad y conocimientos que se tienen en el diseño de este tipo de equipos. Además, para el diseño de sistemas de espumación se requiere de estudios más profundos que están fuera del alcance de este trabajo. El proceso elegido se caracteriza por tener un bajo consumo energético, ser aplicable a matrices acuosas que no requieren pretratamientos al jugo de fique, no emplea solventes peligrosos o controlados, se obtienen valores de recuperación superiores y su TRL evidencia un desarrollo tecnológico superior comparado con el proceso 3.
Diseño del proceso de extracción de saponinas de jugo de fique
Para el diseño del proceso, se consideró que el contenido de jugo de fique en la planta es de 61%. En el departamento de Antioquia, la producción anual de fique es de 2.650 ton/ha, por lo que se considera un 10% del total para una planta piloto[73]; el caudal de trabajo es 67.462 L/h; la eficiencia será de 87,45% descrito en[61]; el floculante elegido es PAC (policloruro de aluminio) por su vasto uso en la industria[74]; las corrientes se simulan como agua + sólido, ya que el solvente corresponde a más del 95% del contenido, y la concentración de saponinas en el jugo de fique es 4,48 g/kg de jugo.
Sedimentador
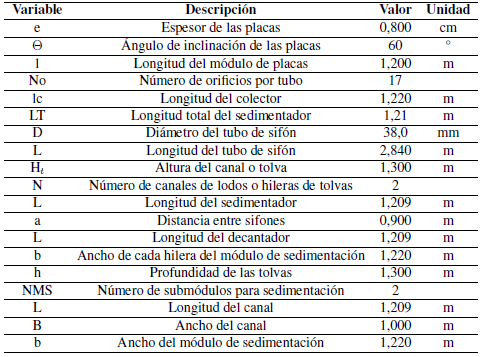
Para determinar el volumen sedimentado en el sistema PAC + jugo de fique, se mezclaron 400 mL de jugo de fique, 3.600mL de agua destilada y 120 gotas de PAC (4,9320g) generando vórtice por un minuto. El total se trasvasó a un decantador de 4.000 mL, donde se dejó en reposo por dieciséis horas hasta alcanzar el estado estacionario. Se determinó que el volumen sedimentado fue de 140 mL. El caudal de trabajo es 0,000187395 m3/s. En la Tabla V se muestran las dimensiones principales del sedimentador de placas siguiendo los cálculos de [75] y[76].
Tabla V: Resultados dimensionales del sedimentador.
Pulido del producto final
Simulación
En el pulido del producto final, lo que se espera es remover la mayor cantidad de agua posible con el fin de aumentar la concentración final de las saponinas. En ensayos realizados en laboratorio, el remanente de la sedimentación (3.860mL) se sometió a evaporación hasta reducir su volumen a 40 mL. La presencia de saponinas se verificó con la formación de espumación en el frasco contenedor. El recipiente que contenía el fique en proceso de evaporación no mostró presencia de azúcares debido a que las paredes no estaban caramelizadas, lo que indica que estos fueron removidos en los lodos y que el PAC presenta selectividad por las saponinas. Según lo anterior, la evaporación debe remover el 99 % del agua que entra a la unidad de evaporación. Se emplea Aspen ONE R versión 10 como simulador. Debido a que no se cuenta con datos termodinámicos y de equilibrio del sistema agua-saponinas, se emplea sacarosa para simular el sólido, ya que el uso de un sólido hipotético no arrojó datos confiables.
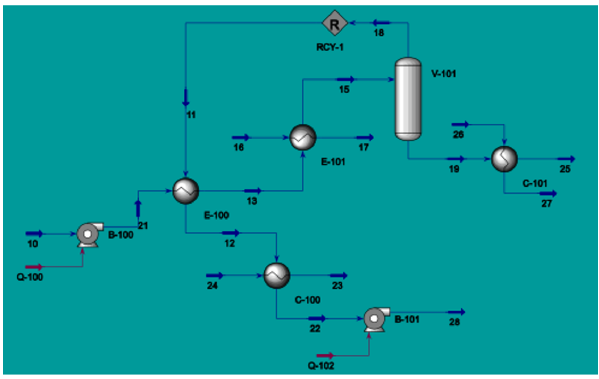
Se simula como un evaporador de un solo efecto (solo un efecto debido a la concentración tan baja de las saponinas que no permite tener rampas de evaporación). La salida del sedimentador (flujo 10) se alimenta de un intercambiador E-100, donde la corriente se precalienta antes de ser enviado a otro intercambiador E-101 que emplea vapor de baja presión para entregar el calor necesario con el fin de obtener una corriente líquido-vapor que se separa en la unidad V-101. La corriente vapor del flash (flujo 18) se recircula al intercambiador E-100 como precalentamiento de la corriente a tratar para luego enfriarse en la unidad C -100 y así retornar como agua destilada al mezclado de materias primas. En la unidad C-101, se enfría el producto terminado (flujo 27) que está a la concentración deseada (0,002149086 en fracción mol o 0,039257825 en fracción masa). Las unidades C-100 y C-101 emplean agua de enfriamiento estándar (Figura 4).
Figura 4: Simulación en AspenONE R de un evaporador de una sola etapa.
Dimensionamiento
En la Tabla VI, la Tabla VII y la Tabla VIII se muestran los resultados del dimensionamiento de las unidades B- 100, E-100, E-101, V-101, C-100, C-101 y B-101 empleando criterios descritos en la bibliografía[77].
Tabla VI: Dimensionamiento de las unidades de intercambio de calor. Fuente [77]
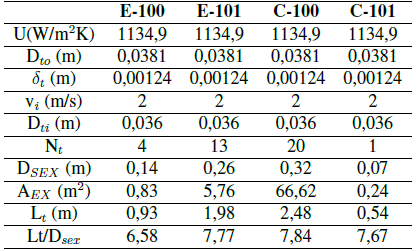
Tabla VII: Dimensionamiento de bombas. Fuente [77].
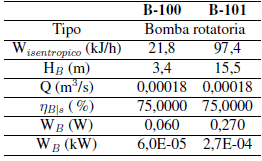
Tabla VIII: Dimensionamiento de unidad flash. Fuente [77].

En la Tabla IX se muestra la nomenclatura utilizada en el dimensionamiento.
Tabla IX: Nomenclatura empleada en el dimensionamiento.
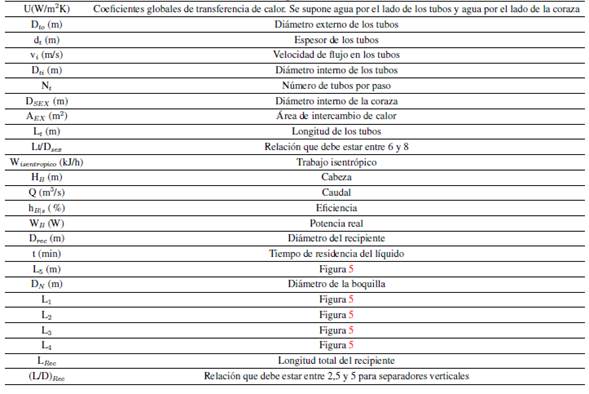
Figura 5: Esquema de un separador flash. Fuente: [77].
Conclusiones
El jugo de fique como residual agroindustrial es potencialmente aprovechable para la extracción de saponinas a través de procesos de floculación, con bajo consumo energético, aplicabilidad directa sobre la matriz de interés y uso de solventes inocuos al medio ambiente.
En Colombia se estima un potencial de producción de saponinas de 447 T/A a partir de jugo de fique residual, lo que generaría un impacto ambiental positivo evidenciado en una reducción significativa de la DQO y la DBO5 de los efluentes generados en las plantas de beneficio.
En el diseño conceptual, se presenta una planta piloto con una capacidad de 67.462 L/h y una eficiencia de 87,45%. El pulido del producto final se puede realizar empleando un evaporador de un solo efecto, simulado como un intercambiador de calor y una unidad flash.
Referencias
Licencia
A partir de la edición del V23N3 del año 2018 hacia adelante, se cambia la Licencia Creative Commons “Atribución—No Comercial – Sin Obra Derivada” a la siguiente:
Atribución - No Comercial – Compartir igual: esta licencia permite a otros distribuir, remezclar, retocar, y crear a partir de tu obra de modo no comercial, siempre y cuando te den crédito y licencien sus nuevas creaciones bajo las mismas condiciones.


![Principales importadores de saponinas en Colombia entre 2013 y 2017. Fuente: Elaboración propia con base en[43].](https://revistas.udistrital.edu.co/index.php/reving/article/download/15298/version/11403/16176/92554/2344-8393-inge-25-01-50-gf2.jpg)

![Esquema de un separador flash. Fuente: [77].](https://revistas.udistrital.edu.co/index.php/reving/article/download/15298/version/11403/16176/92557/2344-8393-inge-25-01-50-gf5.png)


2.jpg)